摘要
背景
在有道理的心脏谱系中看到的结构现象,这些谱系已经迷住了许多学者,包括查尔斯达尔文,包括植物肉食的演变。显然,这些结构特征集体称为食肉综合征,演变为援助被吸引,捕获和消化的猎物的营养收购。我们现在明白为什么植物肉激活演变,但食肉植物如何获得这些属性仍然是一个谜。试图了解的演变养猪为了进一步阐明其在猎物消化中的作用,我们分析了高度专业化的蛋白质的转录组数据猪笼草叶包括叶基片,卷须和猪笼管的不同部分/区域,即消化区,蜡区和盖。
结果
总的来说,我们产生了大约2620万的高品质illumina读。汇集了读取,标准化和De Novo组装以产生约412,224个转录物的参考转录组。然后我们估计成绩丰富沿着N哈西亚纳通过映射每个部分/区域的个体阅读到参考转录组。对27,208个常见表达基因的相关聚类分析表明,叶片基部和猪笼草发育的功能关系和相似的细胞过程,表明猪笼草和猪笼草在发育过程中具有重要的功能关系养猪猪笼草确实是一种改良的叶子。从2386个差异表达基因(DEGs)列表中,我们鉴定出了编码参与猎物消化和抵御病原体攻击的关键酶的转录本,其中一些在消化区高水平表达。有趣的是,许多这些酶编码基因也在未打开的基因中表达N哈西亚纳投掷者。同时检测到与细菌和真菌同源的转录本;在消化道中,真菌比细菌更占优势。从组织学和扫描电镜(SEM)显微照片中,我们发现了参与叶片发育的关键调控基因表达的改变。特别有趣的是,第三类同源域亮氨酸拉链(HD-ZIPIII)以及ARGONAUTE(前)卷须中的基因表达上调。
结论
我们的发现表明N哈西亚纳投手使用各种酶用于猎物消化和植物防御,港口微生物,并且可能通过改变的叶极性基因的表达而演变。
背景
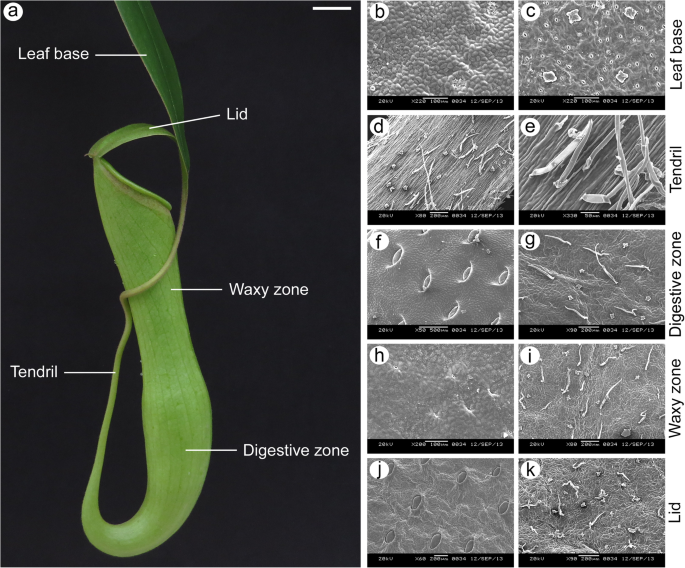
食肉植物是一种引人注目的植物实体,在植物适应环境中具有相当大的兴趣。这些植物在五个被子植物谱系中独立进化了好几次,并以一系列被称为食肉综合症的特征为特征[1,2].这种综合征主要反映在叶片中,以促进猎物的吸引力,捕获和消化和随后吸收溶解的营养物质,以抵消其天然栖息地的低营养可用性。在这些高度专业的叶子中,陷阱陷阱或“投手”在三个家庭中公认。Cephalotaceae,Nepenthaceae和Sarraceniacee [3.].Sarraceniaceae的成员发展出既能捕食又能光合作用的猪笼草养猪和Cephalotus生产的水罐可以捕捉到几乎没有光合作用的猎物[4].但是,与投手不同Sarracenia.和Cephalotus,的养猪投手通过称为卷须的刚性细长结构在底座上连接到扁平的光合叶片基础晶片(图。1).在解剖和功能上,它被进一步划分为两个不同的区域:覆盖在猪笼草上部内部的光滑的蜡状区域,其功能是捕获猎物;1). 水罐口上覆盖着一个带有蜜腺的盖子,既能吸引猎物,又能防止雨水冲淡消化液[5].这种非凡的属性在全世界令人着迷的科学家们,并且研究在理解血迹和消化机制方向上取得了进展。
为了阐明养猪投手们,研究主要集中在光滑的蜡质区[6]湿口[7,8,9和粘弹性消化液[10,11].一旦被困在含有液体的猪笼草中,昆虫就开始死亡,并被几种水解酶消化。这些酶包括天冬氨酸或半胱氨酸蛋白酶、几丁质酶、核糖核酸酶、酯酶、磷酸酶、β-1,3-葡聚糖酶和β- d -木糖苷酶(Biteau et al. [12]以及其中的参考文献)。但到目前为止,这些酶的来源仍然是一个有争议的问题。这种情况产生于矛盾的结果,表明[13,14或缺席[12,15某些未开封的消化液中的微生物养猪投手。是否N哈西亚纳目前还不知道猪笼草是否含有微生物;然而,我们知道它含有编码几丁质酶的基因[16],并产生抗真菌次生代谢物萘醌[17]. 除此之外,目前还没有其他关于动物致病相关基因或猎物消化基因的报道N哈西亚纳.此外,在开放和未开封的投手中是否表达了类似数量的基因养猪还有待探索。
为了解决这些问题,我们对高度专业化的基因进行了基于测序的转录组分析N哈西亚纳叶包括叶基片,卷须和猪笼管的不同部分/区域,即消化区,蜡区和盖。我们对转录组数据的分析表明养猪猪笼草确实是一种改良的叶子。这是基于观察结果,与卷须相比,叶基底层薄膜与投手管的不同部件/区域共享类似的转录表达模式。我们发现在捕获的猎物或致病微生物(露出诱发剂)的存在下,几乎所有编码已知在捕食性消化中发挥作用和对病原体攻击的关键酶的转录物的几乎所有转录物都表示在N哈西亚纳投手。出乎意料的是,许多这种酶编码基因也在未打开的猪笼草中表达;但与开放式猪笼草相比,表达的基因数量减少了。例如,忘形蛋白酶I和II在未打开和开放的罐中都有表达,而IV类几丁质酶在开放的罐中特异性表达。我们还检测了微生物来源的转录本,即细菌和真菌在所有五个不同的部分/区域N哈西亚纳叶子;但在消化区,这些转录物与真菌的大部分同源。我们还观察到第三类的表达改变同源域亮氨酸拉链(HD-ZIPII)和ARGONAUTE(前)基因,表明指定叶极性的基因可能在开发中起着关键作用养猪投掷者。我们的发现表明N哈西亚纳猪笼草使用各种各样的酶来消化猎物和植物防御,其中许多在打开盖子之前就表达了,主要是在消化区隐藏真菌,可能是通过改变叶片极性基因的表达进化而来。
结果
排序、从头组装和注释
基因组五个不同部分/区域的RNA测序N哈西亚纳叶子导致总计2.62亿高质量的配对末端Illumina读取(附加文件1:表S1)。读取的数据被组合成一个单一的数据集,并使用免费的软件Trinity [18,19]通过应用默认设置来生成N哈西亚纳叶子。使用cd\u hit\u est从Trinity生成的程序集中删除多余的转录本。参考转录组包含412224个转录本,平均重叠长度和最大重叠长度为0.695 kb和23.743 kb。N50值为1.356 kb。附加文件中的图S11显示所有组装的转录物的长度分布。使用BLASTX程序[20],然后我们将长度≥200 bp的组装转录本与NCBI非冗余蛋白数据库进行比较,并保留匹配E-value cut≤10− 5.相似度评分≥40%。我们发现99604个组装的转录本对NCBI非冗余蛋白数据库至少有一个重要的打击。至少1 e− 5.大约60%的转录本的置信水平被观察到,这表明高蛋白保守性(额外文件)1:图S2a)。约79%的转录本具有60%以上的蛋白质水平相似性(另附文件)1:图S2b)。利用UniProt数据库对BLASTX的预测蛋白进行了注释。在99604个转录本中,50222个转录本与UniProt数据库中可用的蛋白质相匹配。与每个转录本的顶部BLASTX命中相对应的生物体名称被提取出来并绘制在附加文件中1:图S3。普通贝塔亚种。庸俗随着9292个匹配的转录物出现为顶级生物。'碳水化合物降解'(249),'氨基酸生物合成'(199)和“蛋白质修饰”(126)是映射最丰富的代谢途径(附加档案1:图。S4)。附加文件中的图S51显示每个类别中确定的前10个围棋术语。在生物过程类别中,“DNA整合”位于顶部,而“膜的整体成分”则是细胞成分类别中最重要的术语。分子功能类别在顶部用“核酸结合”来表示。我们已将本研究中产生的两个生物复制品的RNA序列数据提交给NCBI短读存档,可在注册号SRP064181下访问。
转录本丰度估计和差异表达基因
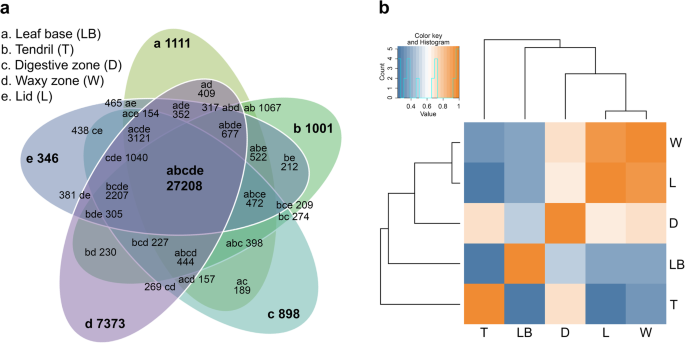
我们估计了转录本的丰度N哈西亚纳通过将每个部分/区域的单个读数映射到参考转录组(长度 ≥ 200 bp)使用领结2[21]. 平均而言,大约95%的阅读与参考转录组正确对齐。路线摘要在附加文件中提供1:表S2。然后,我们在所有不同的组织部件/区域中提取独特和共享的成绩单。我们在蜡质区(7373)中检测到最高数量的唯一表达转录物,然后是叶碱(1111),卷须(1001),消化区(898)和盖子(346)(图。2a) 是的。在蜡质区,有24个GO分子函数项被富集,其中15个被过度表达,9个被低估“蛋白质二聚活性”和“氧化还原酶活性”分别出现在代表性不足和代表性过高的分子功能的顶部(附加文件1:图S6)。两个氧化石墨烯分子功能项显示在叶碱中富集,其中“氧化还原酶活性”过多,“结合”不足。在卷须中,“rna导向的DNA聚合酶活性”和“半胱氨酸型肽酶活性”弥补了两个过度代表的氧化石墨烯分子功能项。四个氧化石墨烯分子功能项在消化区富集,而盖子没有检测到富集(附加文件1:图S6)。令人惊讶的是,在消化道中表达的具有顶层分子功能的基因(“角质层的结构成分”)与昆虫角质层蛋白具有同源性。所有五个部分/区域N哈西亚纳叶片共有27,208个表达的转录本(图。2a).从5个不同样本的相关性分析来看,蜡质区与盖层以及消化区之间具有较高的相关性(图5)。2b)。同时,投手管的这些不同的部件/区域与卷须的叶基呈现相对较高的相关性。这意味着叶基和投手份额份额类似的转录表达式模式。
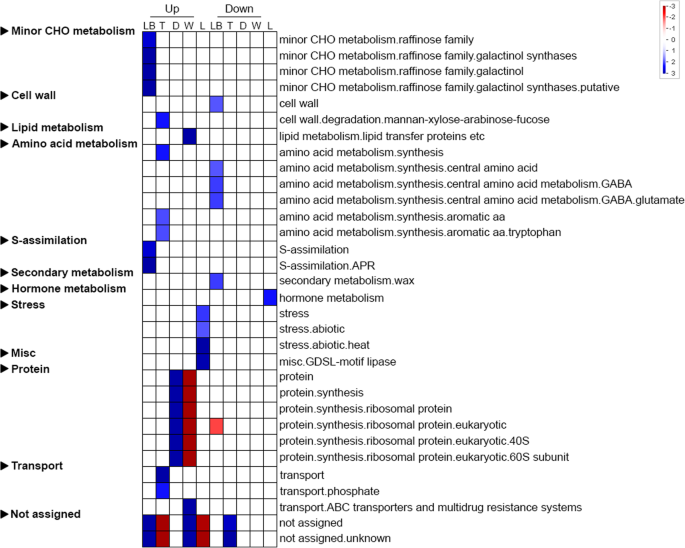
然后我们使用DeSeq软件[22]生成读取计数和每千碱基转录物每百万映射读取(FPKM)值。附加文件中的图S71显示FPKM值的分布。根据适用标准[p- value <0.05],我们确定了12,610次沿着N哈西亚纳叶子。在调整p-Value,显着降低的数量减少到2386.自动注释软件符号[23]然后被用来生成一个deg的映射文件,用于过度表达和功能类别丰富分析。Mercator结果显示56%的数据被分配了函数,而其余44%的数据没有被分配函数(附加文件1:图。S8)。使用Pageman的超级陈述分析[24]表明,最丰富的功能是特定于特定的部分/区域N哈西亚纳叶片的代谢包括:微量CHO代谢、细胞壁代谢、脂质代谢、氨基酸代谢、s同化、次级代谢、激素代谢、应激、杂项代谢。和运输(图。3.). 在这些上调的基因中,蛋白质合成是人类消化道中过度表达的丰富分子功能之一N哈西亚纳投手。早在食肉植物中就发现了这种现象肌腱鞘蛋白质的重新合成与消化液的分泌同时发生,部分新合成的蛋白质也直接分泌到消化液中[25]. 根据这一发现,我们的结果表明,从头蛋白质合成也发生在猪笼草N哈西亚纳.一些基因未分配任何职能,并且可以代表那些具体的职能N哈西亚纳(图。3.).
k均值聚类和功能类别富集分析
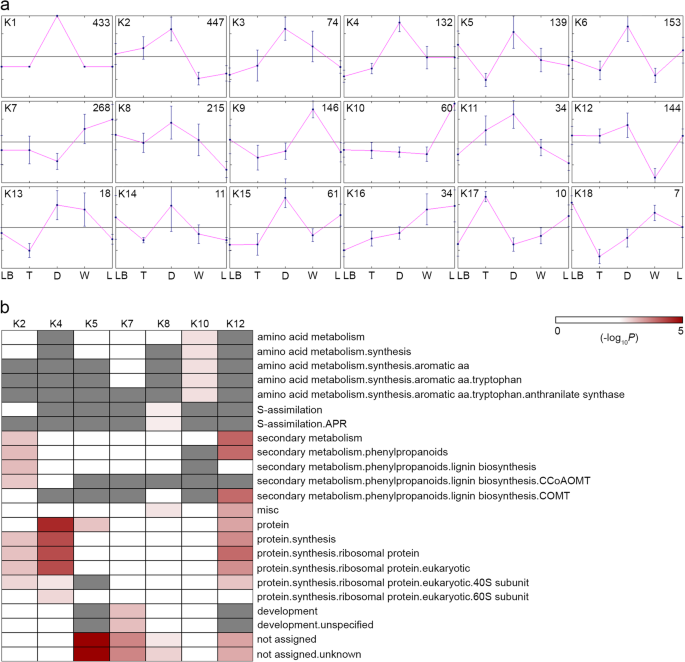
然后根据k-means聚类算法对显著差异基因进行分组。在k-means聚类之前,聚类的数量k是使用MeV程序中嵌入的优点数字(FOM)应用程序估计的[26].结果表明,调整后的FOM急剧下降,并在达到4个集群(附加文件1:图S9)。除FOM外,在R程序中使用间隙统计算法得到6个聚类(附加文件1:图S10)。因此,使用MeV程序的k-means / k- median Support Module (KMS),并应用Kendall tau秩相关,进行了3次k-means聚类分析,每次运行生成6个聚类。最终输出由18个共识聚类组成,所有成员基因在至少80%的K-Means运行中聚类在一起(图。4a).聚类1-6、8、11、12、14和15的基因在消化区表现出较高的表达量,而聚类9的基因在蜡区表现出较高的表达量。聚类10和17分别由在盖和卷须中高表达的基因代表。集群18由在叶基部高水平表达的基因组成。聚类13的基因在消化区和蜡质区均有较高水平的表达,而聚类7和16的基因在蜡质区和盖层均有高表达。
为了测试每个集群中MAPMAN功能类别的富集,进行了威尔士逊州统计,然后进行了本杰里尼 - Hochberg校正。18个集群中的七个显示了各种丰富的功能(图。4b) 是的。但大多数功能类别都集中在第12类,包括次级代谢、杂项和蛋白质合成。聚集在簇2中的DEGs表现出对次级代谢和蛋白质合成的富集。蛋白质合成也在簇4中富集,而簇5的基因在未分配的功能中表现出富集。聚类7显示出丰富的发展和未分配的功能。S同化和氨基酸代谢分别在簇8和簇10中富集。据报道,金鱼草花瓣发育过程中芳香族氨基酸含量增加,可能是为了吸引潜在的传粉者[27].因此,芳香氨基酸在杯盖中代谢N哈西亚纳水罐可能与昆虫对猎物的吸引力有关。“未分配”功能也在簇5、8和12中富集,并且可能包含特定于基因的基因N哈西亚纳(图。4b)。
转录组分析识别了参与猎物消化和植物防御的基因
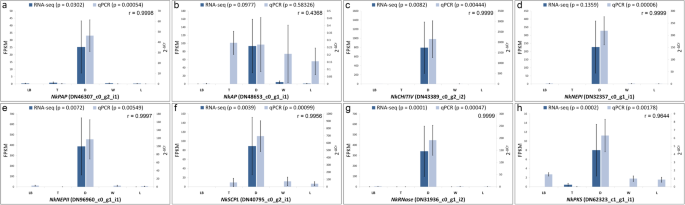
表格1显示对已知在牺牲品消化和植物防御中发挥作用的酶编码基因的同源性的转录物列表。在不同部分/区域中检测到的所有酶的完整列表N哈西亚纳leaf及其描述、功能、转录本id和丰度可以在其他文件中找到2:表S4。其中,天冬氨酸蛋白酶nepenthesin I和nepenthesin II (DN32357_c0_g1_i1, DN96960_c0_g1_i1),第IV类几丁质酶(DN167792_c0_g1_i1, DN43389_c0_g2_i1, DN43389_c0_g2_i2), c末端肽酶(dn61492_c2_i1, DN61492_c2_g2_i2), defensin (DN3077_c0_g2_i1), GDSL酯酶/脂酶(DN43304_c0_g2_i1, DN43304_c0_g2_i1),过氧化物酶(DN42192_c0_g1_i1, DN42192_c0_g1_i2)、磷酸酶(DN6769_c0_g2_i1)和丝氨酸羧肽酶(DN40795_c0_g2_i1, DN40795_c0_g2_i2)在消化区高水平表达,而在其他部位/区低表达或缺乏表达N哈西亚纳叶(表1). 编码Ⅲ型聚酮合酶的转录本在消化道也有高表达。此外,一些编码酶的转录本,如酸性磷酸酶(DN46307_c0_g2_i1、DN46369_c0_g1_i1和DN46369_c0_g1_i4)、酸性内酰胺酶(DN61615_c0_g1_i1和DN61615_c0_g1_i2)、C末端肽酶(DN61492_c2_g1_i9、DN61492_c2_g1_i2)、葡聚糖酶(DN60686_c0_g1_i1)、丝氨酸羧肽酶(DN55176_c1_g1_i1),S样RNase(DN31936_c0_g1_i1,DN31936_c0_g1_i2)和thaumatin样蛋白(DN58459_c0_g2_i6,DN60173_c0_g2_i12,DN60173_c0_g2_i2)在整个细胞中表达N哈西亚纳在消化区水平升高的叶子。一个编码脂质转移蛋白的转录本(DN14283\ u c0\ u g1\ u i1)也在整个细胞中表达N哈西亚纳叶子在投手管中的增加表达。使用实时验证RNA-SEQ数据QPCR分析表明两种数据之间的相关性强(图。5).
RNA-SEQ衍生的基因表达模式的图形表示已知在牺牲品消化和植物防御中起作用。还绘制了用于验证的相应QPCR数据('P'表示p价值观;n = 4.误差线表示标准误差)。每个基因的两个数据之间的皮尔逊相关(r)也被指出。每个基因的扩展形式在附加文件中表示1:表S3。括号内的代码表示文本id。磅:叶基地;T:卷须;D:消化区;W:蜡质区;L:盖子
已知在猎物消化和植物防御中起作用的基因也表达在未打开的猪笼草中N哈西亚纳
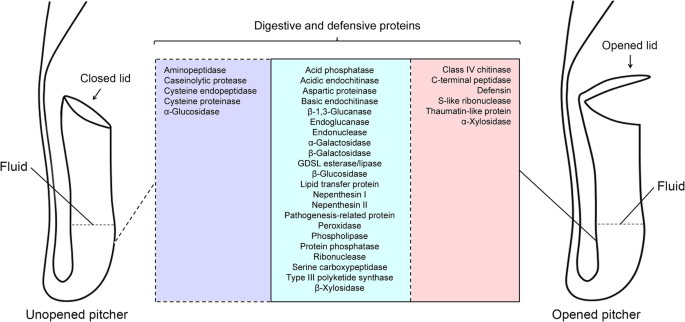
一个问题,目的是在未开封中也表达了类似种类的消化酶 - 编码基因N哈西亚纳壶,在其中的盖子仍然附在壶管(附加文件1:图。S11)。为了解决这个问题,我们研究了未开封的投手的转录组剖面,从本研究中独立产生[28]. 结果表明,大多数与猎物消化和植物防御相关的关键酶具有同源性的转录物也在未开放的基因中表达N哈西亚纳投手(附加文件)3.:表S5)。在打开和未打开的猪笼草之间通常表达的基因包括编码酸性磷酸酶、猪笼素I和II、GDSL酯酶/脂肪酶、过氧化物酶、III型聚酮合酶、致病相关蛋白和其他一些基因,而编码IV类几丁质酶、C末端肽酶、防御素、S样核糖核酸酶的基因,thaumatin样蛋白和α-木糖苷酶在开罐中特异表达(图。6). 因此,由于打开盖子,捕获的昆虫或病原微生物的存在,触发了更多编码其他关键消化酶的基因的表达。
转录组数据表明存在微生物转录本
我们的RNA-seq结果显示存在与微生物起源的基因同源性,即细菌和真菌(附加文件4:表S6和附加文件5:表S7)。细菌起源的转录本大部分在蜡样区检测到,虽然也有一些在消化区被发现(附加文件1:图S12)。就检测到的转录本数量而言,最丰富的细菌包括Chryseobacterium.(50),微杆菌(34),微球菌(26),葡萄球菌(12),和链球菌(10). 尽管许多转录物对应于具有蛋白水解和核水解活性的酶,即。鉴定了限制性内切酶(DN49567\U c0\U g1\U i1)、LD羧肽酶(DN53339\U c0\U g1\U i2)、M23家族肽酶(DN18977\U c0\U g1\U i1)、切核酸酶ABC亚基B(DN55294\U c1\U g1\U i1)和HNH内切酶(DN19920\U c0\U g3\U i1),这些酶是在蜡质区而不是消化区检测到的。
我们还检测到了真菌来源的转录本,其中大多数局限于猪笼管的不同部位/区域,而一些出现在高度专一化的整个猪笼管N哈西亚纳叶(附加文件5:表S7)。我们的数据进一步表明,与细菌相比,真菌主要发生在消化区(另一份文件)1:图S12)。在消化道中检测到真菌转录物的情况下,一些对应于编码参与蛋白质降解和有机磷酸盐水解的酶的基因。这些酶包括酸性磷酸酶(DN225864\ U c0\ U g1\ U i1)、酸性蛋白酶(DN47168\ U c0\ U g1\ U i1、DN47168\ U c0\ U g2\ U i1)和肽酶C1B(DN94491\ U c0\ U g1\ U i1),它们都属于metschnikowia bicuspidata.,一种真菌寄生虫。有趣的是,我们发现了甲虫传播的真菌包括罗汉果,德酵母,蛇舌草和Spathaspora passalidarum. 另外,一种嗜酸性丝状真菌Acidomyces richmondensis和蚂蚁相关的真菌阿塔菲洛夫拉还确定了。基于他们的转录数,最多的占优势真菌包括假丝酵母(141),Clavispora lusitaniae.(60),罗汉果(12),kwoniella.(18),Metschnikowia(167),真菌球孢菌(11),蛇舌草(15)和孢子丝(64)。
在未开封的水罐中也检测到微生物来源的转录本N哈西亚纳(附加文件6:表S8和附加文件7:表S9)。虽然检测到的细菌和真菌数量相对较少,但打开的和未打开的罐子确实共享微生物起源的转录本。这些转录本属于真菌属曲霉和塔拉莫尼斯以及细菌属气单胞菌属,伯克氏菌属,Pantoea和假单胞菌.
高度专业化的超微结构和解剖学N哈西亚纳叶
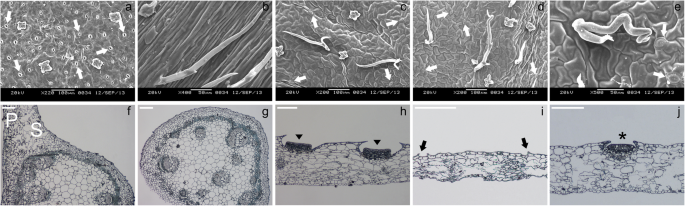
扫描电镜观察表明,叶基背面气孔的排列规律N哈西亚纳不遵循模型工厂中看到的单单元间距规则拟南芥[29].但与投手管的不同部件/区域的附带表面相比,叶片底座具有更多数量的气孔(图。7a e)。另一方面,卷须完全没有气孔(图。7b).这些观察结果还得到了指甲油表皮印记的支持,叶基部的气孔指数为11.19±0.96%,消化区、蜡质区和盖子的气孔指数分别为0.97±0.31%、1.26±0.33%和1.36±0.42%(附加文件)1:图。S13)。沿着横截面N哈西亚纳叶显示,在叶基部保持近轴/远轴极性,但在组成猪笼管的不同部分/区域变得模糊(图。7f j)。
气孔发育和叶片极性调控关键基因的表达模式
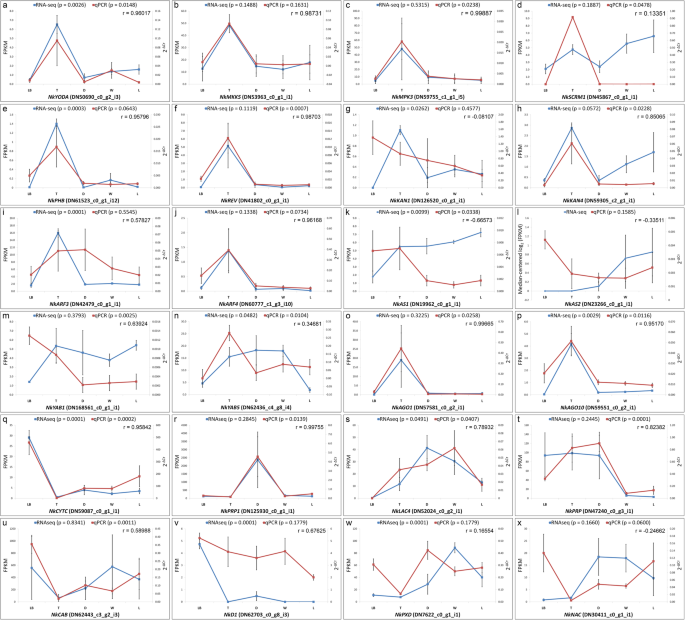
从大脑五个不同部位/区域的组织学和扫描电镜显微照片中提取线索N哈西亚纳研究了气孔发育和叶片极性分化相关基因的表达模式。由于所研究的样本代表成熟的组织,我们试图确定在气孔发育后期起作用的基因的表达模式。基于模型植物拟南芥的可用信息(见附加文件1:注意S1)并假设类似的基因控制气孔形成N哈西亚纳,我们预测NkYDA以及它的下游信号组件(nkmkk4 / nkmkk5和NkMPK3 / NkMPK6)将在叶碱中下调,在投手中相对较小,但在卷须中上调N哈西亚纳.我们还确定了表达式NkSCRM考虑到功能丧失的事实,预计卷须的表达增加scrm拟南芥突变体显示出升高的气孔密度[30].我们的结果显示,几乎所有基因的行为都与预测的一致。8模拟)。在N哈西亚纳,叶基部的近轴/远轴极性保持不变,但在组成猪笼管的不同部位/区域,极性丧失(图。7缩略词;还看到pavlovič等人。[4])。由于这种极性特征的缺失,我们试图确定高度专门化的叶片极性基因的表达模式N哈西亚纳叶子。三班成员同源域亮氨酸拉链(HD-ZIPII)基因家族,如Phabulosa(PHB),Phavora(PHV)和转速(REVOLUTA),的卡纳迪(KAN)编码核局部GARP域转录因子的基因家族,生长素响应因子(东盟地区论坛)基因家族,羧基终端PAZ和PIWI域含有Argonaute(前)基因和MYB域不对称叶子(AS)1和LOB域AS2公司转录因子在拟南芥中指定了adaxial / Zaxial叶极性。我们发现对拟南芥同源同源的转录物表达III高清拉链(NkPHB公司&恩克莱夫)以及ARGONAUTE(nkago1.&nkago10)在卷须中上调基因(图。8e、 f、o、p)。qPCR进一步验证RNA序列结果(图。8e,f,o,p)。数字8Q-X表示基于QPCR的随机选择基因的额外RNA-SEQ数据的验证。
讨论
投手N哈西亚纳利用多种酶来消化猎物
我们对转录组数据的分析表明N哈西亚纳投手使用多种酶来消化猎物(表1). 其中,几丁质酶是唯一的酶,以前已被分离和表征N哈西亚纳[16].利用简并PCR, Eilenberg等[16]确定了四类I类逐蛋白酶基因N哈西亚纳(NKCHIT1B-1和2,NKCHIT2B-1和2)。他们发现,两个几丁酶在投手(组织)中以响应于封闭的添加N哈西亚纳水罐陷阱模仿捕获的猎物。然而,在几丁质诱导之前也检测到NkChit2b的表达,这意味着这种酶可能代表组成性表达的内务几丁质酶。我们的结果证实了他们的发现,即在6个检测到的与酸性内切酶具有同源性的转录本中,有2个(DN61615\U c0\U g1\U i1,DN61615\U c0\U g1\U i2)在细胞的不同部位/区域表达N哈西亚纳叶子。其中一个转录物(DN168202_c0_g1_i1)仅在猪笼管中表达,其余三个转录物(DN167792_c0_g1_i1、DN43389_c0_g2_i1、DN43389_c0_g2_i2)对应于IV类几丁质酶,在消化区高水平表达。后者的转录本与Hatano&Hamada在2007年鉴定的转录本一致N阿拉塔,它们的蛋白质产品很可能被分泌到猪笼草的液体中N哈西亚纳帮助猎物消化和抵御病原体攻击。
我们的结果进一步表明,与猪笼素Ⅰ和Ⅱ具有序列同源性的转录物(DN32357×c0×g1×i1,DN96960×c0×g1×i1)在猪消化道中高水平表达N哈西亚纳. 猪笼素属于一类对天冬氨酸残基有特异性的酸性蛋白酶[31]. 它们与其他天冬氨酸蛋白酶(APs)的关系尚不清楚;因此被认为是APs的一个新的亚家族,与其他同源APs不同的是,APs被分泌到细胞外空间(消化液)[31].同样,基于rna序列衍生的表达模式,推测的神经节蛋白I和IIN哈西亚纳可能分泌到消化液中,帮助蛋白质降解。与此相反,从中分离到的4个APs同源物的表达N阿拉塔不局限于消化区,也在根、茎、叶和卷须组织中检测到,其中叶组织中含量最高[32]. Athauda等人[31]认为这些可能代表液泡性APs,不同于猪笼素。这一点在我们的研究中也很明显,其中一个转录本(DN48653\ U c0\ U g1\ U i1)的表达记录在细胞的其他区域/部分N哈西亚纳表明胞外和胞内APs均在黄芪中表达N哈西亚纳叶子。
其他在消化区表达相对较高的转录本(DN31936_c0_g1_i1, DN31936_c0_g1_i2)对应于S-like核糖核酸酶n bicalcarata. 马修斯[33]是第一个报告在几个国家的罐液中存在核糖核酸酶的人养猪以表明TMV RNA降解的实验为基础。类似地,斯蒂芬森和霍根[34]报道了猪笼液中核糖核酸酶活性的存在N腹肌,并鉴定具有66%同一性的推定的RNase克隆与S样RNase。最近的一项研究进一步证实了,由于在肉食植物的诱捕器官中表达了植物肉食中的植物疾病中的可能在植物肉类中的可能作用[35]. 在非肉食性植物中,磷酸饥饿或机械损伤可诱导S样rna酶的产生[36],可能在营养限制的情况下促进磷酸盐的动员。在N哈西亚纳,消化区S-like RNase的高表达可以促进磷酸盐的动员,促进生长和发育。猪笼草液体中磷酸盐的可用性是由于磷酸酶对猎物衍生的含磷酸盐化合物的作用而成为可能。在消化腺中检测到磷酸酶活性N托拜卡这些酶最容易被分泌到投手液中以帮助磷酸盐水解[37].我们的数据显示出表达分类对酸和蛋白质磷酸酶的同源性,其中一些(DN46307_C0_C0_G2_I1,DN46369_C0_G1_I1,DN46369_C0_G1_I4,DN6769_C0_G2_I1)在消化区中高度表达,为Płachno等人提供额外的支持。[37)观察N托拜卡.
目前的数据还显示存在与假定的过氧化物酶共享同源性的转录本。过氧化物酶已在许多养猪在植物保护中对病原菌起着重要的作用[38]. 它们也可以通过产生活性氧来帮助蛋白质降解[39].从我们的数据中获得的一个转录本DN61358_c1_g2_i4与从N阿拉塔[38].然而,与我们的结果中鉴定的其他假定过氧化物酶(DN42192_c0_g1_i1, DN42192_c0_g1_i2)相比,其表达水平较低。这些假定的过氧化物酶在整个细胞中表达N哈西亚纳在消化区中具有更高表达的叶子。这种相对大的高表达推定的过氧化物酶显示了过氧化物酶在牺牲品消化和免受病原体攻击的保护中起作用的至关重要作用。
我们的转录组数据还指出存在编码c末端肽酶的转录本,其中5个在消化区有较高水平的表达(表1). C-末端肽酶是一类丝氨酸蛋白酶,早期在人类消化液中发现N阿拉塔[40]. 有趣的是,我们对转录组数据的分析也表明存在一个与富含半胱氨酸的蛋白防御素同源的转录物(DN3077\ U c0\ U g2\ U i1)。这些蛋白质主要对真菌起作用[41].
在最近的一项研究中,Rottloff等人。[42]确定了20种新的蛋白质,可能分泌到五个不同的投手液中养猪物种。包括丝氨酸羧肽酶、α-和β-半乳糖苷酶、脂质转移蛋白和酯酶/脂肪酶。我们在这里还显示了与这些假定蛋白质具有同源性的转录物的存在,从而证实了Rottloff等人的研究[42观察。其中,编码丝氨酸羧肽酶的两个转录本(DN40795_c0_g2_i1, DN40795_c0_g2_i2)与Rottloff等人鉴定的转录本相匹配[42]这两种蛋白都只在消化道表达。综上所述,我们的发现表明N哈西亚纳植物表达一系列编码有助于消化捕获猎物的基因的酶,其中一些可能是该属的代表养猪.
致病相关(PR)基因表达N哈西亚纳抑制病原微生物生长的猪笼草
一旦捕获的猎物被消化,猪笼草中的液体就会成为植物生长发育所需的丰富营养来源。反过来,它也有利于细菌和真菌的生长。因此,两者之间存在着竞争养猪植物和微生物对罐液中有效养分的吸收[15].为了充分利用溶解的营养素,养猪植物通过释放致病相关(PR)蛋白来抑制潜在微生物竞争对手或病原体的生长。早前的研究表明,PR蛋白如索马汀样蛋白和β-1,3-葡聚糖酶可分泌到猪笼草的猪笼草液中N阿拉塔[30]. 我们的结果显示存在与thaumatin样蛋白和葡聚糖酶具有同源性的转录物。thaumatin样蛋白的两个转录本(DN60173_c0_g2_i12,DN60173_c0_g2_i2)与先前在养猪,所有这些都在消化区中高度表达。尽管在消化区中的较高水平的情况下表达单个转录物(DN60686_C0_G1_I1)的表达,但在消化区中的较高水平,两种β-1,3-葡聚糖酶转录物(DN24941_C0_C0_G1_I3,DN62573_C0_C0_G1_I5)的表达式表达N哈西亚纳这和从N阿拉塔相对较低,暗示β-1,3-葡聚糖酶不会强烈诱导N哈西亚纳。这也可能是在N阿拉塔,作为畑野和滨田的银色SDS-PAGE凝胶[30]指向微弱的信号从而证实了我们的结果。脂肪酶也被检测到在几个国家的罐液养猪物种[38,39,42,43]; 但是它们的作用还不清楚,尽管有人认为它们通过破坏细胞膜来促进蛋白质的利用[44]. 我们检测到一些与GDSL样脂肪酶相匹配的转录物,其中一些仅在消化区表达(DN43304\U c0\U g1\U i1,DN43304\U c0\U g2\U i1)。GDSL脂肪酶样1(GLIP1)诱导拟南芥对病原菌的系统抗性[45]. 由于其在消化道中的表达增加,结果表明其在植物免疫中的作用。此外,我们还鉴定了一些与肉食性植物Ⅲ型聚酮合成酶(PKS)基因同源的转录本Drosophyllum lusitanicum.III型pks参与次生代谢物的生物合成[46],其中包括萘醌类[47].III型PKS基因在消化区中的专用表达N哈西亚纳表明防御微生物病原体需要萘醌。除了这些酶之外,IV类Chitinase是另一种蛋白质,其有助于植物防御,结果表明它在投手中高度表达。基于我们的结果,硫红素样蛋白,IV类曲丁醇酶和GDSL样脂肪酶提供保护N哈西亚纳针对病原体攻击。
真菌起源的转录本大多在消化区检测到
微生物在从未开封的流体中分离后,微生物在猛禽消化中的作用被带入敏捷程度N阿拉塔投手[48]. 这一情况仍有报道[13,14,尽管其他一些证据表明一种没有微生物的消化液来自未开封的养猪投手[12,15].我们不会试图在本文中解决这一争议;然而,我们确实认为由于检测到微生物来源的转录物而有关于这方面的讨论。我们的结果显示了不同部位/地区的细菌和真菌的存在N哈西亚纳叶子。这是预期的,因为组织是从开放的N哈西亚纳猪笼草和报告表明存在内生细菌或来自叶圈[14,48]. 但有趣的是这些微生物被检测到的模式:细菌起源的转录物主要出现在蜡质区,而真菌的转录物则出现在整个叶片上,其中大部分在消化区被检测到。这与Buch等人的研究结果一致[15]这表明细菌在猪笼液中培养时会死亡,而真菌则存活下来,但无法生长。它还指出了真菌所起的重要作用,如果在所有微生物参与猎物消化或竞争可用的营养物质。真菌内生菌已从几种植物中分离出来Sarracenia.和养猪物种[49,50]在他们中间,曲霉,刺盘孢属,Meyerozyma,青霉素和trichoderma.代表本研究中发现的一些属。Meyerozyma Guilliermondii.是一种溶磷酵母菌,能促进玉米和莴苣的养分吸收,并对真菌病原体有保护作用[51]. 这一证据表明两者之间存在着共生关系N哈西亚纳和真菌。我们不排除细菌在猎物消化中的作用,因为某些细菌转录本在消化区被检测到。就像人类肠道的情况一样,这些物质实际上可能有助于被捕获猎物的消化。事实上,我们发现了与人类肠道中报告的细菌相匹配的转录本,例如双歧杆菌[52]. 令人惊讶的是,在目前的研究中,只有两种细菌物种与最近从一个动物的消化液中发现的细菌物种相匹配养猪16S rDNA和MALDI-TOF质谱[53].这些包括Leifsonia Aquatica.和短黄杆菌. 尽管Chan等人[53]没有指定物种名称,这些结果意味着不同养猪物种拥有不同的微生物群落。这一命题也得到了Takeuchi等人研究的支持[14],它只检测到一个细菌运作的分类单位(OTU),其中16个养猪调查样本。然而,在14个样本中,Takeuchi等人[14]检测到22个共享OTUs,本研究也检测到部分OTUs。这些包括不动杆菌,芽孢杆菌,微球菌,足杆菌,假单胞菌,和红球菌.
未开封的投手N哈西亚纳表达参与猎物消化和抵御病原体攻击的几个基因
几份报告指出了未开封的流体中酶活性的存在养猪投手。Tökés等人。[44]确定了两种不同分子量的蛋白酶,并证明存在脂肪酶活性N麦克费拉内伊. 在三个未打开的罐子中也观察到了几种酶养猪物种,即。N阿拉塔,N托拜卡,和N腹肌[54];在某些物种中养猪未开封和未开封的猪笼草都表现出相同水平的磷酸酶活性[55].在打开投手盖之前,它很可能是那么多养猪猪笼草表达了一些与猎物消化和抵御病原体攻击有关的基因。这一观点从我们对未打开的转录组数据的分析中得到支持N哈西亚纳投手。结果表明,在未开封的投手中也表达了对参与杂种消化和植物防御的关键酶的大多数转录物也在未开封的投手中表达。例如,Nepenthesin I和II通常在开放和未开封的投手中表达。另一方面,IV类Chitinase在打开的投射器中特异性地表达(图。6). 我们的发现表明,对于捕获的猎物或致病微生物的存在,N哈西亚纳植物采用更广泛的消化酶。
叶片极性基因可能在植物的发育中起着关键作用养猪投手
我们基于相关性的层次聚类分析表明,叶基和猪笼管的不同部分/区域之间的表达模式相似。这些相似之处不仅表明了功能关系,而且表明了相似的细胞过程[56]这两个不同结构的发展基础,即叶基和猪笼草。数字7表明养猪猪笼草具有气孔,尽管与光合作用有效的叶基相比,气孔数量减少。这表明,招募潜在的遗传机制,控制气孔发育过程。然而,扫描电镜照片和表皮印记显示,它们的低密度表明,正调控气孔发育的基因表达减少。假设已知基因在模式植物气孔发育中起作用拟南芥也对这种发展事件负责吗N哈西亚纳,我们基本上可以预测它们的表达模式N哈西亚纳叶子。大多数基因的行为与预期一致(图。8),并且在遵循预测模式的情况下,qPCR结果也与它们很好地相关(图。8a-c)。有趣的是,沿着N哈西亚纳叶基部被描绘成典型的被子植物叶,极性保持,表现出明显的近轴域和远轴域(图。7f).然而,壶状细胞和壶盖细胞并没有分化为栅栏组织和海绵组织(图。7h-j型;另请参阅Pavlovič等人[4]),表示极性规格的损失。我们最近展示了一个年轻的投手N哈西亚纳叶片具有与幼卷叶基部叶片相同的解剖特征[28],表明水罐极性的丧失发生在水罐发育的后期。近轴-远轴极性的损失养猪投手可能与减少相关联kan1.表达和/或增加AS2公司正如在拟南芥中所证明的那样,叶片解剖功能丧失kan1.突变体和AS2公司与野生型相比,过表达植物的正-背面极性被破坏[57,58]. 我们将我们的研究扩展到与叶极性规范相关的基因,并确定了它们在叶片中的表达模式N哈西亚纳叶子。然而,RNA-seq衍生的表达模式恩卡恩1和NkAS2基因不遵循预测的模式(图。8g l);而是第III类的表达同源域亮氨酸拉链(HD-ZIPII)和ARGONAUTE(前)在卷须中上调基因(图。8e、 f、o、p)。以往的研究表明,近轴晶的本构表达式HD-ZIPIII基因博士和版次改变了扁平的卵形形状的叶子拟南芥变成棒状或喇叭状的叶子[59,60,61].这些叶在表皮表面显示出丰富的毛状体,这是叶片正向表型的特征[62]. 除了表现出PHB / REV.表情,卷须N哈西亚纳由相对较多的毛状体组成(图。1和7b) ,与在拟南芥叶片中观察到的一致PHB1-D.突变体[62]. 毛状体也观察到在背轴表面N哈西亚纳猪笼草包括消化区,蜡质区和盖子(图。7c-e)。
结论
在本研究中,我们分析并报告了高度专业化的N哈西亚纳叶包括叶基片,卷须和猪笼管的不同部分/区域,即消化区,蜡区和盖。我们发现,不管猪笼草的盖子是打开还是关闭,许多参与猎物消化和植物防御的酶编码基因都被普遍表达。这个观察结果表明养猪植物通过在投射器盖子的开口之前装备猎物吸引力,捕获和消化所需的必要机器。此外,我们的研究结果意味着如果在所有微生物都涉及任何微生物,则真菌可能在捕获的猎物消化中发挥至关重要的作用,并且可能存在作为Sembionts养猪植物。此外,我们还发现,叶基部的近轴极性和远轴极性保持不变,但在组成猪笼管的不同部位/区域中却被破坏。我们对一些已知在叶极性规范中起作用的基因的RNA-seq衍生表达模式的研究表明高清拉链基因可能在发展中发挥关键作用养猪投手。
方法
植物材料和组织收获
猪笼草本研究中使用的植物在位于Jaraiñ, Jaiñtia Hills District, Meghalaya(25°18.651,92°07)的野外发现。786 E),代表5个不同部分/区域的组织N哈西亚纳叶,即叶基部,卷须,消化区,蜡质区和盖子在两个单独的日期收获,一个在2013年6月和另一个在2013年10月(附加文件1:图S14系列)。我们认为在两个不同的时间采集样本不会影响结果,因为这些样本代表的是同一类的营养组织;相反,这种抽样策略会为我们的发现增加更多的力量。选择成熟的叶子,其特征是有一个打开的盖子,并在消化液中存在捕获的、杀死的昆虫。在组织冷冻前,液体被抽干了。然后,组织样本在液氮中冷冻,转移到干冰中,运送到新德里的贾瓦哈拉尔·尼赫鲁大学(Jawaharlal Nehru University),并保持在−80℃,直到进一步处理。组织样本由杰里米·德卡尔(Jeremy Dkhar)在两次单独的旅行中收集。鉴定的植物物种是由杰里米Dkhar基于可靠的来源可在文献。一个凭证标本有一个沉积编号17466已经被保存在csir -研究所喜马拉雅生物资源技术,帕兰普尔,印度植物标本室。
组织学和扫描电子显微镜(SEM)分析
每个部分/区域的小组织块N哈西亚纳叶片固定在0.1 M磷酸盐缓冲液,含2.5%戊二醛(pH 7.2). 固定组织样品通过分级乙醇系列脱水,包埋在饱和石蜡中,横切面,在二甲苯中脱蜡,用0.05%甲苯胺蓝染色,并使用尼康Eclipse Ti-S倒置显微镜进行观察和拍照,该显微镜可在新德里JNU生命科学学院中央仪器设备处获得。对于SEM,样品在锡隆东北山地大学的精密分析仪器设备上进行处理。固定样品在缓冲液中洗涤过夜,在1%四氧化锇中后固定,通过增加丙酮浓度脱水,使用HCP-2(日立)临界点干燥器干燥,涂金并在JEOL JSM-6360 SEM下观察。
RNA提取、文库制备和测序
我们从所有五个不同的部分/区域提取总RNAN哈西亚纳按照制造商的说明,使用Raflex试剂盒(印度班加罗尔Genei)和/或Spectrum Plant Total RNA试剂盒(美国西格玛)。使用安捷伦2100生物分析仪对提取的RNA样品进行质量检查。提取的rna在EtBr染色的甲醛琼脂糖凝胶上显示三条不同的条带(28S、18S和5S)1:图S15)。所提取RNA的RNA完整性数(RNA integrity number, RIN)值为6.6 ~ 8.5。文库的制备和测序工作在印度班加罗尔的细胞和分子平台中心进行。每个样品用1微克RNA进行文库制备,用polydT Oligo珠纯化mRNA。然后将mRNA片段化,然后进行cDNA合成。末端修复,a -尾迹和适配器连接,然后PCR富集15个周期。使用安捷伦生物分析仪对生成的文库进行验证,并在Illumina HiSeq 1000平台上按照制造商推荐的方案进行测序,生成2 × 100 bp的配对端数据。五个不同的部分/区域N哈西亚纳从两个单独的个体植物中收获叶子并分开测序。因此,用于RNA-SEQ的两个生物重复。
数据预处理和解除污染
数据预处理和净化步骤如Dkhar和Pareek所述[28].
从头转录组组装、注释和差异表达分析
转录组reads被汇集到一个单一的数据集,并使用Trinity进行从头组装[18,19],应用默认设置。然后,我们将每个组织(即叶基部、卷须、消化区、蜡质区和盖子)的单个读数与组装的参考转录组对齐,以使用Bowtie2版本2.2.2估计基因表达。我们在种子区域(长度)允许最多1个不匹配 = 31 bp),并报告所有多个映射位置。使用SciGenom Labs Pvt.Ltd.Perl脚本计算FPKM值。然后使用SciGenom Labs Pvt.Ltd.pipeline CANoPI(Contig Annotator pipeline)对组装的转录本进行注释。FPKM成绩单≥1和最小长度 ≥ 用blastx2.2.28程序对NCBI非冗余蛋白质数据库进行注释[20], e值截止≤10− 5.相似性得分 ≥ 40%. BLASTX hits转录本也在UniProt数据库中进行了注释。带读取计数的成绩单≥用DESeq 3.2.0进行差异基因表达分析[22]. 分析是在部分/区域之间成对组合进行的,例如叶基与卷须、卷须与叶基、叶基与消化区等,以确定每个部分/区域中上调和下调的基因。经调整的成绩单p-value (FDR)≤0.05和log fold change (logFC)≥1或≤−1被认为是显著性差异表达。
相关分析
我们使用自由的R软件(https://www.r-project.org/)对该区域的五个不同部分/区域进行相关性分析N哈西亚纳如Dkhar和Pareek在Dkhar和Pareek中提到的叶子[28].
过度代表性分析
在运行过度复苏分析之前,使用自动注释软件符号生成DEG的映射文件[23].在这里,所有的DEGs序列都被用作输入序列,并作为一个fasta格式的文件上传到Mercator的web应用程序http://www.plabipd.de/portal/web/guest/mercator- sequence-annotation..每个输入序列都应该映射到一个或多个MapMan bins。在PageMan软件中实施的benjamin - hochberg校正后的Fisher精确测试[24]被用来识别大脑不同部位/区域之间存在显著差异的功能地图员类别N哈西亚纳叶子。
K-mears聚类和功能类别富集分析
在聚类之前,使用嵌入在MEV计划中的优点(FOM)应用程序的图来估计群集k的数量[26].FPKM值在整个过程中加1和log2在运行FOM之前转换。执行五次运行,所有运行显示出类似的结果。除了FOM,间隙统计算法[63]在r(https://www.r-project.org/)也被用来估计聚类的数量k。在估计k (k = 4)之后,我们对显著的deg (log)进行k-means聚类2利用MeV中的K-means/K-medians支持(KMS)模块和Kendall-tau秩相关对FPKM进行变换。KMS进行了四次。通过应用Wilcoxon统计量和Pageman中的Benjamini-Hochberg多重检验校正,对每个聚类进行了功能MapMan分类富集分析[24].
识别与猎物消化和植物防御有关的基因
我们手动搜索了注释的成绩单列表,显示出明显的差异表达,以识别捕食性消化和免受病原体攻击的保护的基因。然后我们检查了他们的丰富,并比较了他们的五个不同部分/区域之间的表达模式N哈西亚纳叶子。
植物发育关键调控基因的转录谱分析
同样,我们检测了与气孔发育和叶片极性相关的关键调控基因的表达水平。我们将我们的研究扩展到注释转录本的总列表中,以确定感兴趣的基因,并比较它们在基因的五个不同部分/区域中的表达模式N哈西亚纳叶子。
使用实时QPCR验证RNA-SEQ数据
RNA-seq结果用实时qPCR进行验证。使用第一链cDNA合成试剂盒(Thermo-Scientific)合成了四个生物复制体的cDNA。用于验证的转录本是从已知在猎物消化和植物防御、气孔发育和叶片极性中起作用的基因列表中选择的。另外,8个随机选择的基因也被用于验证。我们最初测试了四个内源性基因{肌动蛋白,延伸因子(精灵),甘油醛-3-磷酸脱氢酶(GAPC2.)和泛素(UBQ)对于稳定的表达,其中一个(精灵),对所选基因的表达进行归一化。Real-time qPCR检测如Dkhar和Pareek所述[28].每个样本分析3个技术重复,数据分析使用7500 Software v 2.0.5 (Applied Biosystems)软件进行。2-ΔCT生成值,然后将其与RNA-seq衍生的FKPM值进行比较。采用SPSS软件进行方差分析,检验显著性水平(p< 0.05),计算Pearson相关性(r),检验RNA-seq数据与qPCR数据的相关性。表S3附加文件1包含qPCR引物列表。
在未开封的投手中识别参与猎物消化和植物防御的基因N哈西亚纳
未开封的投手养猪已知含有消化液,但与开胃的液体相比,其含量较少养猪投手[64]. 它也可能含有非常低水平的蛋白质,在打开瓶盖时蛋白质含量会增加,或者与打开的瓶盖的蛋白质含量相同[55].在这样的场景中,预期的是未开封的投手养猪应显示与猎物消化和植物防御有关的基因表达。为了证实这一点,我们检查了一个未开封的N哈西亚纳猪笼草,以确定基因参与猎物消化和防止病原体攻击。然后,我们将它们与那些从水罐中分离出来的基因进行了比较N哈西亚纳. 未打开的N哈西亚纳投手是独立产生的,与本研究的目的不同[28],并可在NCBI在线查阅,登录号为SRR4340048 (raw reads)和GFDV00000000(组装转录序列)。所有生物信息学分析步骤导致鉴定未开封的degN哈西亚纳如上所述进行投手。
可用性数据和材料
在当前研究期间生成和分析的数据集可在NCBI短读档案中获得,登记号为SRP064181。
缩写
- 前:
-
ARGONAUTE
- 度:
-
差异表达基因;
- 飞行里程:
-
每千碱基转录本每百万映射读取片段数
- HD-ZIPIII:
-
第三类同源域亮氨酸拉链
- 版次:
-
罗沃拉
- 扫描电镜:
-
扫描电子显微镜
参考文献
- 1.
艾伯特·VA,威廉姆斯·SE,蔡斯·MW。食肉植物:系统发育和结构进化。科学。1992;257:1491–5.
- 2.
埃里森AM, Gotelli NJ。能量学和食肉植物的进化——达尔文的“世界上最奇妙的植物”。实验机器人。2009;60:19-42。
- 3.
Król E、Płachno BJ、Adamec l、Stolarz M、Dziubièska H、Trębacz K。有很多理由称食肉动物为“世界上最奇妙的植物”。安·博特。2012;109:47–64.
- 4.
帕夫洛维奇,马萨罗维奇,胡达克。猪笼草属亚洲猪笼草的食肉综合征。安·博特。2007;100:527–36.
- 5.
猪笼草是如何诱捕昆虫的。新的科学。1962;13:75 - 77。
- 6.
Gaume L,Giusto BD。Nepenthes Rafflesiana蜡质区的自适应意义和梭子变异性。Ann Bot。2009; 104:1281-1291。
- 7.
Bauer U,Federle W。猪笼草诱虫缘的表面结构与功能。电厂信号行为。2009;4:1019–23.
- 8.
肉食性猪笼草的形态遵循功能:形态多样化和交替诱捕策略。进化生物学杂志,2012;25:90-102。
- 9.
Bauer U,Federle W,Seidel H,Grafe Tu,Ioannou CC。如何捕获更多的猎物,较少有效的陷阱:解释临时无活性陷阱在食肉投手植物中的演变。Proc R SoC B. 2015; 282:20142675。
- 10
Gaume L, Forterre YA。肉食性猪笼草中的粘弹性致命液体。《公共科学图书馆•综合》。2007;2:e1185。
- 11
Bonhomme V,Pelloux-Prayer H,Jousselin E,Forterre Y,Labat Jj,Gaume L.滑溜溜或粘性?猪肉肉食植物捕获策略中的功能多样性。新植物。2011; 191:545-54。
- 12
关键词:聚类,聚类,聚类,聚类猪笼草分泌物的SDS-PAGE蛋白图谱作为鉴别猪笼草种类的新工具。Am J Bot, 2013; 100:2478-2484。
- 13
周利,陈志明,戴克斯。与三种生长在野外的猪笼草(忘我科)猪笼草植物猪笼草液相关的细菌群落。拱Microbiol。2014;196:709-17。
- 14
Takeuchi Y,Chaffron S,Salcher MM,Shimizu Inatsugi R,Kobayashi MJ,Diway B等。猪笼草属猪笼草液体中细菌多样性和组成。系统应用微生物学。2015;38:330–339.
- 15
Buch F, Rott M, Rottloff S, Paetz C, Hilke I, Raessler M, Mithöfer A.肉食性猪笼草分泌的诱捕液不适合微生物生长。安机器人。2013;111:375 - 83。
- 16
Eilenberg H、Pnini Cohen S、Schuster S、Movtchan A、Zilberstein A。肉食性植物猪笼草几丁质酶基因的分离与鉴定。J实验机器人。2006;57:2775–84.
- 17
Eilenberg H,Pnini-Cohen S,Rahamim Y,Sionov E,Segal E,Carmeli S等人。诱导食肉植物芽孢菌菌的投手中抗真菌萘醌的生产。J Exp Bot。2010; 61:911-22。
- 18.
Grabherr Mg,Haas Bj,Yassour M,Levin Jz,Thompson Da,Amit I等。三位一体:在没有来自RNA-SEQ数据的情况下重建全长转录组。NAT。Biotechnol。2011; 29:644-52。
- 19.
Haas BJ,Papanicolaou A,Yassour M,Grabherr M,血液PD,Bowden J,等人。从RNA-SEQ使用Trinity平台进行参考生成和分析的DE Novo转录序列重建。NAT PROTOC。2013; 8:1494-512。
- 20.
Altschul SF、Gish W、Miller W、Myers EW、Lipman DJ。基本的局部对齐搜索工具。分子生物学杂志。1990;215:403–10.
- 21.
Langmead B,Trapnell C,Pop M,Salzberg SL.短DNA序列与人类基因组的超快和记忆有效比对。基因组生物学。2009;第10章:R25。
- 22
序列计数数据的差异表达分析。基因组医学杂志。2010;11:R106。
- 23
Lohse M,Nagel A,Herter T,May P,Schroda M,Zrenner R,et al.Mercator:一种用于植物序列数据基因组尺度功能注释的快速简单的网络服务器。植物细胞环境。2014;37:1250–8.
- 24
Usadel B,Nagel A,Steinhauser D,Gibon Y,Bläsing OE,Redestig H,et al.《PageMan:一种交互式本体工具,用于生成、显示和注释概要分析实验的概述图》。生物信息学。2016;7:535.
- 25
罗宾斯RJ,杜松柏BE。长肌薯蓣属植物的分泌周期。二。分泌蛋白质的储存和合成。新植物醇。1980;86:297–311.
- 26.
李建平,李建平,梁伟,等。TM4:一个用于微阵列数据管理和分析的免费开源系统。生物学技术。2003;34:374-8。
- 27.
Muhlemann JK,Maeda H,Chang CY,San Miguel P,Baxter I,Cooper B等。金鱼草花代谢网络的发育变化。公共科学图书馆一号。2012;第7章:e40381。
- 28.
DKHAR J,Pareek A.不对称的叶子1和ruboluta是与尼泊什尼斯卡尼亚人的投手发育相关的关键调节基因。SCI批准。2019; 9:6318。
- 29.
杨M,我是FD。拟南芥过多的嘴和四个唇的突变影响气孔的产生。植物细胞。1995;7:2227–2239.
- 30.
Kanaoka MM, Pillitteri LJ, Fujii H, Yoshida Y, Bogenschutz NL, Takabayashi J,等。尖叫/ICE1和SCREAM2指明了导致拟南芥气孔分化的三个细胞状态的过渡步骤。植物细胞。2008;20:1775 - 1785。
- 31
Hatano N,Hamada T。食肉植物猪笼草猪笼水蛋白质组分析。蛋白质组研究杂志,2008;7:809–16.
- 32
Athauda SB,Matsumoto K,Rajapakshe S,Kuribayashi M,Kojima M,Kubomura Yoshida N,et al.猪笼素的酶学和结构表征,猪笼素是一种新型天冬氨酸蛋白酶亚家族的独特成员。生物化学杂志。2004;381:295–306.
- 33
安慈、福崎E、小林A。天冬氨酸蛋白酶在肉食性植物猪笼草的猪笼草中表达。足底。2002;214:661–7.
- 34
杨建平。猪笼草核糖核酸酶的研究进展。生物化学学报,2000,29(3):431 - 431。
- 35
斯蒂芬森P,霍根J。肉食性植物猪笼草中核糖核酸酶、半胱氨酸蛋白酶和天冬氨酸蛋白酶的克隆与鉴定。国际植物科学杂志。2006;167:239–48.
- 36
Nishimura E,Kawahara M,Kodaira R,Kume M,Arai N,Nishikawa J等。S样核糖核酸酶基因在食肉植物中的表达。足底。2013;238:955–67.
- 37
冈部T、岩手Y、森H、小川T、大山T。在食肉植物Drosera adelae中,一个S样核糖核酸酶基因被用来产生一种陷阱叶酶。费布斯莱特。2005;579:5729–33.
- 38
PłachnoBJ,Adamec L,Lichtscheidl Ik,Peroutka M,Adlassnig W,Vrba J.肉食植物消化腺中磷酸酶活性的荧光标记。植物BIOL。2006; 8:813-20。
- 39
HATANO N,HAMADA T.肉食植物胰岛肉质植物液中捕食性诱导分泌蛋白质蛋白质组学分析。J蛋白质组。2012; 75:4844-52。
- 40。
Chia TF, Aung HH, Osipov AN, Goh NK, Chia LS。肉食性猪笼草利用自由基消化猎物。氧化还原众议员9:255 2004;61年。
- 41。
Fukushima K,Fang X,Alvarez-Ponce D,Cai H,Carretero-Paulet L,Chen C,等。投手植物Cephalotus的基因组揭示了与肉食相关的遗传变化。NAT ECOL EVOL。2017; 1:59。
- 42。
Stotz HU、Thomson JG、Wang Y。植物防御素的防御、开发与应用。电厂信号行为。2009;4:1010–2.
- 43。
Rottloff S、Miguel S、Biteau F、Nisse E、Hammann P、Kuhn L等。猪笼草消化液蛋白质组分析。安·博特。2016;117:479–95.
- 44.
Lee L,Zhang Y,Ozar B,Sensen CW,Schriemer DC。肉食营养在投手植物(Nepenthes SPP。)通过不寻常的内源性酶补充剂。J蛋白质组。2016; 15:3108-17。
- 45.
Tökés ZA, Woon WC, Chambers SM。肉食性植物猪笼草分泌的消化酶。1974;119:39-46。
- 46
Kwon SJ,Jin HC,Lee S,Nam MH,Chung JH,Kwon SI,等.拟南芥中GDSL脂肪酶样1调节与乙烯信号相关的系统抗性。植物J。2009;58:235–45.
- 47
Flores-Sanchez IJ,Verpoorte R.植物聚酮合成酶:令人着迷的酶组。植物理性生物化学。2009; 47:167-74。
- 48
Jindaprasert A, Springob K, Schmidt J, De-Eknamkul W, Kutchan TM。用III型聚酮合成酶从果蝇中合成吡酮聚酮。Phytochem。2008;69:3043-53。
- 49
Sota T,Mogi M,Kato K.本地和区域规模的食物网结构在山雀塔拉塔罐头。Biotropica。1998; 30:82-91。
- 50。
李建民,陈伟士,丁爱希。揭示了热带猪笼草内生真菌的抗菌和酶活性。Mycosphere。2014;5:364 - 77。
- 51。
植物内生真菌多样性。《公共科学图书馆•综合》。2012;7:e32980。
- 52。
李永平,李永平,李永平。土壤溶磷酵母Meyerozyma guilliermondii CC1提高了玉米(Zea mays L.)产量,并减少了所需的化肥。土壤植物。2013;373:301-15。
- 53。
肠道菌群与健康和疾病。《柳叶刀》杂志。2003;361:512-9。
- 54。
Chan X-Y,Hong K-W,Yin W-F,Chan K-G。微生物组和生物催化细菌在猴子杯(Nepenthes Pitcher)消化液中。SCI REP。2016; 6:20016。
- 55
哈帕是,哈勒姆是。忘忧草科猪笼草、猪笼草和猪笼草的猪笼草消化腺和酶的发育。植物学报,2008;
- 56
Takeuchi Y,Salcher MM,Ushio M,Shimizu Inatsugi R,Kobayashi MJ,Diway B,et al.2011.猪笼草属四种猪笼草植物液体溶解和颗粒部分的原位酶活性。PLoS One 2011年;第6章:e25144。
- 57
Eisen MB,Spellman Pt,Brown Po,Botstein D.集群分析和基因组表达模式的显示。Proc Natl Acad Sci U S A. 1998; 95:14863-8。
- 58
林战,帅B,Springer PS。拟南芥横向器官界限 - 域基因不对称的叶片2在抑制knox基因表达和对脂肪图案中的作用。植物细胞。2003; 15:2241-52。
- 59
克斯特特·拉,博尔曼·K,泰勒·拉,博姆斯·K。Poethig RS.KANADI调控拟南芥器官极性。自然。2011;411:706–709.
- 60.
McConnell JR,Emery J,Eshed Y,Bao N,Bowman J,Barton MK.PHABULOSA和Phavolula在确定嫩枝辐射模式中的作用。自然。2001;411:709–13.
- 61。
Emery JF,Floyd SK,Alvarez J,Eshed Y,Hawker NP,Izhaki A等.第三类HD-ZIP和KANADI基因对拟南芥新梢的径向模式化。电流生物学。2003;13:1768–74.
- 62。
钟锐,叶志华。两维管束1是IFL1/REV基因的功能获得突变,与叶、茎和心皮的极性改变有关。植物细胞生理学。2004;45:39 - 85。
- 63。
Bowman JL、Eshed Y、Baum SF。被子植物侧器官极性的建立。趋势Genet。2002;18:134–41.
- 64。
提比希拉尼R,沃尔特G,黑斯蒂T。通过间隙统计估计数据集中的聚类数。J R Stat Soc B.公司。2001;63:411–23.
- 65。
Juniper BE, Robins RJ, Joel DM.食肉植物。伦敦:学术出版社;1989.
确认
作者感谢编辑和两位匿名审稿人的批评阅读和改进手稿的建议。作者感谢班加罗尔的细胞和分子平台中心在测序方面的帮助养猪叶转录组。作者感谢喀拉拉邦Scigenom实验室私人有限公司在数据分析(组装、注释和差异表达分析)方面的帮助。
基金
这项工作得到了印度政府科技部(DST)的资助(DST INSPIRE Faculty Scheme IFA12-LSPA-07)。DST在研究设计、数据收集和分析、决定出版或准备出版手稿方面没有发挥任何作用。
作者信息
从属关系
贡献
JD和AP构思了这个项目。JD和AP设计了项目的实验流程。JD进行了实验。YKB和AL协助进行数据分析。JD在所有合著者的关键输入下撰写了这份手稿。所有作者通过了最终稿。
通讯作者
道德宣言
道德认可和参与同意
本研究中使用的植物部分符合国际、国家和/或机构指南。采集濒危植物叶片样本的许可N哈西亚纳来自Jaraiñ, Jaiñtia Hills区,梅加拉亚邦政府森林和环境部门首席野生动物看守人,印度梅加拉亚邦政府,森林和环境部门,2020年7月1日第20号办公室命令授予。
出版许可
不适用。
相互竞争的利益
作者声明他们没有相互竞争的利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1。
基因组装转录本的长度分布N哈西亚纳叶子。图。S2。一个的BLASTX命中率的E值分布N哈西亚纳针对NCBI非冗余蛋白质数据库的叶转录组。b,BLASTX相似性得分分布N哈西亚纳利用NCBI非冗余蛋白质数据库建立了叶片转录组。图S3。使用BLASTX分析组装的转录组的前50个生物体的分布。图S4。组装转录组的代谢途径图。图。S5。生物过程、细胞成分和分子功能的前10个GO术语。图S6。在大脑的五个不同部分/区域中,每一个都有代表性过高和代表性过低的分子功能N哈西亚纳叶子。盖子中未检测到铀浓缩。图S7。在五种组织样品中的转录表达分布。图S8。使用在线可用的自动注释软件Mercator将Mapman'bins分配给Degshttps://mapman.gabipd.org/app/mercator..图S9。利用MeV程序中嵌入的优值(FOM)应用程序确定k-means聚类的聚类数。调整后的FOM急剧下降,达到4个簇后趋于平稳。图S10。使用R中的间隙统计算法确定K-Means聚类的簇数的确定。簇数为6。图。S11。N哈西亚纳一种植物,有几片正在发育的叶子,每片叶子都有不同的发育阶段。阶段5代表叶(L5)显示水罐膨胀,盖子保持未打开。第5阶段的转录组数据包括在本研究中。白色垂直/水平线指定每个阶段的解剖区域。酒吧 = 6. 厘米。图。S12。相对丰富的细菌转录本对真菌转录本跨越不同的部分/区域N哈西亚纳叶子。LB:叶基;T:卷须;D:消化区;W:蜡质带;L:盖子。图向。表皮指甲油的四种不同部位/区域的轴向表面的印记N哈西亚纳叶子。然后这些印记被用来估计气孔密度[1].箭头表示气孔。图S14系列。样本收集用于转录组测序N哈西亚纳叶子。一个,猪笼草在梅加拉亚邦Jaraiñ, Jaiñtia Hills区自然栖息地生长的植物。b,具有完全打开的盖子的成熟投手和沿着投手侧面形成的突出翅膀。光盘,制备叶子viz的不同部位/区域。叶碱,卷须,消化区,蜡质区和液氮保存的盖子。注意:过渡区域代表叶片中的那些区域,表示从一个部件/区域转移到另一个部分/区域。图S15。总RNA的提取及质量检测N哈西亚纳叶子。一个,从五个不同的部位/区域中提取的总RNAN哈西亚纳叶子。凝胶全长照片见图S16。下面的;b,使用安捷伦生物分析仪的分离的总RNA(叶碱)的质量检查产生的总RNA谱和相应的峰值;c, RNA文库电泳图谱。图S16。从五种不同的部分/区域隔离的全长凝胶照片的总RNAN哈西亚纳叶子。左侧的凝胶照片显示了消化区,卷须和叶碱(车道4,5和6)的提取的RNA。由于卷须的RNA质量差(泳道5),因此重复分离以产生更好的(中间凝胶照片的泳道8)。右侧的凝胶照片显示了盖子和蜡质区域的提取的RNA(车道4和5)。每个部件/区域的RNA凝胶图像被裁剪并呈现在图21a中。注释S1。模型植物的气孔密度和分布拟南芥.表S1。RNA测序读取了两组不同组织部分的统计数据N哈西亚纳叶子样本。我们对每个类别下的FASTQ文件(原始和质量过滤器通过的读取)执行MD5校验和,以确保数据完整性。表S2。个体读数与参考转录组的比对摘要。表S3.用于验证RNA-SEQ衍生转录表达式模式的QPCR引物列表。
附加文件2:表S4。
编码在食物消化和植物防御中酶的转录本列表N哈西亚纳.
附加文件3:表S5。
在未打开的猪笼草中检测到的编码参与猎物消化和植物防御的酶的转录本列表N哈西亚纳.
附加文件4:表S6。
细菌来源的转录本列表。
附加文件5:表S7。
真菌来源的转录本列表。
附加文件6:表S8。
在未开封的水罐中检测到的细菌来源的转录本列表n Khasiana.
附加文件7:表S9。
在未开封的猪笼草中检测到的真菌来源的转录本清单N哈西亚纳.
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/. 知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用这篇文章
Dkhar,J.,Bhaskar,Y.K.,Lynn,A.et al。投手猪笼草表达几种消化酶编码基因,主要是真菌,可能是通过叶片极性基因表达的变化进化而来。BMC植物生物学20.524(2020)。https://doi.org/10.1186/s12870-020-02663-2
收到:
接受:
出版:
关键字
- 猪笼草
- 叶转录组
- 水罐的发展与演变
- 猎物消化
- 植物防御