抽象的
背景
农业收益率与氮施用密切相关。因此,减少氮的应用而不影响农业生产仍然是一个具有挑战性的任务。了解小麦的代谢,生理和形态反应(Triticum Aestivum.)对于缺乏缺乏,鉴定参与活化的信号通路的基因至关重要。
结果
我们使用完全营养溶液(N1)和没有氮气(N0)的营养溶液进行了水培实验。小麦植物在氮气缺乏条件下(NDC)显示作物高度,叶面积,根部体积,光合速率,作物重量和根长度增加,根表面积,根/芽比下降。表明氮缺乏症改变了小麦植物的表型。此外,我们对在NDC下生长的小麦中鉴定的表型,转录组,GO途径和Kegg途径进行了全面的分析。它显示出对EXP(24)的上调,NRT(9)基因家族成员增加了PET(3),PSB(8),NAR(3)和NIR(1)的氮吸收和下调基因家族成员阻碍了光合作用和氮代谢。
结论
我们确定了48个候选基因,这些基因涉及在NDC种植的小麦植物中改善的光合作用和氮代谢。这些基因可用作作物遗传育种的分子标记。
背景
冬小麦过度施氮和氮肥利用率低是世界各国面临的挑战[1].小麦的低氮利用效率主要是由于氮肥的过度施用[2].此外,它会导致环境污染,妨碍农业的可持续发展。在确保作物产量的前提下,减少的氮施用需要紧急调查。利用分子育种方法对小麦的生理,代谢和形态过程进行深入了解,可以提高作物产量和氮气使用效率(NUE)[3.,4]在缺氮条件下生长的小麦植株。
详细了解植物的生理、代谢和根系冠层结构对于在遮荫、干旱或营养缺乏等逆境条件下提高作物产量和资源利用效率至关重要[5,6,7].如先前的研究所述,减少的氮施用改性了根形态和改进的根系结构,从而增加了氮吸收能力和NUE [8],但它降低了光合作用和代谢率[9,10.].因此,为了提高小麦植物对缺乏缺乏的适应性,旨在在转录组水平下辨别小麦植物的生理和代谢过程至关重要。
缺氮会改变植物的基因表达。大麦植株缺氮诱导HvNiR1、HvGS2、HvGLU2表达上调,HvASN1表达下调,HvGLU2表达上调。因此,它提高了大麦植株对缺氮的适应性[11.].上调的替代氧化酶(AOX)增加了过量糖的利用率,并在NDC下平衡碳水平[12.,13.,14.].类似地,GMCZ-SOD1基因高度诱导在NDC下生长的大豆植物的根中[2].1799在NDC下生长的玉米作物中鉴定了1799族表达基因(DEG)[11.].虽然已经对小麦作物进行了多种转录组学研究,但NDC下与小麦作物生理代谢相关的基因尚不清楚,需要深入研究[15.].
因此,该研究进行了旨在的实验:(i)探讨小麦在氮气缺乏条件下的生理,代谢和形态变化;(ii)在氮气缺乏下筛选小麦转录组的差异表达基因(DEG);(iii)综合分析转录,代谢途径和重要生理和代谢过程的表型,我们试图找出可以在氮缺乏症下促进小麦生长的潜在基因。
结果
氮缺乏条件下小麦的形态学和生理变化
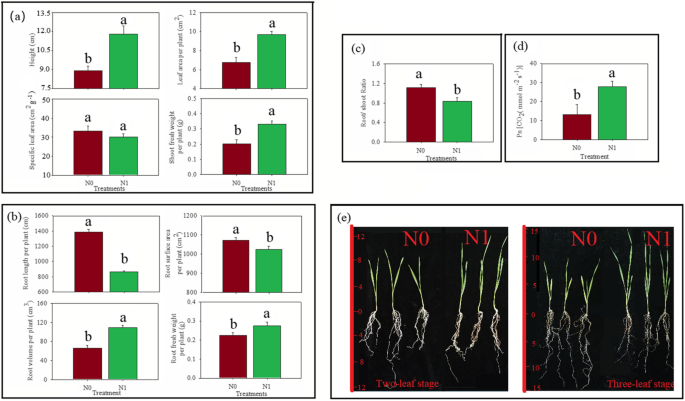
图中描述了小麦形态和生理状态的变化。1.N0组小麦株高显著低于N1组的0.75倍(图1)。1一种)。小麦植物的叶面积在N0组中的0.70倍明显小于N1组的小麦植物。然而,在N0和N1组的小麦植物的特定叶面积中没有观察到显着差异。N0组小麦植物的净光合速率(PN)和新鲜枝条重量分别比N1组中的小麦植物显着降低0.47%和0.61倍(图。1d)。结果表明,氮缺乏症导致小麦植物中每株植物,PN和新鲜枝条重量减少。
N0组小麦单株根长显著高于N1组的1.61倍。1b)。此外,N0组小麦植物的每个植物的根体积比N1组中的小麦植物低0.61倍。然而,每种植物的根表面积,N0组中小麦植物的根部重量,小麦植物的根芽比分别比N1组中的小麦植物分别为1.04,0.82和1.36倍(图。1c).缺氮导致根长、单株根表面积、鲜根重、根冠比增加,单株根体积减小。
在氮缺陷条件下生长的小麦植物RNA-SEQ数据的全局分析
计算N0组小麦植株不同部位表达的基因数量,构建堆叠直方图(图S)1一种)。在N0组的小麦芽中鉴定了总共72,487-78,729个基因,其中17,116-22,418个基因具有FPKM(每百万片段映射的每千碱基片段映射)值> 1。此外,还确定了63,273-64,413个基因在N0组的小麦根部中,其中27,785-29,233基因具有FPKM值> 1。
采用主成分分析(PCA)对不同维度的样本进行定位,探讨样本之间的关系(图S1b)。较少的聚类距离表示更相同的样本。PCA1反映了根源和拍摄的差异,占总变异的99.41%。此外,通过PCA2和PCA3推导出N0和N1小麦植物之间的芽和根部转录差异,其占总变化的0.21和0.11%。PCA3反映了N0和N1小麦植物组之间的根转录差异,占0.11%的总变异。
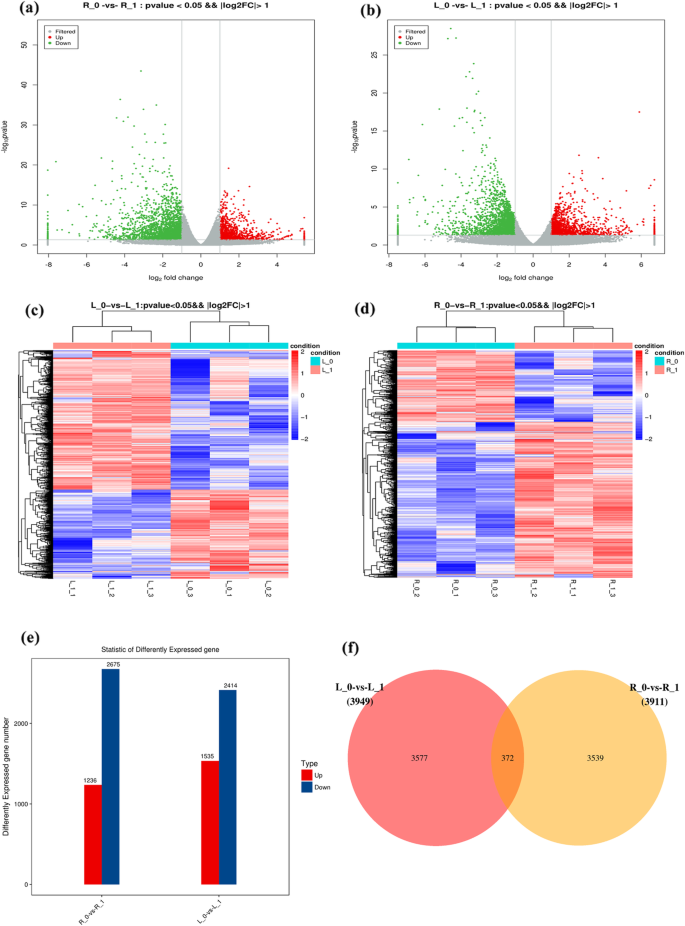
火山中(图。2(a, b)和聚类图(图。2c, d)p- 值和日志2与对照(N1)小麦植物相比,将Fc筛选在N0小麦植物中的差异表达基因(DEGS)。我们在NDC下生长的小麦植物的芽中鉴定了3949次,其中1535次上调,2414次下调。此外,我们鉴定了在NDC,其中1236的小麦植物的根部中鉴定了3911次,其上调1236,下调2675(图。2e)。venn map(图。2f)揭示上调1535℃,在NDC下生长的小麦植物的芽和根部下调2414℃,并在根部和芽中鉴定了总共372°。
缺氮条件下小麦中二磷酸腺苷的功能分析
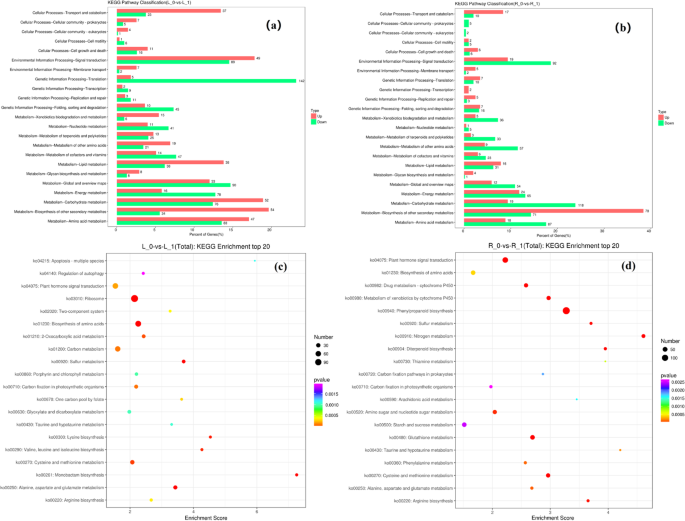
1205次调节基因和1888个芽中的下调基因,而在NDC生长的小麦植物的根部鉴定的961个上调基因和1883个下调基因,富集在基因本体(GO)分析中(图。2).富集基因可分为3大类64个亚类,部分基因可分为2类或2类以上。细胞过程、代谢过程、结合和催化活性是富集程度最高的类别,包括980多个DEGs(表1)1).
我们进行了Kegg途径浓缩分析(图。3.a, b)在NDC下生长的小麦植株的茎和根的DEGs,以及富集数量最高的DEGs的途径在这里进行了讨论。根系DEGs表达富集于基因信息加工翻译途径(142个下调基因)和其他次生代谢产物代谢生物合成途径(54个上调基因)。根DEG的KEGG途径分析导致代谢-碳水化合物代谢途径(118个下调基因)和其他次生代谢途径(78个上调基因)富集。Shoot DEG的KEGG通路分析显示单巴坦生物合成富集(图。3.c)和氮代谢途径(图。3.d)。
细胞过程相关基因家族分析
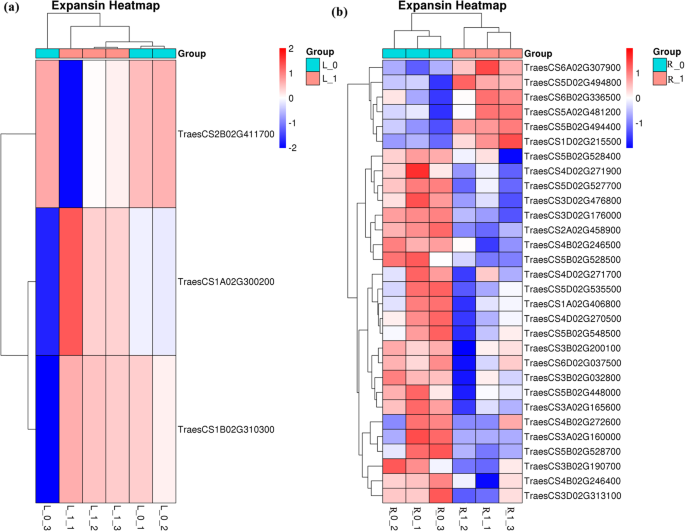
扩展素家庭成员主要属于GO类别 - 蜂窝过程。在NDC下生长的小麦植物拍摄3℃(图。4)扩展素家庭,包括企业2B02G411700(上调),TERWS1A02G30020(下调)和企业1B02G310300(下调)。此外,在NDC生长的小麦植物的根中,6个下调基因(TERPRICS6A02G307900等)和24个上调基因(TERPRICS5B02G528400等)属于扩展素家族。
与代谢过程相关的基因家族分析
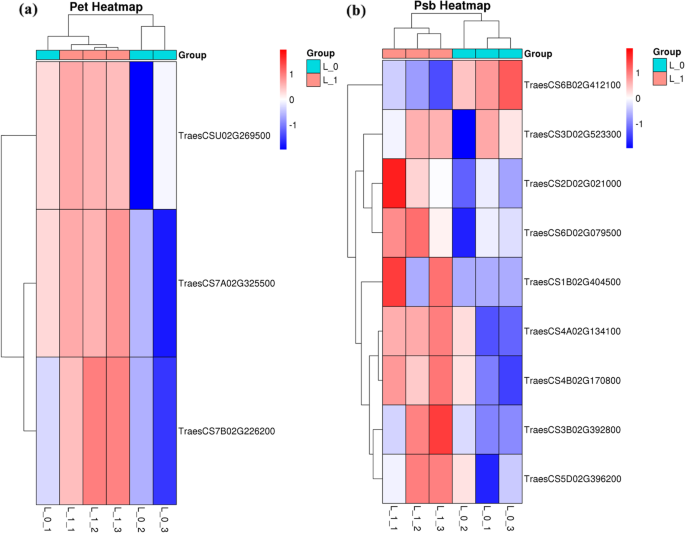
Pet和Psb家族成员是小麦芽中关键的光系统成员,属于GO类代谢过程。在NDC下生长的小麦植株中,3个DEGs下调(图1)。5)属于PET系列(TERPRICS7A02G325500等),8个下调的DOW-COMETED DEGS属于PSB系列(TERPRICS3D02G523300等),1个上调的DEG属于PSB系列(TERPRICS6B02G412100)。
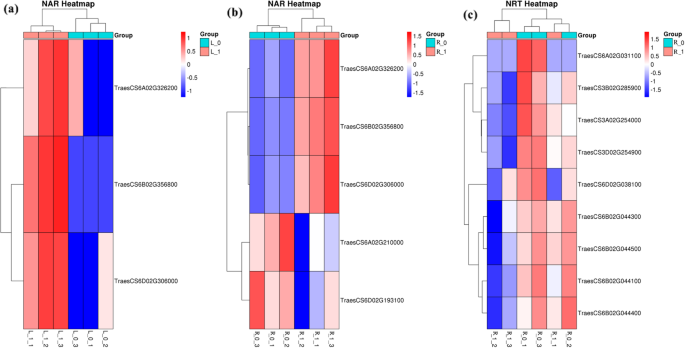
Nar和Nrt家族成员参与氮代谢,属于GO类代谢过程。在NDC下生长的小麦植株中,根和茎中有3个基因表达下调。6)均属于Nar家族(treasure cs6a02g326200、treasure cs6b02g356800、treasure cs6d02g306000),根中2个上调基因属于Nar家族成员(treasure cs6a02g210000、treasure cs6d02g193100),根中9个上调基因属于Nrt家族(treasure cs6a02g031100)。
转录组数据验证
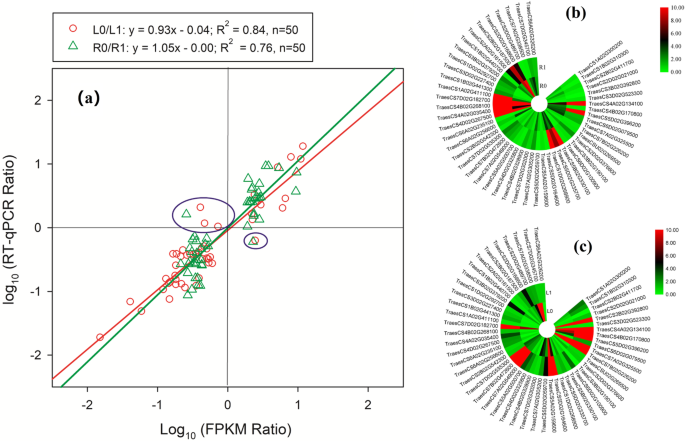
根据基于RT-qPCR的验证研究,100个候选基因中94个(46个茎基因和48个根基因)的表达水平与转录组数据的FPKM值一致(图1)。7一种)。结果表明,大约94%的转录组数据是可靠的。分别为芽和根部的回归线X系数为0.93和1.05,表明转录组数据的高精度。来自根和芽的50个候选基因的RT-QPCR数据在图2中描绘。7b,无花果。7c,分别。RT-qPCR与各基因转录组数据的比较可通过表S查询1和表S.2.
(一个)回归线路的日志10.(FPKM比率)和日志10.(RT-QPCR比率)拍摄和根部;(含量)的50候选基因的相对表达水平(b)根和(c)分别拍摄。在图中。9,红色圆圈代表了日志10.(FPKM比率)和日志10.(RT-qPCR比值)L0/L1的值,绿色三角形表示对数10.(FPKM比率)和日志10.(RT-QPCR比率)R0 / R1的值。蓝框中的圆圈和三角形代表其RT-QPCR结果与转录组数据不一致的基因。R0和L0分别代表N0(无氮气营养溶液)的根源和芽面氮缺乏小麦植物;R1和L1分别代表N1(完整营养溶液)小麦植物的根源和芽
讨论
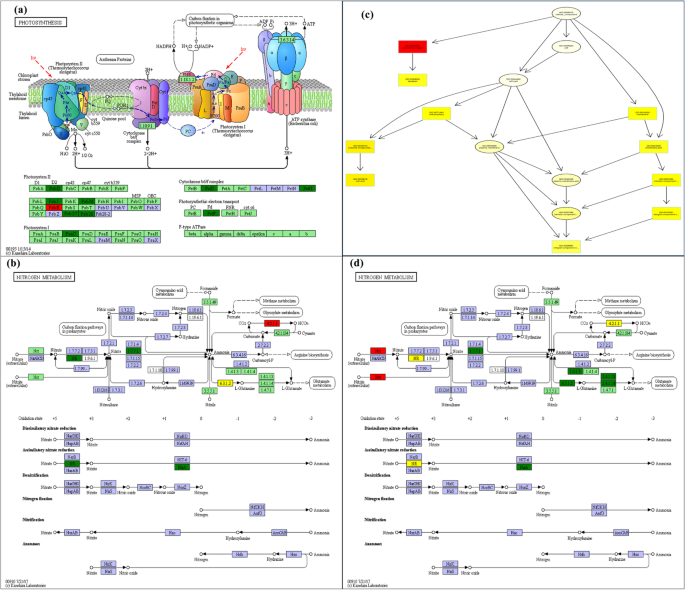
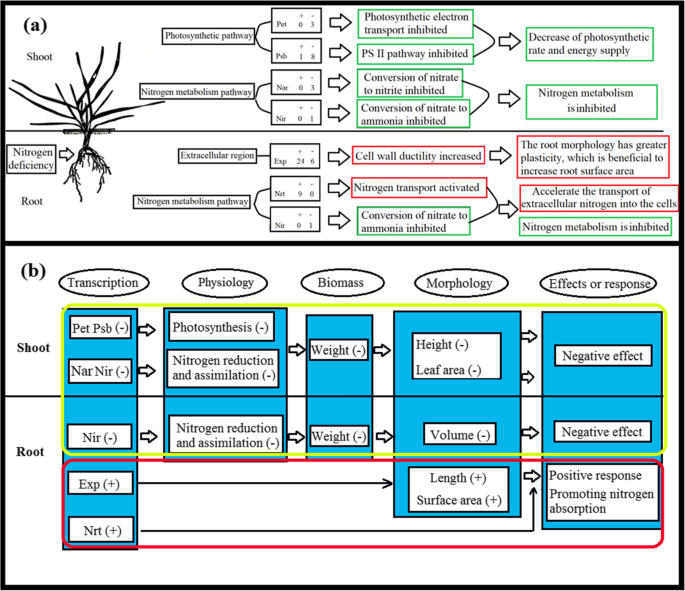
可以从其转录组数据中推断出麦植物的改变的形态,新陈代谢和生理学[16.,17.,18.].根据之前的报告,在光合作用途径中(图。8a),由PET和PSB基因家族编码的蛋白质是细胞色素B6 / F复合物,光合电子传输和光系统II的关键组分[19.,20.,21.,22.,23.].以前的研究表明,这些蛋白质的抑制阻碍了植物的光合效率[24.,25.].在目前的研究中,发现属于PET和PSB基因家族的基因是下调的。这些下调基因导致光合电子传输的抑制和在NDC下生长的小麦植物中的光系统II途径,这降低了光合速率和能量代谢。
此外,在NDC下生长的小麦植物中鉴定的DEG也富集在氮代谢途径中(图。8B,D)。属于NAR(硝酸还原酶)基因家族的DEGS参与硝酸盐-N减少到硝酸盐-N过程[26.,27.].Nir(亚硝酸盐还原酶)基因家族的DEGs参与了亚硝酸盐- n还原氨氮过程[28.,29.].此外,属于NRT基因家族的DEGS涉及从细胞外到细胞内方法的氮输送过程[30.].此外,根据之前的报告,发现NRT家族参与了多种生理过程的根生长,开花时间和转录调节,荷尔蒙和硝酸盐信号传递[31.,32.,33.,34.].上调的DEG,NIR和NRT基因家族的成员增加了作物中的营养吸收[35.,36.,37.].发现属于NAR和NIR基因家族的小麦拍摄中鉴定的基因的表达水平,并发现氮代谢途径的组分进行了下调。类似地,在根本中,发现属于NIR基因家族的基因的表达水平被发现下调,其又可以减轻芽和根部的氮代谢途径。有趣的是,NRT基因家族成员在氮缺陷型小麦根系中的表达被上调,其加速了细胞外氮进入细胞的运动。在NDC下生长的小麦植物中氮代谢途径的最高浓缩评分表明转录差对根氮代谢的影响最高。
在细胞外区域途径(图。8c),扩展素基因家族成员增加了植物细胞壁的伸展性[38.,39.,40].以往的研究表明,过表达的扩张蛋白基因家族成员改变了作物形态,提高了作物对逆境或营养不良的适应性[41.,42.].例如,过表达的TaEXPB23改变了转基因烟草植株的根系结构,提高了植株对低磷条件的适应性[8].本研究中,在NDC作用下,小麦根系中expansin基因家族成员的表达上调,导致根系长度和表面积增加。根长和表面积的增加增加了NDC下小麦植株的氮素吸收效率。
植物的转录水平根据外部环境条件改变[39.,43.,进而影响蛋白质水平和代谢过程,最终导致物质积累和形态变化[8,44.].一些反应改善了作物对外部环境的适应性。此外,根部和叶片中基因的差异表达导致不同的效果。属于在NDC下生长的小麦根系中鉴定的扩展素和NRT基因系列的基因的上调表达涉及增加根表面积和氮传输。它可以被认为是小麦植物以增加氮吸收的适应(图。9).
发现PET,PSB,NAR,NIR基因家族成员的表达被测调节,其抑制光合作用和氮同化率(图。9).它阻碍了生物质积累,在减少的枝条高度,叶面积和根部体积中。此外,在NDC下生长的小麦植物的芽中,下调的单离药生物合成途径具有最高的富集评分降低降低抗菌活性。可以使用基因工程来增加我们研究中鉴定的四个基因家族(PET,PSB,NAR,NIR)中的下调基因的表达。它还可以增加光合作用和氮代谢的速率,以改善在NDC下种植的作物的物质积累和生长条件。
结论
与对照相比,缺氮条件下的小麦植株株高、叶面积、根体积、光合速率和作物重均有所降低,而根长、根表面积和根冠比均有所增加。在茎中鉴定出3949个差异表达基因(下调2414个,上调1535个),在根中鉴定出3911个差异表达基因(下调2675个,上调1536个)。
还进行了GO途径和KEGG途径浓缩分析这些DEG。24扩展蛋白基因(例如TERPRCS5B02G528400)和9个NRT基因(例如TERMS6A02G031100)与增加N吸收增加。此外,3个PET基因(如TERPRCS7B02G226200)和8个PSB基因(例如TERPRCS3D02G523300)与光合途径的抑制相关;此外,3个NAR基因(例如TERPRCS6A02G326200)和1个NIR基因(TERPRCS6D02G333900)与在NDC下生长的小麦植物中的氮代谢途径抑制相关。
方法
实验设计
在本研究中使用了施农29的氮敏小麦品种。实验是在中国黄淮海地区进行的。汕农29的种子来自山东省苗籽技术有限公司两种营养溶液,具有不同的氮浓度(NH4没有3.),即用5mmol L的完全营养溶液(N1)- 1NH4没有3.没有氮气(n0)的营养溶液,0 mmol l- 1NH4没有3.(N0),用于本研究。因此,使用营养溶液,N0和N1生长的小麦植物分别称为N0和N1植物。Haagland溶液配方用来制备营养溶液(N0:没有氮气)。营养溶液包含2mmol L.- 1CaCl2, 1.8 mmol L- 1KCl, 0.2 mmol L- 1kh.2宝4, 0.5 mmol L- 1MgSO4,0.1 mmol l- 1Feedta,0.5μmoll- 1ki,1μmoll- 1H3.薄3.,1μmoll- 1MNSO.4,1μmoll- 1ZnSO.4,1μmoll- 1Na2MoO4, 0.1 μmol L- 1Cuso.4, 0.1 μmol L- 1Cocl.2.pH维持在6.8±0.3。小麦种子先用75%酒精消毒30 s,然后用消毒蒸馏水洗涤3次。冬小麦种子消毒后,培养至1叶1心期。每个试验处理100株,每个试验重复3次。将幼苗移栽到不同营养液中,用海绵固定。在光照周期分别为8 h和16 h,相对湿度为70%的人工培养箱中培养。
实验测量
形态指数
将幼苗移植到营养溶液中3天,对每种治疗中的10种植物(在三次重复中重复),用于测量叶面积,植物高度,根长,根表面积和根部体积。此外,对另外10种植物进行采样,以确定根和芽的鲜重。测量根长度,表面积和体积的方法如下:人工漂洗根部,去除杂质和杂根,吸收根的表面水,在根扫描仪的玻璃盘子中展开根部(0.24×0.32米),并通过根扫描仪将照片作为600 API像素(HP Scanjet 8200; Hewlett-Packard,Palo Alto,CA,USA)。根分析软件(Delta-T区域仪表型AMB2;剑桥,英国剑桥)用于数据分析。
生理指标
将幼苗移植到营养溶液中3天,使用Li-6400便携式光合作用液(USU,USA)测量顶叶的净光合速率(PN),气孔导率(GS)和细胞间二氧化碳浓度(CI)用红色光源和1400μmolm的光量子密度2年代- l.
转录组测序
将幼苗移植到营养溶液后1天,每次实验重复的20株植物被迅速采样,然后分离根和芽,将这些样品放入液氮中以便快速冷冻。根据制造商的指示,使用Mirvana miRNA隔离套件(AMBION)提取总RNA。使用Agilent 2100 Bioanalyzer(Agilent Technologies,Santa Clara,CA,USA)评估RNA完整性。对于随后的分析,仅使用具有RNA完整性数(rin)≥7的样品。根据制造商的说明,使用Truseq Stranded MRNA Ltsample预备套件(Illumina,San Diego,CA)构建了图书馆。这些文库在Illumina测序平台上测序(Hiseqtm 2500或Illumina Hiseq x十),并产生125bp / 150bp配对末端读数。
基于RT-QPCR的验证
同时采集小麦的茎和根进行转录组测序。这些样品立即在液氮上冷冻,并在-80°C保存。将每个样品的50 ~ 100 mg植物组织在液氮中磨成粉末,在粉末样品中加入500 μL缓冲液RLS。样品立即用离心机混合。使用RNA试剂盒(中国康威)提取RNA。PCR反应混合物为RNA 7 μL, Oligo (dT) 1 μL, 2*R-Mix 10 μL, E-mix 1 μL, gDNA去除剂1 μL, Rnase-free water 0 μL。引物是根据NCBI的首次爆炸设计的。实时定量RT-PCR分析采用多通道荧光定量PCR仪(CFX 384 Touch, America)进行。使用TBtools构建热图[45.].
数据分析
使用基因本体论对差异表达基因(DEGs)进行功能分类[46.].使用的基因组和mRNA数据库是ftp://ftp.ensemblgenomes.org/pub/plants/release-45/fasta/triticum_aestivum/dna/triticum_aestivum.iwgsc.dna.toplevel.fa.gz。在Go功能浓缩分析(http://geneontology.org/)中,所有蛋白质编码基因/转录物被用作背景列表,并且使用差异蛋白质编码基因/转录物作为从背景列表中筛选的候选名单。采用超高度分布试验来计算p价值。它代表富集的鉴别蛋白编码基因/转录物的富集功能类别的重要性。使用Benjamin和Hochberg的多次测试测试p值。
我们用了kegg [47.,48.]数据库(http://www.genome.jp/kegg/),结合KEGG注释结果分析deg。并采用超几何分布检验计算各途径差异基因富集的显著性。计算结果将返回一个显著的富集p值,较小的p值表明差异基因已经在该途径中富集。通过KEGG途径富集分析揭示了DEGs的富集。
实验数据表示为三次重复的平均值。使用SPSS软件版本19.0(SPSS Inc.,Chicago,USA)进行统计计算。使用单向ANOVA和DUNCHAN的多个范围测试(DMRT)进行比较实验处理。P < 0.05 was considered statistically significant.
可用性数据和材料
与本文相关联的转录组数据被上传用于补充数据。其他数据集可以从合理的请求中获取相应的作者。
缩写
- PSB:
-
光系统II反应中心蛋白质
- 宠物:
-
细胞色素B6 / F复杂亚基4
- Nar:
-
硝酸还原酶
- Nrt:
-
高亲和力硝酸盐转运蛋白
- exp:
-
棒曲霉素
- Pn:
-
净光合速率
- GS:
-
气孔电导
- 置信区间:
-
细胞间二氧化碳浓度
- DEG:
-
差异表达基因
- Kegg:
-
Kyoto基因和基因组的百科全书
- 走:
-
基因本体论
- NDC:
-
Nitrogen-Deficient条件
- PCA:
-
主成分分析
- FPKM:
-
每千碱基的转录片段每百万片段
参考
- 1。
张飞,陈旭,维图塞克总理。中国农业:一个面向世界的实验。大自然。2013;497(7447):33-5。
- 2。
王X,张H,高y,张W.低氮胁迫下大豆Cu / Zn-SOD酶活性和基因表达的表征。J SCI食物农业。2016; 96(8):2692-7。
- 3.
Timsina J,Singh U,BadAruddin M,Meisner C,Amin Mr。孟加拉国稻米序列的生产力,氮气和水影响,施用氮素利用效率和平衡。现场裁剪。2001; 72(2):143-61。
- 4.
Dobermann A,Cassman Kg。植物养分管理提高美国和亚洲集约粮食生产系统生产力。植物土壤。2002; 247(1):153-75。
- 5。
耐荫性是植物具有复杂性质和后果的一个关键特征。生态发展系统,2008;39(1):237-57。
- 6。
朱家,vos j,der werf wv,der putten pelv,evers jb。早期竞争形状玉米混合架的全植物开发。J Exp Bot。2014; 65(2):641-53。
- 7.
刘王,宋C,苏B,杨F,永T,吴Y,张C,杨W.玉米 - 大豆间作系统的光环境,形态,生长和产量的变化。现场裁剪。2017; 200:38-46。
- 8.
关键词:小麦,磷素利用率,扩张蛋白,植物abstract:植物生理学杂志。2014;
- 9.
桑娜P,Pinochet D. P缺乏下小麦生物质和籽粒产量的生态学决定因素。现场裁剪。2011; 120(2):311-9。
- 10.
刘M,Wu X,Li C,Li M,Xiong T,唐Y.在接头阶段氮缺乏术后合成衍生小麦品种的干物质和氮气积累,分配和易位。现场裁剪。2020A; 248:107720。
- 11.
陈R,田M,吴X,黄Y.差异全局基因表达响应于两种玉米自交系中的低氮胁迫,对比低氮耐受性。基因基因组。2011; 33(5):491-7。
- 12.
Sieger Sm,Kristensen Bk,Robson Ca,Sasan A,Eng Ewy,Amal Am,Mi M,Vanlerberghe GC。替代氧化酶在烟草细胞中调节碳利用效率和生长的作用。J Exp Bot。2005; 416:416。
- 13。
Noguchi K,Terashima I.菠菜叶线粒体的反应低于N个可用性。植物细胞环境。2006; 29(4):710-9。
- 14。
关键词:AOX1a,低氮胁迫,拟南芥,生长,呼吸成分,代谢植物生理学杂志。2010;51(5):710 - 22。
- 15.
洛杉矶多诺万的Brouillette LC。一个杂交物种对氮胁迫的响应:基因表达研究。安机器人。2011;107(1):101 - 8。
- 16。
Reddy Sk,Liu S,Rudd JC,Xue Q,Payton P,Finlayson SA,Mahan JR,Akhunova A,Holalu SV,Lu N.水缺陷应力反应在小麦品种TAM 111和TAM 112中的生理学和转录组织。J植物physiol。2014; 171(14):1289-98。
- 17.
Xanthopoulou A,Ganopoulos I,Psomopoulos F,Manioudaki M,Moysiadis T,Kapazoglou A,oSathanunkul M,Michairidou S,Kalivas A,Tsaftaris A,Tsaftaris A. de Novo比较转录组合分析南瓜品种果实形式的基因分析,具有极端尺寸差异和发展EST-SSR标记。基因。2017; 622:50-66。
- 18.
[15]刘慧,朱强,潘晓霞,邢刚,欧旭,李慧。小麦品种及其亲本光合生理特性和转录组的比较分析。中国农业科学,2011,40(5):689 - 694。作物j . 2020。(印刷中)。
- 19.
Kawaguchi H,Fukuda I,Shiina T,Toyoshima Y. Freening小麦幼苗中PSB基因转录物的动态行为。I:在光诱导的绿化过程中通过PSBN基因转录物积累PSBA的时间过程。植物mol biol。1992年; 20(4):695-704。
- 20.
Yi X, Hargett SR, Frankel LK, Bricker TM。RNAi同步抑制拟南芥光系统II中PsbO和PsbP蛋白表达的影响Photosynth杂志2008;98:439-48。
- 21.
Fristedt R,Trotta A,Suorsa M,Nilsson AK,Croce R,Aro E,Lundin B. PSB33在波动的光线条件下维持光源II D1蛋白。J Exp Bot。2017; 68(15):4281-93。
- 22.
Kato Y,Yokono M,Akimoto S,Takabayashi A,Tanaka A,Tanaka R.Stanaka R.Stanaka R.Stanaka R. stanaka蛋白LIL8 / PSB33的缺乏影响拟南芥PSI周围的能量转移。植物细胞生理。2017; 58(11):2026-39。
- 23。
Kroliczewski J,Bartoszewski R,Kroliczewska B. chorloplast Petd蛋白质:SRP / ALB3依赖性插入囊体膜的证据。BMC植物BIOL。2017; 17(1):213。
- 24。
Monde R,Greene JC,Stern DB。烟草叶绿体中PetB-PETD族代骨区的破坏影响了PETD RNA积累和翻译。Mol Gen Genomics。2000; 263(4):610-8。
- 25。
Vargassuarez M, Castrosanchez A, Toledoortiz G, La Vara LEGD, Garcia E, Lozatavera H.在体外菠菜叶绿体petD mRNA 3 ' -非翻译区的稳定性、加工和降解。Biochimie。2013;95(2):400 - 9。
- 26。
李Q,王X,MA L,Wei M,Shi Q,杨F.黄瓜硝酸盐还原酶(CSNR)基因的分子表征3.压力。Mol Biol Rep. 2012;39(4): 4283-90。
- 27。
Huarancca Reyes T,Scartazza A,Pompeiano A,Ciurli A,Lu Y,Guglielminetti L,Yamaguchi J.硝酸盐还原酶调节响应于拟南芥中C / N平衡和氮源的变化。植物细胞生理。2018; 59(6):1248-54。
- 28。
Konishi M,Yanagisawa S.鉴定拟南芥NIR1启动子中的硝酸盐响应性CIS元素的鉴定定义了多种顺式调节元件的氮响应。工厂J.2010; 63(2):269-82。
- 29.
黄L,张H,张H,邓XW,魏恩卫生5,调节亚硝酸盐还原酶1(NIR1)和铵转运蛋白1; 2(AMT1; 2)在拟南芥幼苗中。植物SCI。2015; 238:330-9。
- 30.
赵立,张某,杨y,李z,李n,qi s,crawford nm,王Y.拟南芥NLP7基因在铵存在下通过NRT1.1依赖性途径调节硝酸根信号传导。SCI代表2018; 8(1):1487。
- 31。
ho c,frommer wb。用于活性和调节硝酸血肿CHL1 / NRT1.1和寡肽转运蛋白的荧光传感器。Elife。2014; 3:01917。
- 32.
通过转录后调控NRT1.1/NPF6.3转运体/传感器,硝酸盐可以调控根的发育。植物杂志。2016;172(2):1237 - 48。
- 33.
滕y,梁y,王m,mai h,Ke L.硝酸盐转运仪1.1涉及通过拟南芥C的开花基因座C的转录调节来调节开花时间。植物SCI。2019; 284:30-6。
- 34.
张X,崔y,yu m,su b,贡w,baluska f,komis g,samaj,山x,林J.磷酸化介导的硝酸盐血肿介导的动态Nrt1.1调节侧根生长中的毒素通量和硝酸盐信号传导.植物理性。2019; 181(2):480-98。
- 35。
方XZ,天无班,刘XX,林XY,金c,郑SJ。通过硝酸盐摄取来减轻质子毒性,具体取决于拟南芥中的硝酸盐转运蛋白1.1。新植物。2016; 211(1):149-58。
- 36。
关键词:NH4 +, nrt1.1, nrt1.1, nrt1.1, nrt1.1, nrt1.1植物杂志。2018;178(4):1473 - 88。
- 37。
Medici A,Szponarski W,Danceville P,Safi A,DissArayake IM,Saenchai C,Emanuel A,Rubio V,Lacombe B,Ruffel S.鉴定分子积分剂表明,氮气积极控制植物中的磷酸盐饥饿反应。植物细胞。2019; 31(5):1171-84。
- 38。
高Q,赵米,李F,郭Q,兴S,王W.小麦的扩张和植物精神伸长率。原生质。2008; 233:73-81。
- 39。
Ilias Ia,Negishi K,Yasue K,Jomura N,Morohashi K,Baharum Sn,Goh Hh。膨胀素基因操纵在硫酸化拟南芥幼苗中的转录物宽影响。j植物res。2019; 132(2):159-72。
- 40。
汉诗,刘y,邓x,刘d,刘y,胡y,yan y。常见小麦扩张素基因家族的基因组型鉴定及表达分析(Triticum aestivum L.)。BMC基因组学。2019; 20(1):1-19。
- 41。
李F,兴S,郭Q,赵米,张继,高Q,王G,王W.通过转基因烟草扩展基因Taexpb23过度表达的抗旱性。J植物理性。2011; 168(9):960-6。
- 42。
关键词:拟南芥,小麦扩展蛋白,TaEXPA8,过表达,低温耐性植物医学杂志。2019;21(6):1119 - 31所示。
- 43。
Yu X,Wang T,Zhu M,张L,张F,Jing E,Ren Y,王Z,Xin Z,Lin T.转录组和生理学分析揭示小麦反应对内质网应力的基因。BMC植物BIOL。2019; 19(1):1-22。
- 44.
Kumar J,Gunapati S,Kianian SF,Singh Sp。两种小麦基因型转录组的比较分析,其含水量对比水平。原生质。2018; 255(5):1487-504。
- 45.
关键词:大生物数据,交互分析,TBtools摩尔。2020;13(8):1194 - 202。
- 46.
托马斯PD。基因本体论与生物学功能的意义。中国生物医学工程学报。2017;1446:15-24。
- 47。
Kanehisa M, Sato Y, Kawashima M, Furumichi M, Tanabe M. KEGG作为基因和蛋白注释的参考资源。核酸杂志2016;44:457-62。
- 48。
Kanehisa M,Furumichi M,Tanabe M,Sato Y,Morishima K. Kegg:关于基因组,途径,疾病和药物的新观点。核酸RES。2017; 45:D353-61。
致谢
我们感谢兴州张在山东省苗岭种子科技有限公司提供汕农的种子。
资金
国家自然科学基金资助项目(No. 31901457);中国博士后科学基金资助项目(No. 2019 M652454);国家现代农业产业技术研究体系专项基金资助项目(No. 31901457);CARS-27),山东省高校青创科技支撑项目(批准号:2019KJF020)。
实验材料的购买、转录组数据的确定、研究的设计、数据的解读、手稿的撰写由31901457和2019 M652454资助,
实验平台的建设和购买实验仪器由Cars-27和2019KJF020资助。
作者信息
从属关系
贡献
LX、MZQ和YCM发起并设计了实验。LX、YCM、XL、JWT和XSZ进行了实验并收集了数据。LX对数据进行分析并撰写稿件。LX, MZQ, YCM对稿件进行了修改。所有作者阅读并批准最终稿件。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
刘晓,尹春春,向磊。等等。与氮缺乏症的光合作用和小麦氮代谢相关的转录策略。BMC植物BIOL.20.448(2020)。https://doi.org/10.1186/s12870-020-02662-3.
收到了:
接受:
发表:
关键词
- 缺氮
- 氮代谢
- 光合作用
- 转录组
- 小麦