- 研究文章
- 开放访问
- 发表:
欧洲白蜡树病变发生中的转录反应(Frakinus Excelsior.)揭示响应感染的基因Hymenoscyphus fraxineus.
BMC植物生物学体积20., 文章编号:455.(2020)
抽象的
背景
随着在欧洲大陆传播的扩张灰烬陷入困境,需要改善对患病宿主的疾病发展的功能性了解。该研究调查了共同灰烬之间的坏死延伸差异(Frakinus Excelsior.)树木与真菌不同程度的易感性Hymenoscyphus fraxineus.与基因表达模式的差异有关,并可以被解释。我们接种了看似健康的两个抗性和易感灰分基因型的分支H.Faxineus.在一个共同的花园里种植。
结果
接种10个月后,抗性基因型的坏死长度比敏感基因型短。在坏死病灶边缘和病灶远端健康组织采集的树皮样本的RNA测序显示,敏感基因型和抗性基因型之间的基因表达模式差异相对有限。在坏死前沿,只有138个转录物在基因型类别之间差异表达,而1082个转录物在远端无症状组织中差异表达。在这些差异表达的基因中,甲羟戊酸(MVA)和环烯醚萜途径中的几个基因被发现受到共同调控,可能表明通过这些途径的通量增加,以响应对药物的反应H.Faxineus..
在对照温室实验中比较有症状和无症状灰烬的转录反应,发现在这两项研究中差异一致表达的基因相对较少。这个基因集包括MVA途径中的限速酶和一些转录因子。此外,一些一致表达的候选基因显示出与编码脱落酸或茉莉酸信号通路的基因的显著相似性。
结论
确定了一组候选基因,在场和温室实验之间巧妙地表达。候选者与激素信号传导和专门的代谢物生物合成途径有关,表明这些途径参与宿主对感染的响应H.Faxineus..
背景
自1990年代是一种影响普通灰的新外星侵袭性疾病(Frakinus Excelsior.L.)树引起了欧洲的严重死亡和死亡率[1].因果因子,Hymenoscyphus fraxineus.Baral、Queloz和Hosoya几乎遍布了欧洲所有的自然分布区,对这一重要树种和相关的生物多样性构成了重大威胁[1,2].在过去十年中,在理解持续的灰烬沉浸性流行方面存在很大的突飞猛飞机。使用DNA的标志物和全基因组测序已经给予了洞察的起源H.亚思米斯及其进化潜力[3.,4,5]. 同样的,分子基因组学、代谢物分析、基因组和转录组测序也有助于了解植物的遗传多样性和抗药性水平H.Faxineus.在欧洲灰烬人口的毁灭性流行病后[6,7,8,9,10.].然而,了解常见灰烬之间的相互作用H.亚思米斯仍然非常有限,这可能会妨碍使用遗传选择来控制灰度倒影流行病。为了获得对树种和害虫和病原体之间的相互作用的功能理解,可以分析相互作用的分子反应。分子反应可以定义为不同专门的代谢物的产生[8,9,11.来自表达基因的转录物[6,12.,13.].在相互作用中,专门的代谢物在相互作用中进行了相对良好F. Excelsior.和H.Faxineus.例如显示各种酚类、萜类衍生物和植物激素在控制感染和症状发展中的重要性[7,8,9,14.].探讨了基于代谢物型材的优质基因型的潜力[11.].
对依赖于替换机制的功能理解。具有不同易感性的树木之间的代谢物谱和代谢物累积模式仍然有限于森林树木,常见的灰分也不例外。植物生物应激相互作用已解释在草本模型植物中,允许机会描述和利用植物防御系统,涉及两种触发的免疫(PTI)和效应触发免疫(ETI),以及多种植物激素信号传导途径[15.,16.].森林树木面临的一个挑战是,潜在的抗性机制并不总是与模型系统中描述或预测的相同,因此需要直接研究树木物种使用的防御途径和策略[17.].例如对植物接种和模拟处理的比较或植物抗性和易感腐蚀性的转录调节的分析允许鉴定赋予害虫和病原体的基因,包括参与病原体感知,信号传导和专门的代谢物生物合成的基因途径[13.,18.,19.,20.,21.].
在这项研究中,我们对已知敏感程度的树木进行了控制接种,其中一株是H.Faxineus.和RNA测序组织样品以检查转录的反应F. Excelsior.感染H.Faxineus..该研究解决了以下假设:(i)具有不同易感程度的树木之间的坏死延伸的差异在非症状和症状组织中具有不同的基因表达模式;(ii)转录反应解释表型反应(坏死的长度);(iii)转录响应对导致坏死形成的机制提供了洞察力。与第三个假设相关,我们进行了额外的实验;用相同的孤立接种了2岁的幼苗H.Faxineus.并在受控条件下进行低温喷雾损伤,分析互作早期候选基因的表达模式。
结果
具有不同易感程度水平的树木显示非症状和症状组织中表达模式的差异
四棵树的分支,具有已知的易感程度(易感克隆S21K926076和S21K916009和耐克隆S21K926100和S21K916008 [22.])被接种H.Faxineus..接种10个月后,在先前确定的敏感基因型中,可识别的坏死时间至少是耐药基因型的3倍1,P<0.01,学生的T检验)。
从病变处和病变远端采集的树皮样本中提取总RNA,并用Illumina Hiseq 2000对富含mRNA的样本进行测序。经过质量过滤后,读取的结果与灰基因组BATG-0.4v3一致(http://www.ashgenome.org.)使用的TopHat-Cufflinks管道(23.,24.]. 在将每个样本的过滤读取数据与ash基因组比对后,文库中总共呈现了87413个转录本。平均读取映射频率为80%,每个库的平均对齐对数为7086883(补充文件)S1).估计金额H.Faxineus.在样本中,读取也被映射到H.Faxineus.Nf4基因组(Elfstrand等人在prep)。读取映射频率从0.1到6.6%不等(补充文件S2).估计结果无显著差异H.Faxineus.在基因型类别或治疗之间发现生物质,并且估计的生物质与基因型类别之间的坏死长度不相关(补充文件S2).
发育坏死与大量转录变化有关
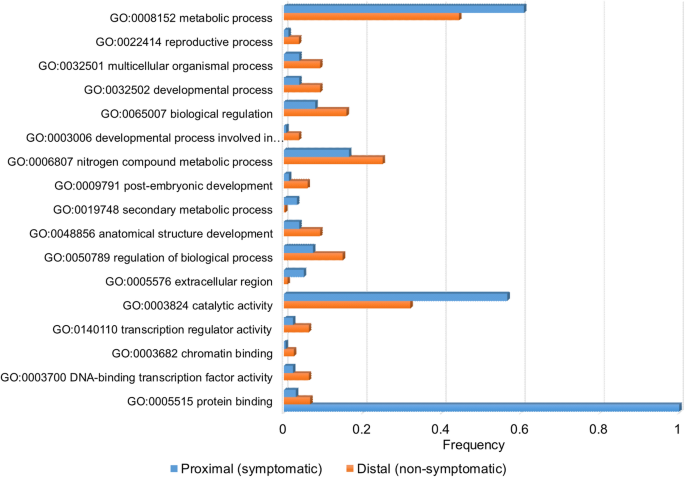
近端组织接种的差异表达分析H.Faxineus.近端有症状组织与远端无症状组织比较,差异表达基因(DEGs)为1009个。大多数deg(693)在坏死组织附近高表达(下表)2,补充档案3.).与在远端组织中特异性表达的单个基因相比,我们发现在症状组织中发现66 de Novo表达基因(表2).在近症状组织中表达的基因中有1个壁相关受体激酶5像基因(XLOC_046826_TCONS_00081726),而另一个壁相关受体激酶(XLOC_019616_TCONS_00033792)被发现与相同的对比度引起。一种丝氨酸蛋白酶抑制剂,马铃薯抑制剂I型家庭蛋白质像基因XLOC_080002_TCONS_00138225和五次相似之处聚半乳糖醛酸酶还发现基因在这些样本中表达了De Novo(补充档案3.).与DEG相关的GO术语的分析表明,GO:0005576细胞外区域,GO:0003824催化活性,GO:与更远侧的样品相邻的正种病变相邻的样品中富含代谢过程(图。1).
在近端症状组织(蓝杆)和远端非对症组织(橙色棒)中显着富集的术语。分析基于表中呈现的egs2
在有症状的组织中,抗性和易感基因型之间的转录差异不太明显
通过比较非症状组织中的表达模式,我们发现1082°的表达模式不同于抗性和易感基因型之间。在抗性基因型中,大约第三(329次)表达(表3.).在对分类为抗性或易受敏感的基因型的样品中表达模式的比较,只有138次,其中124个是在任一基因型类别中表达的DE Novo(表3.,补充档案3.).唯一表示的DEG平均较短,表达较少(由补充文件中的计数数据判断3.)总的来说要比DEG好。当比较耐药基因型和易感基因型的无症状组织时,这些转录物中的绝大多数也是从头表达的。综上所述,结果表明,这些转录物代表了基因型类别之间差异使用的基因,与治疗无关。
我们认为比较耐药和易感基因型的一个基因是xloc_074973_tcon_00129820 A可能富含亮氨酸的重复受体样丝氨酸苏氨酸 - 蛋白激酶,因为该转录物似乎在敏感基因型中的症状组织中关闭(补充文件3.).值得注意的是,我们发现12种不同tify / jaz.在我们的数据集中,其中7个在易感基因型的无症状组织中表现出最大表达(对数2倍变化为)0.9-3.7,与耐药基因型相比(补充文件)3.).
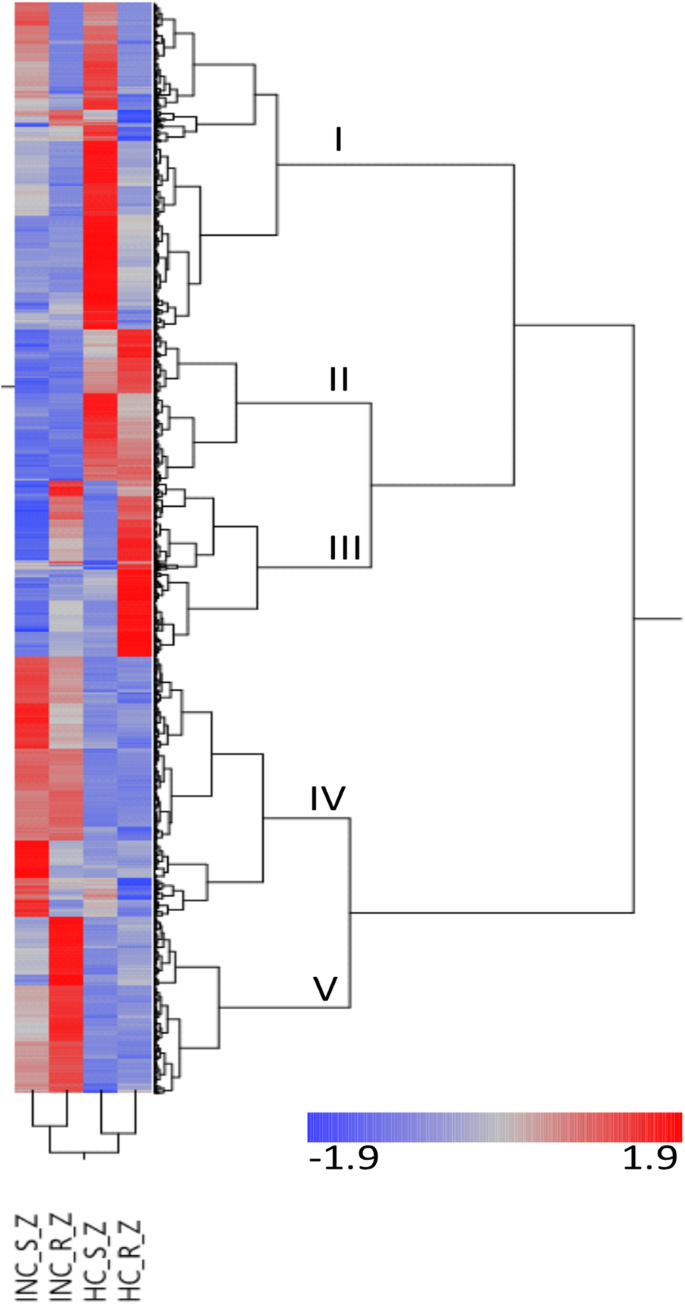
DEGs的双向聚类揭示了甲羟戊酸(MVA)和环烯醚萜通路中的共表达基因
对在至少一次比较中差异表达的基因进行双向层次聚类,发现了五个共表达的聚类(图。2).第一组(I)包含了在明显健康的易感树远端组织中表现出最高表达水平的基因。在聚类I的607个基因中,595个基因在健康组织中在两种基因型类别之间有差异表达(补充文件3.). GO项富集分析表明,聚类I对GO项富集激酶活动(GO:0016301),杂环化合物结合(GO:1901363)和有机环状复合结合(GO:0097159)。簇II中的基因在近端的样品中显着低于损伤而不是在远端无症状组织中的样品(图。2,补充档案3.).群体富集与例如与例如有关的基因。GO条款运输(GO:0006810),细胞 - 细胞信号传导(GO:0007267),射击系统开发(去:0048367)与生殖有关的发育过程(GO:0003006)。在此集群中找到了几种与生长素传输和疾病介导的转录激活/抑制的基因3.).簇III中的基因在抗性树木的明显健康远端组织中最高度表达(图。2).就像在集群I中一样,群体III中的绝大多数(94%)在远端健康组织的两个基因型类别之间进行差异差异,但不是其他对比度。簇IV和v包括比在远端健康的组织中更高度表达的基因,这些基因比在远端健康的组织中(图。2). 对与簇相关的GO项的富集分析表明,簇IV富集了GO项次生代谢过程(GO:0019748),细胞内(GO:0005622)和水解酶活性(GO:0016787)虽然集群v被丰富为GO术语碳水化合物代谢过程(去:0005975)。(补充文件3.).群体IV中的许多基因(118个中的483个基因)在远端也显着更活跃,看似健康组织在易感树上,但不是来自抗性树木(补充档案3.).
在至少一个比较中差异表达的DEG的双向分层聚类。INC_S_Z和HC_S_Z,分别在易感基因型类别中分别在样品中的近端症状组织和远端非对症组织中的表达水平。类似地,INC_R_Z和HC_R_Z,表示分别在样品中的近端症状组织和远端非症状组织中的表达水平,但在抗性基因型类中。热线图表示Z分数。共表达群集用罗马数字和字母表示。在补充文件中找到数据S3
第四组,它被GO术语丰富了次生代谢过程(GO:0019748),苯丙吡喃丙烷,斯蒂屈甲骨类化合物和黄酮类生物合成途径中的母港19次编码酶(补充档案3.).该群体还包括甲戊酯(MVA)途径的七次,产生萜类化合物,甾醇和异戊二烯的前体;HMGS.(hydroxymethylglutaryl-synthase-like,xloc_023247_tcons_00040192),hmgr1.(3-羟基-3-甲基戊二酸辅酶a还原酶,xloc_038797_tcons_00067684),伊蒂(异戊基二磷酸二磷酸二磷酸二苯甲酸酯酶,XLOC\ U 013079\ U TCONS\ U 00022546),MVK(甲羟戊酸激酶XLOC\ U 036719\ U TCONS\ U 00064121和XLOC\ U 060762\ U TCONS\ U 00105621)和FPPS/帧(法呢基焦磷酸合酶,XLOC_029273_TCONS_00050861和XLOC_021137_TCONS_00036448)。这hmgr1.基因模型是有症状近端组织与远端无症状组织比较中差异表达最强的基因之一,上调8.8倍。
看来,单萜和环烯醚萜生物合成途径可以是与MVA途径近端到病变如单萜编码酶的基因(XLOC_012295_TCONS_00021196和XLOC_070583_TCONS_00122368)和环烯醚萜的生物合成途径(XLOC_015937_TCONS_00027469,XLOC_054974_TCONS_00095590,XLOC_057453_TCONS_00099966和XLOC_086030_TCONS_00148326)(补充文件共同被调节的3.)在群集IV中也集群。有趣的是,BHLH转录因子XLOC_049531_TCONS_00086405控体IV(补充文件3.)是一个推定的Fraxinus正射影像环烯醚萜合成(BIS)基因。BIS转录因子特异性控制虹膜生物合成途径中的基因Catharanthus Roseus.[25.,26.].
坏死边缘的转录反应在感染的早期和晚期是相似的
为了调查完全发育坏死边界的响应反映了早期抵抗的反应,我们对温室的受控条件下的两岁植物进行了接种实验,比较健康,冷冻伤员和H.Faxineus.-接种样品2天后 周。
对样本进行RNA测序并将其定位到灰烬基因组(补充文件S4),70,083个预测的灰分转录物在RNA阵的文库中表示。从成绩单中映射的轨迹信息TopHat-Cufflinks管道与早期普通园区实验获得的信息加入,以允许比较DEGS。
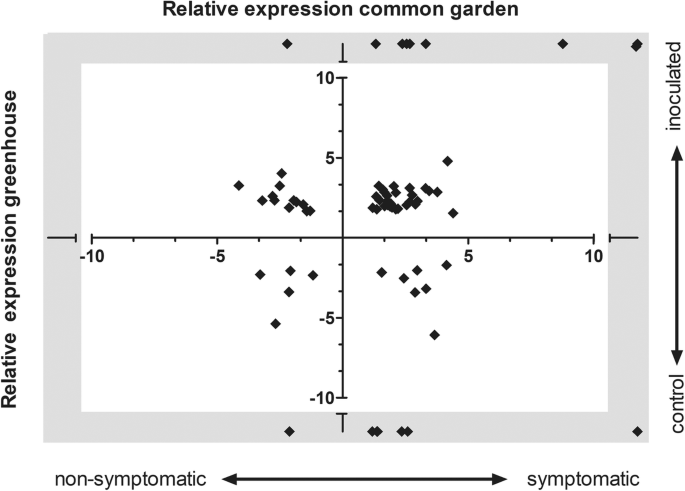
在两个比较中涉及H.Faxineus.接种(即对照与接种、伤害与接种)的DEGs分别为204和151个。对照与接种比较,接种后诱导的DEGs有149个,抑制的有55个。接种与损伤处理比较,诱导的DEGs有87个,抑制的有64个。总共318个转录本在14 dpi处坏死边缘有差异表达。其中72个DEGs与接种9个月后在普通花园试验中采集到的DEGs完全相同。3.补充表S5).三分之二(47个基因)在两个实验中显示出类似的表达模式(图。3.补充表5)而且绝大多数都在邻近坏死时监管。例如,编码丝氨酸蛋白酶抑制剂的转录XLOC_080002_TCONS_00138225是与田间条件和温室条件的看似健康组织相邻的DE NOVO表达。前面提到的hmgr1.基因(XLOC_038797_TCONS_00067684)也与下游基因XLOC_027474_TCONS_00047699(Squalene环氧酶2状,SQE2).xloc_060634_tcon_00105428似乎与拟南芥NAC转录因子ATAF1两项研究也上调(补充表5). 在两个实验中,在坏死附近被抑制的少数基因中,我们发现xloc065346_TCONS00113529与拟南芥BT1和BT2.基因。有趣的是,其中几个t在两种数据集中差异表达的基因中,还存在编码在ABA信令路径HAT22(XLOC_0172777_TCONS_00062118)和HAI2(XLOC_035596_TCONS_00034572114)和HAI2(XLOC_020080_TCONS_00034570)中进行良好表征的调节器的转录物。S5).这t编码Jaz1样蛋白的DEGS在相互作用早期阶段近端地上调,但在10个月的相互作用后,将DEGS在近端下调至坏死。此外,与抗性基因型相比,这些DEG在远端非症状组织中表达显着更高,与抗性基因型相比(补充档案3.).
讨论
接种10个月后H.Faxineus.在两种敏感和两种抗性灰分基因型中,敏感基因型的灰分坏死延伸时间至少是抗性基因型的3倍。的分数的分析H.Faxineus.RNA SEQ库中的读数表明,病变延伸或损伤障碍之间没有相关性,并且H.Faxineus.组织中的生物量。因此,我们选择将坏死样本边缘的样本称为“近端/有症状”,而将坏死远端明显健康组织的样本称为“远端/无症状”,这与Kovalchuk及其合作者的研究很相似[27.].我们发现1009个基因在近似,症状和远端,非对症样本之间差异表达,表明吠叫中的发育坏死和韧皮症与大致转录变化有关,导致大约一如既往。与灰烬中的坏剂相关的代谢变化[8,28.].
易感基因型和耐药基因型之间坏死扩展的显著差异,伴有近端有症状组织中138个基因型类别转录本和远端无症状组织中1082个基因型类别转录本的差异表达。这可以解释为,具有不同易感性水平的树之间坏死扩展的差异与非症状组织和症状组织中表达模式的差异有关,也就是说,具有不同抗性水平的树显示出不同的基础水平的基因表达和可能不同的转录反应近端进展坏死。然而,在来自抗性和易感基因型的症状组织的138个DEGs中,绝大多数(> 100 DEGs)也特异地(de novo)在这两类树中表达,而不依赖于它们与接种的邻近性。这些结果表明,这些deg可能代表基因组中的结构拷贝数变异(CNV),或不同基因型类别中不同使用的基因,而不管处理方式如何[29.,30.]在近似样品中以基因型类别中特异性表达的DEG,但在远端非对症组织中以两种基因型类别表达我们,我们鉴定了来自a的转录物可能富含亮氨酸的重复受体样丝氨酸苏氨酸 - 蛋白激酶在抗性类别中显然具有更高表达的基因。然而,所讨论的转录物在非症状组织中表达更多,特别是在抗性树木中的非症状组织中表达,表明该特定转录物代表基因型类别之间差异使用的基因。然而,为了理解这些唯一表达的转录物,特别是那些在近端和远端样品中显示相同响应的转录物,代表CNV或实际的DEG,目前的分析需要与遗传映射或全基因组重构补充。
双向聚类发现了一簇DEGs,它们在坏死病灶近端有症状的组织中平均上调2.6倍,这表明该聚类可能与控制扩散有关H.Faxineus.和发育中的坏死。该集群强调了MVA中基因的共调节(HMGS,HMGR1,MVK,IDI和FPPS/帧)和Iridoid(例如。7-脱氧糖酸葡糖基转移酶基因)途径。胞质MVA途径产生异戊二烯基二磷酸(IPP)和二甲基丙烯酸二磷酸(DMAPP)前体,例如植物中的萜烯,甾醇和类固醇生物合成等异戊二烯,HMGR1被认为是通过该路径控制通量的速率限制酶[31.,32.,33.,34.].被证实感染了H.Faxineus.导致灰中酚类和异戊二烯化合物的积累[8,28.].灰树的易感性H.Faxineus.已与叶组织中的紫烷醇水平相关联;高易感基因型显示出比抗性基因型更高的几种不同的虹膜糖苷水平[7,9].据推测,在木犀科植物中,单萜衍生物脱氧葡聚糖很可能是仲烯醚萜和环烯醚萜苷类生物合成的中间体[35.]. 虽然我们在本研究中没有量化次级代谢物的水平,但苯丙酸、萜类和环烯醚萜类途径中编码酶的基因的转录激活很可能反映在酚类和萜类、环烯醚萜类和其他类异戊二烯类物质在发展中的坏死附近的积聚中。激活hmgr1.和SQE2.在这两项实验中,与对照组相比,近端有症状的组织中,MVA通路的流量增加可能与控制扩散有关H.Faxineus.并且在相互作用几相期间,灰分中的病变中产生的坏死。
通过比较共同园林实验中的转录反应,在温室中的受控条件下进行的实验,我们试图阐明灰烬的防御反应缩小H.Faxineus.假设实验之间始终表达的基因与病原体的防御有关.我们发现在两个实验中差异表达的一组相对较小的基因,包括先前讨论的hmgr1..鉴于众异不同的实验条件,这不是出乎意料的,相反,它支持所识别的共调节基因与相互作用相关的可能性。其中一种表达的转录物是PR-6家族中的丝氨酸蛋白酶抑制剂。据报道,丝氨酸蛋白酶抑制剂活性和转录水平增加Fraxinus和茉莉酸甲酯(MeJA)处理时[13.,36.]. 蛋白酶抑制剂与蛋白酶结合并控制蛋白酶活性,这是调节多种过程所需的功能在Planta.包括防御攻击者。植物与真菌的相互作用例如,植物蛋白酶抑制剂可能降低真菌利用其致病性所必需的蛋白酶的能力[37.].de novo表达的灰蛋白酶抑制剂类似于拟南芥异常丝氨酸蛋白酶抑制剂(万国邮联基因。万国邮联,由茉莉酸酯(JA),水杨酸(SA)和脱落酸(ABA)诱导,并且是一种组成部分拟南芥对病症的真菌感染和昆虫草食病的反应[38.].laluk和mengiste [38.]提示UPI可能参与了坏死性感染阻断真菌毒素诱导的细胞死亡过程中坏死的控制。很容易想象ash需要在与细胞的相互作用中控制细胞死亡和坏死的进程H.Faxineus..
几个表达的候选基因与编码ABA或JA信号传导途径中的玩家的基因显示出显着的相似性。我们之前报道,来自耐药和易感基因型类别的灰幼苗在与植物毒素血管藻啶胺治疗后产生的姓氏和积累在ABA生物合成途径中的中间体H.Faxineus.[8]. ATAF1和它的几个助手拟南芥是非生物学之间的重要转录集成商[39.,40,41.]和生物[41.,42.,43.] 压力。ATAF1调节ABA代谢中的几种基因,包括nced3.编码ABA生物合成酶9-顺式 - 环氧丙酮蛋白二恶英酶[44.,45.],因此可以激活近似对坏死的灰烬Ataf1 orthogog的激活在组织中激活ABA生物合成途径。拟南芥转录因子的邻近的观察结果HAT22.以及PP2C基因AHG3.在两个实验中均显示中度上调,通过MVA途径的通量支持了这一解释,即在对活病原体的坏死反应中,ABA也会积累。HAT22和AHG3都是ABA信号级联的核心角色;HAT22调节的表达包括,AHG3.在里面拟南芥对ABA处理和非生物胁迫的反应[46.,47.].相比之下,JA信令似乎差异激活了两个数据集中的坏死的近端;在共同的园林实验中,JA生物合成基因如操作程序3和脂氧合酶对病变的近端进行上限,而Jaz / Tify蛋白质被调节。然而,JA-Signal传导在相互作用中的作用可能是复杂的,四个转录物与JAZ1 (TIFY)显示两个实验之间的对比规律。JAZ蛋白是JA途径中最重要的组成部分,与COI1受体一起作为激素的共同受体,并作为下游TFs的抑制物调节植物JA诱导的防御反应[48.].jaz蛋白早期相互作用中的诱导表达表明,在该相互作用的这种阶段,JA信号传导下调到坏死近端。jaz / tify.基因是在普通花园实验中基因型类别之间被调节的deg之一。它们的表达模式表明,茉莉酸途径在抗性树中比在易感树中更活跃,茉莉酸介导的反应可能在控制茉莉酸的传播中起重要作用H.Faxineus.在灰烬上开发病变。
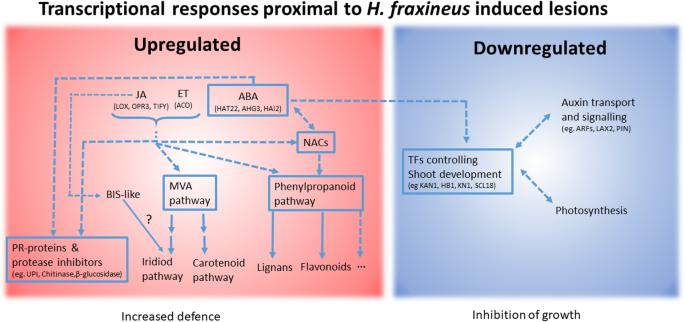
总之,我们可以表明,易感和抗性基因型类别之间看到的坏死延伸的差异与差异无关H.Faxineus.生物量和相关的相对有限的差异,二甘醇模式之间的基因型类别在坏死前线。尽管如此,我们还是可以确定一组候选基因、激素信号途径和次级代谢产物生物合成途径(图。4),很可能参与了疫苗接种后坏死的控制H.Faxineus..
方法
接种实验
常见的园林接种实验
两个易感基因型的分支(克隆S21K926076和S21K916009)和欧洲灰分(克隆S21K926100和S21K916008)的欧洲灰分在瑞典南部的Trolleholm的共同花园中生长(55.937076,13.282873)[22.人工接种H.Faxineus.(分离物nf4,以前收集自瑞典一株受感染的白蜡树)。这些树和该基地是斯科福斯克瑞典地区白蜡树育种项目的一部分,该实验得到了斯科福斯克的许可。实验设计及取样步骤如下:2011年9月选择健康的枝条,用手术刀切开树皮瓣,两周大的接种琼脂插头H.Faxineus.在2%麦芽提取物琼脂上培养,用保护膜和另一条尼龙带密封。10个月后,也就是2012年6月,研究人员对这些树木进行了取样。在取样时,从接种部位测量内皮可见病变的扩展,并根据枝条纵断面估计木材可见坏死的程度。在4个克隆的病变边缘分别采集3个样本(约2 × 0.5 cm)。三个样本来自同一无性系的非接种和非症状分支作为对照。切除的树皮样本立即浸泡在RNA中之后™ 稳定溶液,储存于− 20 °C,直到可以进行提取。
温室接种实验
两岁的裸根幼苗F. Excelsior.3月30日瑞典瑞典瑞典赫尔辛堡附近的商业幼苗获得30-50厘米。灰幼苗在塑料盆(直径20厘米)上,填充着光筛分的泥炭,黑泥炭和沙子60:25:分别为15个比例(Hasselfors Garden,Örebro,瑞典)。将植物保持在温室中,温室为16小时,6小时光周期,20/15℃(日/夜/夜晚)温度,并根据需要7周浇水,然后进行以下治疗方法之一:1)健康对照;2)伤口和3)接种H.Faxineus.. 用5号刀造成伤口 mm海绵浸泡在液体低温喷雾(cryospray 59,Cuxson-Gerrad,UK)中至树皮表面10分钟 S接种物的制备方法是将无菌木塞添加到2周龄的培养物中H.Faxineus.(NF4)。4周后,插头完全殖民H.Faxineus.用于通过切割1×1cm的树皮接种灰苗,并使用灭菌的镊子将接种物插头施加到血管结合,然后用parafilm密封伤口。在接种后7,14,28和42天进行病变开发的宏观观察。在每个采样日期,幼苗被破坏性采样,并从所有治疗中收集样品。通过用无菌的手术刀去除1×2 cm部分,从冷冻损伤或接种点收集韧皮植物组织。然后在液体n中冷冻组织2-80℃保存至RNA提取。在目前的研究中,我们只研究了那些受伤和接种后14天收集的样本。
RNA提取,cDNA合成和样品制剂
总RNA提取后[49.],用DNASEI(SIGMA)处理样品以在储存在-70℃之前除去基因组DNA。在生物分析仪2100(Agilent)上测量RNA浓度。根据制造商规格使用DynaBeAds®MRNA纯化试剂盒(Invitrogen),从样品中提取聚(a)+ RNA。使用Messageampiii套件(AMBION)根据制造商的指示进行了信使RNA扩增。然后,从扩增的RNA(ARNA),根据制造商的规格,使用IScript cDNA合成试剂盒(Bio-rad)合成cDNA,其中一个例外:RT-反应持续约50分钟。然后根据Sambrook和Russel描述的协议合成第二链cDNA [50.].接下来汇集足够的双链cDNA质量,根据治疗。然后使用Illumina Truseq 2000仪器上使用Illumina Truseq和测序(2×100bp)送到每种cDNA样品的2至5μg。
生物信息学和统计数据
从Illumina测序获得的读数用Nesoni过滤(http://www.vicbioinformatics.com/software.nesoni.shtml),以去除质量较低的碱基(质量低于20)、适配器序列,以及裁剪后读取长度小于55 bp。过滤后的读取数据与Ash基因组BATG-0.4v3 (http://www.ashgenome.org.)使用的TopHat-Cufflinks管道(23.,24.],使用推荐的设置。此后,袖手柜用于识别在每个处理中差异调节的基因,使用读取和合并的组件,根据推荐的设置。以可视化结果TopHat-Cufflinks我们使用的管道积水潭[23.,24.]和JMP Pro 13(SAS Institute)。估计金额H.Faxineus.在样本中,过滤的读取数据对齐H.Faxineus.NF 4基因组(Elfstrand等人。提交MS)使用顶帽[23.,51.]和一小部分H.Faxineus.估计每个库中的读取((在库中映射读/总读数)×100)。FASTA序列在补充文件中可用S6.
从ASH树基因组主页访问DEG的注释(http://www.ashgenome.org.)如果可用,并使用Blast2GO软件套件进行手动注释补充[52.,53.]当缺少注释时。我们还使用BLAST2GO使用Fischer精确测试在不同的比较中比较Go术语富集,(具有FDR <0.05的截止值)和Kegg Pathway映射。
为了对至少一种比较中差异表达的基因的表达模式进行双向聚类,处理INC_S(来自易感树的近端症状组织)和HC_S中的FPKM值,(敏感树样本中的远端非症状组织)和INC_R和HC_R(对应的处理样本和未处理样本即抗性树)被转换为z分数。将z分数导入JMP Pro 13,采用双向层次聚类病房的方法(补充文件中提供的数据S3).然后用热图显示表达模式。
分别分别分别分别分析了来自共同的花园和绿房实验的样本,并使用IN House Python脚本加入来自两个实验的映射数据,以允许在两个实验中进行DEGS的比较。在两种实验中差异表达的次数被验证拟南芥V 11使用BLASTX算法蛋白质组。这些DEG的FASTA序列也可用于补充文件S6.
数据和材料的可用性
来自RNA测序实验的原始读数用PRJNA663173和PRJNA663171中的NCBI沉积。
工具书类
- 1。
Pautasso M、Aas G、Queloz V、Holdenrieder O。欧洲灰(Frakinus Excelsior.)沉浸式 - 一种保护生物学挑战。BIOL CAREN。2013; 158:37-49。
- 2。
Hultberg T,SandströmJ,Felton A,ÖhmanK,RönnbergJ,Witzell J,Cleary M. Ash DieBack风险灭绝级联。BIOL CAREN。2020; 244:108516。
- 3.
Burokiene D、Prospero S、Jung E、Marciulynee D、Moosbrugger K、Norkute G、Rigling D、Lygis V、Schoebel CN。入侵灰腐病菌的遗传群体结构Hymenoscyphus fraxineus.在其扩展范围内。生物侵犯。2015; 17(9):2743-56。
- 4.
Cleary M, Nguyen D, Marčiulynienė D, Berlin A, Vasaitis R, Stenlid J.是敌是友?白蜡树枯梢病病原的生物学和生态学特性Hymenoscyphus fraxineus.在它的本土环境中。SCI批准。2016; 6:21895。
- 5。
德伦汗R、索尔海姆H、博加切瓦A、里特T、亚当森K、德伦汗T、马腾T、希拉姆。Hymenoscyphus fraxineus.是当地的一种叶病原菌Fraxinus俄罗斯远东的物种。植物病理学。2017;66(3):490–500.
- 6。
Harper Al,McKinney LV,Nielsen LR,Havlickova L,Li Y,Trick M,Fraser F,Wang L,Petergett A,Sollars ESA,等。欧洲灰分耐受的分子标记物(Frakinus Excelsior.)使用联想转录组织鉴定的沉浸病。SCI批准。2016; 6:19335。https://doi.org/10.1038/srep19335.
- 7。
Sollars ESA、Harper AL、Kelly LJ、Sambles CM、Ramirez Gonzalez RH、Swarbreck D、Kaithakottil G、Cooper ED、Uauy C、Havlickova L等。欧洲白蜡树的基因组序列和遗传多样性。自然。2017;541:212–6.
- 8。
Cleary先生、Andersson PF、Broberg A、Elfstrand M、Daniel G、Stenlid J。基因型Frakinus Excelsior.对灰腐病菌的敏感性不同Hymenoscyphus伪鼠及其对植物毒素viridiol的反应 - 一种代谢组和微观研究。植物化学。2014; 102:115-25。
- 9。
Sambles Cm,Salmon DL,Florance H,Howard TP,Smirnoff N,Nielsen LR,McKinney LV,Kjæred,Buggs Rja,Studholme DJ等。灰叶代谢物揭示树木耐受性和易受灰烬沉淀疾病的差异。SCI数据。2017; 4:170190。
- 10。
股票JJ,Metheringham Cl,Plumb Wj,Lee Sj,Kelly LJ,Nichols Ra,Buggs RJA。欧洲灰树抗灰沉浸式真菌的基因组基础。NAT ECOL EVOL。2019; 3(12):1686-96。
- 11.
Villari C, Dowkiw A, Enderle R, Ghasemkhani M, Kirisits T, Kjær ED, Marčiulynienė D, McKinney LV, Metzler B, Muñoz F, et al。先进的光谱学为白蜡病的流行提供了一个潜在的解决方案。Sci众议员2018;8(1):17448。
- 12.
白X,Rivera-Vega L,Mamidala P,Bonello P,Herms Da,Mittapalli O.转录灰分的转录组特征(Fraxinusspp。)phloem。Plos一个。2011; 6(1):E16368。
- 13。
Lane T,最佳T,Zembower N,Davitt J,Henry N,Xu Y,Koch J,Liang H,McGraw J,Schuster S等人。青春灰转录组和对非生物和生物应力应对基因的鉴定。BMC基因组学。2016; 17(1):702。
- 14。
Nemesio-Gorriz M,Menezes Rc,Paetz C,Hammerbacher A,Steenackers M,Schamp K,Höftem,Svatoša,Gershenzon J,Douglas GC。代谢组学Frakinus Excelsior.;生物化学标志物的鉴定与验证灰度沉淀的耐受性。J Exp Bot。2020:ERAA306。https://doi.org/10.1093/jxb/eraa306.
- 15.
Cui H,Tsuda K,Parker Je。效应触发的免疫:从病原体感知到强大的防御。Annu Rev植物Biol。2015; 66(1):487-511。
- 16。
Jones JDG,Dangl JL。植物免疫系统。自然。2006; 444(7117):323-9。
- 17。
Naidoo S,拖鞋B,PLETT JM,COLS D,OATE CN。森林树木抵抗道路。前植物SCI。2019; 10:273。
- 18。
Danielsson M、Lunden K、Elfstrand M、Hu J、Zhao T、Arnerup J、Ihrmark K、Swedjemark G、Borg Karlson AK、Stenlid J。不同易感性挪威云杉基因型的化学和转录反应异常SPP.感染。BMC植物BIOL。2011; 11:154。
- 19。
尹卓,柯旭,康志,黄磊。苹果对黄羽的抗性反应瓦萨马里通过转录组学分析发现。植物病理生理学。2016;93:85–92.
- 20。
陈t,lv y,zhao t,li n,yang y,yu w,他x,liu t,张b。抗易感番茄的比较转录组谱分析(Solanum lycopersicum.)品种对番茄黄曲叶病毒侵染的反应。8。2013;(11):e80816。
- 21。
Kersten B,Ghirardo A,Schnitzler J-P,Kanawati B,Schmitt-Kopplin P,Fladung M,Schroeder H.集成的转录组和代谢组学侵蚀橡皮擦抗橡皮擦对食草动物的抗性差异Tortrix ViridanaL. BMC基因组学。2013; 14(1):737。
- 22。
速度L-g。克隆差异对死刑的易感性Frakinus Excelsior.在瑞典南部。Scand J for Res。2013; 28(3):205-16。
- 23。
Trapnell C,Roberts A,Goff L,Pertea G,Kim D,Kelley Dr,Pimentel H,Salzberg SL,RINN JL,Pachter L.差分基因和RNA-SEQ实验与Tophat和袖扣的实验分析。NAT PROTOC。2012; 7(3):562-78。
- 24。
Trapnell C,Roberts A,Goff L,Pertea G,Kim D,Kelley Dr,Pimentel H,Salzberg SL,RINN JL,Pachter L.差分基因和RNA-SEQ实验与Tophat和袖扣的实验(Vol 7,PG562,2012)。NAT PROTOC。2014; 9(10):2513。
- 25。
Van Moerkercke A、Steensma P、Gariboldi I、Espoz J、Purnama PC、Schweizer F、Miettinen K、Vanden Bossche R、De Clercq R、Memelink J等。碱性螺旋-环-螺旋转录因子BIS2是药用植物生产单萜类吲哚生物碱所必需的Catharanthus Roseus..工厂J. 2016; 88(1):3-12。
- 26。
Van Moerkercke A,Steensma P,Schweizer F,Pollier J,Gariboldi I,Payne R,Vanden Bossche R,Miettinen K,Espoz J,Purnama PC等。BHLH转录因子BIS1控制单调吲哚生物碱途径的虹膜骨分支Catharanthus Roseus..PROC NATL ACAD SCI。2015; 112(26):8130。
- 27。
Kovalchuk A,Mukrimin M,Zeng Z,Raffaello T,Liu M,Kasanen R,Sun H,Asiegbu Fo。针叶树病原体自然感染无症状挪威云杉树的宫霉素分析异质素SPP。环境微生物批准。2018; 10(5):532-41。
- 28。
科奇安、特卡奇克M、Żółciak a、斯托克M、卡拉吉MH、诺瓦科夫斯卡AJ、奥斯扎科T。用亚磷酸处理的欧洲灰树幼苗在感染病毒后的存活率Hymenoscyphus fraxineus.和Phytophthora.物种。森林。2018;9(8):442.https://doi.org/10.3390/f9080442.
- 29。
Prunier J,Caron S,Lamothe M,Blais S,Bousquet J,Isabel N,Mackay J.基因拷贝数变异在自适应演变中:基因拷贝数变异的基因组分布且遗传映射揭示的基因拷贝数变异及其在未经组织物种中的适应性作用揭示,白色云杉(Picea glauca.).Mol Ecol。2017; 26(21):5989-6001。
- 30.
Dal Santo S,Zenoni S,Sandri M,De Lorenzis G,Magris G,De Paoli E,Di Gaspero G,Del Fabbro C,Morgante M,Brancadoro L等。葡萄园田间实验揭示了基因型,环境的影响和它们相互作用(G×e)对浆果转录组的贡献。工厂J. 2018; 93(6):1143-59。
- 31.
Chappell J,Wolf F,Proulx J,Cuellar R,桑德斯C.是通过3-羟基-3-甲基utaryl辅酶A还原酶催化的反应促进植物中异戊二烯生物合成的速率限制步骤吗?植物理性。1995年; 109(4):1337。
- 32。
VranováE,Coman D,Gruissem W.等异单元路径网络的结构和动态。莫尔植物。2012; 5(2):318-33。
- 33。
Thimmappa R,Geisler K,Louveau T,O'Maille P,Osbourn A.植物中的Triterpene生物合成。Annu Rev植物Biol。2014; 65(1):225-57。
- 34。
Doblas vg,Amorim-Silva V,Poséd,Rosado A,Esteban A,Arróm,Azevedo H,Bomaryly A,Borsani O,Valpuesta v等人。这SUD1.基因编码推定的E3泛素连接酶,是3-羟基-3-甲基谷族辅酶A还原酶活性的正调节剂拟南芥. 植物细胞。2013;25(2):728.
- 35。
遵守HK,Prentler PD,Ryan D,Servili M,Tyaticchi A,Esposto S,Robards K.生物合成和酚类共轭疏松症SecoIridoids的生物合成和生物转化Olea EuropaeaL. Nat Prod Rep。2008; 25(6):1167-79。
- 36。
WhiteHill JGA,Rigsby C,Cipollini D,Herms Da,Bonello P.从茉莉酸甲酯处理的灰烬中的祖母绿灰烬的出现与一般防御性状和有毒酚醛化合物血管内有关。oecologia。2014; 176(4):1047-59。
- 37。
Sels J、Mathys J、De Coninck BMA、Cammue BPA、De Bolle MFC。植物致病相关蛋白:植物致病肽的研究热点。植物生理生化。2008;46(11):941–50.
- 38。
Laluk K,Mengiste T.拟南芥细胞外的异常丝氨酸蛋白酶抑制剂抗病性真菌和昆虫草本病变。工厂J1111; 68(3):480-94。
- 39。
关键词:NAC蛋白,抗逆境胁迫,调控植物生态学报,2012;
- 40
Jensen MK、Kjaersgaard T、Petersen K、Skriver K。NAC基因:拟南芥激素信号转导的时间特异性调控因子。电厂信号行为。2010;5(7):907–10.
- 41.
吴y,邓z,赖j,张y,杨c,尹b,赵q,张l,李y,杨c等。非生物和生物应激反应中Arabidopsis Ataf1的双重功能。细胞res。2009; 19(11):1279-90。
- 42.
王X,巴斯纳亚克BM,张H,李G,李W,维尔克N,门吉斯特T,宋F。拟南芥ATAF1是一种NAC转录因子,是对坏死性真菌和细菌病原体防御反应的负调节因子。植物与微生物相互作用。2009;22(10):1227–38.
- 43.
Delessert C,Kazan K,Wilson Iw,Van der Straeten D,Wanners J,Dennis Es,Dolferus R.转录因子AtaF2抑制了拟南芥在拟南芥中的发病相关基因的表达。工厂J. 2005; 43(5):745-57。
- 44。
Garapati P,Xue G-P,Munné-Bosch S,Balazadeh S.转录因子Ataf1在拟南芥中通过直接调节关键的叶绿体维持和衰老转录级联促进衰老。植物理性。2015; 168(3):1122。
- 45。
Jensen Mk,Lindemose S,FD M,Reimer Jj,Nielsen M,Perera v,工人CT,Turck F,Grant Mr,Mundy J等人。ATAF1转录因子直接调节脱钙生物合成基因nced3.在里面拟南芥.FEBS开放生物。2013; 3:321-7。
- 46。
Song L, Huang S-sC, Wise A, Castanon R, Nery JR., Chen H, Watanabe M, Thomas J, ba - joseph Z, Ecker JR. .转录因子层次定义了一个环境应激反应网络。科学。2016;354 (6312):aag1550。
- 47。
Liu T,Longhurst广告,Talavera-Rauh F,Hokin SA,Barton MK。拟南芥转录因子Abig1继ABA信号发出的生长抑制和干旱诱导衰老。Elife。2016; 5:E13768。
- 48。
Chini A,Gimenez-ibanez S,Goossens A,Solano R.延期信号中的冗余和特异性。CurrOp植物BIOL。2016; 33:147-56。
- 49。
张S,Puryear J,Cairney J.一种从松树中提取RNA的简单有效的方法。植物mol biol报告。1993; 11(2):113-6。
- 50
桑布鲁克J,拉塞尔D。分子克隆:实验室手册。第三版,纽约:冷斯平港实验室出版社;2001
- 51
Trapnell C,Hendrickson DG,Sauvageau M,Goff L,Rinn JL,Pachter L.用RNA-SEQ进行转录分辨率的基因调节差异分析。NAT BIOTECHNOL。2013; 31(1):46-53。
- 52
Conesa A,Götzs,García-gómezJM,Terol J,TalónM,Robles M.Bast2Go:功能基因组学研究中的注释,可视化和分析的通用工具。生物信息学。2005; 21(18):3674-6。
- 53.
Gotz S,Garcia-Gomez JM,Terol J,Williams Td,Nagaraj Sh,Nueda MJ,Robles M,Talon M,Dopazo J,Conesa A.高吞吐功能注释和数据挖掘与Blast2Go套件。核酸RES。2008; 36(10):3420-35。
致谢
作者非常感谢katarinaihrmark在样本处理方面的帮助,以及位于乌普萨拉和斯德哥尔摩的SciLife实验室节点对NGS测序的支持。
资金
瑞典研究委员会的表现,授予2010-01344,2013-00965和2012-1276,以及瑞典战略研究基金会(SSF),赠款号码R8B08-0011,以及瑞典研究理事会的表现,为该研究提供了财政支持.资助者在研究设计,数据收集和分析中没有作用,决定发布或准备稿件。瑞典大学提供的开放式访问资金。
作者信息
隶属关系
贡献
MC和JS构思了这项研究。MC进行了接种实验和RNA提取物。SES进行了生物信息学分析,借助MBD和ME,并起草了稿件。我写了最后的手稿,所有作者都阅读并批准了最终版本。
通讯作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用本文
Sahraei,S.E.,Cleary,M.,Stenlid,J.等。欧洲白蜡树病变发生中的转录反应(Frakinus Excelsior.)揭示响应感染的基因Hymenoscyphus fraxineus..BMC植物BIOL.20,455(2020)。https://doi.org/10.1186/s12870-020-02656.1.
已收到:
接受:
发表:
关键词
- 灰枯死
- Frakinus Excelsior.
- 3-羟基-3-甲基戊二酰辅酶a还原酶1
- ATAF1
- 抵抗性
- 坏死的病变