- 研究文章
- 开放获取
- 发布:
转录组Cunninghamia lanceolata.雄性/雌性球果揭示了MIKC MADS-box基因与生殖器官发育的关系
BMC植物生物学体积20., 文章编号:508(2020)
抽象的
背景
Cunninghamia lanceolata.(中国FIR)是针叶树家族山脉的成员,是中国木材生产最受欢迎的栽培树之一。正在持续研究进行改进c .生长状况育种价值。鉴于种子流产率高(胚珠和花粉发育失败的原因之一)c .生长状况,女性/男性锥体的正确形成可以理论上可以增加后代的后代数量。Mikc Mads-Box基因以其在花/锥体开发中的作用而闻名,并包括典型/非典型花卉开发模型,用于AgeniSperms和Gymnosperms。
结果
我们进行了转录组分析,以发现在一个精心确定的单一发育阶段,雌性和雄性球果之间的基因差异表达,重点是MIKC MADS-box基因。最终获得47个独特的MIKC MADS-box基因c .生长状况把这些基因分成不同的分支。47个mic MADS-box基因中有27个在雌球果和雄球果中有差异表达,大部分在叶片中不表达。在这27个基因中,大多数b类基因(AP3 / PI.)在雄球果中表达上调TM8基因在雌性锥体上调节。然后,没有明显的整体偏好AG)(C + D类别)基因在雌性/雄性锥体中,似乎这些基因似乎参与了两个锥体的发展。最后,少数基因如GGM7,高级副总裁,AGL15,这些基因在雌性/雄性球果中特异表达,使其成为性别特异性球果发育的候选基因。
结论
我们的研究发现了一些MIKC MADS-box基因,这些基因在雄性和雌性球果中表现出不同的表达c .生长状况,阐明了这些基因与c .生长状况锥的发展。在此基础上,我们假设了一种可能的锥发育模型c .生长状况.研究结果表明,雌球果和雄球果的基因表达存在差异,可用于研究与性别特异性球果发育相关的未知调控网络。
背景
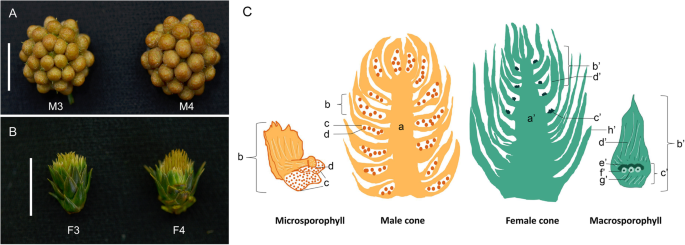
Cunninghamia lanceolata.(羔羊。)钩(中国冷杉)是中国南部最具商业中最重要的木材树之一。由于其杰出的木质性质和高增长率,它已经耕种数千年[1],其种植面积占全国总种植面积的24% [2].c .生长状况是一种单一的针叶树种类,具有分布在上冠和中间冠和中下冠和下冠中的阳锥体的雌锥[3.].c .生长状况雌性/雄性锥体从经典的贪眼花很大(图。1一种)。具体地,雌性锥由苞片鳞片组成,其底部产生的胚珠。苞片鳞片将逐渐打开,然后将接受花粉以完成施肥(图。2c) [8].在c .生长状况,雄球果聚集成一个复合结构,由几个球果组成,每个球果被许多小孢子叶包裹,其中包含花粉囊,花粉粒成熟后释放(图。2A和c) [8].由于其较高的商业价值,c .生长状况由育种者不断改进。其中一个重要的繁殖目标是提高其繁殖效率;由于约50-70%的种子可能败育,这是其发芽率低的根本原因[9].为什么种子中止尚未完全理解;两种可能的原因是花粉流产和异常胚珠发育[10].因此,研究花球发育的分子机制是了解种子败育的潜在过程。
c .生长状况女性和男性锥体与他们的垂直部分。一个与大量的男性斯特罗比利的男性锥体。b与鳞片叶子和略微打开的苞片鳞片的女性锥体。树3-15-31,显示为F3,M3;树No.4-9-31,显示为F4,M4。秤栏:A,B = 1厘米。c雄性锥与轴(a),microcophyll(b)。microclophyll熊花粉囊(c)和花粉(d)。与轴(a'),鳞片(h')和宏观孢子的雌锥。宏观孢子基与苞片尺度(d'),排卵量表(c')。用Lobe(E'),Integument(F'),Nucellus(G')的排卵量表[8]
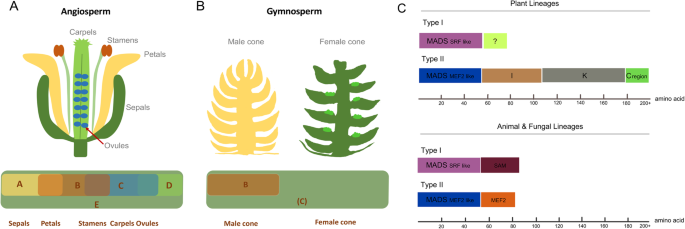
花卉发展是一种复杂的生物过程,受到遗传和环境因素的影响[11].在Angiosperms中,经典的Homeicog ABC模型解释了局部基因表达如何能够控制花卉身份(A类基因,SQUA / AP1;B类基因,AP3,PI.;C类基因,AG))[12].在最初的概念之后,ABC模型后来得到了扩展,增加了D类(D类基因,SHP,Stk.)[13]和E (E类基因,Sep1, 2, 3, 4)[14ABCDE模型,因为更多的基因参与其中。该模型的工作原理是,在发育中的花的特定区域中表达的每种同种异体基因(A到E)的独特组合,产生了特定的花组织类型[5].例如,A和E类参与萼片形成,ABE的组合影响了花瓣发育,BCE控制雄蕊形成,CE影响CARPEL发育,DCE参与建立胚珠(图。1) (15,16].然而,在裸子植物中,雌性和雄性球果的发育被认为仅受B类和C类蛋白质四聚体的控制[5,6].然而,关于裸子植物花同种异体模式仍然存在两种不同的观点:B(C)系统(图。1b)和(A) b (C)系统,其中(C)代表C + D类,(A)代表A + E类[5].
除了AP2基因,属于ABCDE模型的基因是MADS-box基因家族的成员,在花器官发育中具有重要的功能[17].所有Mads-Box蛋白质都有一个高度保守的领域,疯狂的域,可以分为两个主要谱系:I型(SRF样)和II型(MEF2类似),基于序列保护[7].这两种MADS谱系都可以在植物、动物和真菌中找到。然而,有一些特殊的结构,如K域,只有在植物的II型MADS-box基因中才发现(图1)。1c;从图重画。1(https://www.pnas.org/content/97/10/5328)“版权所有(2000)美国国家科学院,U.A.”)[7].到目前为止,在植物花卉发展中,II型疯子箱基因已经更彻底地研究了它们的功能[18].植物II型MADS-box基因的一个显著特征是,它们比I型MADS基因多包含三个结构域:介入(I)结构域、角蛋白样卷曲卷曲(K)结构域和C端(C)结构域(图1)。1c) (19].高度保守的MADS结构域是该基因家族的主要特征之一,它决定了DNA的结合和二聚[20.].K结构域可能介导蛋白质之间的相互作用,也可能参与与其他蛋白质的直接相互作用[20.].MADS域和K域由一个短的中间I域连接[21].在一些疯子箱中,C末端区域参与转录激活或三元复合物形成[22,23].这些基因被归类为mikc型,是植物特有的[7].
以前的研究c .生长状况主要关注形成层活性的调节[24, EST-SSR标记开发[25,26,27],与生长和发展相关的基因[28]纤维素和木质素生物合成[29]和早期种子发育的蛋白质组分析[1].到目前为止,关于其女性/雄性锥发育的分子机制很少。在这里,我们进行了RNA-SEQ转录组方法以鉴定差异表达在未成熟的女性和雄性锥之间的基因c .生长状况.本研究为裸子植物球果发育相关基因的研究提供了有价值的资源,并可能为今后杉木改良项目中增加种子数量的培育提供帮助。
方法
植物材料
本研究于2月下旬在两棵不同的单株活树(3 - 15-31,4 - 9-31)上采集了未成熟的雌球果和雄球果c .生长状况克隆(6421)(24].这些树种位于中国福建省杉木国家种质资源库洋口森林站。该站与南京林业大学有合作关系。为了避免样本差异的影响,雌/雄球果在树中以相似的状态和高度进行采样。雌球果的采集状态是被绿色鳞片覆盖,苞片稍开。2b),而阳锥是由几种斯特罗基(图。2a).此时胚珠已经出现,但尚未完全形成,花粉也是如此。样品的正式鉴定由作者郑仁华负责。然而,据我们所知,没有植物标本馆存放这一特定材料的凭据标本。为了进行转录组学分析,雌性/雄性球果立即在液氮中冷冻,并保存在−80°C,直到RNA提取。为了进行SEM分析,采集新鲜球果,用2.5%戊二醛(0.1 M PBS, pH 7.2)固定。所有材料均经许可获得。
扫描电子显微镜
用0.1M磷酸盐缓冲液冲洗2.5%戊二醛的雌性/雄性锥,使用一系列分级乙醇溶液脱水,使用临界点烘干机(K850,Emitech,England)干燥,在短柱上安装双面胶带,并在溅射涂餐(E-1010,日本,日本)中涂有耳云。在Quanta 200扫描电子显微镜(Fei,America)上观察样品[30.].
RNA提取和mRNA图书馆建设
根据制造商的说明,使用乙醇沉淀方案和CTAB-PBIOZOL试剂纯化总RNA。总RNA由NanoDrop和Agilent 2100生物分析仪(Thermo Fisher Scientific, MA, USA)进行质量控制和定量。用寡聚物(dT)附着的磁珠纯化mRNA。然后将mRNA片段化,然后使用第一链反应体系生成第一链和第二链cDNA。然后,将纯化的cDNA与特定的适配器序列连接。用PCR扩增cDNA片段,用Ampure XP Beads纯化。采用Agilent 2100生物分析仪和ABI StepOnePlus Real-Time PCR系统对样品库进行定量和质量控制。文库随后使用Illumina HiSeq 4000平台(华大基因深圳)进行测序(reads长度为151 bp)。测序后的reads保存在NCBI Sequence Read Archive (SRA)中,注册号为SRR10161401、SRR10161402、SRR10161403、SRR10161404。
转录组数据组装和功能注释
首先过滤原始数据以获得高质量的清洁数据。适配器序列,低质量读取(我们将低质量读取为具有超过10%的基础的低质量读数,并且从原始读取中删除了超过5%的基地的读数。然后通过FASTQC V0.11.7控制的质量清洁读数[31].通过运行trinity(v2.0.6),通过序列之间的重叠延伸到contigs中的清洁读数[32].然后,根据配对结束序列信息,将CONTIG组装成转录序列。
将装配后的unigenes的编码区域分别标注到多个公共数据库中,使用TransDecoder对其进行注释,然后使用blastp算法[33]对UniProt_sprot进行了运行[34]和HMMER数据库与pf - a。hmm(隐马尔科夫模型)[35]鉴定保守的蛋白质。
通过blast对蛋白质序列进行功能注释拟南芥,杨树trichocarpa,奥雅萨苜蓿,瑞士Prot [34].最终基因本体论(GO)[36]注释结果合并来自两者的数据答:芥和p . trichocarpa.由于我们对转录因子(TFs)特别感兴趣,我们在注释过程中添加了一个基因类型参数。在所有情况下,BLAST算法[33]应用了不大于10的电子值参数−5.
差异表达分析
通过使用RSEM将清洁读数映射到Trinity转录程序组件来估计基因表达水平[37]对于每个样本。所有基因的丰富是通过FPKM方法使用唯一映射读数的标准化和计算的[38].软件边缘器[39用于鉴定差异表达基因(DEGS)。所结果的P- 通过多次测试方法调整虚假发现率(FDR)的阈值[40].筛选显著差异表达基因(上调和下调基因)的条件为FDR < 0.01和倍数变化> 2。一个R包用于可视化结果和阅读分散。显著的DEGs也通过TopGO R包进行了GO富集分析[41].为了检测哪些转录因子家族在这个发育阶段显著富集(p值< 0.01),使用卡方检验。
MADS-box转录因子和DEGs的鉴定及系统发育重建
识别c .生长状况MADS-box序列,两个报道的隐马尔科夫模型剖面SRF (PF00319)和K-box (PF01486)均来自Pfam [35].使用hmmer软件[42],并得到了过滤条件E-value≤1.0E-04的候选序列,然后使用SMART对序列进行进一步验证[43].
为了准确地识别不同表达的MADS-box基因的雌/雄锥体c .生长状况,用edgeR分析包将低表达的MADS-box基因从DEG列表中剔除[39],留下27个疯子箱子的unigenes。R包Pheatmap(1.0.12)和Mega 7.0用于分析表达水平并构建系统发育树,其显示为热图簇。一岁的叶子的序列原始数据[44]从NCBI Sequence Read Archive (SRA)数据库(SRX2586190)下载,作为营养器官表达比较。
MADS-box序列答:芥,o .漂白亚麻纤维卷和葡萄从植物转录因子数据库中获得(http://planttfdb.cbi.pku.edu.cn/index.php),而序列日本柳杉粳稻,挪威云杉,Pinus Taeda.(http://congenie.org)分别从Futamura等人的三篇文章中获得[45, Carlsbecker等人[46和Chen等人[47].所有引用序列在附加文件中列出1.随后,使用MAFFT对多个序列的全长进行对齐[48,之后的RAxML v8.2.11 [49]构建了PROTGAMMAAUTO模式和100个bootstrap复制的系统发育树。为了支持系统发育分析,对MADS-box基因M, I, K, C结构域进行比对葡萄球菌,冷杉杆菌,P. Taeda.,C. japonica.,c .生长状况被Texshade选中并显示[50].
QRT-PCR分析
选择了几个疯狂箱基因以验证我们的DEG检测。使用生物植物总RNA提取试剂盒(RP3301)从未成熟的雌性/阳锥中获得总RNA(RP3301),仅通过CTAB替换裂解缓冲液。通过凝胶电泳(1%凝胶)测定总RNA完整性,使用NanoDrop-2000分光光度计(Thermo,Inc。)测定RNA浓度。使用Vazyme标记第1链CDNA合成试剂盒(R211-02)通过逆转录酶方法合成cDNA,然后使用QUBBit 2.0(Invitrogen)进行定量。使用vazyme aceq QPCR Sybr Green Master混合物(没有Rox)(Q121-02)在Lighcycler 480i(Roche)上一式三份进行定量实时PCR(QRT-PCR)反应。基于三次技术和生物学重复进行基因表达分析,并与参考基因标准化CleIF3.表达数据采用Livak计算方法计算,表示为log (2-ΔΔct)[51].
结果
雌球果和雄球果发育于c .生长状况
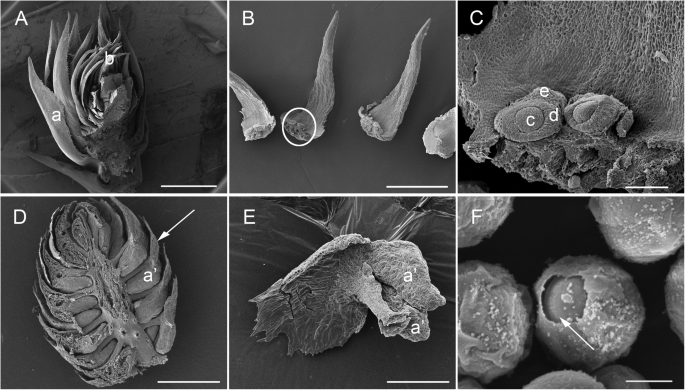
种子流产是一个不可忽略的方面c .生长状况繁殖。提高品种的育种价值c .生长状况因此,有必要对球果发育的分子机制进行研究。更糟的是c .生长状况是一个裸子植物,其雌性/雄性锥的结构与高昂的花朵的大大不同(图。1一个和无花果。2)[52].为了更好地了解其形态特征c .生长状况女性/雄性锥体,我们使用扫描电子显微镜(SEM)观察雌性和雄性锥,特别是观察胚珠和花粉。在我们采样的阶段,每种雌性锥体含有大量的苞片鳞片,在苞片尺度的底部处具有排卵,并且位于排卵等级的2-3个胚珠(图。3.b)。裂片,nucellus和整数(图。3.c)已经形成但尚未完全分化,每个胚珠的一个排卵尺度的一个叶子(图。3.c) (30.].雄性锥由大量的微麦基组成,一个在中心位置和周围螺旋布置中的残留物。每个microclecophyll都携带2-3种花粉囊(图。3.d e)。每个花粉(无花果。3.f)含有花粉孔径。
序列组装和注释c .生长状况
接下来,我们进行了整个转录组的方法来鉴定差异调节的成绩单,在雌性和公锥体的发育过程之间进行差异c .生长状况.因此,我们从全雌性/阳锥体中分离出总RNA,并使用Illumina测序技术来确定转录组。我们总共获得了22,188,695(F3女性,从树3-15-31),18,114,397(F3男性,来自树No.3-15-31),18,731,606(F4女性,来自树No.4-9-31)和22,054,735(F4男性,来自树No.4-9-31)的每个图书馆的原始读取(表S1).经过过滤和去除适配器和低质量序列后,22123838 (F3母序),18051760 (F3公序),18299131 (F4母序)和21990476 (F4公序)清除读取(表S1)保留了进一步的大会。总共产生24.14GB RNA-SEQ数据。我们总共组装了97,856名转录物,其葡萄藤N50长度为1925年的BP和63,223个unigenes,具有1721年的折叠N50长度(表S)2).所有转录物和unigenes的中位数斑纹长度为784bp和620bp,所有转录物和unigenes的平均长度分别为1228bp和1066 bp(表S2).所有63,223个组装的unigenes(表S2),共鉴定出2117个转录因子(表S3.).
雌性和雄性球果的差异基因表达
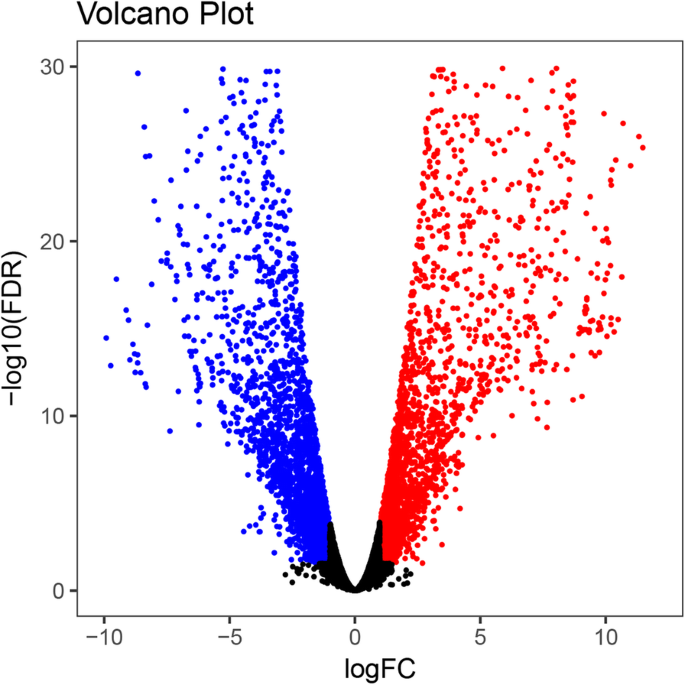
为了鉴定特异性差异表达的转录本c .生长状况雌球果和雄球果处于同一发育阶段。在所有组装的unigenes中,剔除了低表达水平的unigenes,得到18045个unigenes。我们以FDR < 0.01和Fold Change > 2为筛选标准筛选这些单基因。然后,我们进一步用GO术语和功能分类对这些基因进行了表征。我们发现5016个unigenes明显差异表达,其中2506个unigenes下调表达,2510个unigenes上调表达。4).
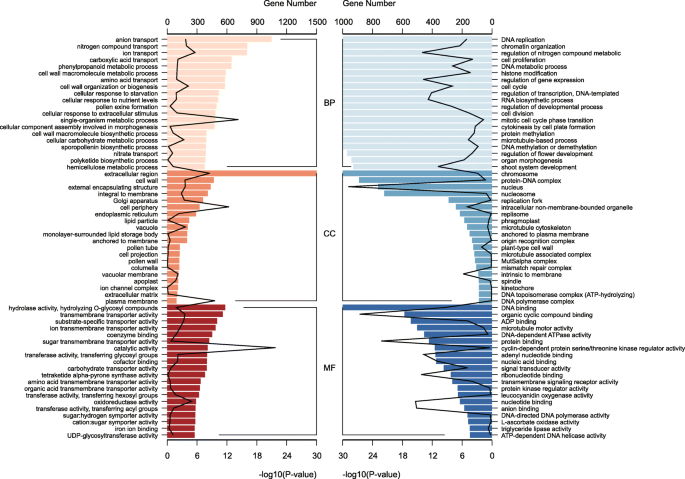
致富集分析成功地将上调/下调的未经内衣2217/2168分为三个GO子组(图。5).我们分别绘制了每个子组的前20个富集的阶段。下调基因(雄性<雌性,冷调)参与DNA复制(BP),核(CC),蛋白质结合(MF)等,而上调(男性>雌性,温调)基因参与花粉外膨胀形成(BP),细胞壁(CC),氧化还原酶活性(MF)等(图。5).这些结果表明,雌球果在生长旺盛时期细胞分裂活跃,而雄球果则主要参与花粉发育。
专注于我们之前确定的2117c .生长状况我们发现三个基因家族显著富集(P< 0.01): AP2, myb相关,和MADS-box(表1).MADS-box基因的显著表达c .生长状况在其他植物中,球果发育与花的形成过程是一致的,表明该基因家族在花的形成过程中起着重要的作用c .生长状况也
mikc mads-box转录因子c .生长状况
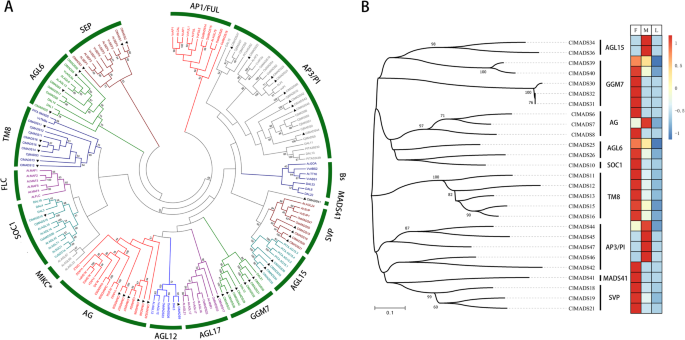
使用上面的方法,我们终于获得了47个独特的Mikc Mad-Box基因c .生长状况(表4)基于先前的研究,将这些基因分成几个分支(图。6一、表2和s4)[46,47,53,54].同时,MADS-box蛋白结构域的比较结果C. Lanceolata,P. Abies,P. Taeda和V.Vinifera,使系统发育分析可用(图S1).
中可以找到大多数MADS分支c .生长状况,就像AP3 / PI.(b级),9月(类E),AG)(c级),STK / SHP.(d级),参与花器官身份[16].然而,树枝像FLC,BS.,富裕和AP1(A类)找不到。这可以通过在所选时期期间这些同源基因的低表达来解释。另一种可能的原因是c .生长状况基因组不含这些基因。由于没有某种典型的花卉结构,花器官身份相关基因,喜欢AP1这有助于在Agiospers中有助于萼片和花瓣形成,在进化时间期间可能会丢失。具体情况下这种潜在的基因损失需要进一步研究来说明。
相反,一些疯子分支,就像TM8基因,不是在拟南芥和赖斯,但可以在c .生长状况,C. japonica.[45],V. Vinifera.[53].这些结果表明TM8基因是在高血管植物和裸子植物的共同祖先中建立的,并且在一些植物谱系的相对近期的演化历史中,它们已经独立丢失了[55].
我们还发现了少量的MIKC MADS-box基因,这些基因可以归类到GGM7分支中,而在被子植物中没有发现[46].相比之下,AGL15和AGL12基因在c .生长状况,Pinus Taeda.[47],以及服直者等答:芥[56),V. Vinifera.[53,表明这些基因可能在被子植物和裸子植物的花/球果发育中具有重要的功能保守性。与此同时,有一种基因不能被归入任何分支。我们在NCBI (https://www.ncbi.nlm.nih.gov/)使用BLASTP并发现它是部分身份AG-like基因。然而,在我们的系统发育树中无法得到分类。因此,我们用它的编号命名它:MADS41,这使其成为一种新的候选基因。
mikc mads-box degsc .生长状况女性和雄性锥体
接下来,我们使用我们的差异基因表达数据来确定哪些MADS-box基因在雌球果和雄球果之间有差异表达,使用来自叶片的表达数据作为非生殖组织的比较。我们推断,参与生殖器官发育的基因应该在这些器官中更具体地表达。47个人中c .生长状况Mikc Mads-Box基因,27个基因在阳性和雌性锥体之间差异表达,其中18(27分)不在叶片中表达,9(27个)在叶子中没有显着表达。(图。6b及表S5).大多数B级基因(AP3 / PI.)(4)在雄性锥上调节,类似于在其他植物物种中进行的先前研究中发现的内容[57,58),而TM8基因在雌性锥形的较高水平下显然表达,并且更有可能参与女性锥发育。
因为我们发现了一些AG)(C + D类别)基因在雌锥中的雄性锥和其他基因上上调,似乎这些基因似乎参与了任何锥体的发展。我们确定了三个9月(e)和四AGL6基因c .生长状况.然而,9月基因表现出非常低的表达水平,这是很难确定他们的差异表达在锥。然而,我们确实找到了两个AGL6在女性和雄性锥体中表达的基因。事实上,在我们收集的阶段,AGL6基因在雌锥中显示出更高的表达水平。
GGM7根据系统发育树,基因可以细分为2类:DAL10-like和DAL21-like.它们在雌性和雄性锥体中有不同的表达模式P. Abies.[46),以及在c .生长状况.而在答:芥AGL15在叶、花序、花药和花粉中表达[59];高级副总裁表达于幼叶、花原基和早期共花期[60],AGL15和高级副总裁的雄性和雌性锥体中都高度表达c .生长状况, 分别。除了,MADS41是一个特别的基因,没有明显分类。但其雌性锥体中的高表达水平,使其成为可能参与女性锥发育的候选基因。
的验证c .生长状况女性/男性锥体转录om
为了验证雄性和雌性球果库的差异,我们选择了有限数量的球果库c .生长状况来自差异表达基因名单的MIKC MADS-BOX基因(表S.5)在整个锥体RNA上进行QRT-PCR分析(图。7).该组包括已知在模型生物中涉及Carpel或雄蕊发育的基因(AG) AP3 /π),以及在某些高昂(如拟南芥和米饭)(TM8).
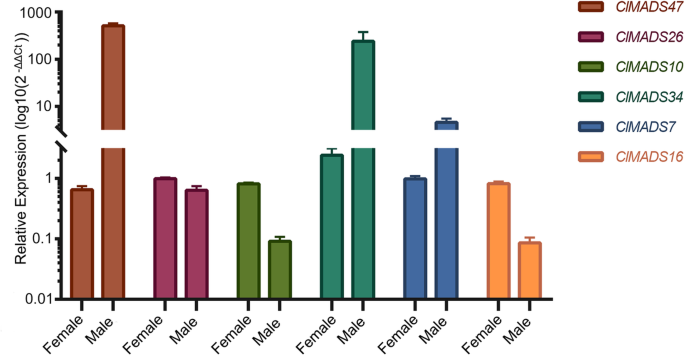
差异表达的相对表达c .生长状况选择的女性和雄性基因验证RNA-SEQ结果。Clmads7,10,16,26,34,47选择验证,CleIF3用作参考基因。y轴表示表达水平(2-ΔΔct),这是用利瓦克的方法计算的[47然后转换为log10刻度(log10 (2-ΔΔct)).错误条表示标准错误(SE)
这些结果与RNA-SEQ数据密切一致,例如,表达水平ClMADS34雄球果的基因表达量约为雌球果的100倍ClMADS10在雌性球果中是雄性球果的近10倍,这与转录组数据的结果一致,提示了我们的转录组分析数据的可靠性(图1)。6b和无花果。7).
讨论
作为一种重要的木材品种,c .生长状况再现一直是通过育种计划提高的特征之一。种子流产是一种常见的发生c .生长状况而不正确形成的胚珠和花粉可引起。在这里,我们研究了分子机制c .生长状况通过转录组分析的球果发育。
基于这些数据,我们进行了顺序分析,以确定女性和男性锥体之间的差异,然后我们专注于疯子箱基因家族c .生长状况揭示可能涉及的特定基因c .生长状况锥形发展与裸子植物中ABC模型的表现。
我们发现B类,C,D和E基因c .生长状况并且对于那些在雄性或雌性锥体中显着上调的那些基因,主要是在叶子中表达。B类基因,AP3 / PI.(ClMADS44, 45, 46, 47)主要在雄球果中表达上调,最可能影响雄性器官的发育。类似的结果在被子植物中也有报道Quercus Suber.[57和裸子植物C. japonica.[61例如,CjMADS1b型MADS-box基因在雄球果中表达C. japonica..在挪威云杉中发现,b型MADS-box基因在雄性器官原基中具有活性[62],与被子植物中的b类基因同源[63].这些结果表明,b型基因在裸子植物和被子植物中都有保存,可能在整个种子植物中都有保存。
C类和d类基因不能被明显分离c .生长状况,并在两个生殖器官中表达。AG)在两个锥体中表达的基因P. Abies.[64),Gnetum gnemon[65)(裸子植物)。这与Quercus Suber.(被子植物),其中c类基因在雄花和雌花中表达水平相似[57].这些结果表明,这些C型基因可能在裸子植物和高管培养中起着类似的作用,这是女性和男性锥形/花开发的供应[4].不幸的是,我们无法识别E-Class基因的表达,因为它们在雄性或女性锥体上没有显着表达。因此,我们推测在这种发展过程中没有必要的级别基因。
此外,我们确定了表达AGL6基因c .生长状况,在雌球果和雄球果中均有表达,在雌球果中表达量较高,但在叶片中不表达,与它们的同源基因的表达模式相似G. Gnemon.[65].GGM7基因引起了我们极大的关注,因为它们只存在于裸子植物中[66].在P. Abies., 这GGM7分支包含2个基因:DAL10和DAL21.DAL10在球果和花粉球果中特别活跃[66),而DAL21在雄性锥或营养芽中未检测到,但在雌性锥体的排卵量表中。意味着,ClMADS 30,31,32,被分为DAL21在雌球果中表达量明显较高,而在雄球果和叶片中表达量不高,具有相似的表达模式那在P. Abies..但当涉及到DAL10基因。DAL10基因(ClMADS 39、40)c .生长状况在雌球果和雄球果中均有表达,雌球果中表达更高。这反映了不同物种的基因既有功能保守性,也有功能分化性。
AGL15和高级副总裁基因充当花卉过渡的阻遏物答:芥[59,60),而在c .生长状况,AGL15和高级副总裁在男性和女性锥体中高度表达。这可能是一个有趣的研究问题,可能意味着中国冷杉中类似的抑制剂,限制了锥体的发展范围。
此外,我们鉴定了几种可能在女性锥发育中发挥重要作用的基因。我们检测到TM8在雌性锥体上全调节的基因,基本上没有用叶子表达。研究人员发现了大肠茅,EGTM8在早期和晚期的花蕾[67].在番茄中,TM8可能对子房和果实的形成很重要[68].Gramzow等人[69)表明,TM8基因可以在许多裸子植物中发现,但很少的研究揭示了它在裸子植物的器官开发中的功能。考虑到胚珠和花粉c .生长状况收集时仍处于发育阶段,我们推测这些基因很可能影响胚珠发育,可以进一步研究。
基于我们的研究结果,我们倾向于同意Theißen等人提出的裸子植物球果发育的B(C)模型[5),其中A类和e类基因可能与球果发育无关。为了验证该模型的适用性c .生长状况,需要更多的实验来确认B(c)基因的功能,并排除其他基因(A,E-Class基因)的累积。以一般的方式,我们通过过表达和敲除该物种中的这种基因来研究基因功能。不幸的是,成熟的转基因系统c .生长状况尚未开发出来,并且在这种物种中进行转基因实验将具有额外的缺点,即木质植物的开花需要很长时间。因此,例如,应该考虑其他方法,例如,表达c .生长状况模式生物的b型基因拟南芥,从而研究这些基因的功能保存程度。但必须强调的是,基因功能研究最终将回归物种本身。然而,考虑到转基因裸子植物产生的困难和其漫长的代期,这些研究需要大量的时间和精力。
由于材料选择的限制,我们的结果仅限于一定发育时期的雌、雄球果差异基因。虽然通过我们的研究确实发现了一些值得注意的基因,但可能丢失了一些有关球果发育的信息,无法获得这些MADS-box基因参与整个发育过程。进一步的研究可以监测从球果起始到雌球果受精的整个发育过程,可能发现所有涉及的MADS-box基因,并进行更完整的解释。
结论
综上所述,我们对雌性和雄性锥体进行了RNA-Seq分析c .生长状况并分析了雌性和阳锥之间的基因表达差异。我们确定了47个mikc mads-box基因c .生长状况,并鉴定了一些与球果发育相关的MADS-box基因c .生长状况,可能符合前一个B(c)型裸子植物模型。我们还确定了可能在女性/男性锥形发育中发挥重要作用的额外基因。此外,我们提供了一个基因数据库,其显示了女性和雄性锥之间的差异表达,可以用作在未来发现未知的监管网络的基础。
数据和材料的可用性
本研究中产生或分析的所有数据均包含在文件和NCBI SRA数据库(登录号SRR10161401、SRR10161402、SRR10161403、SRR10161404)中,可通过联系通讯作者(chenjh@njfu.edu.cn).
缩写
- FPKM:
-
每千碱基中的片段每百万次读取
- RSEM:
-
期望最大化的rna测序
- 磨边机:
-
数字基因表达数据的实证分析。
参考
- 1.
史金生,郑瑞荣。种子早期发育的蛋白质组学分析Cunninghamia lanceolata.(羊)。钩。实验机器人。2010;61:2367-81。
- 2.
关键词:杉木人工林,土壤酶活性,土壤肥力,土壤肥力为杂志1993;6:321-6。
- 3.
关键词:杉木,传粉生物学,传粉生物学引用本文:南京林业大学学报1995;19:47-51。
- 4.
赵t,holmer r,bruijn s,Angenent GC,Ha Vdb,Schranz Me。MADS箱转录因子基因的系统核发生物同步网络分析揭示了谱系特异性的换位,古代串联重复和深部位保护。植物细胞。2017; 29:1278-92。
- 5.
mads结构域转录因子与花发育的四个模式:连接植物的发育和进化。发展。2016;143:3259 - 71。
- 6.
Chanderbali as,Yoo Mj,Zahn LM,Brockington SF,Wall PK,Gitzendanner Ma,Albert VA,Leebens-Mack J,Altman NS,Ma H,Depamphilis CW,Soltis de,Soltis PS。花香植物多样化过程中基因表达的养护与调用伴随着花的起源和演化。PROC NATL ACAD SCI。2010; 107:22570-5。
- 7.
Alvarez-Buylla ER, Pelaz S, Liljegren SJ, Gold SE, burgff C, Ditta GS, Lluis RDP, Martinez-Castilla L, Yanofsky MF。祖先MADS-box基因复制发生在动植物分化之前。美国国家科学研究院,2000;
- 8。
张,W.Z.(2005年)).杉木繁殖特性研究。[dissertation/doctor's thesis], Huazhong Agricultural University.
- 9。
高智,史志林,徐义明,朱志平,沈荣军,唐晓华。种子发育生理、败育种子的形成及减少败育措施的研究Cunninghamia lanceolata..适用权。2000; 13:659-66。
- 10.
梁春林,刘明杰,赵杰。植物种子败育研究进展。Mol Plant Breed. 2005; 3:117-22。
- 11.
Fornara F,De Montaigu A,Concland G. Snapshot:控制拟南芥的开花。细胞。2010; 141:550。
- 12.
Coen Es,Meyerowitz Em。螺纹战争:控制花发育的遗传相互作用。自然。1991; 353:31-7。
- 13.
Angenent GC, Franken J, Busscher M, Dijken AV, Went JLV, don HJ, Tunen AJV。矮牵牛花胚珠发育与一类新的MADS box基因有关。植物细胞。1995;7:1569 - 82。
- 14.
Pelaz S, Ditta GS, Baumann E, Wisman E, Yanofsky MF。B和C花器官功能需要SEPALLATA MADS-box基因。大自然。2000;405:200-3。
- 15.
花卉器官身份的发展:来自MADS房子的故事。植物生物学,2001;4:75-85。
- 16.
Soltis De,Soltis PS,Albert VA,Oppenheimer DG,Depamphilis CW,Ma H,Frohlich MW,TheIßenG.缺失链接:花卉和花卉多样化的遗传建筑。趋势植物SCI。2002; 7:22-31。
- 17.
ParenicováL,Folter SD,Kieffer M,Horner DS,Favalli C,Busscher J,Cook He,Ingram RM,Kater MM,Davies B,Angenent GC,Colombo L.分子和系统发育分析完全疯狂箱转录因子家庭的分子和系统发育分析拟南芥:对疯子世界的新开口。植物细胞。2003;15:1538-51。
- 18。
De Bodt S,Raes J,Florquin K,Rombauts S,Rouz P,TheI en Gn,Van de Peer Y. Genomewide在植物中I型疯子箱基因的结构注释和进化分析。J Mol Evol。2003; 56:573-86。
- 19。
关键词:拟南芥,同源性,转录因子,AGL1-AGL6基因Dev。1991;5:484 - 95。
- 20。
Shore P, Sharrocks AD。MADS-box转录因子家族。生物化学,1995;271 - 13。
- 21。
Purugganan MD,Rounsley SD,Schmidt RJ,Yanofsky MF。花卉发展的分子演变:植物疯子箱调节基因家族的多样化。遗传学。1995年; 140:345-56。
- 22。
拟南芥(Arabidopsis thaliana)无瓣a1 (APETALA1)转录激活域c -末端的分析。中国生物医学工程学报,1999;
- 23.
EGEA-Cortines M,Saedler H,Sommer H.疯狂箱子蛋白酶,Deficiens和Globosa之间的三元复杂的形成参与了Antirrhinummus的花卉建筑。2014年EMBO J. 2014; 18:5370-9。
- 24.
关键词:杉木,形成层,转录组,转录组特征Cunninghamia lanceolata.(羊肉。)钩子)。Plos一个。2013; 8:E71562。
- 25.
关键词:杉木,EST-SSR,多态性,转录组Silvae麝猫。2013;62:137-41。
- 26.
徐勇,陈建华,李勇,洪志,王勇,赵永强,王新民,史建生。杉木EST-SSR和基因组- ssr的开发。南京林业大学学报(自然科学版)。2014; 38:9-14。
- 27.
欧阳林,陈建华,郑瑞荣,徐勇,林云飞,黄建华,叶德强,方永红,史金生。利用SSR标记分析杉木1个育种群体种质的遗传多样性南京林业大学学报2014;38:21-6。
- 28.
王光发,高原,王建军,杨利伟,宋瑞涛,李新荣,史建军。2个形成层丰富的杉木(Cunninghamia lanceolata) α-扩张蛋白基因clexpa1和ClEXPA2的过表达影响了转基因烟草的生长发育,增加了细胞壁纤维素含量。植物生物技术2011,9:486 - 502。
- 29.
黄洪辉,徐丽丽,童宗坤,林爱平,刘庆平,程丽娟,朱美美。杉木(Cunninghamia lanceolata)转录组的从头特征和参与纤维素和木质素生物合成的候选基因分析。BMC基因组学。2012;13:648。
- 30.
Farjon A,Ortiz Garcia S. Cunninghamia和台湾(Cupressaceae Sensu Lato)的卵子和卵子发育及其对针叶树进化的重要性。我是J机器人。2003; 90:8-16。
- 31.
安德鲁斯,S . .一个高通量序列数据的质量控制工具。http://www.bioinformatics.babraham.ac.uk/projects/fastqc/.2014.
- 32.
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q,Chen Z,Mauceli E,Hacohen N,Gnirke A,Rhind N,Di Palma F,BirrenBW,NUSBAUM C,LINDBLAD-TOH K,Friedman N,REGEV A.来自RNA-SEQ数据的全长转录组件,没有参考基因组。NAT BIOTECHNOL。2011; 29:644-52。
- 33.
Camacho C, Coulouris G, Avagyan V, Ma N, Papadopoulos J, Bealer K, Madden TL. BLAST+:架构与应用。BMC生物信息学。2009;10:421。
- 34.
Apweiler R,Bairoch A,Wu C,Barker W,Boeckmann B,Ferro S,Gasteiger e,Huang H,Lopez R,Magrane M,Martin M,Natale D,O'Donovan C,Redaschi N,Yeh LSL。UNIPROT:通用蛋白质知识库。核酸RES。2004; 32:D115-9。
- 35.
Finn Rd,Bateman A,Clement J,Coggill P,Eberhardt Ry,Eddy SR,Heger A,Hethington K,Holm L,Mistry J,Sonnhammer Ell,Tate J,Punta M. PFam:蛋白质家庭数据库。核酸RES。2013; 42:D222-30。
- 36.
Ashburner M,球CA,Blake J,Botstein D,Butler H,Cherry J. Gene本体:统一生物学的工具。基因本体组织。NAT Genet。2000; 25:25-9。
- 37.
李斌,杜威CN。RSEM:从RNA-Seq数据中准确的转录本定量,有或没有参考基因组。BMC生物信息学。2011;12:323。
- 38.
Trapnell C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ, Salzberg SL, Wold BJ, Pachter L.转录本组装和定量的RNA-Seq揭示了细胞分化过程中未注释的转录本和亚型转换。生物科技Nat》。2010;28:511-5。
- 39.
罗宾逊MD,麦卡锡DJ,SMYTH GK。编辑:用于数字基因表达数据的差异表达分析的生物导体包。生物信息学。2009; 26:139-40。
- 40。
利用假发现率控制方法鉴别差异表达基因。生物信息学。2003;19:368 - 75。
- 41。
Alexa A,Rahnenfuhrer J. Gene与Topgo设定了丰富分析;2009年。
- 42。
HMMER web服务器:交互式序列相似性搜索。核酸杂志2011;39:W29-37。
- 43。
Schultz J, Milpetz F, Bork P, Ponting CP. SMART,一个简单的模块化架构研究工具:信号域的识别。自然科学学报,1998;95:5857。
- 44。
李敏,苏松,吴萍,张勇,陈伟,马晓明。杉木(Cunninghamia lanceolata (Lamb.))转录组特征以及候选磷酸盐转运体基因的表达分析。森林。2017;8:420。
- 45。
Futamura N ., Totoki Y ., Toyoda A ., Igasaki T ., Nanjo T ., Seki M ., Sakaki Y ., Mari A ., Shinozaki K., Shinohara K.。BMC基因组学。2008;9:383。
- 46。
(1)挪威云杉(Picea abies)种子球果发育的分子调控及针叶树胚珠发育器官的进化。新植醇。2013;200:261 - 75。
- 47.
陈F,张X,刘X,张L.裸子植物和植物植物中Mikcc型Mad-Box基因的进化分析。前植物SCI。2017; 8:1-11。
- 48.
Katoh K,Misawa K,Kuma Ki,Miyata T. Mafft:一种基于快速傅里叶变换的快速多序列对齐的新方法。核酸RES。2002; 30:3059-66。
- 49.
Stamatakis a . RAxML version 8:用于系统发育分析和大型系统发育后分析的工具。生物信息学。2014;30:1312-3。
- 50.
Beitz E. TexShade:使用LaTex2e的多个序列对齐的着色和标记。生物信息学。2000; 16:135-9。
- 51.
Livak KJ, Schmittgen TD。采用实时荧光定量PCR对相关基因表达数据进行分析-ΔΔct、方法。方法。2001;25:402-8。
- 52.
鲍曼杰。被子植物花发育在分子和遗传水平上的进化保护。J Biosci。1997;22:515-27。
- 53.
Díaz-riquelme J,Lijavetzky D,Martínez-Zapater Jm,Carmona MJ。MIKC的基因组分析C,C型Mads Box基因在葡萄树中。植物理性。2009; 149:354-69。
- 54.
Ren Z, Yu D, Yang Z, Li C, qanber G, Li Y, Li J, Liu Z, Lu L, Wang L, Zhang H, Chen Q, Li F, Yang Z. the genome identification of mic -type MADS-box gene family in Gossypium hirsutum L., 2011 .(1)中国农业科学(中国农业科学)植物科学进展,2017;
- 55.
Becker A.和G,T ..疯狂箱基因的主要种族及其在开花植物的发展和演变中的作用。mol phylocyet evol。2003; 29:464-89。
- 56.
关键词:拟南芥,MADS-Box转录因子,分子生物学,系统发育植物细胞。2003;15:1538-51。
- 57.
Rocheta M, Sobral R, Magalhães J, Amorim MI, Ribeiro T, Pinheiro M, Egas C, Morais-Cecílio L, Costa MMR。雌雄同株栎雌雄花的转录组学比较分析。植物科学与技术,2014;
- 58.
Immink RGH, Ferrario S, Busscherlange J, Kooiker M, Busscher M, Angenent GC。矮牵牛MADS-box转录因子家族分析。Mol Gen Genomics, 2003;
- 59.
Adamczyk Bj,Lehtishiu Md,Fernandez de。疯子域因素AGL15和AGL18行动被释放为拟南芥花转换的阻遏。工厂J. 2007; 50:1007-19。
- 60。
Hartmann U,Hohmann S,Nettesheim K,Wisman E,Saedler H,Huijser P. SVP的分子克隆:拟南芥中花卉过渡的负调节器。工厂J. 2000; 21:351-60。
- 61。
Fukui M,Futamura N,Mukai Y,Wang Y,Nagao A,Shinohara K.祖先疯狂盒基因在Sugi,Cryptomeria japonica D. Don(Taxodiaceae),对Anuiospers的B功能基因同源。植物细胞生理。2001; 42:566-75。
- 62。
SundströmJ,EngströmP.Conifer生殖发育涉及B型Mad-Box基因,在雄性器官原基中具有不同和不同的活动。工厂J. 2002; 31:161-9。
- 63。
Sundstrom J,Carlsbecker A,Svensson Me,Svenson M,Johanson U,Theissen G,Engstrom在开发挪威云杉(Picea Andea)的花粉锥体中活跃的疯狂盒基因对Agiosperms的B级花卉归属基因同源。Dev Genet。1999年; 25:253-66。
- 64。
Tandre K,Albert VA,Sundas A,Engstrom P.针叶树同源物给治疗Angiosperms的花卉发育。植物mol biol。1995年; 27:69-78。
- 65。
冬天K,Becker A,Munster T,Kim Jt,Saedler H,Theisen G. Mad-Box基因揭示了Gnetophytes与针叶树更密切相关,而不是开花植物。P Natl Acad Sci USA。1999; 96:7342-7。
- 66。
Carlsbecker A, Sundström J, Tandre K, Englund M, Kvarnheden A, Johanson U, Engström P.来自挪威云杉(Picea abies)的DAL10基因可能属于裸子植物特有的MADS-box基因亚类,在种子球果和花粉球果中具有特异活性。另一个星球Dev。2003;5:551 - 61。
- 67。
Vining KJ, Romanel E, Jones RC, Klocko A, ales - ferreira M, Hefer CA, Amarasinghe V, Dharmawardhana P, Naithani S, Ranik M, Wesley-Smith J, Solomon L, Jaiswal P, Myburg AA, Strauss SH. .巨桉的花转录组。新植醇。2015;206:1406-22。
- 68。
关键词:番茄花,MADS-box, TM8,基因表达中国生物医学工程学报,2014;
- 69。
Gramzow L,Weilandt L,TheißenG.Mods在针叶树中出现基因组:朝着确定种子植物中的祖先疯子盒基因。安乐伦敦。2014; 114:1407-29。
致谢
作者希望感谢编辑和审稿人提供的有用的评论和建议。
资金
该研究得到了江苏林业局(Lykj [2017] 42),江苏省重点研发计划,中国的自然科学基金(31770715),江苏省清兰工程,杰出教授项目(31770715)作者:王莹,江苏省高等教育机构与优先学术课程开发。这些融资机构没有在收集,分析,数据解释以及写作稿件中发挥任何作用。
作者信息
隶属关系
贡献
D.D.w为此工作数据分析,实验表演和写作做出了贡献。J.H.C和JS.S设计了这项工作并提供了修改建议。z.d.h写了分析代码,并使用x.f.l,z.j.w和y提供了编辑建议.P提供了锥结构标识支持。r.h.z,x.y.z和d.q.y执行了实地工作和收集的样本。W.H.W帮助数据执行。x.y.h和g.b.w提供编辑建议。所有作者都读过并批准了稿件。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
利益争夺
作者们宣称他们没有相互竞争的利益。
附加信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
额外的文件1。
所有系统发育树参考序列。
附加文件2表S1。
测序数据的c .生长状况锥RNA-SEQ图书馆。各个文库由四个特定的RNA池产生,来自雌锥(F3和F4)的两个,来自阳锥(M3和M4)。表S2。关于所有样品的组装转录物和未成年人的概述。表S3。注释转录因子(TFS)概述。
附加文件3表S4。
全部c .生长状况MIKC型MADS-box基因。
附加文件4图S1。
所选MADS-BOX基因的对齐域保护域。m(a),i(b),k(b&c),c(d)毛箱蛋白的域V. Vinifera.,C. japonica,p. abies,p. taeda和c .生长状况(不完全长度).
附加文件5表S5。
差分表达的mikc mads-box基因C.兰克拉塔。
附加文件6表S6。
用于QRT-PCR的引物列表。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
王,D.,Hao,Z.,Long,X.等等。转录组Cunninghamia lanceolata.雄性/雌性球果揭示了MIKC MADS-box基因与生殖器官发育的关系。BMC植物杂志20,508(2020)。https://doi.org/10.1186/s12870-020-02634-7
收到了:
接受:
发表:
关键词
- 锥发展
- c .生长状况,转录组
- MADS-box基因
- 花卉的发展模式