抽象的
背景
桂花(桂花雀族露(Lour.)是中国十大传统观赏花卉之一。一次开花品种的开花时间o .桂花低温对其影响较大,但对其分子机理的报道较少。有一种假说认为,在低温胁迫下,与花开放相关的基因可能被上调o .桂花.因此,我们的工作旨在探讨相对低温调控花开放的潜在分子机制o .桂花.
结果
观察了不同发育时期花瓣表皮细胞的正、背面大小和花瓣细胞的超微结构形态。花瓣表皮细胞的大小随着花的开放而逐渐增大。然后利用转录组测序分析相对低温(19°C)和相对低温(23°C)处理不同天数下的差异表达基因(DEGs)。基因本体论分析中DEGs的“代谢过程”、“细胞过程”、“结合”、“催化活性”、“细胞”、“细胞部分”、“膜”、“膜部分”、“单生物过程”和“细胞器”高度富集。在KEGG分析中,“代谢途径”、“次生代谢物生物合成途径”、“植物-病原体相互作用途径”、“淀粉-蔗糖代谢途径”和“植物激素信号转导途径”是含DEGs最多的5个途径。深入分析了参与细胞壁代谢、植物激素信号转导途径以及8种转录因子的二烷基糖苷类化合物。
结论
涉及细胞壁代谢,植物激素信号转导途径的几种unigenes,以及在不同温度处理之间的具有高度可变的表达水平的转录因子,可以响应于相对低温的花瓣细胞膨胀。这些结果可以改善我们对相对低温调节的花开口的分子机制的理解o .桂花,为开花时间的预测和调节提供实用信息o .桂花,最终为转基因技术的发展铺平了道路o .桂花.
背景
桂花雀族不悦之色。(木犀科)是中国十大传统观赏植物之一,已有2500多年的栽培历史[1].它是一棵小常绿树,作为芬芳的食用花朵的观赏植物种植。栽培品种o .桂花根据开花习性的不同可分为一次开花组和反复开花组[2].春天的春天绽放,开花时间在不同的地区变化很大,如杭州,上海,南京和苏州,甚至在同一地区的不同年份[3.].对不同品种花期的研究表明,开花前较低的温度是决定花期开放的最重要环境因素o .桂花[3.,4].然而,对花开放的分子机制的认识o .桂花特别是对较低温度的反应仍然有限。
在许多高等植物中,花瓣的生长是花朵开放过程中最显著的过程。花瓣是花卉生殖器官中最重要的组成部分,在吸引合适的传粉者方面起着重要作用。花朵的颜色、大小、形状和外观由花瓣决定,是育种者和消费者欣赏的重要性状[5].花瓣的大小是由花瓣生长初期的细胞分裂和开花后期的细胞扩张决定的[6].
细胞膨胀伴随着一系列过程,包括细胞壁松动,纤维素生物合成,多糖转化为可溶性碳水化合物,离子和水吸收,以及细胞骨架重排[7].细胞壁松动蛋白包括扩张蛋白(EXP)、木葡聚糖内转糖基化酶/水解酶(XTH)、内切-1,4-β- d -葡聚糖酶和果胶酶[8].其中,EXP和XTH特别参与破坏纤维素微纤维与细胞壁交联聚糖之间的非共价键,增加细胞壁的蠕变速率,而果胶酶和endo1,4 -β- d -葡聚糖酶则能降解细胞壁[9].梅花(Chimonanthus早熟),的表达式经验值开花期间基因增加[10].康乃馨的发展瓣显示纤维素酶和果胶酯酶的高活性[11].这些发现表明,与花开口相关的花瓣增长可能归因于细胞扩张。此外,根据多糖的降解可溶性碳水化合物可以充当渗透活性化合物,其可以降低渗透水势并促进水涌以允许细胞扩张[12].在香石竹等植物的开花过程中,花瓣中可溶性碳水化合物的浓度会增加[13],玫瑰[14,菊花15],Tweedia caerulea[16),而桔梗[17].
细胞的扩张既受温度、湿度、光的质量和数量等外部因素的调控,也受生物钟和植物激素等内部因素的调控[18,19].植物激素是调节花开放最重要的介质,可受昼夜节律因素或环境因素的影响。就目前的研究而言,大多数植物激素,如生长素(AUX)、赤霉素(GA)、乙烯(ETH)、油菜素内酯(BR)、茉莉酸(JA)和脱落酸(ABA)都被证实影响花的开放[5,6,20.,21.,22.].
在本研究中,盆栽植物o .桂花“燕河桂”被用作研究不同温度条件对在控制相对低温下的开花过程的影响的材料。然后,转录组测序用于分析在相对高或低温下的不同天治疗后的差异表达的基因(DEGS),以弄清楚与相对于相对低的温度相对于相对低的花开口调节所涉及的关键基因。本研究将完全揭示相对低温调节开花的分子机制的基础o .桂花为预测和调节开花时间和遗传修饰提供理论参考o .桂花.
结果
扫描电镜(SEM)和透射电镜(TEM)分析
通过扫描电镜和透射电镜分析表明,桂花的发育阶段为:第一阶段(S1),外芽鳞展开,内芽鳞仍皱缩;S2,芽呈球状,内苞片覆盖花序;S3,花序爆裂苞片和小花紧密拥挤;S4,花期初期;S5,盛花期;S6, pollen-scattered阶段。用扫描电镜观察花瓣正、背面表皮细胞大小,发现花瓣正面表皮细胞大小逐渐增大(P< 0.05,通过Duncan多重极差检验),从S1到S6(图6)。1一个,表s1),背面花瓣表皮细胞从S1到S5逐渐增大,在S5时达到峰值,然后从S5到S6显著减小(图5)。1b,表1).这些结果与天人菊属植物大花蔷薇[23.],康乃馨[24.),t . caerulea[16],表明在花开放过程中,细胞分裂停止,细胞膨胀。然而,在玫瑰中[25.),淫羊藿开花期[26.在此过程中同时出现细胞分裂和细胞膨胀。更重要的是,基于TEM观察,发现液泡占据了大部分关于曲瓣表皮细胞的区域o .桂花(图。1c,表1).发生了同样的情况淫羊藿开花期[26.].这些结果表明,花瓣细胞膨胀伴随着液泡的增大。从S1至S6逐渐增加液泡尺寸。在S2,电池的液泡尺寸几乎与S1一样大的两倍。随着细胞的开发,S6的细胞的液泡尺寸仅比S2大的一次(图。1c,表1),表明S1至S2的生长速率在花发育中最高。
处理后的芽外观
23°C或19°C处理前,所有植株的芽均在S1,呈纺锤形,外芽鳞展开,内芽鳞卷曲。23°C处理2 d、4 d、6 d (H2、H4、H6)和19°C处理2 d、4 d (L2、L4)芽外观基本相同。19℃处理6 d (L6),芽期达到S2,说明在实验条件下,相对较低的温度,如19℃,有利于“延红贵”开花。
Illumina测序和从头组装序列reads
为了揭示19°C对“延红GUI”转录组变化的影响,我们收集了H2,H4,H6,L2,L4和L6的三个生物复制样品,用于参考转录组测序和RNA-SEQ分析。参考转录组测序产生了164,753,984个原始读数和110,307,366清洁读数(表S2).共获得152,247个平均长度为751 nt的转录本,拼接所有clean reads后获得96,920个平均长度为873 nt的unigenes(表S3.).
功能注释和分类
将组装好的unigenes分别与非冗余蛋白序列数据库(NR)、核苷酸序列数据库(NT)、瑞士prot数据库、京都基因和基因组百科全书数据库(KEGG)、真核生物同源蛋白组数据库(KOG)、基因本体数据库(GO)和InterPro数据库进行比对。以获得假定的注释(表S4).至少一个数据库成功注释61654条(63.61%)unigenes, 7个数据库共成功注释8150条(8.41%)unigenes。NR数据库共注释了57,721条(59.56%)unigenes,其中59.26%与同源性较高胡麻属indicum(无花果。1).在Swiss-Prot数据库中总共匹配了37284个unigenes,占所有注释unigenes的38.47%(表S4).有40,764个unigenes映射到134 keggg途径,可分为六个大途径,包括“细胞过程”,“环境信息处理”,“遗传信息处理”,“人类疾病”,“新陈代谢”和“有机体系统”(表S.5).具有最多的unigenes的途径是“代谢途径”(KO01100,8561 unigenes,21%),其次是“二次代谢物的生物合成”(KO01110,4440 ungenes,10.89%),“植物 - 病原体相互作用”(KO04626,1876年的unigenes,4.6%)和“植物激素信号转导”(KO04075,1444 Unigenes,3.54%)(表S5).接下来,进行GO分析,共16014个unigenes(占所有注释unigenes的16.52%)被归类为53个GO术语,分为三个主要类别:生物过程、细胞成分和分子功能(图S2).在生物过程中,与“代谢过程”、“细胞过程”、“单生物过程”相关的蛋白质丰富。“单一生物过程”类别定义了一个只涉及一个生物体的生物过程,这样注释的4806个unigenes可能专门与开花生物有关。在细胞成分类别中,“细胞”、“细胞部分”和“膜”是最常出现的氧化石墨烯术语。在分子功能类别下,“催化活性”和“结合蛋白”最富集(图S2).我们还对组装的unigenes进行了KOG分析,对43,496个unigenes进行了25个KOG分类(图S3.).在25个Kog分类中,“一般功能预测”(11,753个未成年人,27.02%)代表了最大的组,其次是“信号转导机制”(6000人未进,13.79%)和“功能未知”(4761,10.95%)。“细胞运动”比例最小,仅占0.20%(图S3.).另外,转录组文库中的46,405(47.88%)未经原则对Acrigo数据库注释(表S.4).
rna测序(RNA-seq)并定位到参考转录组数据库
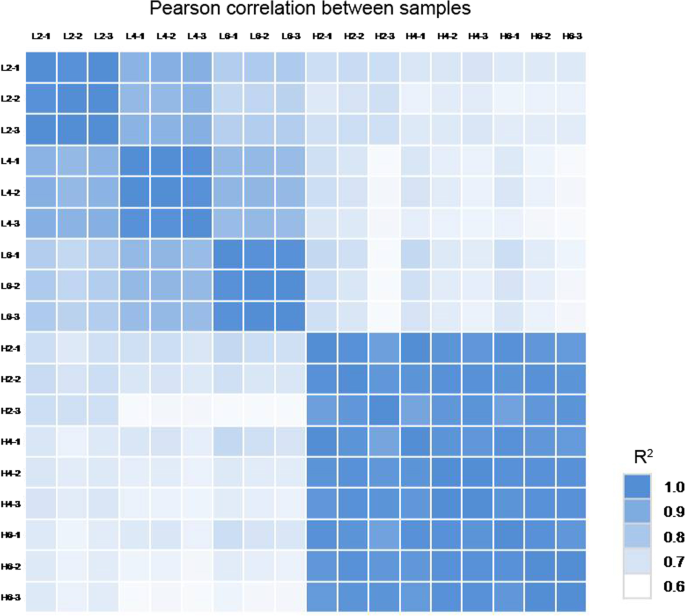
用于RNA-SEQ分析的十八cDNA文库分别测序,生成23.58-24.14 MB的原始读数(表S2).在18个cDNA文库中获得了23.58 ~ 24.13 Mb的clean reads, clean data rate为99.94 ~ 99.97%。然后,将这些干净的reads分别定位到参考转录组数据库中。18个库中的总映射读取百分比和唯一匹配百分比相似。总映射reads百分比为86.39 ~ 88.44%,唯一匹配百分比为53.7 ~ 56.29%(表S6).所有样本的生物重复之间的相关系数均大于0.94。2,表7).
筛选和分析DEGS
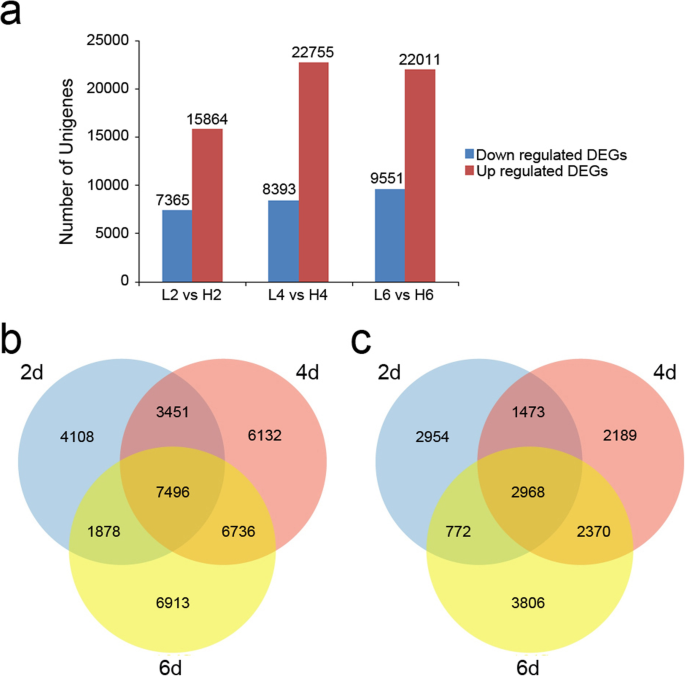
我们对deg (P取值≤0.01,|log2|≥1),包括L2 vs H2, L4 vs H4, L6 vs H6。在L2和H2比较中,下调和上调的unigenes分别为7365和15864。在L4和H4组合中,分别有8393和22755个unigenes被下调和上调。在L6与H6的比较中,下调的unigenes分别为9551个,上调的unigenes分别为22011个(图5)。3.一种)。总共有更多的上调unigenes,而不是在相对低温下的花开口期间的下调unigenes。另外,通过三个比较共享7496个上调的次数,而4108,6132和6913个上调的次数分别仅在L2 Vs H 2,L4 Vs H4和L6 Vs H6比较中上调(图。3.b)。更重要的是,2968次下调的次数被三种比较共享,而2954,2189和3806个下调的未经植物分别仅在L2 Vs H 2,L4 Vs H4和L6 Vs H6比较中表达(图。3.c)。
二聚体GO富集及KEGG通路分析
在这项工作中,去分析用于将带注释的DEG的功能分类为不同的天数处理的不同温度。在所有比较中,生物过程中最具明显的富集术语是“代谢过程”,“细胞过程”和“单有机物过程”。在细胞成分中,高度富集,包括“细胞”,“细胞部分”,“膜”,“膜部”和“细胞器”的五个GO术语。在分子函数中的“结合”和“催化活性”在所有比较的群体中显着富集(表1).所有的DEGs都被映射到KEGG通路中,以便研究它们的主要通路(表22).在L2 vs H2、L4 vs H4和L6 vs H6比较中,它们在132、133和134 KEGG代谢途径中富集。在所有的对照组中,“代谢途径”、“次生代谢物生物合成途径”、“植物-病原体互作途径”、“淀粉-蔗糖代谢途径”和“植物激素信号转导途径”是DEGs数量最多的5个途径(表5)2).
鉴定涉及细胞壁代谢的次数
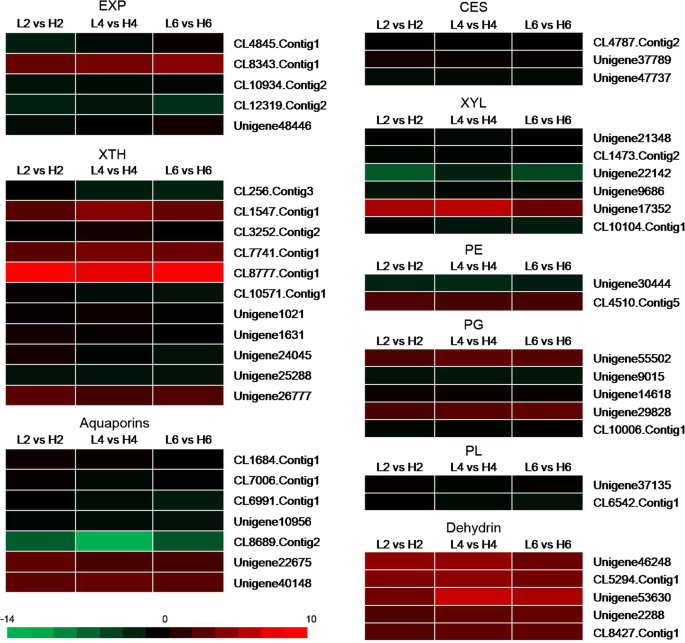
花瓣细胞的扩张依赖于细胞壁的松动和纤维素的生物合成、可溶性碳水化合物的分配、离子和水的运输以及细胞骨架的重排[7].因此,我们筛选了在不同温度下可以参与细胞壁代谢的次数。EXP和XTH,是两种涉及细胞膨胀,松动和重新排列生长组织中的细胞壁纤维的两种必需蛋白[8].在黄瓜中,EXPs由4个亚家族组成:α-EXP, β-EXP, EXP-like A和EXP-like B,并首次被发现以pH依赖的方式松弛细胞壁[27.].在我们的研究中,在23°C和19°C比较下表达了四个α-Exp和一种β-exp(图。4,表8).其中,四个α实验在相对较低的温度(19°C)和1β-EXP.在19°C处理下下调。
三种比较(L2 vs H2, L4 vs H4, L6 vs H6)中细胞壁代谢相关基因的热图。红色矩形表示上调的ungenes,绿色矩形表示下调的ungenes。每个基因列表的所有信息见表S8。XTH: xyloglucan endotransglucosylase /水解酶;XYL:木糖苷酶;CES:纤维素合酶;体育:果胶酯酶;PG:聚半乳糖醛酸酶;PL:果胶酸裂解酶。L2、L4、L6分别代表19℃处理2 d、4 d、6 d的植株样本; H2, H4 and H6 respectively represents the samples from the plants under 23 °C treatment for 2 d, 4 d, and 6 d
11个编码XTH蛋白的unigenes均显著表达,其中7个(CL256。Contig3 CL3252。Contig2 CL10571。cong1、Unigene1021、Unigene1631、Unigene24045、Unigene25288)在19℃和4个(CL1547。Contig1 CL7741。Contig1 CL8777。在19℃处理下,它们的Contig1和Unigene26777)表达量下调(图1)。4,表8).
还评估了可能参与花开口过程的细胞壁合成,改性或水解中的unigenes的表达(图。4,表8).3个纤维素合成酶(CES)基因、6个木糖糖苷酶(XYL)基因、2个果胶酯酶(PE)基因、5个聚半乳糖醛酸酶(PG)基因和2个果胶酸裂解酶(PL)基因在三种比较中都发生了显著的fold change(图1)。4,表8).当用相对低的温度为19℃的不同天数处理时,所有CESS和PLS基因的表达增加。除了Unigene17352之外,大多数Xyls在相对低的温度下上调。三动力当暴露在相对较低的温度下时,表达量增加,其中两种表达量减少。在19℃条件下,一个PE基因显著上调,另一个PE基因显著下调。一些与细胞壁合成、修饰或水解相关的基因被上调,表明这些基因可能在调节花瓣细胞的扩张中发挥重要作用。
水通道蛋白可以促进水和/或小的中性溶质通量通过膜,可分为四个亚类,如质膜内在蛋白(pip),液泡膜内在蛋白(TIPs),基于序列同源性和细胞定位的结节蛋白-26样内在膜蛋白(nodulin-26-like intrinsic membrane proteins, NIPs)和小基础内在蛋白(small basic intrinsic proteins, SIPs) [28.].我们在转录组中发现了3种水通道蛋白,包括2个pip、2个TIPs和3个NIPs,其中大部分在相对低温下显著上调(图1)。4,表8).但在较低温度下,只有Unigene22675和Unigene40148两个NIPs的表达水平下降。脱氢酶是亲水性、耐热性的应激蛋白,其中一些被鉴定为渗透性应激反应蛋白,可以促进水的流入和流出[29.].在我们的研究中,所有的脱氢蛋白基因在相对低温条件下都是下调的(图。4,表8).
参与植物激素信号转导通路的DEGs的鉴定
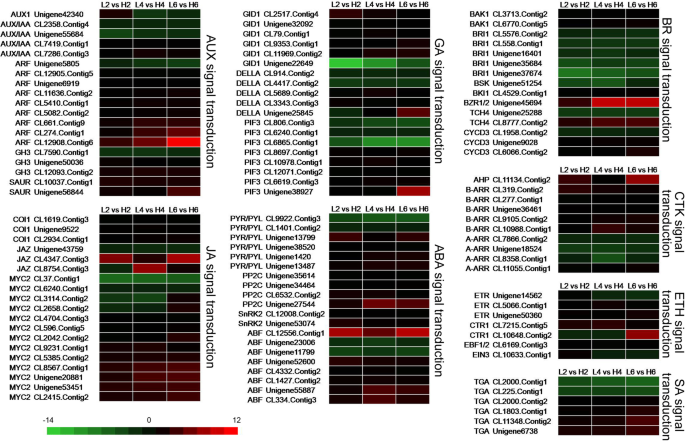
有一些关于植物激素可以影响花张开的报道[19,因此,我们探讨了涉及8种植物激素信号转导途径的DEGs。基础花瓣中内源AUX含量较高,外源吲哚-3-丁酸(IBA)的施用可使菊花细胞长度增加[5].涉及Aux信号转导途径的许多未成年人越来越多地表达着玫瑰的开花,表明Aux信令参与了花瓣发育[30.].本研究通过生长素转运蛋白(AUX1)、生长素诱导蛋白/生长素响应蛋白(AUX/IAA)、生长素响应因子(ARF)、生长素反应性GH3家族蛋白(GH3)和生长素上升小RNA家族蛋白(SAUR)(图。5).其中大部分在较低温度下表达量较低,尤其是3个ARF成员(CL661。Contig9 CL274。而CL12908.Contig6)则随处理天数的延长而急剧下降。在较低温度下,只有1个AUX1、2个AUX/IAA、1个ARF和1个GH3表达上调(图5)。5,表9).
植物激素Ja及其衍生物甲基茉莉酸盐(Meja)可以影响开花开口淫羊藿开花期[31.)、大米(32.],A. Thaliana.[20.].基因BIGPETALp(BPEp)也可能在JA介导的花瓣生长中发挥作用[6].在JA信号转导途径中,大部分基因如冠状病毒不敏感蛋白1 (COI1.),斋月Zim结构域蛋白质(JAZ),myc2.在本研究中被下调。只有两个JAZ(Unigene43759和Cl8754.contig3)基因和四个myc2.(CL37。Contig1 CL6240。Contig1 CL3114。在19°C处理下,Contig2和CL2658.Contig2基因表达上调(图。5,表9),这表明这些单基因可能是花开放的正调控因子o .桂花(图。5,表9).只有六种tgacg序列特异性dna结合蛋白(矫正性大动脉转位)在19℃处理后,水杨酸(SA)信号转导途径中的基因不同地表达在不同温度下,其中两种(Cl2000.contig1和Cl225.contig1)在增加(图。5,表9).
赤霉素(GA)信号通路中的19个unigenes在不同温度下也有差异表达。5).在相对低的温度下,六个GID1中的五种情况下降,除了Unigene22649之外,该Unigene22649除外,在2 d治疗19°C后几乎增加了八千次。在相对低的温度处理后,增加了三个della和五个PIF3基因,而在相对低的温度处理后增加了两种Della和三个PIF 3基因(图。5,表9).在19℃处理后,在ABA信号转导途径中仅在ABA信号转导通路中仅包括两个unigenes中的四种unigenes中的四种unigenes中的四种undigenes中的四个ungenenes。然而,与23℃下方相比,在19℃的相对低温下,1 ABF(Cl12556.Contig1)的表达在相对低的温度下降低了2百倍(图3)(图。5,表9).
细胞分裂素(CTK)信号转导通路的大部分ungenes在较低温度下均被下调拟南芥组氨酸磷转移蛋白(AHP)基因,所有B-ARR成员,特别是层次分析法(CL11134.Contig2),在19°C处理6 d后严重下降(图。5).然而,当通过相对低温处理时,大部分A-Arr构件(CL7866.Contig2,Unigene18524和Cl8358.contig1)上调(图。5,表9).
ETH对花朵开放的影响可能取决于剂量、品种或品种[19].在ETH信号转导途径中,部分乙烯受体(ETR, Unigene14562)、丝氨酸/苏氨酸蛋白激酶(CTR1, CL10648.Contig2)和乙烯不敏感3蛋白(EIN3, CL10633.Contig1)基因的表达模式更为复杂。例如Unigene14562和CL10633的表达水平。相对低温处理2 d时,连续度降低,随着处理时间的延长,连续度升高。该途径的大部分基因在低温处理后均被下调(图5)。5,表9).
细胞伸长也由BR调节,这是一种特异性的类固醇激素,Br突变体的纵向细胞膨胀大大降低A. Thaliana.[33.,34.].在BR信号转导途径中的八个在19°C处理中增加,包括所有芸苔类固醇受体(BRI1),一个BRI1相关的受体激酶1(BSK),一个TCH4和一个细胞周期蛋白-D3(CYCD3)(图。5,表9).当用19℃处理时,Bri 1,尤其是Unigene37674和Unigene35684的表达水平显着增加。然而,在该信号途径中的七个十五个未成年体处理下减少了19°C处理。与23℃相比,BZR1 / 2的表达水平在19℃下为八倍,随着治疗时间延长,表达水平持续增加,表明BZR1 / 2在花瓣发育中的作用相同的作用o .桂花和矮牵牛。的表达水平TCH4(CL8777.Contig2)在较低温度下增强。
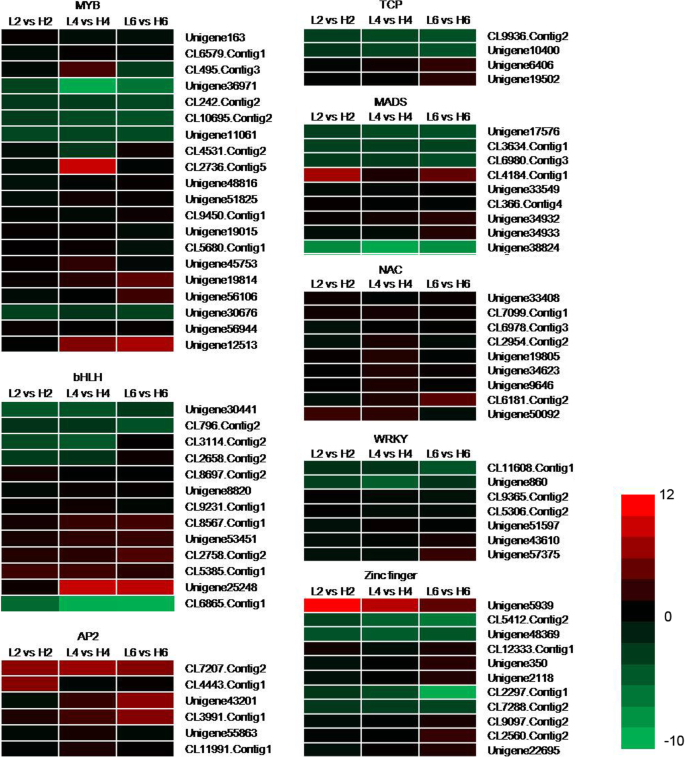
转录因子DEGs (TFs)的鉴定
很多TFs在不同温度下变化很大,所以我们改进了筛选标准。带有|日志的tf2进一步分析任何比较的比值|≥2。79个转录因子被分为8个基因家族(图。6,表10选择进一步分析,因为它们可能参与花瓣细胞扩张[5,30.].在MYB TF家族中,20个基因中只有5个(Unigene36971, CL242。Contig2 CL10695。Contig2、Unigene11061和Unigene30676)在较低温度下表达量较高。过度的MYB62基因导致Ga缺陷的表型,并且可以与外源GA的施用部分地缓解[35.].在我们的研究中,我们没有找到同源unigenesMYB62在o .桂花,但一些与其他基因家族成员同源的unigenes,如MYB4 (CL9450.Contig1)和MYB86 (Unigene19015),在不同温度下表达不同(图。6,表10),表明它们可能参与对开花开口相对低温的调节o .桂花.
在BHLH TF家族中,在10℃处理后,表达了三种基因(UNIGENE30441,CL796.Contig2和Cl6865.contig1)。其中,特别是BHLH79,BHLH79同种型X2(CL6865.Contig1)的表达水平在较低温度的6天处理时增加了五百倍。然而,当暴露于19℃时,BHLH 117的表达水平急剧下降。在AP2和NAC TF家族中,没有在相对低的温度下上调TF基因。植物特异性NAC家族基因可以调节植物发育,细胞分裂,衰老和对非生物胁迫的反应[36.].在最近的研究中,RhNAC2的n端结合域可以结合到启动子RhEXPA4因此,在玫瑰花瓣的膨胀过程中调节脱水耐受性[37.].NAC家族所有成员的表达量在较低温度下均有所下降。6,表10),表明抑制南汽基因可能促进表达经验值促进花瓣在S中的伸长o .桂花.
在TCP TF家族中,在相对低的温度处理下升高两种基因(CL9936.Contig2和Unigene10400)。也发现MiRNA,例如miRNA319a,通过调节,也发现涉及花瓣伸长率TCP4.规管辅助效果[38.].所以,TCP4-like基因(Cl9936.Contig2和Unigene10400)随着相对低的温度处理而增加,暗示它们可以调节瓣膜发育o .桂花(图。6,表10).
MADS TF家族9个基因中有4个基因表达上调,尤其是C功能基因AGAMOUS基因,其表达在19℃处理下显著增加。在WRKY TF家族中,只有两个基因(CL11608。在较低温度下,cong1和Unigene860)的表达量上调。在锌指TF家族中,11个基因中有4个在19°C暴露时表达增加。总的来说,在较低温度下,只有一小部分TFs被上调。
QRT-PCR分析
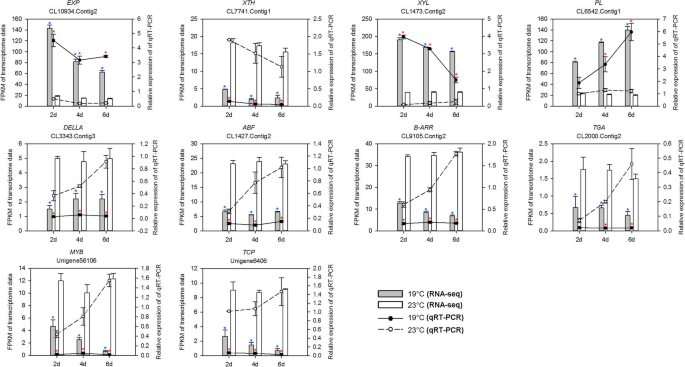
通过QRT-PCR分析10个涉及细胞壁代谢的四种基因的十种差异表达的未成应于涉及细胞壁代谢的四种基因,以确认RNA-SEQ的结果。通过QRT-PCR测试的所有10个基因证实了显着的差异表达(P< 0.05),在19°C和23°C处理(图。7).在RNA-Seq和qRT-PCR结果中,虽然在19°C和23°C处理之间10个基因的倍数变化并不总是相似的,但总体趋势是一致的。一般CL10934的表达水平。CL1473 Contig2 (EXP)。Contig2 (XYL)和CL6542。qRT-PCR分析23°C处理下的Contig1 (PL)明显低于19°C处理,而其他7个基因的表达水平在23°C处理下均高于19°C处理。同样,CL10934。Contig2 CL1473。Contig2 CL6542。23℃处理下,Contig1表达下调,其他7个基因表达上调,验证了RNA-Seq结果的准确性。
讨论
一次开花品种的开花时间o .桂花受较低温度影响较大,需要在秋季积累一定的低温才能开花[3.].不同品种对相对低温需求的敏感性差异导致开花时间的变化[3.].在这项研究中,6 d实验条件下的19°C处理足以在“延红桂”中的花朵开口。The early flowering cultivar such as ‘Zao Yingui’ would blossom when the daily minimum temperature lower than 21 °C last for after 5–8 days, while the late blossoming cultivar, such as ‘Wan Yingui’, needs 5–8 days of the daily minimum temperature lower than 19 °C [39.].
花开口伴随着细胞分裂和花瓣细胞的细胞膨胀[7].在桑氏花开放过程中被上调[40.],紫茉莉[41.],矮牵牛[9],康乃馨[42.、腊梅[10].同样,在开花开口期间o .桂花在相对较低的温度下,四个α实验在本研究中被上调(图。4,表8).也有报道称,β-EXP比α-EXP更有效地破坏细胞壁聚合物[41.然而,]β-EXP.在19°C处理下,表达下调。结果与玫瑰的结果一致[30.],表明β-EXP可以以不同于α-Exp的特殊方式涉及花瓣发育。至于xth,四个玫瑰xth.基因(RBXTH3.,RBXTH5.,RBXTH6.,RbXTH12)在花朵开放时被上调,并与花瓣运动有关[43.].大米OsXTH12基因在高温条件下发生花香液后会导致稻瘟病 -44.].在我们的实验中,我们无法找到同源基因xth3.,xth5.,xth6.和XTH12,但其他家庭成员被发现。大部分的xth.在较低温度下,相关基因表达上调,表明它们可能参与了花的开放过程o .桂花不同的家庭成员可能有不同的功能。
这些细胞壁代谢过程也受转录因子的多种植物激素的影响[19].在我们研究中不同天处理的不同温度下,植物激素途径基因的表达模式不同。在A. Thaliana., AUX和JA信号转导在花瓣发育过程中协同作用[45.].ARF8可以与BigPlep(BPEP)相互作用以调节花瓣中的细胞扩展[6,并能触发MYB21和MYB24诱导JA产生促进花瓣生长[45.].然而,参与AUX和JA信号通路的大部分DEGs被下调(图。5,表9),暗示在花开口时对相对低温的调节o .桂花不依赖AUX和JA信号。
Ga可以调节种子萌发,干伸长,花瓣生长和开花[46.], ABA在花的转变和果实发育等方面具有拮抗作用[47.].相同的情况发生在g .矮牵牛花瓣增长(22.].与参与ABA信号转导通路的unigenes相比,GA信号转导通路的unigenes更多,并且在19℃处理下急剧增加。这一结果与rose的结果一致[30.].然而,这种拮抗作用在花瓣生长中是否存在o .桂花还需要进一步的论证。
Eth可以促进康乃馨的花开口,蝴蝶兰兰花和矮牵牛花,但它抑制了一些玫瑰品种的花朵开放[19].当玫瑰花开口期间用作抑制剂时,eth可以通过ein3-3诱导Della基因的表达。22.].在我们的研究中,EIN3在相对较低的温度下下调(图。5,表9),建议Eth可以在响应于相对低的温度时对开花开口造成负面的作用o .桂花.
在g .矮牵牛,BL表明了更有效的效果对花瓣的中间区域和基底区域的延长而不是GA [21.].而BES1/BZR1在BR处理仅0.5 h后表达水平下降,表明其在花瓣细胞扩张中发挥了重要作用[21.].在我们的研究中,BZR1的同源单基因(Unigene45694)在相对低温条件下表达量显著下降(图1)。5,表9),表明其在花瓣发育中起着相同的作用o .桂花就像那样g .矮牵牛.
结论
与花开口有关的综合转录组数据集o .桂花在相对低的温度(19℃)处理下,使用RNA-SEQ技术进行处理,并且已经鉴定了一组可通过对不同温度处理之间的切数来调节花瓣生长的次数,包括在细胞壁中涉及的unigenes新陈代谢,植物激素信号转导途径和TFS。总的来说,本研究中产生的资源将完全揭示相对低温调节开花的分子机制的基础o .桂花为预测和调节开花时间和遗传修饰提供理论参考o .桂花.我们未来的研究将重点致力于了解这些候选人的生物学功能,并揭示这些参数对相对较低的温度的响应o .桂花.
方法
植物材料和治疗
植物的o .桂花在浙江农林大学资源苗圃盆栽栽培了“延红贵”。所有植物材料均为浙江农林大学所有。如本文所述,花朵开放过程的发展分为S1-S6 [3.].在S1开花发育阶段,将盆栽植物移入温度分别为19℃(相对低温)和23℃(相对高温)的生长柜中。相对湿度为50 ~ 60%,光周期为12h光/ 12h暗,光照量为80 μmol·m- 2·S.- 1.处理后每2天采收一次花瓣,直到19℃条件下植株发育阶段达到S2为止。分别命名为H2、H4、H6(分别在23℃处理2 d、4 d、6 d)和L2、L4、L6(分别在19℃处理2 d、4 d、6 d)。为避免昼夜节律的影响,所有样本均在上午10:00采集。采集3个生物重复样本,共生成18个样本。此外,对不同发育阶段(s1 ~ s6)的花瓣分别取样进行SEM和TEM分析。
扫描电镜和透射电镜分析
根据以往的研究[25.,48.SEM和TEM分别在日立模型TM-1000 SEM和Model H-7650中观察并拍摄,并在浙江大学观察和拍摄。使用Image J软件手动测量araxial和缺陷瓣表皮细胞的细胞尺寸和液泡尺寸(http://rsb.info.nih.gov/ij/美国国家卫生研究院医学博士)。
RNA提取、cDNA文库制备及测序
如前所述进行18个样品的RNA分离和RNA纯化[49.].cDNA文库制备和18样品的测序o .桂花分别如前所述进行[50.]用于rna序列分析。利用18个RNA样本的RNA池构建cDNA文库进行参考转录组测序。Illumina基因测序在北京华大基因研究院(中国深圳)进行(http://www.genomics.cn/index.php),根据制造商的说明(Illumina Inc., San Diego, CA, USA)。共获得18组raw reads用于RNA-seq分析,分别为H2-1、H2-2、H2-3、H4-2、H6-2、H6-3、L2-1、L2-2、L2-3、l1 - 1、l1 - 2、L4-2、L4-3、L6-1、L6-2、L6-2、L6-3, ALL对应的参考转录组为raw reads。
转录组数据处理与分析
通过去除适配器的序列,未知基础的高含量和下游分析之前的低质量读取来清洁原始读取,以降低数据噪声。作为o .桂花没有合适的参考基因组序列,三位一体方法[51.]用于从头组装所有干净的reads和Tgicl方法[52.]用来聚集转录本以获得非冗余的unigenes。组装的单基因序列用Blastn [53.]核苷酸数据库NT,由Blastx对齐[53.或钻石[54.]蛋白质数据库NR,Swiss-Prot,Kegg和Kog,并由Interprancan排列[55.]到蛋白质数据库InterPro中获取注释。利用Blast2GO软件对unigenes进行NR注释,得到GO注释[56.].FPKM (reads mapped per 1000bp per million sequenced reads)方法用于计算表达水平[57.].对每个Unigene进行相同天数在不同温度下处理的样品之间的样品与分别处理的样品之间的差异进行比较(L2 Vs H2,L4 Vs H4和L6 Vs H6)。为了识别两种样本中的次数,就采用了Audic和Claverie方法[58.].Unigene与P取值≤0.01,为|日志2|≥1被认为是显著的DEGs。所有的deg都被映射到GO和KEGG数据库的每个词条中。转录因子分析用|log2|≥2表示两个样本之间存在显著差异。
实时定量PCR (qRT-PCR)分析
如前所述进行总RNA,第一链cDNA合成和QRT-PCR的提取[49.].随机选择10次DEG,表S中列出了引物序列11.这10个基因的相对表达水平相对于一个内控基因的表达水平归一化骨[59.]使用2-△Ct方法。
统计分析
采用SPSS软件version 18.0 (SPSS Inc., Chicago, IL, USA),采用单因素方差分析(ANOVA)对花瓣正面表皮细胞大小、花瓣背面表皮细胞大小、液泡大小以及相对表达量进行统计分析和FPKM分析。采用邓肯多程检验,差异有统计学意义P< 0.05为显著。
可用性数据和材料
当前研究中使用的RNA-Seq数据集可在NCBI短读存档项目中获得- PRJNA642321 (http://www.ncbi.nlm.nih.gov/bioproject/PRJNA642321).本研究生成的所有RNA-SEQ读数在NCBI SRRA下公开可用,如“登录号”SRR12109992-SRR12110009。
缩写
- 阿坝:
-
脱盐酸
- 东盟地区论坛:
-
助线响应因子
- AHP:
-
拟南芥组氨酸phosphotransfer蛋白质
- 辅助:
-
生长素
- 辅助/ IAA:
-
Auxin-induced蛋白质/ auxin-responsive蛋白质
- AUX1:
-
生长素转运蛋白
- BPEp:
-
BIGPETALp
- BR:
-
Brassinosteroid
- CES上:
-
纤维素合成酶
- COI1:
-
Coronatine-insensitive蛋白1
- CYCD3:
-
Cyclin-D3
- CTK:
-
细胞分裂素
- CTR1:
-
丝氨酸/苏氨酸 - 蛋白激酶
- 可见:
-
差异表达基因
- EIN3:
-
乙烯不敏感蛋白
- 乙:
-
乙烯
- ETR:
-
乙烯受体
- 经验值:
-
棒曲霉素
- FPKM:
-
每100万个测序读取映射1000 bp的读取
- 遗传算法:
-
吉布林素
- GH3:
-
生长素反应性GH3家族蛋白
- 国际宇航科学院:
-
Indole-3-acetic酸
- IBA:
-
Indole-3-butyric酸
- 是:
-
茉莉酸
- JAZ:
-
茉莉酸ZIM结构域蛋白
- Kegg:
-
京都基因和基因组百科全书
- KOG:
-
真核生物同源蛋白群
- 惩罚:
-
茉莉酸甲酯
- 夹:
-
结节蛋白-26样内在膜蛋白
- NR:
-
非冗余蛋白序列数据库
- NT:
-
核苷酸序列数据库
- 遗传算法:
-
赤霉素酸
- 去:
-
基因本体论
- 体育:
-
果胶酯酶
- 答:
-
polygalacturonase.
- PIP:
-
血浆膜内在蛋白质
- PL:
-
果胶酸裂解酶
- QRT-PCR:
-
定量实时PCR
- SA:
-
水杨酸
- 阿富汗二月:
-
生长素RNA家族小蛋白
- SEM:
-
扫描电子显微镜
- 啜:
-
小基本内在蛋白质
- TGA:
-
TGACG-sequence-specific dna结合蛋白质
- 透射电镜:
-
透射电子显微镜法
- 提示:
-
液泡膜内在蛋白
- xth:
-
Xyloglucan内转糖基酶/水解酶
- XYL:
-
Xylosidase.
参考
- 1.
杨凯桂花。北京:中国林业出版社;2011.
- 2。
向强,刘勇。中国桂花品种图解专著。杭州:浙江科学技术出版社;2008.
- 3.
王y,张c,傅j,赵h.在花蕾分化和开花上的进展桂花雀族.J浙江A&F大学。2016; 33(2):340-7。
- 4.
董林,王旭,丁勇桂花雀族物候学盛开的季节。南京林业大学学报(自然科学版)。2014; 38 (S1): 51-6。
- 5。
关键词:花瓣伸长,转录组学,激素,转录组学菊花'jinba'。植物mol biol。2017; 93(6):593-606。
- 6。
Varaud E,Brioudes F,Szecsi J,Leroux J,Brown S,Perrot-Rechenmann C,Bendahmane M.助长响应因子8调节拟南芥通过与bHLH转录因子BIGPETALp相互作用生长花瓣。植物细胞。2011;23(3):973 - 83。
- 7。
Christiaens A,De Ke,Pauwels E,De RJ,Gobin B,Van Labeke MC。次优灯条件在开花期间影响源区水解。前植物SCI。2016; 7:249。
- 8。
•DJ。墙体结构和墙体松动。回顾过去,展望未来。植物杂志。2001;125(1):131 - 4。
- 9。
Zenoni S, Reale L, Tornielli GB, Lanfaloni L, Porceddu A, Ferrarini A, Moretti C, Zamboni A, speeghini A, Ferranti F.下调矮牵牛花α -扩张蛋白基因PhEXP1减少了细胞壁的结晶纤维素量,导致花瓣肢体的表型改变。植物细胞。2004;16(2):295 - 308。
- 10.
Ma J,Li Z,Wang B,Sui S,Li M.克隆扩展素基因Chimonanthus早熟花及其在乙烯利或1-甲基环丙烯处理花中的表达。Hortscience。2012;47(10):1472 - 7。
- 11.
Panavas T,Reid Pd,Rubinstein B. DareLily花瓣的编程细胞死亡:壁基酶活和热休克的影响。植物理性生物化学。1998年; 36(5):379-88。
- 12.
Tarpley L,Sassenrath GF。棉花花芽(方形)开发期间的碳水化合物曲线。J Agron作物SCI。2006; 192(5):363-72。
- 13。
香石竹花蕾发育过程中主要糖成分松糖醇的鉴定及其含量变化(石竹类植物caryophyllusl .)。植物生理学杂志。1998;152(5):363-7。
- 14。
Yamada K, Ichimura K.非水分离结合渗透离心法测定玫瑰花瓣开放过程中可溶性碳水化合物亚细胞浓度。足底。2009;230(6):1115 - 27所示。
- 15.
Ichimura K,Kohata K,Yamaguchi Y,Douzono M,Ikeda H,Koketsu M.鉴定L-肌醇和Scyllitol及其在菊花中各种器官的分布。Biosci Biotechnol Biochem。2000; 64(4):865-8。
- 16。
植物体内碳水化合物和无机离子浓度、渗透势和细胞数量的变化Tweedia caerulea在开花期间。J JPN SoC Hortic SCI。2013; 82(1):51-6。
- 17。
Norikoshi R,Kohata K,Shimizu-Yumoto H,Goto R,Ichimura K.在花开口期间鉴定可溶性碳水化合物及其亚细胞浓度eustoma grandiflorum.Horticult J. 2016; 85(3):238-47。
- 18。
克里泽克BA,安德森JT。控制花的大小。实验机器人。2013;64(6):1427-37。
- 19。
花的开放和关闭:更新。实验机器人,2014;65(20):5749-57。
- 20。
Brioudes F,Joly C,Szécsij,varaud e,leroux j,Bellvert f,Bertrand C,Bendahmane M. jasmonate控制了花瓣增长的后期发展阶段拟南芥.植物j . 2009; 60(6): 1070 - 80。
- 21.
转录组分析揭示油菜素内酯对花瓣生长的调控作用非洲菊矮牵牛.Peerj。2017;5 (5):e3382。
- 22.
李丽,张伟,张玲,李楠,彭杰,王勇,钟春,杨勇,孙松,梁s。赤霉素和脱落酸拮抗植物花瓣生长的转录组学研究。植物营养与肥料学报,2017,30 (5):557 - 564非洲菊矮牵牛.植物科学与技术,2015;
- 23.
植物激素在黄瓜花冠生长中的作用天人菊属植物大花蔷薇(Asteraceae)射线花。我是J机器人。1984; 71(1):1-8。
- 24.
Kenis JD,Silvente ST,Trippi Vs.康乃馨花卉生长期间的氮代谢和衰老相关变化。physiol platararum。1985; 65(4):455-9。
- 25.
Yamada K,Norikoshi R,铃木K,Nishijima T,Imanishi H,Ichimura K.细胞分裂和玫瑰花瓣发育过程中的扩张增长。J JPN SoC Hortic SCI。2009; 78(3):356-62。
- 26.
Norikoshi R,Shibata T,Ichimura K.在花开发和开放期间花瓣的细胞分裂和扩张eustoma grandiflorum.Horticult j . 2016; 85(2): 154 - 60。
- 27.
Marowa P,Ding A,Kong Y.扩展素:植物生长和作物改善潜在应用的作用。植物细胞批准。2016; 35(5):949-65。
- 28.
Maurel C,Verdoucq L,Luu Dt,Santoni V.植物水疗法:膜通道,具有多种集成功能。Annu Rev植物Biol。2008; 59:595-624。
- 29.
脱氢酶基因的过表达,OsDhn1,通过清除活性氧改善水稻的抗旱性和耐盐性(栽培稻l .)。植物生物学学报。2014;57(6):383-93。
- 30.
关键词:花瓣发育,转录组,RNA-seq,转录组动态引用本文罗莎中华民神.SCI REP。2017; 7:43382。
- 31.
茉莉酸甲酯通过诱导叶片细胞壁松弛蛋白促进切口花的开放。采后生物技术,2013;82(21):1-5。
- 32.
他,林YJ,曾XC。天然化学期间茉莉酸生物合成的动态变化。Acta Agron Sin。2012; 38(10):1891-9。
- 33.
Gallego-Bartolomé J, Blázquez MA。中赤霉素与油菜素内酯信号通路相互作用的分子机制拟南芥.国家自然科学基金资助项目:国家自然科学基金资助项目。
- 34.
李秋芳,王超,蒋玲,李珊,孙思珊,何建新。BZR1和DELLAs之间的相互作用介导油菜素内酯和赤霉素之间的直接信号串扰拟南芥.Sci信号。2012;5 (244):ra72。
- 35.
Devaiah Bn,Madhuvanthi R,Karthikeyan As,Raghothama Kg。磷酸盐饥饿反应和甘草酸生物合成受到MyB62转录因子的调节拟南芥.摩尔。2009;2(1):43-58。
- 36.
Olsen An,Ernst Ha,Leggio LL,Skriver K.NAC转录因子:在结构上独特,功能多样化。趋势植物SCI。2005; 10(2):79-87。
- 37。
关键词:玫瑰花瓣,脱水耐性,RhNAC2, RhNAC2, RhEXPA4植物杂志。2012;160(4):2064 - 82。
- 38。
NAG A,King S,Jack T.Mir319a TCP4的靶向对于拟南芥的花瓣生长和发育至关重要。Proc Natl Acad Sci U S A. 2009; 106(52):22534-9。
- 39。
王勇,胡勇。温度对花期影响的研究桂花雀族在上海。见:中国观赏园艺学进展2011:中国林业出版社;2011.p . 768 - 71。
- 40.
O'Donoghue EM, Somerfield SD, Heyes JA。细胞壁的组织Sandersonia Aurantiaca花组织。J Exp Bot。2002; 53(368):513-23。
- 41。
花开放和衰老过程中α和β -扩张蛋白表达的时间分析。植物科学。2003;164(5):769 - 81。
- 42。
Harada T,Torii Y,Morita S,Onodera R,Hara Y,Yokoyama R,Nishitani K,Satoh S.克隆,表征和与康乃馨开花期间的花瓣生长和发育相关的Xyloglucan内葡萄糖酶/水解酶和扩张基因的表达。J Exp Bot。2011; 62(2):815-23。
- 43。
研究表明,外源木葡聚糖内转糖基化酶/水解酶基因的差异表达调控了玫瑰的开花和花瓣脱落。Aob植物2013;5 (1):plt030。
- 44。
1 .付春,王芳,刘伟,刘东,李静,朱敏,廖勇,刘智,黄辉,曾新。高温胁迫下水稻雄性不育系颖片开放的转录组学分析。中国水稻科学(英文版),2014,30(4):474 - 478。植物科学与技术,2017;
- 45.
Reeves PH, Ellis CM, Ploense SE, Wu MF, Yadav V, Tholl D, Chételat A, Haupt I, Kennerley BJ, Hodgens c。公共科学图书馆麝猫。2012;8 (2):e1002506。
- 46.
Hedden P,托马斯SG。吉布林素生物合成及其调节。Biochem J. 2012; 444(1):11-25。
- 47.
打开赤霉素和脱落酸信号。植物生物学杂志。2006;9(5):454-9。
- 48.
关键词:MoFis1, MoMdv1,过氧化物酶体,线粒体分裂,动力蛋白Magnaporthe oryzae.公共科学图书馆Pathog。2016;12 (8):e1005823。
- 49.
关键词:胡萝卜素,转录组学,花瓣着色,基因表达桂花雀族'延红吉'。树木 - 结构功能。2016; 30(4):1207-23。
- 50.
张C,王Y,傅J,Dong L,Gao S,Du D.使用RNA-SEQ技术对葡萄糖供应切割树牡丹的转录组分析。植物细胞批准。2014; 33(1):111-29。
- 51.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng Q.没有参考基因组的RNA-Seq全长转录组组装。生物科技Nat》。2011;29(7):644 - 52。
- 52.
Pertea G,Huang X,Liang F,Antonescu V,Sultana R,Karamycheva S,Lee Y,White J,Cheung F,Parvizi B. TIGR基因指数聚类工具(TGICL):用于大型EST数据集的快速聚类软件系统。生物信息学。2003; 19(5):651-2。
- 53.
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ。基本的局部对齐搜索工具。中国生物医学工程学报,1999,15(3):431 - 436。
- 54.
Buchfink B, Xie C, Huson DH。快速和敏感的蛋白质对齐使用金刚石。Nat方法。2015;12(1):59-60。
- 55.
InterProScan:蛋白质结构域标识符(protein domain identifier)。核酸杂志2005;33:W116-20。
- 56.
coesa A, Götz S, García-Gómez JM, Terol J, Talón M, Robles M. Blast2GO:用于功能基因组学研究的注释、可视化和分析的通用工具。生物信息学。2005;21(18):3674 - 6。
- 57.
关键词:哺乳动物,RNA-Seq,转录组,定量Nat方法。2008;5(7):621 - 8。
- 58.
Audic S, Claverie JM。数字基因表达谱的意义。基因组研究》1997;7(10):986 - 95。
- 59.
关键词:桂花,实时荧光定量PCR,基因表达归一化,内参基因桂花雀族柔软。)。Plos一个。2015; 10(8):E0136355。
确认
不适用。
同意发布
不适用。
资金
本研究由浙江省自然科学基金资助(No. LY19C160006, LY19C160002, LQ16C160003),浙江省新品种选育重点项目(No. 2016C02056-12)和国家留学基金委资助(No. 201808330145, 201808330146)。关键词:水稻,遗传多样性,遗传多样性,遗传多样性资助机构为研究项目提供资金支持,但不参与研究的设计、数据收集、数据分析或手稿的撰写。
作者信息
从属关系
贡献
HZ设计了这项研究。JF, CZ和HZ起草了手稿。JF和CZ对转录组数据进行处理分析。YL进行qRT-PCR检测。TP提取RNA,构建cDNA文库。BD, XG和YZ进行了SEM和TEM分析。所有作者均已阅读并批准稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:图S1。
BLASTX的物种分布与参考转录组中的unigenes匹配桂花雀族.我们使用NCBI NR数据库中的所有植物蛋白进行同源性搜索,并为每个序列选择最接近的匹配物进行分析。
附加文件2:图S2。
来自参考转录组的单基因GO分类桂花雀族.研究结果归纳为氧化石墨烯的生物过程、细胞成分和分子功能三大类。右边的x轴表示同一类别的基因数量。
附加文件3:图S3。
KOG分类桂花雀族参考转录组中的Unigenes。从总共96,920个从头组装的unigenes中,有43,496个在KOG数据库中具有显著同源性的转录本被分为25个KOG类别。
附加文件4:表S1。
在不同发育阶段的甜桂花中甜桂花的脂肪瓣表皮细胞,脂肪瓣表皮细胞的尺寸,叶形瓣表皮细胞和熔液体
附加文件5:表S2。
Illumina转录组测序概述。
附加文件6:表S3。
转录本和单基因组装质量综述。
附加文件7:表S4。
来自参考转录组的组装unigenes对公共数据库的诠释结果。
附加文件8:表S5。
kegg路径诠释桂花雀族从参考转录组中获得的unigenes。有40,764个unigenes映射到134 kegg途径。
附加文件9:表S6。
映射到参考序列的18个样本的总干净读取数。
附加文件10:表S7。
6个样本的Pearson相关系数,每个样本有3个生物重复。
附加文件11:表S8。
在不同温度和不同处理时间下,二烷基糖苷参与细胞壁代谢桂花姜。
附加文件12:表S9。
不同温度、不同天数处理的二烷基糖苷参与植物激素信号转导通路桂花姜。
附加文件13:表S10。
在不同温度下,不同处理时间处理TFs中涉及的deg桂花姜。
附加文件14:表S11。
引物序列及扩增子特征。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
付军,张诚,刘烨。et al。转录响应对相对低温的开花响应的转录组分析桂花雀族.BMC植物BIOL.20,337(2020)。https://doi.org/10.1186/s12870-020-02549-3
收到了:
接受:
发表:
关键字
- 花开发
- 花瓣表皮细胞
- 温度
- 桂花
- RNA-seq分析