抽象的
背景
镰刀菌素愿意,引起的尖孢镰刀菌F。sp。法测定(Foc)是一种严重影响黄瓜(Cucumis巨大成功L.)在全球生产,但机制潜在镰刀菌素黄瓜对枯萎病的抗性尚不清楚。为了更好地理解接种Foc引起的防御机制,基于RNA测序的转录组分析应答镰刀菌素接种Foc后0、24、48、96、192 h的抗萎蔫黄瓜品种日结城。
结果
我们鉴定了在接种后在0小时和其他时间点之间差异表达的4116个基因。滤出来自差异表达基因的所有乙烯相关和发病相关基因。实时PCR分析表明,响应FOC感染诱导乙烯相关基因。重要的是,在Foc感染和Ethephon的外源应用后,乙烯供体,高表达乙烯相关基因。响应于外源性乙烯治疗结合FOC接种,COUMOMBER幼苗的感染抗性增强,内源性乙烯生物合成急剧增加。
结论
集体,乙烯信号传导途径在调节黄瓜以FOC感染的防御响应方面发挥积极作用。结果提供了对黄瓜的洞察力镰刀菌素为培育优质黄瓜新品种提供了有价值的信息镰刀菌素卷曲的宽容。
背景
黄瓜是世界上种植最广泛的蔬菜之一。考虑到我国黄瓜生产中采用的连作制度,黄瓜的产量和产量都有一定的差异镰刀菌素枯萎(FW)发病率同比加剧。FW是一种典型的土壤传播疾病尖孢镰刀菌F。sp。法测定(船)1],这通常导致全球黄瓜输出中的严重损失[2].Foc包括指定的1、2、3、4四个种族,主要流行于美国、以色列、日本和中国[3.,4,5], 分别。Foc可以在土壤和种子中存活多年甚至数十年[6].该病原体的菌丝穿透黄瓜根,然后蔓延到血管组织并堵塞木质血管,并产生毒素以杀死细胞,这导致叶片或甚至整个植物,直到植物死亡发生几天或几周感染后[7,8].FW非常难以控制,并且FOC的致病性的变化导致某些杀菌剂的无效性[9,10.].因此,鉴定抗病基因、扩增种质库、培育抗FW的黄瓜品种是防治黄瓜FW的有效策略[11.].
功能基因组学在研究宿主免疫系统以增强疾病保护方面的潜力越来越受到关注[12.].植物暴露于病原体后所产生的防御机制,包括交叉通讯的信号通路网络,可能会阻止病原体的感染。乙烯(ET)是植物中这些信号通路的主要介质[13.,14.].ET因其对果实成熟、衰老、萌发、细胞伸长和开花的影响而首次被鉴定为植物激素[15.,16.,随后被确定为植物免疫信号网络的调制器[17.].先前的分子研究表明,在植物中,许多参与抵抗生物胁迫的植物激素调节途径是通过病原体生物合成效应蛋白来触发的[18.].黄瓜感染Foc后的主要症状是水分平衡受到干扰而导致的萎蔫[19.,20.].脱落酸(ABA)可能在改变气孔行为方面发挥至关重要的调节作用,这对黄瓜损失的扰动产生了重大影响[21].转录因子AtMYC2的破坏,它是ABA信号的正调控因子[22,诱导乙烯反应基因的表达[23].在拟南芥,属于ET受体家族的乙烯反应1(ETR1),积极影响病原体介导的反应[24].还已知Et信号传导途径在诱导植物防御反应中起着至关重要的作用[18.,25].当大豆被感染时大豆花叶病毒在阴影中,ET信令被激活,这可能在规范防御反应方面发挥着重要作用[26].Liu等人[27]发现ET信号通路可能正向调节的防御反应田七来腐皮镰孢霉菌.
在这项研究中,我们在黄瓜的防御响应期间对转录组进行了全面的和全局分析,以使用高通量RNA测序(RNA-SEQ)方法FOC感染。我们的目标是鉴定差异表达的基因(可表达的基因和富集的途径,其在接受不同时间点的孢子悬浮液中接种黄瓜根系后有助于抗病抗性。该研究结果提供了对与FW抗性相关的ET相关候选基因和途径的洞察力,这将有助于更广泛地了解Cucumber中的抗性机制。
结果
FOC感染黄瓜根源RNA-SEQ数据的质量分析
COCUMBER'RIJIECHENG'的根源,耐滤波线,用三种生物学重复进行采样并测序转录组分析。Pearson的相关系数(R)被用作重复相关性的评估指标。在原始读取的质量检查后,从15个RNA-SEQ库获得超过100.75 GB的清洁数据(附加文件1:表S1;存放在加入No.Prjna472169的NCBI SRA数据库中)。映射到黄瓜中国长参考基因组的读数超过2954万(占总读数的70.64%)。对于每个样本,Q30值高于85.27%,表明序列数据具有高质量。
ET相关基因的DEGS和表达谱的鉴定
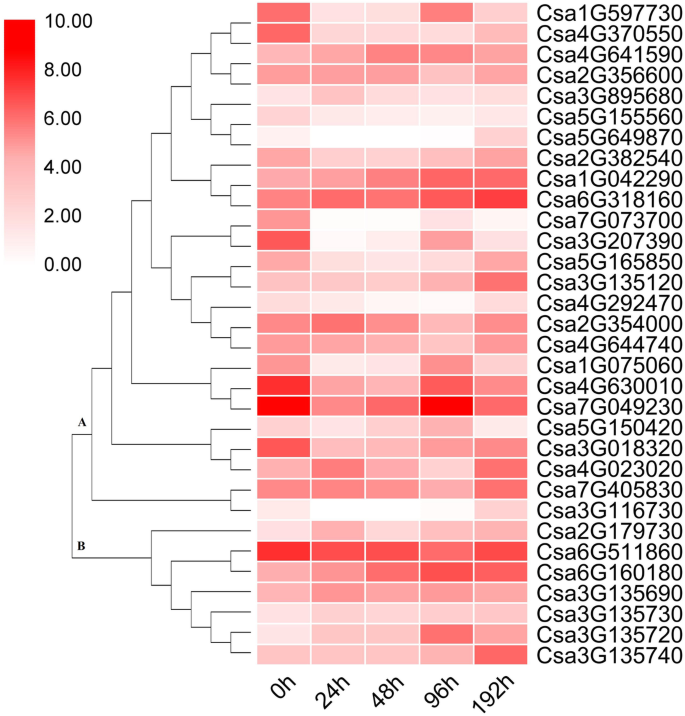
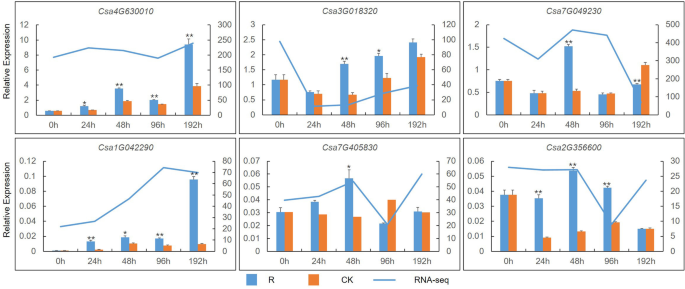
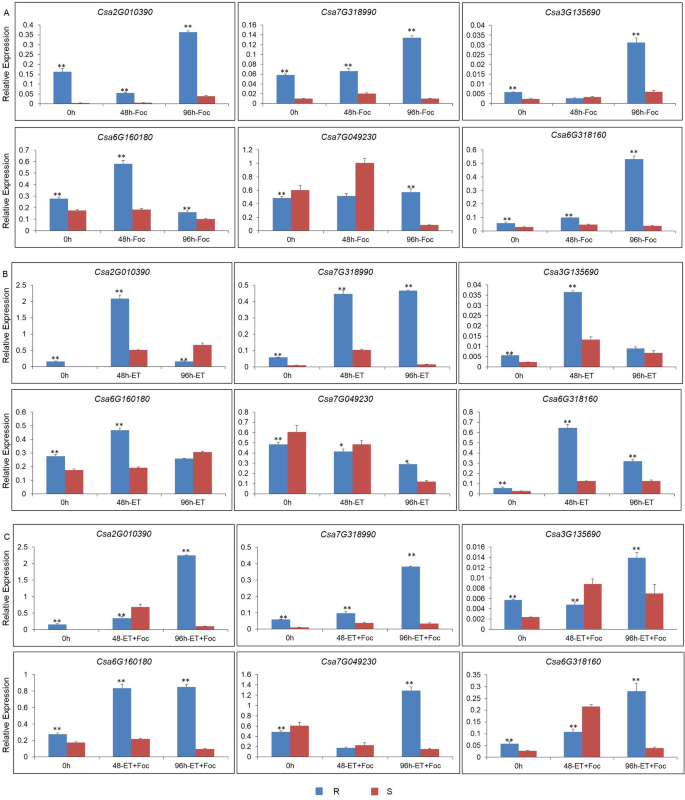
使用折叠变化≥1和假发现速率(FDR)<0.01作为截止值,确定了4116次。在这些基因中,上调1469个基因,下调2647个基因(附加文件2:图S1)。滤出了32个与相关的egs(图。1).过滤的基因,A组由ET-responsive转录因子包括25度,和B组由1-aminocyclopropane-1-carboxylate (ACC)氧化酶,催化氧化乳沟的ACC形成等。A组分为几个子组的表达谱在每个子群相似度。采用实时荧光定量PCR (Quantitative real-time PCR, qPCR)分析,筛选出6个相对表达量高且表达量上调的二磷酸脱氢酶(DEGs)。2).表达趋势在QPCR和RNA-SEQ分析中一致,这表明两种方法之间这些基因的相对表达显示出相关性。
ET影响Foc的生长
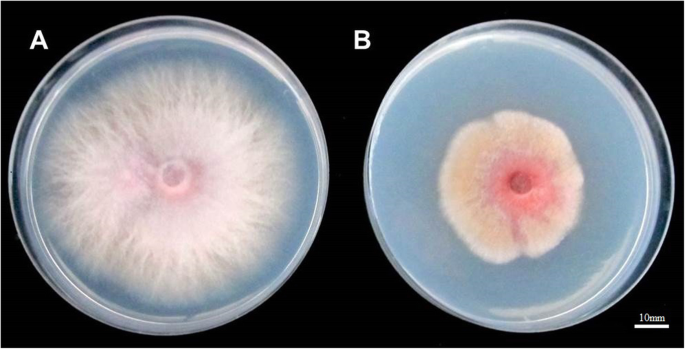
为了澄清ET是否影响了Foc的生长,我们培养了诱惑含有1000ppm etophon的马铃薯葡萄糖琼脂(PDA)培养基。诱捕PDA的FOC菌株的菌丝体生长,其补充有无菌水(对照)优于与Ethephon的PDA上的那样(图。3.).补充有无菌水的PDA的菌丝菌落的平均直径为74.33mm,而补充乙烯的PDA的平均直径为43.67毫米。菌丝体的颜色在补充有Ethephon的PDA上的颜色比对照媒体更暗。这些结果表明,ET可以在1000ppm ethephon存在下抑制Foc的生长。
ET增加了黄瓜幼苗的抗性
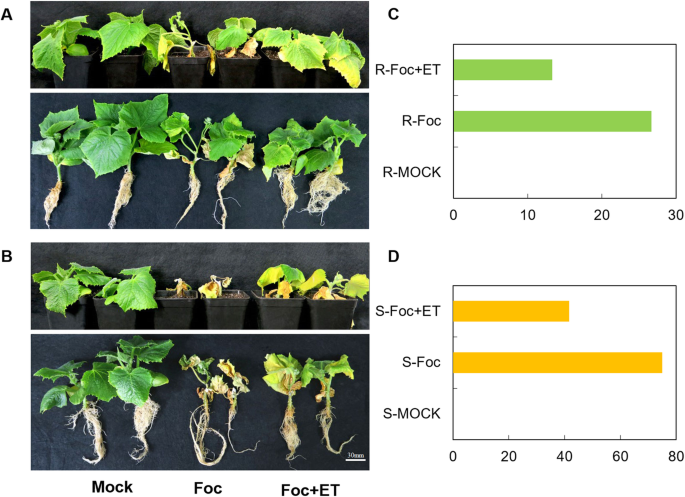
为探讨ET是否可能增强黄瓜幼苗的抗性反应,在真叶二期黄瓜幼苗接种Foc和外源乙烯利,生长3周。对疾病分级进行编号,计算疾病指数。接种4 d后,focc敏感品种Superina的子叶开始变黄,而接种10 d后,focc和乙烯利培养的Superina的子叶出现相同的症状。在接种Foc后7 d、接种Foc和外生乙烯利后15 d,观察抗foca品种“日结城”幼苗的症状。接种Foc和外源乙烯利联合接种Superina的病害指数分别为75和41.67。日杰城分别为26.67和13.33。2个品种接种Foc后的病害指数均高于接种外源乙烯利时的病害指数。4C,D)。因此,接种用FoC和Et接种的黄瓜幼苗的抗性优于仅接种焦灶的幼苗(图。4a、b)在抗性品种(日结城)和敏感性品种(Superina)。结果表明,ET可提高黄瓜幼苗对Foc的抗性。
ET相关基因响应外源ET和FOC感染的表达谱
选择14个相对表达量较高的基因,利用qPCR方法确定外源乙烯利对基因表达量的响应。Csa2G010390和Csa7G318990编码的发病机制相关(PR)蛋白,CSA4G630010,CSA7G049230,CSA2G382540,Csa1G042290,Csa4G641590,Csa2G354000, 和Csa6G318160编码的ET响应转录因子,CSA7G405830编码ET受体,和CSA3G135690.,CSA6G511860,Csa3G135740, 和CSA6G160180编码的ACC氧化酶。选择14个基因中的六种作为ET途径中的代表性基因,用于CoCumber抗性。两种PR基因的表达水平响应于耐滤波和敏感品种的外源施用而显着增加(图。5A,B,C)。在抗焦型品种中表达水平比敏感品种的表达水平相对较高。因此,PR基因可以通过ET调节,并且可以同时改善幼苗的抗病性。CSA3G135690.和CSA6G160180,编码Acc氧化酶,CSA7G049230和Csa6G318160外源乙烯利和Foc侵染可上调et -应答转录因子(Fig。5c).其余8个基因的表达水平见附加文件3.:图S2。所有引物都在附加文件中显示4:表S2。简而言之,在接种归属后,响应外源乙烯因,高度表达这些ET信号通路基因。
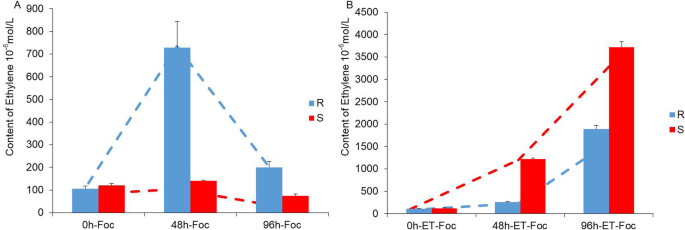
外源乙烯利和Foc侵染黄瓜幼苗内源ET的验证
鉴于ET相关基因通过FOC感染和外源乙烯的外源应用上调,我们测量了黄瓜幼苗的内源性ET生物合成,响应于FOC接种和外源Ethonon(图。6a,b)。rijiecheng中的内源性乙烯生物合成率高于48和96小时的超级下行,响应于独生感染。内源性乙烯浓度在48小时的48小时内较高约四倍,在超海中的96小时高于96小时,响应外源乙烯和FOC感染。随后用外源乙烯治疗后,内源性ET生物合成显着增加。这些实验表明,Foc可以诱导内源性ET的生物合成,并且外源乙烯可以增强这种反应。
讨论
FW是一种常见的土传病害,严重阻碍了黄瓜连作[28].目前没有有效的措施来控制这种疾病,除了养殖抗性品种。使用各种方法植物中植物病原体抗性相关的基因的探索是一个主要的研究重点。在许多模型植物中观察到抗性基因的演变[29,30.,31].黄瓜抗FW相关基因的表达谱研究尚未见报道。本研究通过对黄瓜接种后不同时间点的整体转录组谱进行RNA-seq分析,深入了解了黄瓜对Foc的抗性相关基因。全球数据分析有助于阐明黄瓜对FW的抗性相关基因,并最终筛选控制黄瓜对FW抗性的关键基因。
全基因组转录组分析显示et响应基因明显诱导对Foc感染的反应。由此可见,ET信号参与了黄瓜与Foc的互作,ET受体编码基因在接种前后差异表达。在以往的研究中,经常报道生理胁迫或其他非生物胁迫下ET信号通路。本试验表明,ET是影响黄瓜对Foc抗性的关键因素。类似的发现也被报道Medicago truncatula被......感染Rhizoctonia solani.[32,从而导致ET信号的上调。ET受体是ET信号通路的下游调控因子[25],它调节植物的生长、发育和许多类型的应激反应[33].在番茄中,木霉属harzianum感染诱导pr蛋白的表达,其是依赖于依赖信号传导途径的标志物[29].类似地,在本研究中,通过ET上调两种PR基因。PR基因在病原体攻击下的植物免疫诊断中进行开拓作用。编码PR蛋白的基因的表达似乎响应于病原体感染而迅速上调。PR-1在病原体应激中检测到尼科尼亚塔哈瓦姆植物 [34].这些PR蛋白是植物抵抗病原体的重要组成部分[35].Ohme-Takagi和Shinishi [36报道,PR基因的GCC盒促进了ET-encooction元素的功能[25].增强的抗病抗性1(EDR1)编码CTR1样激酶[37],这是ET响应的负调节器[38,39].Tang等人[40]认为EDR1可能在ET信号中发挥作用,促进细胞死亡。
植物免疫系统也可能通过外源应用相关分子来激活,以调节防御反应。植物激素调节内部和外部环境信号[41].乙醇的能力在转基因苹果果实中合成内源性乙烯[42].本研究表明,外源应用乙烯利可显著提高内源ET的生物合成。通过施用外源乙烯利验证ET可提高黄瓜对Foc的抗性。外源乙烯处理为控制梨褐变提供了一种安全有效的方法[43].Acc的外源性应用,ET的前体,增强了抗性nbald1.- 植物的植物尼古利亚娜·宾夕法尼亚州来萝卜马赛克病毒[44].
本转录组数据提供了在Foc感染后对黄瓜基因表达谱的改善了解。数据提供了在黄瓜防御反应中涉及的ET相关基因的功能和效果的全面概述。et相关基因响应Foc接种而诱导;ET相关和PR基因响应于外源Ethon申请,高度表达,并且同时增强了黄瓜幼苗的抗病性。本结果为进一步发现黄瓜中的基因函数提供了基础。未来的研究应专注于过表达和淘汰候选基因的淘汰,增强抗障碍的抗性,并阐明黄瓜抗性的分子机制。
结论
通过全局转录组分析,我们确定了4116个基因,其在接种FOC后在0h和24,48,96和192h之间差异表达。响应于FOC感染和外源应用Ethephon,ET相关和PR基因被证实使用QPCR分析高度表达。外源性Ethephon治疗与Foc接种增强了黄瓜幼苗的抗病性,内源性ET生物合成显着增加。目前的结果说明了ET信号通路在积极调节黄瓜的防御响应方面发挥作用。该研究结果将有助于阐明黄瓜FW防御机制,有关候选基因的信息将丰富具有增强的FW耐受性的新黄瓜品种的繁殖。
方法
真菌培养和植物材料
从江苏省扬州大学,中国的实验领域分离了焦化菌株,并在28°C的PDA板上繁殖4天,然后在28℃下在180℃下在振荡器上培养马铃薯葡萄糖汤3 days. The spore suspension was diluted to 1 × 106每毫升孢子加无菌蒸馏水。
Seedlings of cucumber ‘Rijiecheng’ and ‘Superina’, moderately Foc-resistant cultivar and Foc-sensitive cultivar, were grown in 32-well plates filled with an aseptic organic substrate (contents of total nitrogen, phosphorus, and potassium = 40–60 g/kg, content of humus ≥350 g/kg, pH = 6.5–7.5) at 25 °C/18 °C day/night temperatures with a 16 h/8 h photoperiod. Seedlings were infected with Foc by irrigation of the roots with a fungal spore suspension (5 mL per seedling) at the second-true-leaf stage. Cucumber roots were sampled at 0, 24, 48, 96, and 192 h after inoculation with three biological replicates. All the seeds were obtained from the homozygous inbred lines of our own laboratory.
RNA提取,cDNA文库构建,Illumina测序,序列分析
使用Takara小纤维植物RNA提取套件(Takara,中国)分离出总RNA。使用Qubit RNA测定试剂盒测量RNA浓度,用Qubit®2.0荧光计(USA)。将一种微克RNA用作RNA样品制剂的输入。使用Poly-T oligo附着的磁珠从总RNA纯化mRNA。在Nebnext®第一链合成反应缓冲液(5×)的高温下使用二价阳离子进行碎片化。使用MRNA片段作为模板合成第一链cDNA。为了长度选择优先200-250bp的cDNA片段,用AMPure XP系统(Beckman Coulter,USA)纯化库片段。选择合格的CDNA用于PCR扩增,用Phusion®高保真DNA聚合酶,通用PCR引物和指数(X)底漆进行。使用AMPure XP系统纯化PCR产物,并用安捷伦生物分析仪2100系统评估库质量。
由BioMarker Technologies(北京,中国)利用Illumina HiSeq 2500平台生产的初级cDNA被称为raw reads。通过删除包含适配器的读取、包含poly-N的读取和低质量的读取,得到干净读取。同时计算干净reads的Q20、Q30、gc含量和序列重复值。修剪后的reads与黄瓜Chinese Long参考基因组v2对齐[33,从http://cucurbitgenomics.org/organism/2.所有下游分析都基于干净、高质量的数据。基因表达水平的定量估计为每千碱基的转录片段每百万片段(FPKM) [45,46]使用袖扣(版本:2.1.1)。
QPCR鉴定RNA-SEQ的DEG和验证
通过将数据与其他采样时间点的数据进行比较,通过将数据与其他采样时间点进行比较,将数据划分为四组。使用Deseq R包(1.10.1)进行四组对四组的分析[47].的P采用Benjamini-Hochberg方法对FDR进行了调整。DESeq和log检测到FDR < 0.01的基因2FPKM (fold change)≥1被认为是差异表达。
将根部部分作为表达样品置于。根据QI的方法部分分离每种病症的总RNA [48].使用Primer Premier 5设计qPCR引物序列。qPCR分析采用SYBR®Premix Ex Taq™II (TaKaRa,中国),按照制造商说明书进行。SYBR绿色PCR循环进行一个Iqtm5多色qPCR检测系统(美国Bio-Rad)使用20μL和样品温度程序:95°C 3分钟,其次是39 95°C的周期10年代,60°C 20年代,20年代和72°C,然后融化曲线分析。基因表达的相对定量归一化为微管蛋白α链基因(CSA4G000580).QPCR的每个条件都有三种生物重复。
外源乙烯利对Foc和黄瓜幼苗的影响
为了确定ET对Foc生长的影响,在PDA培养基中加入外源乙烯利(ET的供体)。在18ml PDA培养基中加入2ml乙烯利(最终浓度1000ppm)或2ml无菌水(作为对照)。Foc在PDA培养基上25℃培养5天,测定3次菌落直径。
为了检查ET对Foc的幼苗抗性的影响,用模拟溶液处理的三分之一的幼苗根作为对照,其中三分之一被焦化菌株接种(孢子浓度106其余接种Foc,同时喷施浓度为10ppm的外源乙烯利溶液在叶片上。3周后记录疾病分级。疾病分级根据症状严重程度分为0-4级,根据董氏方法部分[49].使用以下公式计算疾病指数:疾病指数(%)=\(\ frac {\ sum \ left(\ mathrm {uch} \ \ mathrm {rating} \ times \ mathrm {number} \ \ mathrm {} \ \ mathrm {seavlings} \ \ mathrm {with} \ \ mathrm {疾病} \ \ mathrm {rating} \ \右)} {\ mathrm {total} \ mathrm {node} \ \ mathrm {} \ \ mathrm {苗} \ times 4} \)×100。每组至少15株幼苗,3个生物重复处理。以模拟接种的幼苗为对照。
内源性ET生物合成的测量
在该实验中使用了两种黄瓜自交系,“Rijiecheng”和“超级领域,对FOC的抗性分别用于FOC。通过FOC灌溉接种第二真叶阶段的幼苗(孢子浓度106分生孢子/mL),喷施浓度为10ppm的外源性乙烯利溶液。在处理后48和96 h测定了幼苗根系部分内源ET的生物合成。根部置于密封的30ml安瓿中,于黑暗中静置24小时。为了分析ET的产生,使用注射器收集气体样品(1ml),并注入配备有火焰电离和电子捕获检测器的气相色谱仪(Agilent 7890A,美国)[50].实验由3个生物重复进行。
数据和材料的可用性
与本研究相关的所有转录组数据已提交给NCBI,可以使用加入号PRJNA472169找到。
缩写
- FW:
-
镰刀菌素枯萎
- 归档:
-
尖孢镰刀菌F。sp。法测定
- 等:
-
乙烯
- 阿巴:
-
脱盐酸
- ETR1:
-
乙烯反应1
- RNA-SEQ:
-
RNA序列
- 可见:
-
差异表达基因
- FDR:
-
假发现率
- ACC:
-
1-aminocyclopropane-1-carboxylate
- qPCR:
-
定量实时PCR
- PDA:
-
马铃薯葡萄糖琼脂
- 公关:
-
病因相关
参考
- 1。
KATAN J,Katan J,Katan T.植物兼容性群体在以色列的植物兼容性群体:其分布与致病性。植物病学。2000; 90:529-36。
- 2.
杜恩。醋残留堆肥修正对黄瓜生长的影响镰刀菌素枯萎。环境科学与技术;2015;22:199133-41。
- 3.
詹金斯,韦纳TC。发生的尖孢镰刀菌F。sp。法测定在温室成长Cucumis巨大成功种子股票在北卡罗来纳州。植物DIS。1983; 67:1024-5。
- 4.
毛泽东,张某,张立克。抗抵抗的遗传分析镰刀菌素黄瓜WIS2757中枯萎病小种4和黄瓜赤霉病及其连锁反应。农业科学,2008;41:3382-8。
- 5.
Netzer D,Niego S,Galun E.赋予抵抗力的主要基因镰刀菌素在黄瓜中枯萎。植物病理学。1977年; 67:525-7。
- 6。
斯奈德WC,汉森HN。物种的概念镰刀菌素.我是J机器人。1940; 27:64-7。
- 7。
哈丁MW,马奎斯LLR,霍华德RJ,奥尔森ME。丝状真菌能形成生物膜吗?趋势Microbiol。2009;17:475 - 80。
- 8。
李PQ,PU XM,Feng Bz,杨Qy,沉HF,张JX,林Br。FOCVEL1.影响无性生产,丝状生长,生物膜形成和毒力尖孢镰刀菌F。sp。法测定.前面。植物科学。2015;6:312。
- 9。
陈玲,黄XQ,张福音,赵某,杨XM。应用木霉属harzianumSQR-T037生物有机肥明显控制镰刀菌素黄瓜连作土壤枯萎病及其对微生物群落的影响。食品科学学报2012;92:2465-70。
- 10。
黄翔,史德忠,孙凤琴,吕洪辉,刘建军,王文新。污泥和肥料堆肥改良剂的防治效果镰刀菌素黄瓜枯萎。环境科学与技术;2018;
- 11.
张某,拉扎W,杨XM,胡俊,黄QW,徐YC,刘Xh,冉W,沉QR。控制镰刀菌素黄瓜植物的枯萎病,应用生物生物肥料。BIOL海洋土壤。2008; 44:1073-80。
- 12.
Pétriacq P, López A, Luna E.果实腐烂对疾病:诱导抗性和启动有帮助吗?植物。2018;7:1-16。
- 13.
关键词:植物,坏死营养真菌,防御信号转导,信号转导植物生长规律。2016;35:1159-74。
- 14.
De Vos M, Van Oosten VR, Van Poecke RMP, Van Pelt JA, Pozo MJ, Mueller MJ, Buchala AJ, Métraux JP, Van Loon LC, Dicke M, Pieterse CMJ。拟南芥在病原菌和昆虫侵染过程中的信号特征和转录组变化。植物微生物学报,2005;18:9 - 37。
- 15.
Bleecker AB,Kende H.乙烯:植物中的气态信号分子。Annu Rev Cell Dev Biol。2000; 1:1-18。
- 16.
徐k,xu x,fukao t,canlas p,maghirang-rodriguez r,豪尔斯,豪尔斯,伊斯梅尔am,贝利 - Serres j,罗纳德pc,macckill dj。Sub1a是一种乙烯 - 反应因子样基因,赋予水稻潜水耐受性。自然。2006; 442:705-8。
- 17。
Van Loon Lc,Geraats BPJ,Linthorst HJM。乙烯作为植物中抗病性的调节剂。趋势植物SCI。2006; 11:184-91。
- 18。
植物激素在平衡免疫反应和适应成本中的作用(英文)植物科学与技术,2013;
- 19。
王M,凌,董X,朱益,沉QR,郭司。用土壤传播病原体感染黄瓜植物中叶响应的热度显现尖孢镰刀菌F。sp。法测定.植物生理学杂志。2012;61:153-61。
- 20。
王敏,孙玉明,孙广明,刘旭坤,翟丽莲,沈庆荣。黄瓜植株水分平衡发生变化尖孢镰刀菌F。sp。法测定.SCI REP。2015; 5:7722。
- 21。
Rodrigues O,Reshetnyak G,Grondin A,Saijo Y,Leonhardt N,Maurel C,Verdoucq L. Aquaporins促进过氧化氢进入保护细胞,以介导ABA和病原体引发的气孔闭合。pnas。2017; 114:9200-5。
- 22。
拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号转导中具有转录激活因子的作用。植物细胞。2003;15:63 - 78。
- 23。
安德森JP,Badruzsaufari E,Schenk PM,Anyners JM,Desmond OJ,Ehlert C,Maclane DJ,Ebert Pr,喀山K.脱离酸和茉莉 - 乙烯信号通路之间的拮抗相互作用调节拟南芥中的防御基因表达和抗病性。植物细胞。2004; 16:3460-79。
- 24。
东吉,齐Xh,徐Q,陈Xh。鉴定尖孢镰刀菌F。sp。法测定黄瓜的抗性分析。分子植物育种。2017;15:3648-53。
- 25.
关键词:乙烯,植物生长,胁迫,信号转导植物细胞代表2013;32:1099-109。
- 26.
张磊,尚军,王文敏,杜建军,李凯,吴小龙,于磊,刘春英,Khaskheli MI,杨文英。正常光照和遮荫下大豆对大豆花叶病毒反应的转录组差异比较。病毒。2019;11:1-15。
- 27.
刘DQ,赵Q,崔XM,Chen R,Li X,Qiu BB,Ge F.转录组分析揭示田七抵抗腐皮镰孢霉菌茉莉酸甲酯诱导。基因组织。2019; 41:1383-96。
- 28.
王,吴富子,刘谟。根部,燕麦和大豆根除渗滤物的化感众效应对黄瓜种子萌发和生长。Allopathy J. 2009; 24:103-12。
- 29。
关键词:乙烯,sa,信号转导通路,乙烯合成木霉属harzianum- 在感染根结线虫后 - 治疗番茄植物有隐姓埋名的女人.植物细胞批准。2017; 36:621-31。
- 30.
吴九,金SG,康凯,金JG,公园SR,Gupta R,Kim Yh,王YM,Kim St。病因相关蛋白质10的过表达增强了水稻中的生物和非生物胁迫耐受性。植物病理学J. 2016; 32:552-62。
- 31。
Finkina EI, Melnikova DN, Bogdanov IV, Ovchinnikova TV。植物致病相关蛋白PR-10和PR-14作为先天免疫系统和普遍过敏原的组成部分。Curr Med Chem. 2017; 24:1772-87。
- 32。
刘义,哈桑,Kidd BN,Garg G,Mathesius U,Anderson JP。乙烯信号传导对于异黄酮介导的抗性是重要的Rhizoctonia solani.的根Medicago truncatula.植物微生物学报。2017;30:691-700。
- 33。
陈T,刘继,雷克,刘毅,李紫玉,陶吉,郝yj,曹义,林q,张wk,ma b,陈声,张js。烟草乙烯受体突变对受体激酶活性,植物生长应激反应的影响。植物细胞生理。2009; 50:1636-50。
- 34。
Gianinazzi S, Martin C, Vallée JC。Hypersensibilité aux病毒,température和protéines可溶于尼古利亚娜Xanthi.北卡罗来纳:幽灵macromolécules lors de la répression de la synthèse virale。Acta Crystallogr。1970;270:2383-6。
- 35。
琼斯JDG,Vance Re,Dangl JL。植物和动物的细胞内先天免疫监测装置。科学。2016; 354:1117-26。
- 36。
与乙烯反应元件相互作用的乙烯诱导DNA结合蛋白。植物细胞。1995;7:173 - 82。
- 37.
Frye Ca,Tang D,Innes RW。保守地图Kinase植物防御反应的负调节。P Nat Acad SCI。2001; 98:373-8。
- 38.
Cao H,Glazebrok J,Clarke JD,Volko S,Dong Xn。控制全身性获得性抗性的拟南芥NPR1基因编码了含有Ankyrin重复的新型蛋白质。细胞。1997年; 88:57-63。
- 39.
Kieber JJ, Rothenberg M, Roman G, Feldmann KA, Ecker JR. CTR1是拟南芥乙烯反应通路的负调控因子,编码一个Raf蛋白激酶家族成员。细胞。1993;72:427-41。
- 40.
唐D,Christiansen Km,Innes RW。EDR1蛋白激酶对拟南芥植物抗病,应力响应,细胞死亡和乙烯信号传导。植物理性。2005; 138:1018-26。
- 41.
Kazan K.茉莉酸盐和乙烯在非生物胁迫耐受性中的不同作用。趋势植物SCI。2015; 20:219-29。
- 42。
Abhaya MD, Gianni T, Bruno GD, Sandra LU, Andrew JP, Adel K, John RS, Richard C, David JJ。乙烯生物合成下调对苹果果实风味复合物的影响。转基因研究》2004;13:373 - 84。
- 43。
马烨,杨明明,王建军,蒋传忠,王庆国。外源乙烯对黄冠梨采后果皮褐变的抑制作用。植物科学与技术,2016;
- 44。
王S,韩吉,彭·jj,赵jp,姜ll,lu yw,zheng hy,林l,陈吉,yan f。nbald1.通过调节水杨酸的积累和乙烯途径介导对芜菁花叶病毒的抗性尼古利亚娜·宾夕法尼亚州.莫尔植物途径。2019; 20:99-1004。
- 45。
数千个外显子跳跃事件区分了16种人体组织的剪接模式。F1000Res。2013; 2:188。
- 46。
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Kwan G,Baren MJ,Salzberg S1,Wold BJ,Pachter L.转录程序组装和通过RNA-SEQ定量揭示了细胞分化期间的未经纳米转录物和同种型切换。NAT BIOTECHNOL。2010; 28:511-5。
- 47。
王L,冯泽,王X,王XW,张XG。DEGSEQ:用于识别来自RNA-SEQ数据的差异表达基因的R包。生物信息学。2010; 26:136-8。
- 48。
齐Xh,李QQ,马XT,钱克,王鹤,任nn,沉cx,黄sm,xu xw,xu q,陈xh。在黄瓜中的耐涝诱导的不定根形成通过反应性氧物质信号传导来调节乙烯和唾液。植物细胞环境。2019; 42:1458-70。
- 49.
东杰,徐茹,徐XW,徐Q,陈Xh。黄瓜镰刀菌抗性抗性的感受和定量特性轨迹。前植物SCI。2019; 10:1-9。
- 50.
Giné-Bordonaba J, Echeverria G, Ubach D, Aguiló-Aguayo I, López ML, Larrigaudière植物生理学杂志。2017;111:216-25。
确认
我们感谢dananz Group China(中国)Liwen Bianji的Robert McKenzie博士(www.liwenbianji.cn/ac.),编辑本手稿草稿的英文文本。
资金
本研究由国家自然科学基金(31902015)、江苏省自然科学基金(bk201900887)、江苏省现代农业产业技术体系(JATS[2018] 308)、江苏省农业科技创新基金(CX(19)3029)资助。江苏省农业新品种创新重点项目(PZCZ201720)。31902015、bk201900887、CX(19)3029的资方为JX, JATS[2018] 308、PZCZ201720的资方为XC,即本文的通信内容。XC的两个资助机构为转录组测序和分析提供支持。JX的31902015和bk201900887为RNA提取、qPCR等设计提供了支持。CX(19)3029为植物的生长和接种提供了条件。
作者信息
隶属关系
贡献
XC和JX对实验的概念化和设计做出了贡献。JD和YW进行实验,JD写手稿,两位作者为共同第一作者。QX对黄瓜幼苗进行制备和RNA提取。所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
所有作者宣布他们没有竞争利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
补充信息
附加文件1:表S1。
每个样本的数据质量评估。
附加文件2:图S1。
感染后不同时间点差异表达基因(DEGs)。
附加文件3:图S2。
未选择候选基因的表达谱。
附加文件4:表S2。
用于乙烯相关的差异表达基因的引物序列。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。如欲浏览本许可证的副本,请浏览http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
东,J.,Wang,Y.,Xian,Q.et al。转录组分析显示乙烯介导的防御反应尖孢镰刀菌F。sp。法测定感染Cucumis巨大成功l ..BMC植物杂志20,334(2020)。https://doi.org/10.1186/s12870-020-02537-7
已收到:
接受:
发表:
关键字
- 黄瓜
- 外源性乙烯
- 镰刀菌素枯萎
- RNA-seq