摘要
背景
瓜尔(Cyamopsis tetragonoloba(L.)托布。),a short-day plant, is an economically valuable legume crop. Seeds of guar serve as a source of galactomannan polysaccharide, known as guar gum, which is in demand in the gas and oil industries. The rapid and complete maturation of guar seeds depends on the flowering time of a particular genotype. It is known that flowering in guar is controlled by several gene systems. However, no information about the process and mechanisms that trigger flowering in guar on the molecular and biochemical levels was previously reported. The aim of the study was to investigate the metabolic landscape underlying transition to the flowering in guar using GC-MS-metabolomic analysis.
结果
从VIR收集的82个瓜尔胶基因型(每个基因型8个重复)在高湿度、长光周期的实验条件下生长。在胁迫条件下,部分瓜尔豆基因型开花提前(从第一次真叶出现开始的41±1,8天),而其他瓜尔豆基因型开花严重延迟(可达95±1,7天)。利用GC-MS分析82个瓜尔豆基因型的第三真叶期共检测到244个代谢物。其中一些分子与瓜尔豆植物向开花转变有关。在早花和晚花两组植物的代谢组学特征中,有65个代谢产物在早花基因型中丰度显著较高。其中7个关键分子经S-plot鉴定为瓜尔豆“早花”和“晚花”基因型的潜在生物标志物。
结论
首先描述了瓜尔豆开花过程中代谢组学景观。该研究结果可用于后续的基因组研究,以确定代谢-基因关联,揭示瓜尔豆开花开始和光周期敏感性相关基因。此外,检测到的与瓜尔豆开花相关的关键代谢产物可作为生物标志物,用于快速筛选潜在早期开花基因型的育种材料。
背景
瓜尔是一个短日豆科植物作物,最近是流行的,因为它的种子是半乳甘露乳甘油多糖(瓜尔胶)的来源,这些是在许多行业包括天然气和石油生产的行业中。瓜尔耐受高温和干燥条件,适应印度和巴基斯坦的干旱和半干旱气候[1].为了将这种经济上有价值的豆类作物引进地理纬度较高的国家,已经进行了几次尝试。在将瓜尔豆引入新的栖息地时,反复报告了主要问题——作物周期过长在收获时造成问题(例如[2])。据报道,美国瓜尔瓜尔的生长季节为60 - 90天(确定品种)至120-150天(不确定品种),只有早熟瓜尔瓜尔品种推荐在威斯康星州和明尼苏达州生产[1].除了确定和不确定的生长习惯外,特定的日光长度显着影响着瓜尔的开花的发作[3.].反过来,日中性瓜尔基因型通常比对光周期长度高敏感性的那些成熟[4].
利用代谢物图谱作为功能基因组学的新工具,阐明瓜尔豆开花开始的遗传控制将大大受益。有几份报告证明,每种植物基因型具有不同的代谢谱(例如[5,6,7].代谢物分析具有不仅可以提供更深入的洞察力对复杂的调节过程,而且还可直接测定表型[5].
代谢分析和基因组研究已经在许多植物物种中反复进行。例如,使用代谢方法,与胡萝卜抗虫害相关的遗传因素[8)、西红柿(9]以及大麦的盐胁迫[10]进行了测定。几项研究已经致力于寻找分子机制显著减少作物高的温度,干旱,盐渍化,高金属含量的敏感性,和一些基因底层的耐非生物应激已被揭露[11,12,13,14].然而,对于瓜尔豆,代谢方法迄今仅用于研究种子的抗菌活性[15,16,种子质成分[17]和种子的药用特性[18].出于“OMICS”方法,最近报道了两种瓜尔品种叶组织的转录组分析,提供了关于超过6200人的信息[19].作为功能基因组学的额外工具,就业代谢组分的就业可以为植物的代谢和与环境的互动提供新的了解[20.,21].
这项研究的目的是分析各种代谢景观基本过渡C. Tetragonoloba.基因型到开花在长日照条件下,这是压力的这一种短日照植物。为了完成这项任务,我们进行了为期6个月的植被实验,在温室中种植了96种不同的瓜尔瓜尔基因型,自然日照长度与圣彼得堡的地理纬度(~ 60°N)相对应。我们研究了不同的基因型是如何通过开花开始而分离的,这取决于它们对光周期的个体敏感性。与此同时,我们对每一株植物的第三片真叶组织进行了代谢组学分析,这是花蕾形成之前的发育阶段。
结果
温室条件下瓜尔豆不同基因型在长光周期下开花时间的变化
瓜尔-是一种昼短的植物,这意味着瓜尔的开花速度是由于日光长度短于临界光周期[3.].瓜尔生长季节的最佳光周期长度从12.7小时到13.8小时不等,如在焦特布尔省(印度),瓜尔被广泛种植。在VIR普希金分公司的温室条件下,在圣彼得堡(59°53′39″N)自然纬度的光周期下(5 - 10月)培养了96个瓜尔瓜尔基因型,每个8个个体。该实验使我们能够监测不同基因型的短日照作物对日照逐渐减少的反应:从夏至日的最大值(~ 19小时)到10月的前10年的相对较短的时间(11小时)[4].我们有机会观察瓜尔豆植物在光周期达到特定基因型的阈值时,是如何一个接一个地开花的。这使得我们可以根据植物过渡到花芽形成阶段的日期将所有的植物分为组。
在96个瓜尔豆品系中,只有82个成功地进入开花阶段,并进行了代谢组学分析。其中30个基因型花芽形成较早(第一片真叶出现到第一片花芽出现的天数= 41±1.8,平均±SE)。对于其他52个对光周期敏感的基因型来说,日照延长导致向开花程序过渡的障碍,导致花芽形成的强烈延迟(95±1.7,平均值±SE) [4].我们研究了«早开花»瓜尔基因型的两个对比群的植物组织的组织的代谢物谱。(延迟开花»瓜尔基因型(附加档案)1).
瓜尔豆早、晚花期基因型的gc - ms代谢组学分析
是为82点瓜尔胶的基因型,在4-6生物重复每种基因型进行GC-MS分析。为了得到一个洞察技术的再现,检查每个品系3个生物重复至少3个技术复制。总共检测到244个有效峰值和整个人口的半定量。基于GMD和NIST库105倍的代谢物进行鉴定,包括氨基酸,糖,糖苷和多元醇,黄酮类,脂肪酸和有机酸。
首先,我们使用相对标准偏差(RSD)方法检查同一样品的生物重复中代谢物的浓度是否没有显著变化。早花期组和晚花期组各株系生物复制间的RSD值均不超过20%2:表S1,图S1)。因此,在我们的实验中,在相同条件下生长的基因相同的植物之间所看到的生物变异与之前报道的(例如[5])。技术重复显示出更低的变异:244个代谢物的RSD平均值估计为9%±5%,这证实了实验方法学造成的变异与生物学差异相比微不足道。
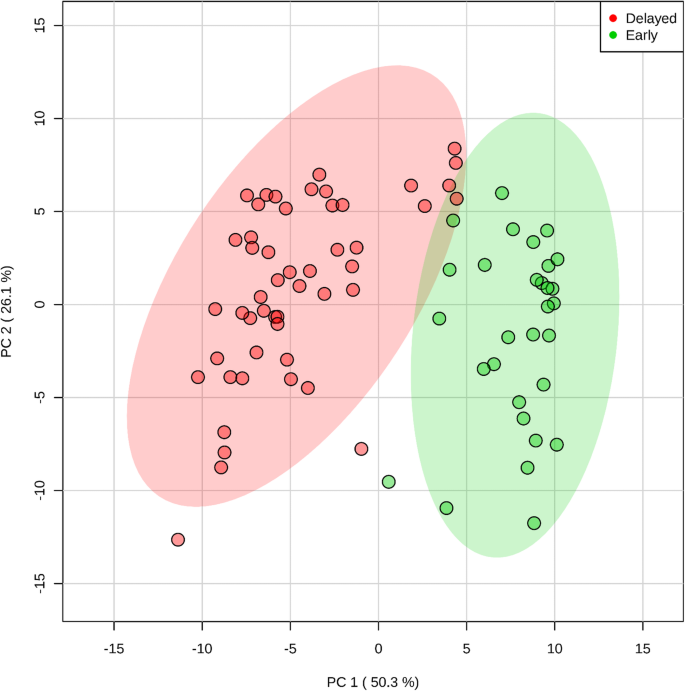
244个代谢谱的主成分分析(PCA)得分图显示了两个明显分离的簇,其中30个开花早,52个开花晚。1).第一个部分负责将82个基因型分成两组,解释了50.3%的变异性。
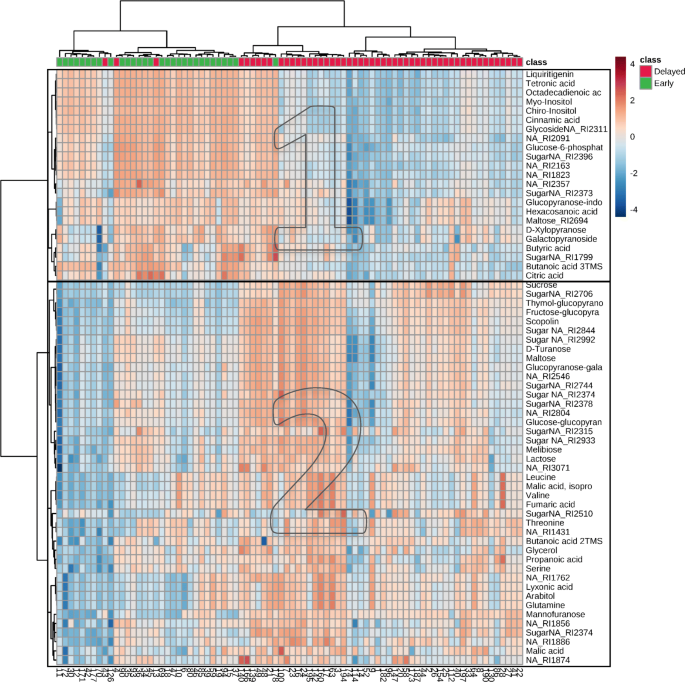
为了确定对瓜尔豆早花期和晚花期基因型分化贡献最大的代谢物,我们进行了t检验,结果显示65个关键代谢物(FDR值< 0.01)在两组间差异显著。接下来,我们利用热图,根据65个代谢物谱对82个瓜尔豆基因型进行聚类。正如预期的那样,热图显示«早花»和«晚花»基因型被分配到两个分离的簇(图2)。2).但也有少数例外:先前被认为是“延迟开花植物”的id4,13,43基因型被归为早开花植物。事实上,id43代谢组与开花延迟组的代谢组完全相同。2).拾取样品叶片后,患有ID 4和ID 13的植物略有影响,因此由于错过了第一次花芽,它们可能会对不正确的表现出来。
在开花早期基因型中鉴定出相对浓度较高的代谢物,其中有2种多元醇、8种糖、2种糖苷、5种有机酸、1种黄酮类化合物、1种脂肪酸和4种未鉴定分子(图1)。2,聚集1)。其他组代谢物显示出具有延迟开花的植物的相对浓度(2多元醇,20糖,1糖苷,6个有机酸,5个氨基酸,8个未识别)(图。2,群集2)。关于65代谢物的详细信息,在早期和延迟开花植物之间的浓度显着不同,如额外文件所示3..
值得注意的是,聚类方法不仅识别出表型差异明显的基因型,而且属于同一代谢物类的代谢物在热图上也表现出相关变异。例如,瓜尔豆植物样品中氨基酸(谷氨酰胺、苏氨酸、缬氨酸、亮氨酸、丝氨酸)的浓度相应不同。还有至少两组只结合了糖代谢谱(图。2).
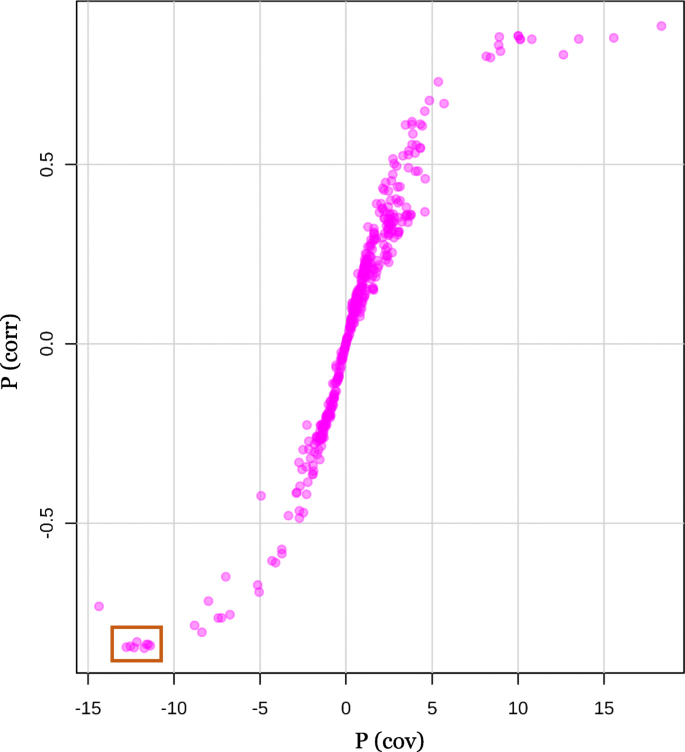
接下来,生成一个s图,以进一步确定具有统计学意义和潜在的生物化学意义的代谢物(图。3.).在s图的左侧,7种具有强模型贡献和高统计可靠性的代谢物被强调为与瓜尔豆植物快速过渡到开花相关的潜在生物标志物:chiro-inositol (6TMS (Trimethylsilyl)) RI 1953 (pCOV. = − 12.56, pcorr=−0.85),myo-肌醇(6TMS) RI 2088 (pCOV.=−11.97,pcorr = − 0.84), unidentified glycoside RI 2311 (pCOV. = − 13.03, pcorr=−0.85),四烯酸(TMS) RI 2115 (pCOV.=−11.74,pcorr=−0.84),肉桂酸,3,4-二羟基(3TMS) RI 2134 (pCOV. = − 12.80, pcorr = − 0.84), unidentified metabolite RI 2358 (pCOV. = − 12.41, pcorr = − 0.83), liquiritigenin RI 2437 (pCOV.=−11.62,pcorr = − 0.84). Those molecules contributed mostly to the metabolome’s discriminations between early and delayed flowering guar plants growing under stressful conditions of prolonged photoperiod.
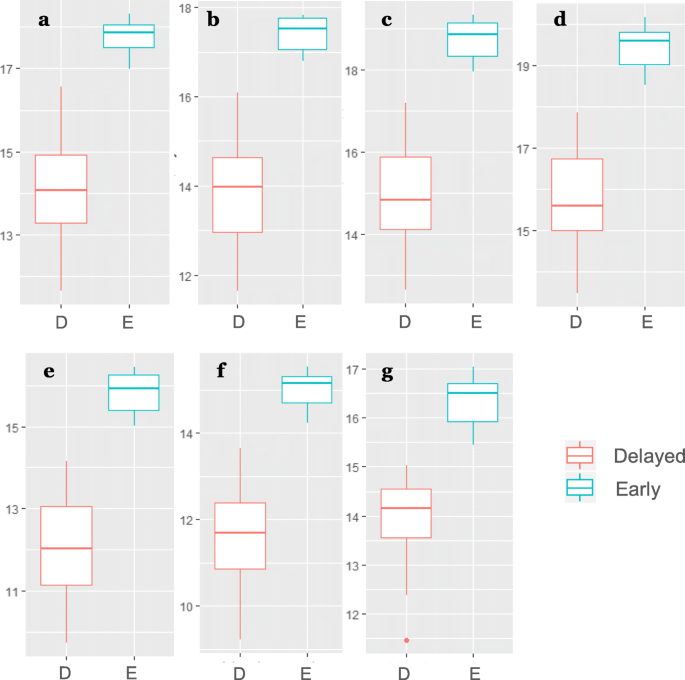
数字4演示日志标准化的7种关键代谢物的相对浓度在早期组和延迟开花的瓜尔胶的基因型。值得注意的是,所有的7组潜在的生物标记物具有在那些准备用于开花(早期开花基因型)的植物的叶组织的显著浓度较高,提示前述(或伴随)的某些生化途径开花的开始的激活。因此,在瓜尔豆植物的第三片叶子的组织这些关键分子的高浓度指示即将开花,而在这些组织中的分子的低浓度是指在开花,至少在未来几周内的延迟。
讨论
代谢组分析可用于检测关键分子和分子机制,这是对生物和非生物胁迫的表型反应的基础[22,23].当研究代谢物变化作为对压力环境条件的反应时,可以比较不同基因型的代谢物反应,并了解塑性的基础和基因型对特定应激源的适应性[22,24,25].
光周期是调节植物发育的重要生物因子之一。日光长度的变化是植物有机体开始各种反应的信号,包括开花或生长季节结束时植物停止生长。Goodacre等人研究了植物在不同日光下生长时所发生的代谢变化。26].使用ESI-MS分析Pharbitis留下提取物随后判别分析,作者展示了识别在不同光周期上生长的植物的能力通过其代谢谱。
在我们的研究中,我们研究了不同瓜尔豆基因型对胁迫因子(延长光周期阻碍这种短日照植物向开花过渡)的代谢反应。结果表明,瓜尔豆的不同基因型通过光周期敏感性分化为早花组和晚花组,并表现出不同的代谢组特征。最后,我们描述了瓜尔豆早期开花基因型伴随适时开花的代谢景观。
尽管使用GC质谱(GC-MS)的分析代谢不允许检测整个集合在被检查的叶组织呈现代谢物的[27],至少65种代谢产物进行检测表示显著不同浓度在早期的叶子和延迟开花的瓜尔胶的基因型。其中,在早期开花植物的叶中含量最高7个键分子可作为生物标志物用于搜索瓜尔豆基因型可以切换到即使在一个长光照的紧张状况在时间开花。对应于以前的报告该生物体的特定的生物状态的诊断是通过代谢谱提供的最大可能性之一[28].
在7个关键的代谢物中,在瓜尔植物叶组织中的增加浓度表明即将到来的开花,有两种肌醇异构体。肌醇及其衍生物对于植物中的开发和信号传导至关重要,表现为代谢介质或参与各种信号通路,以应对应激,激素和营养素,通过刺激反应基因的转录调节[29].据报道,肌醇是植物细胞信号转导、胁迫反应、细胞壁生物发生、生长调节、抗渗透、膜运输等过程的核心成分[30.].本文还阐述了肌醇在植物胚胎发生早期的重要作用。因此,在拟南芥蒂利亚纳,RNA-i诱导突变myo肌醇磷酸合成酶(MIPS)是肌醇生物合成的关键基因,可导致胚胎流产[31].由于瓜尔豆是自花授粉的植物,胚胎发生通常始于未开的花[32[可以假设植物组织中足够浓度的肌醇是花芽形成的先决条件,因为早期胚胎需要保证初始肌醇供应,以进行正常发展。
其中一个关键代谢物来自黄酮甘草素(附加文件)3.).对于豆科植物,据报道多达几十种不同的类黄酮[33,34],其中dihydroxyflavanone甘草素是从分离Glycyrrhizae解费斯。ex DC例如:35,36].最近已建议黄酮类化合物作为疾病运动的有效内源调节剂,从而表现为植物中的发育调节剂[37].因此,我们认为液化甘草苷在瓜尔豆植物胁迫诱导的形态发生反应中起着重要作用。
所检测到的代谢物65,这是过渡非常重要的,以在瓜尔开花,结合5种氨基酸,11种有机酸,28种糖,3个糖苷,4个多元醇,1类黄酮,1种脂肪酸和12种未知代谢物。Significant differences (FDR value < 0.01) in their concentrations between early and delayed flowering plants affect several pathways according to the KEGG database: valine, leucine and isoleucine biosynthesis; glycerolipid metabolism; glycine, serine and threonine metabolism; D-glutamine and D-glutamate metabolism; N-, O-glycan biosynthesis; gluconeogenesis; pentose phosphate pathway; nucleotide sugar biosynthesis, galactose degradation; glycolysis; ascorbate biosynthesis; trehalose biosynthesis; galactose degradation; glycogen biosynthesis; inositol phosphate metabolism; glycosylphosphatidylinositol (GPI)-anchor biosynthesis; phosphatidylinositol signaling system; trans-cinnamate degradation and linoleic acid metabolism.
由于代谢组众多的生物化学途径的最终结果,应该考虑的是,这些途径的有效运行依赖于相应的酶,这反过来,是由基因编码。代谢物变化可以被认为是遗传性状,从而,代谢组学分析被用在遗传研究[38,39,40].代谢物变异相关基因的QTL定位已有多篇报道[41,42,43].同样,我们的研究通过检测关键代谢产物的生物合成,为寻找与瓜尔豆植物开花相关的基因位点提供了可能。由于将GC-MS的能力与生物信息学的最新进展相结合,这成为可能[22,23,这为功能遗传学提供了额外的机会。
结论
首先描述了瓜尔豆开花过程中代谢组学景观。在压力较长的日光(17-18小时)条件下,那些准备好切换到开花的植物呈现出与植物中的代谢型曲线不同,在浓度的至少65代谢物中延迟开花。特别地,瓜尔族的开花的开始与7个关键代谢物浓度的显着增加有关:Chiro-inositol(RI 1953),肌肌醇(RI 2088),四膦(RI 2115),肉桂酸,3,4-二羟基(RI 2134),未识别的糖苷(2311),液中蛋白(RI 2437)和未识别的代谢物(RI 2364)。在第三叶片的组织中可以检测到较高浓度的那些代谢物 - 在第一个花芽外观之前的发育阶段。这些分子可用作生物标志物,用于快速筛选育种材料,以揭示第三叶阶段的潜在早期开花的瓜尔基因型。这可以帮助培养新的瓜尔品种,这些品种更适应培养具有延长的光周期的国家的短日种。
方法
研究设计和样品收集
从VIR标本中选择96个不同地理来源的瓜尔豆基因型进行研究。在这个样本中,提供了来自印度的当地品种,来自美国(Kinman, Lewis, Santa Cruz)的已知品种,以及来自俄罗斯(Vavilovskij 130, Vector, Sinus)的最近开发的品种(附加文件)4).2017年,选定的96个瓜尔瓜尔基因型在VIR(克拉斯诺达尔,俄罗斯)库班实验站进行了繁殖。分别采集96个基因型的种子繁殖情况。2018年,在VIR (St. Petersburg region, 59°53 ' 39″N)普希金分部的温室中,每种基因型的8颗种子被播种在盆栽土壤中,这些植物在相同的光照、湿度和温度条件下生长(附加文件)5).在实验期间,植物未暴露于任何农药治疗。
记录所有植株的出苗(萌发)日期、第一片真叶的出苗日期和第一朵花的出苗日期,然后计算各基因型转入生殖阶段的速率。如前所述,从第一次真正的叶子出现开始,在41±1.8内开花的基因型被记录为“早花”。相应的,如果基因型转变为晚开花(95±1,7天后),则被归为“晚开花”组[4].
由于每个96基因型的是由8种的植物来表示,GS-MC-代谢组学分析的第三真叶分别从构成每个基因型作为生物重复的4至6植物收集。样品采摘于六月,2018(晚上时间)进行。叶子立即称重,并在液氮中冷冻。样品的储存在的温度下进行 - 80°С。
化合物的提取和代谢产物的衍生化
在1.5ml Eppendorf型微管(SSI,USA)的冷甲醇中冻结后,提取瓜尔叶的代谢物在1小时+ 4°С[27].将提取液转移到干净的Eppendorf微管中,用真空浓缩器(美国Labconco)蒸发。
采用硅烷化法进行衍生化。将干代谢物溶于吡啶溶液(1 μg/μl)中50 μl吡啶和20 μl内标tricosane (nC23, Sigma)。硅基化使用50 μl N,O-Bis(三甲基硅基)三氟乙酰胺(BSTFA, Sigma)进行。
GC-MS代谢物鉴定
样品采用气相色谱系统(美国安捷伦6850)和质谱仪(美国安捷伦5975B)进行GC-MS分析。体系采用DB-5HT毛细管柱,5%交联二苯(内径30 m × 250 μm,膜厚0.25 μm;美国安捷伦J&W)。以无分裂方式加入0.8 μm的样品。氦被用作载气。前进口吹扫流量为1 mL/min。初始温度设定为70°С。温度从70°С上升到340°С,速度为4°C/min。注射温度为250°С。质谱数据的全扫描模式为50 m/z - 800 m/z,速率为每秒2个光谱扫描。 The chromatogram recording was performed on the signal of the total ion current by Agilent ChemStation soft.
采用unicchrome5.0.19.1162 (www.unichrom.com.).采用半定量方法计算了样品质量相对浓度与内标三甘醇浓度(1 μg/μl)的关系。
gc - ms分析,平均每个基因型5个重复。结果,每个基因型至少得到3张高质量的色谱图。每个检测代谢物的浓度值的计算是通过将所有可得到的reps平均,并考虑相对标准偏差(RSD)的值[5,44].
使用自动质谱折叠卷积和鉴定系统AMDIS 32进行代谢物的鉴定(http://www.amdis.net/)使用NIST/EPA/NIH 08质谱库(http://www.nist.gov/srd.)和由科马罗夫植物研究所建立的质谱信息数据库。结果(10个最大峰和保留指数(RI))与数据库GMD、Golm Metabolome database (http://gmd.mpimp-golm.mpg.de/analysisinput.aspx).如果匹配因子值超过阈值700,则考虑了代谢物。
各组差异表达代谢物的统计分析
使用在线分析平台MetaboAnalyst 4.0进行代谢组数据的多变量统计处理(http://www.metaboanalyst.ca) [45].数据已经过日志转换(广义对数转换或GLOG)。
单向ANOVA(T-TEST)分析用于识别鉴别两组的重要代谢物。什么时候FDR.p-值小于0.01,则各组间代谢物浓度差异显著。多元分析包括层次聚类分析(Heatmap)、主成分分析(PCA)和隐结构正交投影(OPLS),并构建正交特征s图。多元分析数据的预处理包括缺失值估计。丢失的值被最低值(原始数据中最小正值的一半)所替代。未执行数据过滤和数据缩放。
热图提供了直观的可视化数据表的代谢物浓度在不同的样品。地图上的每个颜色单元格对应于数据表中的浓度值,样本在行中,特征/化合物在列中:颜色越红,浓度的对数越高。蓝色表示浓度对数越低。采用Ward聚类算法,基于欧氏距离估计进行数据聚类。
采用主成分分析方法构建二维模型,确定组间差异,并显示样本之间的一般相似性和差异性。一个S-plot [46,识别出具有统计学意义的代谢物,区分早花和晚花植物,呈高度显著负相关。
数据和材料的可用性
支持数据作为附加文件包括在内。3叶早花和晚花植物的全部代谢组学数据已提交至MetaboLights (EMBI-EBI),登录号为MTBLS1589。
改变历史
2021年1月15日
对本文的修订已发布,并可通过原始文章访问。
缩写
- 气相:
-
气相色谱-质谱联用
- SE:
-
平均标准误差;
- TMS:
-
三甲基硅烷基
- GMD:
-
golm代谢物数据库
- 国家标准:
-
国家标准与技术研究所
- 相对标准偏差:
-
相对标准偏差
- PCA:
-
主要成分分析
- OPLS:
-
对潜在结构的正交投影
参考资料
- 1.
作者简介:张志强,男,河北人,博士,主要从事生物医学工程研究。替代农田作物手册。明尼苏达大学推广服务中心替代动植物产品中心:威斯康星大学合作推广服务中心;1991.
- 2.
Gresta F,Santonoceto C,Ceravolo G,等。瓜尔的生产,定性和种子图像分析特征(“Cyamopsis tetragonolobal。托布)。作物科学,2016;10:1052。
- 3.
吕贝尔斯EL。表征和瓜尔豆光周期的继承,Cyamopsis tetragonoloba(L.)托布。亚利桑那大学博士论文。1987。
- 4.
TegeGakova S,Volkov V,Dzyubenko E等。瓜尔(瓜尔)光周期反应变异性(Cyamopsis tetragonoloba(L.)托布。)genotypes of different geographic origin. Vavilov J of Genetics and Breeding. 2019;23:730–7.
- 5。
Fiehn O,Kopka J,DörmannP,等。用于植物功能基因组学的代谢物分析。NAT BIOTECHNOL。2000; 18:1157-61。
- 6。
等。利用气相色谱-质谱法研究栽培马铃薯(Solanum tuberosum)组andigena, phureja, stenotomum和tuberosum的代谢组学。中国农业科学。2009;58:1214-23。
- 7。
赵建军,王志强,陈敏,等。利用核磁共振和化学计量学分析不同培养条件下玛咖(Lepidium meyenii)的代谢组分化。足底医学。2012;78:90 - 101。
- 8。
王志强,王志强,王志强,等。栽培、生物强化和野生胡萝卜对西花蓟马的寄主植物抗性的生态代谢组学研究。植物化学,2013;93:63 - 70。
- 9。
Mirnezhad M, Romero-González RR, Leiss KA,等。野生和栽培番茄寄主植物对蓟马抗性的代谢组学分析。Phytochem肛门。2010;21:110-7。
- 10.
帕特森JH,Newbigin ED,测试M等人。大麦的盐胁迫代谢反应(Hordeum Vulgare.耐盐性不同的品种,如撒哈拉和克利伯。J Exp Bot. 2009; 60:4089-103。
- 11.
庄Ĵ,张健,侯XL等。转录,非生物胁迫的蔬菜作物的研究蛋白质组学,代谢组学和功能基因组学方法。CRC暴击启植物科学。2014; 33:225-37。
- 12.
王志强,王志强,王志强,等。表达拟南芥脱水反应元件结合蛋白1A (DREB1A)的转基因马铃薯块茎代谢谱研究中国农业科学。2013;61:893-900
- 13.
Evers D,Legay S,Lamoureux D等人。通过转录组和蛋白质组学分析朝着马铃薯冷和盐胁迫响应的合成图。植物mol biol。2012; 78:503-14。
- 14.
Jahangir M,Abdel-Farid IB,Choi Yh等。金属离子诱导芸苔属rapa中的代谢物积累。J植物理性。2008; 165:1429-37。
- 15.
Ali W,Munir I,Ahmad Ma,等。一些局部和异国情调的分子表征芸苔属植物juncea种质。生物技术学报2007;6:1634-8。
- 16。
等。瓜尔胶释放型和精英基因型的特性[Cyamopsis tetragonoloba(L.)Taub。]。遗传资源作物evol。2013; 60:2017-32。
- 17。
Mukhtar HM, Ansari SH, Bhat ZA,等。黄芩的抗高血糖活性。豆类对四氧嘧啶诱导的糖尿病大鼠血糖水平的影响。制药医学杂志。2006;44:10-3。
- 18。
黄菖蒲果实和香附的气相色谱-质谱分析。国际药典杂志2011;3:102-6。
- 19。
Tanwar UK, Pruthi V, Randhawa GS。瓜尔(Cyamopsis tetragonoloba, L. Taub.)叶片rna序列:从头转录组组装、功能注释和基因组资源开发。前面。植物科学。2017;8:91 - 105。
- 20。
绿色系统生物学-从单基因组、蛋白质组和代谢组到生态系统研究和生物技术。J蛋白质组。2011;75:284 - 305。
- 21。
Tugizimana F,Pialter L,Dubery I.植物代谢组学:一种在植物化学分析中的新前沿。S AFR J SCI。2013; 109:01-11。
- 22.
生态代谢组学研究进展与展望。Chemoecology。2011;21:191 - 225。
- 23.
Park S,SEO YS,Hegeman广告。气候变化,植物化学响应植物化学响应的植物化学响应。熟植物生物。2014; 57:137-49。
- 24.
环境代谢组学:一个批判性的回顾和未来的展望。代谢组学。2009;5:3-21。
- 25.
等。植物环境生理学中的代谢组学。J Exp Bot. 2013; 64:4011-20。
- 26.
刘志强,刘志强,刘志强,等。电喷雾质谱分析未分离植物提取物的化学鉴别。植物化学,2003;62:859 - 63。
- 27.
Teplyakova SB, Shavarda AL, Shelenga TV等。瓜尔叶中极性代谢物的提取方法Cyamopsis tetragonoloba(L.)托布。)for GC-MS metabolome analysis. Vavilovskii Zhurnal Genetiki i Selektsii. 2019;23:49–54.
- 28。
Fridman E,Carrari F,Liu Ys等。使用三种间隙突出来放大番茄产量的定量性状。科学。2004; 305:1786-9。
- 29。
Valluru R,范登恩德W.肌醇和压力下超越新兴网络。植物SCI。2011; 181:387-400。
- 30。
欧文·RF,谢尔·乔丹。回到水中:肌醇磷酸盐的回归。《细胞生物学》2001;2:327-38。
- 31。
abid g,silue s,muhovski y等。肌醇磷酸盐合成酶和蔗糖合成酶基因在植物种子发育中的作用。基因。2009; 439:1-10。
- 32。
Pathak R. clusterbean:生理学。遗传和栽培弹簧。2015年。https://doi.org/10.1007/978-287-907-3.
- 33。
Adinarayana D, Ramachandraiah P, Rao K.豆科(豆科)链蕨属某些种黄酮谱。Experientia。1985;41:251-2。
- 34.
王志强,王志强,王志强,等。黄酮类化合物分离苜蓿夜蛾罗德(豆科):其生态和化学系统意义。Caryologia。2010;63:106-14。
- 35.
李志刚,李志刚,李志刚,等。甘草素是一种植物源的高选择性雌激素受体β激动剂。中国生物医学工程学报2008;
- 36.
龚H,张B,闫M等。甘草保护机制(甘草毒素铀虫):Isoliquiritigenin刺激通过NRF2活化的排毒系统。J属植物。2015; 162:134-9。
- 37.
Brunetti C,Di Ferdinando M,Fini A等。黄酮类化合物作为抗氧化剂和发育调节因子:植物和人类的相对意义。int j mol sci。2013; 14:3540-55。
- 38.
Kliebenstein DJ,Kroymann J,Brown P等人。拟南芥葡萄糖苷积累的自然变化的遗传控制。植物理性。2001; 126:811-25。
- 39.
王志强,王志强,王志强,等。植物新陈代谢的遗传学Nat麝猫。2006;38:862-9。
- 40.
张志强,张志强,张志强,等。番茄种间渐渗系改良的综合代谢谱和表型分析。生物科技本质》。2006;24:447-54。
- 41.
Macel M,Van Dam Nm,Keurentjes JJ。代谢组学:生态与遗传学之间的化学。Mol Ecol Resour。2010; 10:583-93。
- 42。
Keurentjes JJ,Sulpice R,Gibon Y等。原发性碳水化合物代谢酶活性遗传变异的综合分析揭示了明显的调节模式拟南芥蒂利亚纳.基因组Biol。2008; 9:R129.1-20。
- 43。
王志强,王志强,王志强,等。淀粉是调节植物生长的主要分子。美国国家科学学院学报2009;106:10348-53。
- 44。
Jorge TF,Mata At,AntónioC.质谱作为植物代谢组学中的定量工具。Philos Trans A Math Phyen Eng SCI。2016; 374:20150370。
- 45。
张志强,李春华,李春华,等。MetaboAnalyst 4.0:迈向更透明、更整合的代谢组学分析。核酸Res. 2018;46: W486-94。
- 46.
王志强,王志强,王志强,等。基于GC/ tof - ms的代谢组学数据可视化,使用OPLS类模型鉴定生物化学有趣的化合物。肛门化学2008;80:115-22。
致谢
我们感谢Elena Dzyubenko博士(VIR, St. Petersburg)在瓜尔种子繁殖技术开发方面的帮助,感谢Tatyana Shelenga博士(VIR, St. Petersburg)在气相色谱技术方面的帮助。
关于这个补充
本文已作为BMC Plant Biology Volume 20 Supplement 1, 2020: Selected articles from the 5th International Scientific Conference“Plant genetics, genomics, bioinformatics, and biotechnology”(PlantGen2019)的一部分发表。该补充的全部内容可在网上找到//www.cinefiend.com/articles/supplements/volume-20- supplement-1..
资金
本研究和论文发表得到了俄罗斯基础研究基金会(no . 17 - 29-08027- offi -m)的资助。GC-MS分析使用圣彼得堡国立大学科学园“分子和细胞技术开发”资源中心的设备进行。资助机构没有参与研究的设计、数据收集、分析和数据解释以及手稿的编写。
作者信息
隶属关系
贡献
SA进行了实验和数据分析。AS监督下的代谢组分析和代谢物鉴定。EP设计研究并撰写手稿。所有作者阅读并批准了最终的手稿。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者声明没有竞争利益。
额外的信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
本文已更新。原始出版物包含错误的历史日期。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。如欲查阅本许可证副本,请浏览http://creativecommons.org/licenses/by/4.0/.创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Arkhimandritova,S.,Shavarda,A.&Potokina,E.与瓜尔基因型开花的开始关键代谢物(Cyamopsis tetragonoloba(L.)Taub)。BMC植物BIOL.20,291(2020)。https://doi.org/10.1186/s12870-020-02498-x
收到:
接受:
发表:
关键字
- GC-MS-analysis
- 代谢组学
- 开花的时间
- 瓜尔
- Cyamopsis tetragonoloba(L.)托布。
- 生物标记物