摘要
背景
组织培养快繁技术是解决植物繁殖困难的重要途径。该实验的目的是红槭的组织培养过程的每个阶段,探索适当的条件和获得的小植株,从而提供为建立红槭的组织培养系统的理论基础。
结果
结果表明,茎段是诱导胚癌的最合适的外植体。The MS (Murashige&Skoog) + 0.8 mg/L TDZ (Thidiazuron) + 1.0 mg/L 6-BA (6-Benzylaminopurine) + 0.5 mg/L IAA(Indole-3-acetic acid) + 35 g/L sucrose+ 7.5 g/L semi-fixed medium was the best for callus formation. When selecting type VI callus as embryonic callus induction material, MS + 0.6 mg/L TDZ + 0.5 mg/L 6-BA + 2.0 mg/L IAA + 35 g/L sucrose+ 7.5 g/L semi-fixed medium can get embryonic callus. The optimal medium for adventitious bud induction is MS + 1.0 mg/L TDZ + 3.0 mg/L 6-BA+ 0.2 mg/L NAA (1-Naphthaleneacetic acid) + 1.2 mg/L IAA + 35 g/L sucrose+ 7.5 g/L semi-fixed medium. The induction rate of adventitious roots in MS + 0.6 mg/L TDZ + 1.0 mg/L 6-BA+ 3 mg/L NAA + 35 g/L sucrose+ 7.5 g/L semi-fixed medium was the highest, reaching 76%.
结论
在我们的研究过程中,我们发现PGRs在愈伤组织诱导阶段起着重要的作用,其中TDZ的作用尤为明显;根据“S”生长曲线,愈伤组织细胞生长和增殖,并且当达到最高的生长点以维持愈伤组织细胞的快速增殖并避免由紧密的利基引起的愈伤组织灭活时,可以亚培养。
背景
园林绿化行业被公认为“永恒的朝阳产业”。红枫作为一种理想的彩叶树种,市场前景广阔,是中国现代景观设计规划中最受欢迎的树种之一[1].然而,由于环境因素的影响,彩叶树种的引种往往伴随着叶色不稳定和后代性状变异的问题。
2011年引进中国,十月荣耀(宏碁石L.,红枫),原产于美国东北部,是一个很好的品种,由于它的美丽,落叶缤纷,湿性,耐寒性,耐旱性[2那3.],生态特征[4.那5.],并适应各种土壤类型的广泛能力。驯化和培育红枫后,我们选择了这个品种,因为它很好地适应在中国西南地区(尤其是芽突变,我们选择),并具有稳定叶色沿快速增长的气候条件。然而,它的低种子成熟率和其后代的不稳定叶色性状使其以促进通过种子繁殖种植困难。使用切屑和其它营养繁殖方法是通过材料的季节和数量的限制。此外,也很难满足由小规模扦插繁殖大量生产的要求。因此,它的现实意义,建立红枫的快速繁殖系统。
植物转化再生系统主要取决于能否形成成熟的胚胎细胞[6.].因此,胚愈伤组织的形成,成为最重要的环节。外植体,渗透压,植物生长调节剂(PGR),环境条件的类型,这些因素在胚性愈伤组织的形成和成熟发挥重要作用[7.那8.那9.].其中,介质和植物生长调节剂之间的相互作用是建立胚胎细胞的[基础10.那11.]. 当PGR刺激外植体和愈伤组织时,内部内源激素产生反馈[12.],诱导愈伤组织形成胚胎愈伤组织[13.那14.].在许多情况下,生长素和细胞分裂素的特定组合和比例可以有效地诱导胚胎愈伤组织或器官的定向分化[15.那16.].体细胞胚胎发生技术在制备人造种子和园林植物的遗传改善方面发挥着重要作用。该技术已被广泛应用于园林植物的繁殖,这些植物繁殖缓慢或具有繁殖问题,对稀有植物的繁殖和保护具有重要意义[17.那18.].目前,组织培养和红槭的快速繁殖系统仍然被完善,但没有关于红槭的胚胎愈伤组织和不定器官形成报告。
为了提供生产提供了理论依据和技术支持宏碁石本实验在胚发生和植株再生过程中,探讨培养基和植物生长调节物质对愈伤组织诱导的影响,并筛选出不同时期适宜的培养基配方。
结果
愈伤组织诱导
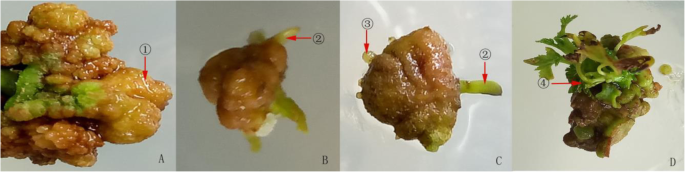
在愈伤组织诱导的期间,由不同类型的外植体诱导的愈伤组织显示出显著差异。随着新发芽枝杈(发芽后大约15 d,而不会芽)作为外植体和初始25-d培养后,有相当大的外植体(图2的切口肿胀。1b).当枝条(萌发后约15 d,带芽)作为外植体培养25 d时,形成各种类型愈伤组织的混合物(图。1C)。然而,将愈伤组织传播相对慢于当硬分支(在同一年的月收集到的弹簧出芽分支)取为外植体和25D(图培养的枝条。1a) 。当嫩叶作为外植体在最初培养到第7天时,叶片边缘开始出现红棕色、黄色、松散和绿色的愈伤组织。培养25天后,叶片开始从边缘卷曲到叶柄,形成多个疏松的愈伤组织(图。1d).继代后叶片被大量愈伤组织覆盖,愈伤组织多呈红褐色、绿色、黄色卷曲。与细枝和硬枝相比,早期叶片愈伤组织诱导较慢,愈伤组织多呈颗粒状、疏松状。但后期叶片愈伤组织增殖速度显著快于细枝和硬枝,愈伤组织状态较前期松弛。
有10种外植体愈伤组织类型的这个阶段。I型愈伤组织(由图中的箭头所示。1a, I)为白色疏松的愈伤组织,外植体诱导在皮孔上连续转移时易碎。愈伤组织可以直接诱导不定根期的发生。II型愈伤组织(图中箭头所示)。1a, II)在坚硬的树枝上似乎长得更长,在水的损害下呈淡黄色半透明。经过几代后,愈伤组织变成褐色并死亡。镜下细胞数量少,形态不规则,呈高度空泡状。III型愈伤组织(图中箭头所示)。1B,III)出现在茎段和有黄色,球形,紧凑的形状,具有快速繁殖率。IV型愈伤组织(由图中的箭头所示。1B,IV)出现在树枝茎段和呈黄绿色和球状,乘以更快,容易形成胚性愈伤组织。V型愈伤组织(由图中的箭头所示。1c, V)为绿色,呈球形,形状紧凑。连续移植后,愈伤组织出现类似的类型,外部白色,内部淡黄。VI型愈伤组织(图中箭头所示)。1C,VI)是瓶绿和球状,具有最快的147繁殖率,其后来的形式不易改变。在显微镜检查中,细胞较大,椭圆形,具有致密细胞质,其在胚胎和非胚胎细胞之间。VII型愈伤组织(由图1中的箭头表示。1C,VII)为淡黄色松动。继代培养后,这种类型的褐色和死亡。类型VIII愈伤组织(由图中的箭头所示。1C,VIII)是一个松散状态乳白色亚麻色和更在愈伤组织形成的边缘。继代培养后,繁殖速度慢,容易排出。类型IX的愈伤组织(由图中的箭头所示。1d,IX形成)在叶片外植体并具有绿色的水损坏,其愈伤组织细胞容易死亡。X型愈伤组织(由图中的箭头所示。1d,形成X)在叶片外植体,是一个绿色的,致密颗粒,并且它是红褐色的愈伤组织,虽然,有时,它没有诱导胚性愈伤组织的形成。
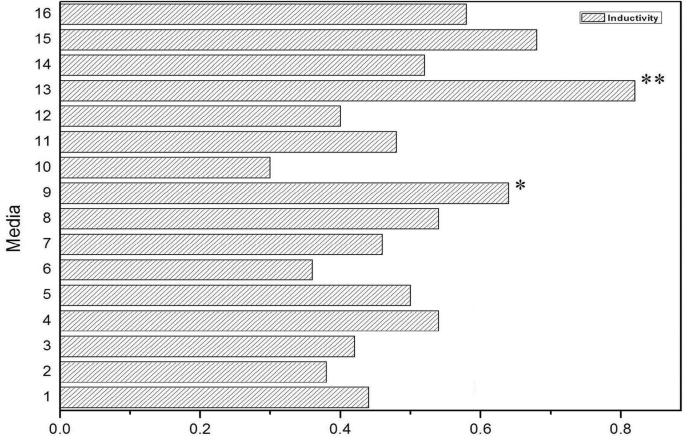
在诱导初期,外植体打破了正常的繁殖模式,建立了新的适应机制。大量实验表明,这种机制与外植体类型、培养基类型、PGR类型及含量密切相关。正交试验结果表明,MS + 0.8 mg/L TDZ + 1.0 mg/L 6-BA + 0.5 mg/L IAA培养基的愈伤组织诱导率最高,高达82%(图1)。2).培养条件对愈伤组织诱导的影响为TDZ >培养基> IAA > 6-BA,P. = 0.049) and TDZ (P. = 0.037) had significant effects on callus induction (P.< 0.05),而6-BA (P. = 0.17) and IAA (P. = 0.338) had no significant effect (P.> 0.05)。
体细胞胚诱导和体细胞胚
在胚性愈伤组织诱导的过程中,VI型愈伤组织具有更快的再现速率和良好的生长被选定为胚性愈伤组织诱导材料。一个56-d培养后,将愈伤组织逐渐变为白色的体细胞胚(图3.d)。在早期阶段,表面胚胎细胞增加,但增殖率相对较慢(图3.a - b)。继代培养5周后,将愈伤组织转移到不含PGR的培养基上。显微镜检查显示细胞小而椭圆形,细胞质致密,具有典型的胚胎细胞特征(图。3.C)。此过程将在PGR调节实现,而胚胎发生由胚发生前的质量(PEM),其可以指示PEM形成是外植体,PGR的正常反应。虽然这是难以直接或间接的体细胞胚胎发生严格区分,胚胎发生是保证经历体细胞胚形成,当PEM的不断发展,并形成一个不确定的器官(图3.D).在本研究中,体细胞胚来源于球形组织块,该球形组织胚是等价卵裂多态性,形成图中所示的多柱胚胎细胞胚现象。3.D.与体胚不同,分生组织可以独立定向形成根或茎(也会从分生组织中生长),体胚几乎无一例外地生长在愈伤组织的表面,很容易与周围的细胞分离。
当愈伤组织长期没有亚培养时,它的表面逐渐变为深褐色。此时,胚胎源性愈伤组织细胞消失,并且愈伤组织几乎死亡,从外部发生在外部(图。3.一种)。After the callus was cut, fit the longitudinal section to the surface of the MS + 2.0 mg/L TDZ + 1.0 mg/L 6-BA + 0.5 mg/L NAA + 35 g/L sucrose + 7.5 g/L AGAR semi-fixed medium for subculture. After a 25-d culture, the brown explants turned green (Fig.3.b).当重新激活的愈伤组织进一步培养时,我们发现原来的愈合表面呈白色,有绿色和棕色愈合(图。3.b)。When this callus continued to be inoculated in the embryonic induction medium of MS + 0.6 mg/L TDZ + 0.5 mg/L 6-BA + 2.0 mg/L IAA + 35 g/L sucrose + 7.5 g/L AGAR semi-fixed culture medium, the callus gradually changed to a green dense globule (Fig.3.C)。对愈伤组织的表面上,发现了一些细胞具有胚胎细胞的性状(图3.d)。
不定芽诱导
切取成熟胚性愈伤组织,接种到不定芽诱导培养基中,逐渐形成绿色不定芽。4.一种)。亚培育后,胚胎愈伤组织开始膨胀,而不定芽伸长(图。4.b).连续培养30天后,不定芽开始展开(图2)。4.c).在40 d时,茎的枝条清晰可见(图。4.d)。
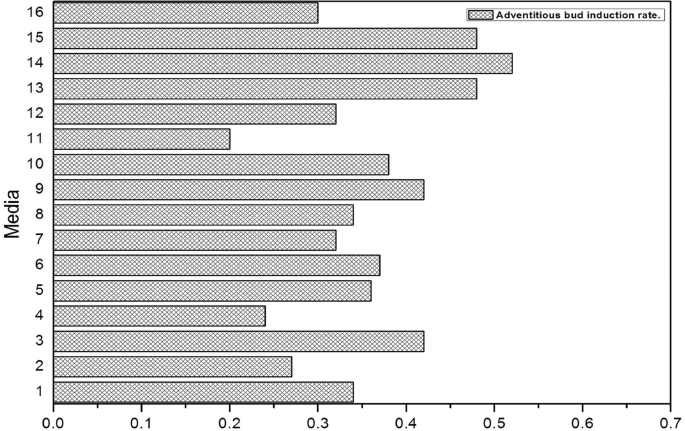
很难区分内部胚胎细胞和非胚胎细胞。然而,胚胎细胞定向发育与体外培养环境密切相关,可以通过改变体外培养条件,尤其是PGR来实现。正交试验结果表明,当外源生长调节剂为1.0 毫克/升TDZ + 3 mg/L 6-BA+ 0.2 毫克/升萘乙酸 + 1.2 IAA浓度为mg/L时,不定芽诱导率最高(图。4.),达到52%(图。5.).The effect of different PGRs on adventitious bud induction rates was different, and the PGR influence sequence was 6-BA > IAA > TDZ > NAA. Moreover, 6-BA (P. = 0.022), IAA (P.= 0.027) and TDZ (P.= 0.046)对愈伤组织诱导的影响最为显著,NAA (P.= 0.0678),差异无统计学意义。
不定根诱导
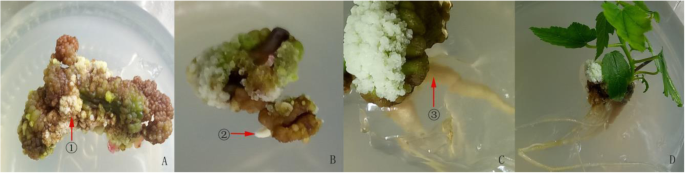
根的诱导是在红枫的快速繁殖成功的最后关键环节和不定根的厚度和数量影响后续的驯化和移植的存活率。当胚性愈伤组织类型VI和胚性愈伤组织用不定芽接种不定根诱导培养基上和15 d培养,绿色胚性愈伤组织逐渐变白和产生许多不定根(图6.c).培养20 d后,带芽胚愈伤组织的不定根萌发,植株叶片增加(图2)。6.d)。
胚愈伤组织的不定根诱导一种:在不定根诱导培养基中培养VI型愈伤组织23 d后,将胚性愈伤组织逐渐成为白色松散的和形成许多不定根。B.:连续培养60 d后,无不定芽的胚愈伤组织不定根大量萌发。C:After the callus that had been differentiated to form adventitious buds was cultured for 25 days, the green embryonic callus gradually changed to white, and a large number of adventitious roots were generated on it.D.: 20 d后不定根和叶片数量增加
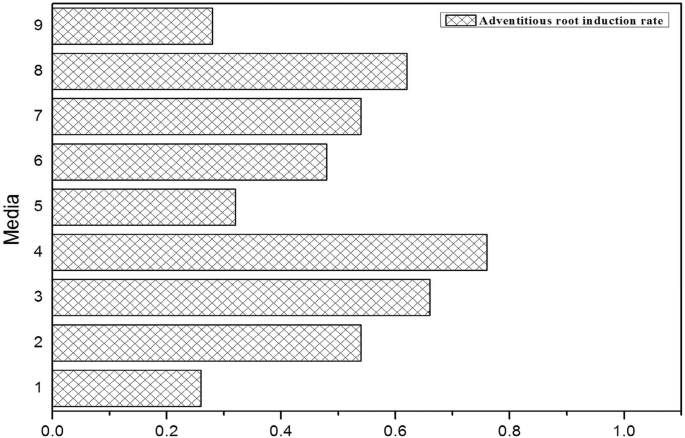
该研究发现,可以直接从茎中诱导不定根,并且也可以通过胚呼应诱导(图。6.).正交实验表明,诱导率高达76%。7.)那when the MS + 0.6 mg/L TDZ + 1.0 mg/L 6-BA + 3 mg/L NAA + 35 g/L sucrose + 7.5 g/L AGAR semi-fixed medium were used. Moreover, with an increase in the NAA concentration, the induction rate of adventitious roots increased. The main effect of NAA on the induction of the adventitious roots process was the most significant (P.= 0.023),而6-BA (P.= 0.442)和TDZ (P.= 0.816)对不定根过程无显著影响。
对试管苗成活率的不同的训练方法效果
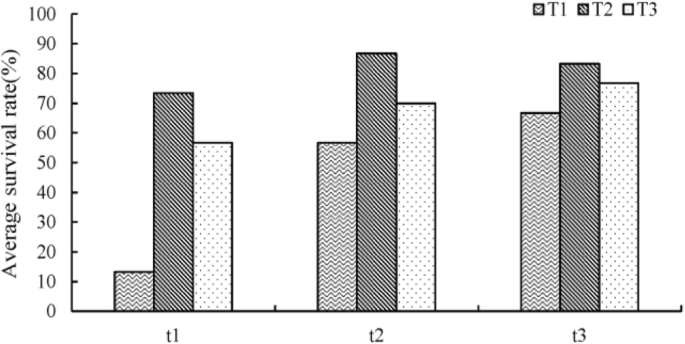
9个处理中,T2t2组(即封闭瓶培养6 d和开放瓶培养2 d组)的存活率最高,达到86.7%(图2)。8.).移栽苗的成活率随关瓶时间的增加呈先增后减的趋势。
不同基质对移栽苗成活率的影响
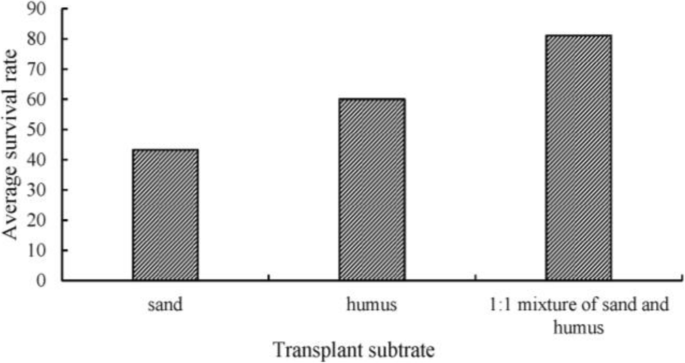
以T2t2组植株为实验材料。不同基质处理的苗成活率差异显著,其中沙与腐殖质1:1混合处理的苗平均成活率最高,达到81.1%(图1)。9.).
讨论
植物生长调节剂的在愈伤组织诱导阶段中的效果
植物中自然存在内源激素;低浓度的这些化合物控制着细胞分裂和伸长的整个过程[19.].激素在建立和维持植物极性方面也起着重要的作用[20.]中,最显着的,其中是顶端优势的维护。在这项研究中,我们探讨愈伤组织诱导和红枫的胚胎再生。在诱导和传播的早期阶段中,外植体和愈伤组织更依赖于植物生长调节剂,尤其是细胞分裂素TDZ。如细胞分裂素TDZ是在一个部位上,如叶,树皮,进化将要针对单一氨基酸活性库中的处理单元。周边氨基酸被转移到库中,从而促进RNA和蛋白质的合成和提高某些酶的活性[21.那22.].这也解释了本实验中出现的现象:在培养基中加入细胞分裂素,特别是TDZ,抑制了有芽茎段的顶端优势,侧芽萌发成单茎分枝,促进了愈伤组织细胞的增殖。在组织培养(以及完整的植物和植物器官)中,细胞分裂素也可以缩短细胞分裂中期,从而加速细胞分裂和增殖[23.]. 因此,PGR在愈伤组织的诱导和繁殖中起着重要的作用。
体细胞胚的再生
当非胚胎细胞经过多次分裂突变时,一些胚胎细胞可以逐渐形成。如果存在次级胚胎愈伤组织诱导培养基,胚胎愈伤组织可以继续形成。相反,如果在同一培养基上培养,胚胎细胞最终将被非胚胎细胞覆盖,导致胚胎愈伤组织消失。连续几代的愈伤组织退化现象说明了这一结果。在本实验中,我们发现,当培养基在组织培养的早期阶段为整个生命周期提供足够的营养时,胚胎细胞开始增殖并分化为不定器官。如果这种供应持续下去,细胞数量将在“S”型生长曲线中成倍增加,但随着细胞的产生和培养基中营养物质的消耗,供应将继续减少,细胞将开始向相反方向发展,即发展为非胚胎细胞。这是由于培养基空间环境和养分供应的限制[24.].因此,当“S”曲线达到最高点后,细胞增殖速率将继续下降,细胞种群的生态位将急剧收缩。即使已经形成的胚胎细胞也不再具有生存优势[25.].然后,蜂窝自我保护机制被激活[26.],和非胚胎细胞将覆盖细胞群体。因此,可以认为,细胞繁殖将继续通过连续几代达到“S”曲线的最高点之前进行。通过这种方式,细胞的增殖持续可以通过新的培养基的营养来维持。
这个解释来源于“竞争”[27.],它是细胞胚胎的消失。多细胞分裂后,如果媒体不能提供足够的能量来维持胚胎细胞的正常分裂,细胞将恢复到保存自己最好的状态,即,非胚胎干细胞的状态。我们称这为“细胞的发展滞后。当有恶化的环境[这种自我保护机制,将有利于细胞的生命周期28.].如果环境再次改变到合适的条件下,胚胎干细胞将被再次激活,并在适当的条件下发育成新的植株。
本研究探讨这个褐变愈伤组织的激活过程。结果表明,在30天的培养,而不更新介质的过程中,骨痂生长开始放缓的第18天。培养24 d后,白色和绿色的愈伤组织逐渐变成褐色。40 d的培养后,将愈伤组织主要是棕色的。棕色愈伤组织传代培养,在新培养基后,绿色和白色的愈伤组织逐渐从原始外植体在20d中形成,并且该时间与所述植体的初始诱导时间相比被延迟显著。这项研究还发现,叶诱导愈伤组织通常是松散和浅黄,而枯枝和分支机构的主要是白色和绿色,和前需要更多的时间形成。该结果表明,外植体的愈伤组织形成之前第一打破原有的传播模式。用枝条和枝叶相比,叶片具有较高的专业化处理,因此它们的原始传播模式更难以突破。
不定器官的形成
通常,在植物的每个正常细胞具有全能性发育成完整的植株,但只有在最好的环境。在适当的培养基,老茧可以保持长期熟悉刺激和再生茎枝,如水稻愈伤组织在2%蔗糖和3%甘露醇介质中,并能保持它们的根和胚胎愈伤组织形成树皮很长时间[29.]. 激素作为诱导胚性愈伤组织最有效的因子,在不同的激素组合和比例以及与其他因子的相互作用下,可以发挥不同的作用。脱落酸(ABA)是组织培养中常用的生长抑制剂,在某些植物的组织培养中能显著促进胚胎细胞的成熟和萌发[30.]培养基中添加ABA能有效促进胚胎细胞营养物质的合成和积累[31.].在山楂组织培养中,只有添加ABA才能获得正常分化的胚细胞[32.]; 对于波斯核桃,ABA促进体细胞胚的成熟和萌发以及芽和根的生长[33.那34.那35.].当ABA与其他激素或其他因素相结合时,植物转换率可以显着改善[36.].不定器官的形成需要生长素和细胞分裂素的组合,我们的结果表明,当NAA的到TDZ的比率是大于3:1,芽诱导机制被激活。不定芽的形成比不定根的更为复杂。然而,当比率提高到5:1,不定芽诱导率开始下降。这个结果可以通过生长素的极性运输造成的。如果愈伤组织在这一类中的培养,就会导致胚胎细胞的死亡[37.].在低浓度到高浓度的过程中,其增强效果不断增强。然而,当达到一定阈值时,较高浓度的生长素也表现出抑制作用[38.],因为大多数生长素具有钟形活性曲线的生理效应[39.].在本研究中,生长素NAA被红枫有效吸收,尤其是在4 mg/L时,其根诱导率高达90%。在含NAA的培养基中愈伤组织增殖缓慢,但添加NAA可诱导不定根的形成。叶片愈伤组织在胚愈伤组织阶段诱导不定根是必要的。在本实验中,外植体的生根率大于愈伤组织的生根率。随着NAA浓度的增加,茎诱导的愈伤组织明显停滞。叶片作为高度分化的器官,不能直接进入生根状态,逐渐变干。因此,从高度发达的植物器官诱导形成不定根的过程中,较难打破其固有的繁殖机制。
结论
在这项研究中,我们筛选了胚胎愈伤组织诱导的最合适的愈伤组织类型,并在各种阶段选择合适的培养基配方,包括愈伤组织诱导,体细胞胚胎诱导和体细胞胚胎发生,不定芽和不定根诱导。在我们的研究过程中,我们发现PGRs在愈伤组织诱导阶段起着重要的作用,其中TDZ的作用尤为明显;根据“S”生长曲线,愈伤组织细胞生长和增殖,并且当达到最高的生长点以维持愈伤组织细胞的快速增殖并避免由紧密的利基引起的愈伤组织灭活时,可以亚培养。
方法
植物来源的
植物材料取自西南大学林业试验基地,由刘玉民副教授正式鉴定。植物(西南大学沉积号SWU-OG-03)保存在基地(不是凭单标本,而是整株活植物),经刘副教授许可可获得。
试验材料的处理和培训条件
本实验选用嫩叶、发芽后15 d左右的有芽小枝、无芽小枝和硬枝(同年10月采集的春芽小枝)4种材料作为外植体。首先,用自来水冲洗外植体5分钟,然后将外植体加入500ml烧杯中。然后将外植体在洗涤剂水中浸泡5分钟,用毛刷清洗,去除表面污渍。然后用自来水冲洗20分钟,切成1 - 2cm的切片,移至无菌柜台。用小水流将叶子冲洗干净,在冲洗表面时将所有受伤和褐变的叶子丢弃。预处理后的外植体在无菌手术台上用75%酒精消毒30 s,用0.1% HgCl处理28分钟。材料用无菌水冲洗6次,切除切割部位。实验所用培养基(PH5.8-6.0)在121℃下灭菌20 min;激素过滤灭菌。采用AD7000数码相机(尼康株式会社,日本东京),手动设定(F = 4.5,快门320 s, iso = 500),定期拍摄愈伤组织,观察并记录其变化。
愈伤组织的诱导
采用正交试验设计,培养基为DKW、N6、MS、/ WPM,添加生长调节剂IAA(0.5、1.0、1.5、2.0 mg/L)、6-BA(0.5、1.0、1.5、2.0 mg/L)和TDZ(0.2、0.4、0.6、0.8 mg/L),共16个处理。2).每组用5〜6个外植体的10瓶处理。The culture bottles were placed in an artificial climate box (RGX-250) and cultured under conditions of humidity 75%, 25 °C, 14 h of light (1500 lx) and 10 h of darkness. The changes of explants were observed and recorded every 2 days.
胚愈伤组织诱导和体细胞胚发生
在愈伤组织诱导和增殖阶段,MS + 0.6 mg / L TDZ + 0.5 mg / L 6-BA + 2.0 mg / L IAA + 35 g / L蔗糖+ 7.5 g / L琼脂半固定有效培养基诱导体细胞胚的形成,以及体细胞胚诱导率高达41每克。根据上述结果,在pH = 5.8的培养基中,选择浅黄色和白色的疏松愈伤组织诱导体胚形成。5周后,将体胚转移到无生长调节物质的MS培养基中培养至胚成熟。培养条件为:湿度85%,(25 + 2)°C,光照16 h (1500 lx),黑暗8 h。在培养过程中,每2天观察并记录一次愈伤组织和体细胞胚的变化。
诱导和不定芽萌发
以胚性愈伤组织为实验材料,采用TDZ(0.5,1.0,1.5,2.0)正交试验设计,获得不定芽 mg/L),6-BA(1.0,2.0,2.5,3.0 NAA(0,0.1,0.2,0.5 mg/L)和IAA(0.6,0.8,1.0,1.2 mg/L),共16次处理(图。5.).Culture conditions were 85% humidity, (25 + 2) °C, 18 h of light (3000 lx) and 2 h of darkness (20 h cycle). During the culture, the changes of callus and the germination of adventitious bud were observed and recorded once every 2 days.
不定根的诱导和发芽
基于上述试验结果,将获得的胚愈伤组织和带芽胚愈伤组织作为不定根诱导的实验材料。采用正交试验设计NAA(1.0、2.0、3.0 mg/L)、6-BA(0.5、1.0、2.0 mg/L)和TDZ(0.6、0.8、1 mg/L),共9个处理(图1)。5.).Culture conditions were 85% humidity, (25 + 2) °C, 12 h of light (1500 lx) and 12 h of darkness. During the culture, the changes of callus and the germination of adventitious root were observed and recorded once every 2 days.
培训植物
植株后搬到育婴室室温20°C,他们首先培养在封闭的玻璃瓶T1 = 3 d, T2 = 6, T3 = 12 d分别,然后继续培养的盖子被打开T1 = 1 d, T2 = 2 d, T3 = 3 d,共有9治疗,30植株/治疗。培养后移栽,移栽30天后统计成活率。
移栽基质筛选
The plantlets obtained from the best training method were transplanted into sand, humus soil, and a 1:1 mixture of sand and humus respectively, and the survival rate was counted 30 days after transplanting.
数据统计与分析
愈伤组织诱导率(%)=愈伤组织/外植体数量× 100%。
体胚诱导率(%)=体胚数/愈伤组织质量× 100%。
The adventitious bud germination rate (%) = the number of adventitious bud/ the total number of callus × 100%.
不定根发芽率(%)=不定根数/愈伤组织总数× 100%。
The average survival rate (%) = the number of viable plantlets/ the total number of plantlets × 100%.
采用SPSS 20.0版本进行数据分析,多重比较采用Duncan 's new multiple range test。
可用性数据和材料
用于支持本研究结果的数据可根据要求可从相应的作者获得。
缩写
- 2,4 - d:
-
2,现在也是酸
- 6-BA:
-
6-苄氨基嘌呤
- 阿坝:
-
脱落酸
- DKW:
-
驱动程序和国之核桃中
- 国际宇航科学院:
-
吲哚-3-乙酸
- IBA:
-
吲哚-3- Butytric酸
- 女士:
-
的Murashige和斯库格
- N6:
-
楚的N-6培养基
- NAA:
-
1-萘乙酸
- PGRS:
-
植物生长调节剂
- TDZ:
-
噻苯隆
- WPM:
-
木本植物中
参考文献
- 1。
李啊,他,yu c,等。美国红枫“白兰地”组织文化与快速繁殖技术。J西南正常的大学(自然科学版)。2014; 39(8):36-42。
- 2。
Townsend AM, Dochinger LS。种子来源和发育阶段与红槭幼苗耐臭氧性的关系。大气压环境。1974;8(9):957 - 64。
- 3。
Schaub的男,斯凯利JM,斯坦纳KC等人。李酸橙木,白蜡,和宏碁癣菌幼苗的生理叶损伤反应不同土壤湿度和臭氧。环境污染。2003; 124(2):307-20。
- 4。
艾布拉姆斯MD,ME Kubiske。光合作用和干旱的对比在宾夕法尼亚州中部的网站宏基癣菌属基因型中水的关系。功能该ECOL。1990; 4(6):727-33。
- 5。
李莉,刘玉明,王敏,等。三种生理反应机制宏碁石在持续高温和干旱胁迫下生长。生态学报,2014;34(22):6471-80。
- 6。
Onay A,Yildirim H,Tokatli Yo等人。植物组织培养技术 - 在植物微扫描中的工具。CurrOgin Biotechnol。2011; 22(5):S130。
- 7。
阿萨德H。Lotfi M和Vahdati K甜瓜胚性悬浮培养的开发。戏剧。2010;871:553–8.
- 8.
巴赫拉米SH,碳水化合物源和聚乙二醇上成熟和体细胞胚的萌发核桃Vahdati K.影响(juglans regia.l .)。Acta Hortic。2009;839:165 - 72。
- 9.
谢赫BGMA,Vahdati K,巴赫拉米SH,Kalantari K,莱斯利CA.成熟和波斯语核桃(胡桃L.)的体细胞胚用osmolites,激素和冷处理的发芽的增强。AFRĴ食品科学。2010; 4:735-43。
- 10。
Skoog F,Miller Co。在体外培养的植物组织中生长和器官形成的化学调节。Symp Soc Exp Biol。1957; 11(21):118。
- 11.
王QM,Wang L.植物组织培养的进化视图:躯体变异和选择。植物细胞代表2012; 31(9):1535-47。
- 12.
黄宗泽DD,SINSKI我,Ritschel PS等。在植物组织培养中的玻璃器皿2,4-二氯苯氧乙酸的残基:它们的效果和去污协议。诠释J生物技术生物化学。2010; 6(4):617。
- 13。
FrimlĴ,Vieten A,绍尔M等人。流出依赖性生长素梯度建立拟南芥的顶端 - 基底轴。自然。2003; 426(6963):147-53。
- 14。
Benishelkh AAG,Tijani Y,Askira NK等。患病率和实验室微生物污染物的管理在植物组织培养。ANAT REC。2015; 127(3):551-67。
- 15.
马拉巴坚果的体外生物技术进展(阿德托多达·瓦西卡孢):成就,现状和前景。Ĵ遗传学工程生物技术。2018年。https://doi.org/10.1016/j.jgeb.2018.03.007。
- 16。
Mazri Ma,Meziani R,Belkoura I,等。有机组合作用和体细胞胚胎发生的组合途径,以枣棕榈的有效大规模传播(Phoenix Dactyliferal .)简历。3生物技术。2018;8(4):215。
- 17。
渡边一世,藤原一世。植物组织培养容器环境的基础研究:(1)培养基组成与液体培养基水势的关系。农业气象杂志。1986;42:1–6.
- 18。
莫拉迪S,DS Dianati阿拉伯男,在火烧兰属veratrifolia Vahdati K.直接胚胎,温带陆地兰花。ĴHortic科学生物技术。2017; 92(1):88-97。
- 19.
Huetteman CA,普里斯JE。噻苯隆:对木本植物组织培养一个强有力的细胞分裂素。植物细胞组织器官培养。1993; 33(2):105-19。
- 20.
Gahan PB。全能和细胞周期。在:jain sm,häggmanh,编辑。木质树木和水果微耕作的协议。DONDRECHT:SPRINGER;2007. p。3-14。
- 21.
帕斯捷尔纳克T,Miskolczi P,Ayaydin F等。外源生长素和细胞分裂素在苜蓿叶原生质体来源的细胞的CDK和细胞分裂的依赖性活化。植物生长调节。2000; 32(2-3):129-41。
- 22。
亨特C,孙H,Poethig RS。拟南芥,异时性基因ZIPPY,是ARGONAUTE,家庭成员。Curr Biol。2003; 13(19):1734。
- 23。
Jouanneau JP。革新protéines和spécifique de la kinétine关于Tabac细胞培养。杂志。1970;23(2):232 - 44。
- 24。
王志强,王志强,王志强,等。植物体外培养体系的研究进展。荷兰:施普林格;2005.
- 25。
Kallendrusch S,梅尔茨楼Bechmann我,等人。成人脑和脾切片中的纳米结构支架的长期组织培养。adv医疗母体。2017年。https://doi.org/10.1002/adhm.201601336。
- 26。
甘巴拉里,阿卜杜拉希等。马铃薯(Solanum tuberosum)小芽腋芽包埋生产人工种子的条件优化。植物学报。2016;126(3):1-10。
- 27。
赖纳特Ĵ,后背在植物细胞在体外生长D.全能性的控制。自然。1968; 220(5174):1340-1。
- 28。
李建民,朱元元。植物组织培养。3版。北京:中国农业大学出版社;2005.
- 29。
基肖尔PBK,雷迪GM。来自稻的长期培养物再生植物的,属植物细胞报告,1986; 5(5):391。
- 30
方HY,朱H,姚JX等。药用植物的脱落酸和组织培养。中国Ĵ钦本草医学。2013; 38(01):14-8。
- 31.
张志强,王志强,王志强,等。体细胞胚胎发生的发育途径。植物学报。2002;69(3):233-49。
- 32.
马静,乔Q,肖YP等。发生在防风组织培养体细胞异常的Embroys控制。ACTA牡丹BOREALI-Occiden仙。2005; 03:552-6。
- 33.
波斯核桃体细胞胚成熟与萌发(juglans regia.l .)。Acta Hortic。2009; 812:313-8。
- 34。
Vahdati K,Jariteh男,Niknam V,Mirmasoumi男,波斯语核桃Ebrahimzadeh H.体细胞胚胎发生和胚成熟。Acta Hortic。2006; 705:199-205。
- 35。
瓦达提K、巴亚特S、易卜拉欣扎德H、杰里特M、米尔马苏米M。外源ABA对核桃体细胞胚成熟和萌发的影响。植物细胞组织培养。2008;93:163–71.
- 36。
巴赫拉米SH,成熟与结冷胶,冷和PGR波斯核桃(核桃L.)的体细胞胚的萌发Vahdati K.增强。Acta Hortic。2010; 861:333-44。
- 37。
Ruffoni B,萨沃纳M.生理用植物组织培养相关的生长异常的生化分析。园艺ENVIRON生物技术。2013; 54(3):191-205。
- 38。
Aryakia E,Naghavi MR,Farahmand Z,等人。在评估组织培养基一些植物物种作为耐性植物的选择的精确方法的化感作用和生物除草剂的筛选。ĴAGRIC科学与技术。2015; 17(4):1011至23年。
- 39。
索普TA。植物组织培养的历史。植物细胞培养协议。纽约:Humana公司出版社;2006.9-32。
致谢
我们感谢所有在讨论和协助中给予我们帮助的人。还要感谢AJE的Krysta博士,他对语言进行了润色。我们得益于他们的帮助才完成了论文。
资金
这项研究是支持项目支持林业大学和重庆市(cfa2018lykj05)技术的重点项目,中央高校(SWU119066)基础研究基金;重庆市(cstc2014yykfB80015)的应用开发计划。供资机构并没有在研究和收集,分析和解释数据的设计,并以书面稿件发挥作用。
作者信息
从属关系
贡献
YY设计了实验,DC,DY和YH进行实验。DC分析的数据,是在写手稿的主要贡献者。LYM(玉敏)和LYM(雅分)校订手稿。所有作者均阅读并批准了手稿。
相应的作者
伦理宣言
伦理批准和同意参与
本文不包含任何作者的完成人类参与者或动物的任何研究。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
附加信息
出版商说明
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
戴,连续波。那Yan, Yy., Liu, Ym.等等。的再生宏碁石L.“十月荣耀”通过胚性愈伤组织。BMC植物BIOL.20.309(2020)。https://doi.org/10.1186/s12870-020-02496-z
收到了:
公认:
发表:
关键词
- 宏碁石L.《十月荣耀》
- 组织培养
- 胚性愈伤组织
- 再生