抽象的
背景
腋芽是棉花株型性状的重要指标,陆地棉腋芽发育的分子机制尚未见报道。我们从低出芽表型品种中获得了一个高出芽表型的腋芽发育突变体(mZ571)G. Hirsutum.为研究腋芽发育的复杂调控网络提供了理想的材料。本研究对Z571(LB,低芽)和mZ571突变体(HB,高芽)腋芽发育的三个阶段进行了RNA测序。
结果
在三组(HB-E与LB-E,HB-G1对LB-G1,HB-G2与LB-G1,HB-G2对LB-G2)中共鉴定了总共7162℃,包括4014下调和3184个上调的次数。此外,在所有三组中通常均确定221只次数,占总参数的约3.09%。这些DEG被确定,注释和分类。大量的DEG与激素代谢,激素信号转导和淀粉和蔗糖代谢有关。此外,在HB-E和LB-E,HB-G1与LB-G1和HB中鉴定了参与激素信号转导途径的激素代谢途径和67,22和19次参与的45,22和9℃。-G2与LB-G2分别表明内源激素是影响棉腋芽生长的主要因素。激素和可溶性糖含量的测量显示,MZ571在所有三个阶段中表现出更高浓度的齐肽,赤霉素和可溶性糖,这证实了这些激素代谢 - ,激素信号转导和淀粉新陈代谢相关基因显示出促进伴随的互动效应MZ571和Z571之间的腋芽生长。
结论
我们的结果证实了内源性激素和糖在腋芽发展中的重要性,我们发现MZ571植物,具有高腋芽表型的腋芽,表现出更高的内源性激素和糖浓度。总体而言,我们提出了一种棉花腋芽的出现和发展模型,为腋芽出现和发育期间提供了对监管网络的复杂性和动态性质的见解。
背景
腋芽是一种重要的农艺性状,其形状植物结构,生物质和产量。在大多数较高的植物中,分支源自腋生分泌,而主干是从顶端商品中衍生的[1那2那3.].在不同的物种中,腋芽在营养期间显示出不同程度的发育和增长[4.].在营养生殖生长中拟南芥,腋芽的形成抑制直至开花的开始[4.那5.那6.].同样,在豌豆(Pisum sativum.),腋芽的生长通常在大多数节点处与未成熟叶片的芽转换后抑制腋窝芽之后抑制[7.]. 米饭(奥雅萨苜蓿),由于其特征生长习惯,腋芽的生长被释放以形成分蘖[3.在玉米时(Zea Mays.)另一种单子叶种类,腋芽的生长仍然相对受限制[8.].在高粱(高粱双色), 这非休眠腋芽1从一个突变株中鉴定出基因并进行功能特征分析,该突变株分蘖增加,株高降低[1].
植物激素是参与腋芽生长调控的主要因子。三种类型的激素,生长素,细胞分裂素和赤霉素(GAs),长期以来一直被研究。在这些激素中,顶芽提供的生长素间接抑制腋芽的生长,而细胞分裂素则直接诱导腋芽的生长[9.].蚕豆的研究(维亚比亚法瓦)显示蚕豆的枝尖可以刺激腋芽的生长,而通过喷洒植物残留头的植物蛋白可以大大抑制这种过剩[10.].然而,由于植物蛋白由杨氏叶产生并在不进入芽的情况下向茎转移到茎上,因此据信养肝对芽生长具有间接影响[11.那12.那13.].细胞分裂素长期以来被认为是一种促进芽生长的因子[14.那15.]. 最近的研究表明,细胞分裂素通过控制生长素的运输来调节芽的生长[16.].腋芽的生长可以通过适当剂量的细胞蛋白的外源供应促进[17.那18.那19.].拟南芥的细胞肝素合成和信号传导突变体表明,细胞蛋白与完整植物的分支有关,但不适用于无头植物的分支[20.].气体是重要的内源性激素,并在作物的总体生长中发挥重要作用[21.].在许多植物中报道了促进气体腋芽的芽芽,如玫瑰[22.], 甜樱桃 [23.]以及麻风树图[18.].
棉花提供优良的天然纤维,是世界上最重要的经济作物之一。在棉花生产中,简化栽培和机械化收获是新兴趋势,取决于棉花植株类型是否满足生产要求。理想株型的棉花品种不仅能促进棉花机械化生产,而且具有较好的透气性、透光性和落叶效果。棉花腋芽过度生长增加了人工修剪的工作量,不利于机械化管理和收获。此外,理想的棉花植株具有良好的透光性和透气性,不受害虫侵害,从而减少对农药的依赖。在腋芽较少的棉花植株上,落叶挂在植株上的可能性较小,从而减少了棉花收获时的杂质,有利于提高纤维质量。因此,带有腋芽的分枝类型是植物类型性状的一个重要指标,在许多不同的物种中都得到了很好的研究[3.那5.那24.那25.那26.那27.那28.].棉花芽生长和发育的机制尚未以棉花报告。
在该研究中,将普满棉花品种Z571(CCRI 9a02)和其腋芽突变体(MZ571)作为用于鉴定载有旱地棉花腋芽的监管网络的材料。Z571具有理想的植物型,用于简化栽培和机械开采,因为它较少的腋芽和植物芽特征。Z571中腋芽的低发芽表型有助于棉花收获的机械化。MZ571是一种表型突变性近亲,与血管芽的发育中具有高萌芽表型,与Z571相比。Z571和MZ571提供了具有相同遗传背景的理想材料,可能与腋芽发展复杂的监管网络研究的环境中没有影响。类似地,检测到与腋芽相关的三种植物激素(细胞素,赤霉素和养肝剂)的含量,以分析旱地棉中的潜在调节机制。另外,在四个,五个和六周内进行两种植物类型的第一个茎孔的转录组测序,以研究腋芽发育早期监管网络。该研究不仅提供了研究棉腋芽发育的分子机制的数据,而且为棉花的理想植物型繁殖奠定了坚实的基础。
结果
表型、内源激素和可溶性糖含量G. Hirsutum.Z571及其突变体mZ571
从第一分支位置的三个阶段收集本研究中使用的茎核节点。Z571中的腋芽的发展是有限的,而MZ571中的血管芽是非常快的(图。1一种)。为了监测在腋芽芽的肺炎中的细胞素素,赤霉素和生长素的变化,我们通过HPLC测量了六个样品中七肽(ZT),赤霉素(气体)和吲哚乙酸(IAA)的浓度[29.].ZT显示HB-E中的最高浓度,Hb-G1和Hb-G2略微降低,LB-E和LB-G2中的浓度显着低于HB-E和HB-G2。两种类型的植物材料显示出在所有阶段期间GA浓度的趋势越来越大。相比之下,IAA在前两个阶段显示了减少的图案,然后在第三阶段保持稳定。然而,Hb-g1和Hb-g2的IAA浓度分别显着低于LB-G1和LB-G2的浓度。此外,随着棉花植物的发展,两种植物类型的腋芽中可溶性糖含量逐渐增加,Hb-e,Hb-g1和Hb-g2的可溶性糖含量高于LB- 分别,LBL-G1和LB-G2(图。1b)。这些结果表明,在棉腋芽发育过程中,内源激素和糖是关键调节因素。
RNA测序和转录组分析
总共产生845,061,558个原始读取是从HB-E,HB-G1,HB-G2,LB-E,LB-G1和LB-G2文库中产生的(每个样品的三重复)。高于20(Q20)的质量分数的核苷酸百分比约为97.60%(表S.2)。在3'末端的适配器滤出读取后,在Q20以下的质量评分之后,读数超过93.30%被确认为清洁读数。结果,通过使用Tophat2升级版本Hisat2,93.98-95.46%的总清洁读数被映射到高地棉花基因组[30.].多映射读和唯一映射读分别占总读数的9.66 ~ 10.94%和89.14 ~ 90.34%(表S3.)。基于参考基因组使用Stringtie软件组装映射的读取,并与已知的转录物进行比较,产生了总共74,324个unigenes。
unigenes的功能注释
通过与五个不同的数据库进行比较来进行unigenes的功能诠释。总共,在所有五个数据库中成功匹配了10,197个未成年人(约13.72%)(表1)。根据Eggnog数据库功能分类,将这些unigenes分为26个描述,其中涉及信号转导机制和转录中涉及的unigenes(图。1)。
探测和分析DEGS
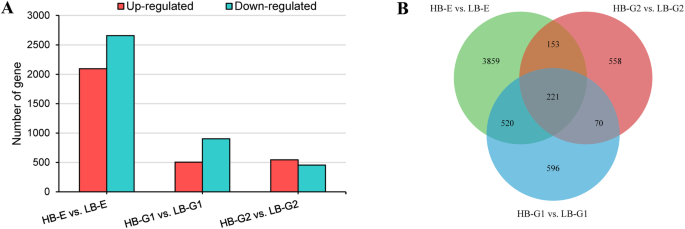
FPKM值用于表示每个基因的丰度。log2(折叠变化)> 1和a的截止P.-value < 0.05用于定义deg。结果发现有7162个unigenes在三组中均有显著差异表达,占总unigenes的9.64%。其中,4014个基因表达下调,3148个基因表达上调。2a).另外,在3个对照组(HB-E vs. LB-E, HB-G1 vs. LB-G1, HB-G2 vs. LB-G2)中,两种腋芽类型中共有221个DEGs,约占总DEGs的3.09%。(无花果。2b)。
GO对DEGs的功能分类
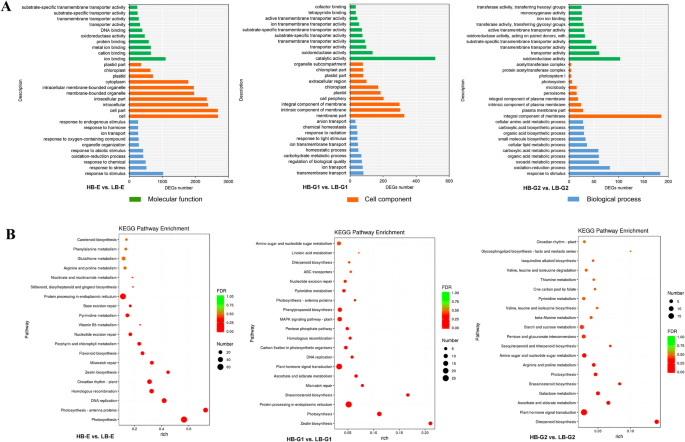
根据GO类别,评估所有DEG的功能。结果表明,HB-E,HB-G1对LB-G1和HB-G2与LB-G2,3783(79.59%),1068(75.91%)和738(73.65%)含量为HB-G1和HB-G2,分别在A的标准下富集在三个主要类别的细胞组分(CC),生物过程(BP)和分子函数(MF)下进行富集P.-Value <0.05(图。3.一种)。在CC类别中注释的DEGS与细胞和膜部件有关。在BP类别下,DEGS参与了响应激素和刺激。在MF类别中注释的DEG主要涉及离子结合,催化活性和氧化还原酶活性。此外,在HB-E与LB-E中鉴定的45℃(7个上调,38下调),22℃,22℃,22℃,9℃,9℃,9℃(5个上调,4下调在HB-G2与LB-G2中涉及激素代谢过程,这表明内源激素在腋芽的发育中发挥着重要作用。
基于KEGG的DEGs通路分析
总共有6893只基于KEGG注释的123个途径,发现57个途径在标准下显着富集P.<0.05。具有涉及腋芽芽显影的最丰富的前30个途径如图2所示。3.B,其中包括光合作用,DNA复制,植物激素信号转导,光合作用 - 天线蛋白和内质网途径中的蛋白质加工。在这些途径中,植物激素相关的,光合作用的光合作用,DNA复制和淀粉和蔗糖代谢途径占大多数次数。表格中显示出最丰富的前五个途径2.
QRT-PCR验证
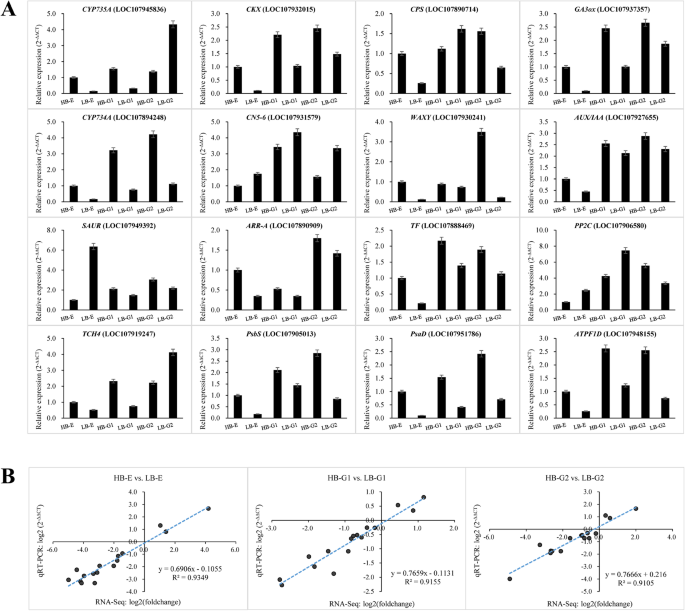
为了验证RNA-SEQ DEG数据的可靠性,十六次(三个光合作用基因,两种Zeatin生物合成基因,两个淀粉和蔗糖代谢基因,两个甘蓝型生物合成基因,一种芸苔类固醇生物合成基因和六种植物激素信号转导基因)用于QRT-PCR分析。结果表明,这些DEG的表达模式主要与RNA-SEQ结果一致(图。4.a) ,相关系数(R2)> 0.91(图。4.b)。因此,结果证实了RNA-SEQ数据的可靠性。
DEGs参与激素生物合成及信号转导的研究进展
以前的研究表明,内源激素对植物生长和发育至关重要。这里,发现植物激素信号转导,扎肽和胃蛋白蛋白途径中涉及的几个基因在HB-E和LB-E,HB-G1和LB-G1和HB-G2和LB-G2之间进行差异表达。例如,分别在细胞蛋白(Zeepin)和Ga生物合成的途径中差异地表达了14和10℃,这被广泛认为参与调节棉花植物生长[31.那32.].
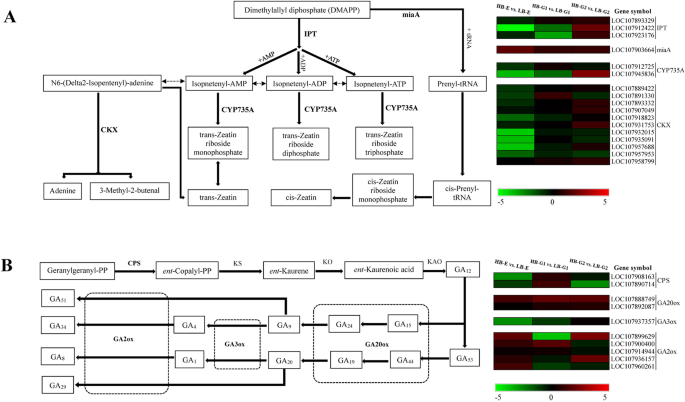
在扎汀生物合成途径中,表达水平军情局在MZ571的所有三个阶段上升了。一IPT.(LOM107912422)和一个CYP735A(LOM107945836)被上调,但大多数CKX.基因仍在HB-G2中下调(图。5.一种)。编码进入GA合成途径的Carbumoyl焦磷酸合成酶的第一基因的表达水平,CPS,在HB-E和HB-G2中略微下调,而HB-G1阶段没有显着变化。一Ga0ox.基因(LOM107888749)在HB-G1和HB-G2中显着上调。三Ga2ox.基因(LOM107899629,LOM107936157,LOM107960261)在HB-G1中显着下调。此外,GA3ox公司(LOM107937357)在HB-E,HB-G1和HB-G2中下调,但逐渐降低的速率下降(图。5.b) 是的。为了AUX1参与生长素信号转导的HB-E和HB-G1细胞表达水平显著上调。一个AUX / IAA.(LOM107906498),四个CH3.(LOM107935022,LOM107934422,LOM107924874,LOM107894308)和四个阿富汗二月(LOM107903130,LOM107927896,LOM107949392,LOC107957583)基因在HB-E中显着上调。三AUX / IAA.(LOC107901319、LOC107906873、LOC107926752),三个CH3.(LOM107935022,LOM107894308,LOM107908866)和两个阿富汗二月(LOC107908681,LOC107918887)基因在HB-G2中显著上调(图。6.)。为了AHP.那ARR-B.和ARR-A.,参与细胞蛋白(Zeepin)信号转导的基因,两个AHP.(LOM107890157,LOC107903216)HB-G1中的基因,一个ARR-B.(LOM107888395)和一个ARR-A.(LOM107901424)HB-E中的基因,以及一个AHP.(LOM107915981)MZ571的所有三个阶段的基因显着上调。这BZR1 / 2.基因。参与芸苔类固醇信号转导的基因,在HB-E中下调,之后其表达在HB-G1和HB-G2中逐渐增加,但仍然低于LB.一BKI1.(LOM107958111)基因在HB-E和HB-G2中显着上调。没有显着的上调TCH4.基因。此外,其他参与信号转导的基因,例如塔那PP2C.,ABF.,与脱钙酸有关;ETR那EBF1 / 2,ERF1型与乙烯相关联;jar1.和jaz.,与茉莉酸相关;和NPR1.那TGA.,PR1与水杨酸相关的,也显示出差异表达。一ABF.(LOM107889167),一个ERF1(LOM107936230)和一个JAZ(LOM107932795)基因在HB-E中显着上调(图。6.)。
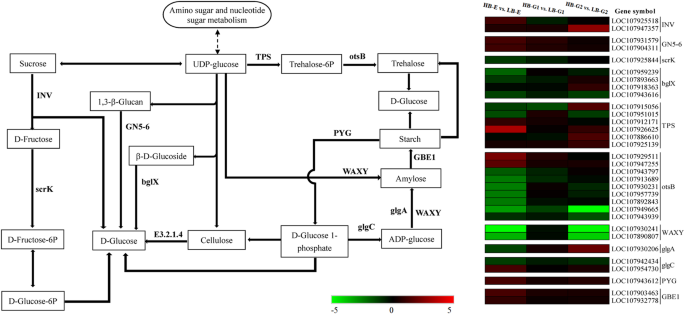
淀粉和蔗糖新陈代谢涉及参与的次数分析
糖在植物的生长和发展中起着重要作用。最近的研究表明,糖是芽增长的重要信号调节剂[33.].在淀粉和蔗糖新陈代谢途径中,挪威与LB-E和LB-G2相比,在HB-E和HB-G2中上调。表达水平GN5-6那侏儒,Gbe1.在HB-E、HB-G1和HB-G2细胞中表达上调。在这些基因中,GN5-6呈现HB-E中的最高表达水平,然后在HB-G1和HB-G2阶段逐渐降低。高表达GN5-6保证了1,3-β-葡聚糖转化为d -葡萄糖。划船那BGLX.,最多TPS和otsb.HB-E和HB-G1基因表达下调。一TPS(LOM107926625)和两个otsb.(LOM107929511,LOM107947255)基因在HB.HB的所有三个阶段上上调,蜡实在HB-E中表现出较高的表达水平,然后在HB-G1中降低,在HB-G2中显著增加(图。7.)。
讨论
植物类型的作物是植物形态结构和独特的生理生态功能的综合表达,与作物生产和繁殖密切相关;良好的植物类型可以提高叶面积系数,光合效率和生育耐受性,从而增加收获指数[34.那35.那36.]. 影响不同陆地棉株型形成的性状包括果枝类型、地上部分枝数、结果分枝数和株高。其中,腋芽形成的枝梢是影响机械收获和栽培措施制定的主要因素之一。转录组研究可以为腋芽发育的基因表达网络提供新的视角[37.那38.].
Cytokinin和Gibberellin是腋芽发展的重要调节因素
长期以来,人们对腋芽的激素控制进行了深入的研究。通过对豌豆、牵牛花、水稻和拟南芥中一系列分枝突变体的分析,进一步证明了芽的激活可以由生长素转运体系统控制[27.那39.那40那41.那42.那43.].细胞因子具有正向调节分生组织的功能,是维持分生组织的必要条件。一般来说,内源性细胞分裂素在木质部汁液中向顶部运输,以促进腋芽的生长[14.].吉布林素属于迪特,植物的生长和发展至关重要[18.].之前的研究还表明,内源性细胞素素和生长素水平的一系列变化是调节腋芽发展的关键因素[14.那44.那45.那46.].
在这项研究中,为了阐明患有腋竹中腋芽出现和发育的基因的差分调节网络,在Z571中进行转录组分析及其MZ571突变体,涉及41个基因分类为参与Zeatin生物合成,嗜酸剂蛋白生物合成,淀粉和蔗糖新陈代谢和植物激素信号转导途径。Z571和MZ571之间的许多差异表达基因与腋芽芽型相关的X571与最近的报告相符。特别是军情局基因(LOM107903664)和一个IPT.在苹果中上调的基因(Loc107912422)[18.那47.还发现在MZ571中升级。事实上,最近的研究已经探索了职能IPT.和CKX.各种植物种类的基因。一项研究Pisum sativum.表明表达了Psipt1.和psipt2.茎节区与玉米素生物合成有关的基因在去头前后存在差异。的表达Psipt.在不添加IAA的缓冲液中,断头植株的表达量保持不变,而在添加IAA的缓冲液中,表达量保持不变Psipt.被压抑了[14.那48.].转基因烟草植物过表达IPT.基因显示出更高trans-zeatin和Zeein核糖苷浓度在根和茎中[49.].在拟南芥中,IPT.单个或多个突变体的分支显著减少[50.]. 研究人员认为,可能主要由腺苷酸合成的内源性细胞分裂素IPTS.在植物发育中发挥更大的功能作用,并受到更高的调控[47.那51.].相比之下,大部分CKX.基因在HB-E,HB-G1和HB-G2中下调(图。5.a),表明这一点CKX.家族基因参与了棉花腋芽生长和发育的负面调控。这种结果与研究一致拟南芥例如,显示过度表达CKX7基因导致细胞素相关的代谢物的含量下降,例如N-葡糖苷细胞蛋白和CIS-ZEEPIN [47.].这ARR-A.基因属于细胞蛋白响应基因家族,其参与细胞素信号转导的负调节[52.].一项研究丝兰突变体表明表达了ARR-A.基因与减少的养蛋白水平联合上调[53.].我们在Z571和MZ571腋芽中的Zeeatin浓度的测定证实了上述结论。
赤霉素是在植物生长和发展期间调节一系列活动的主要激素[54.].的功能GA20ox1型和GA2ox1基因已经在几个物种中被研究过;GA20ox1型积极调节GA综合,而GA2ox1负调控GA的合成[54.].根据我们的结果,一Ga0ox.家庭基因(GA20ox1型;LOM107888749)显示在上调麻风树图[18.]在HB-G1和HB-G2中也上调。大部分Ga2ox.基因在HB的所有三个阶段下调,尤其是Ga2ox.家庭基因GA2ox1(LOM107899629),其显示对应于HB-G1中的-4.09的log2foldchange的下调(图。5.b).三个阶段mZ571的GAs含量均高于Z571, HB-G1和HB-G2阶段的GAs浓度均高于Z571。事实上,在这三个阶段,Z571株样品的玉米素和赤霉素含量都低于mZ571株样品,这与玉米素和赤霉素生物合成相关基因的表达模式一致。例如,在玉米素生物合成途径中,表达水平最高IPT.和CKX.与高萌芽表型植物中的那些相比,低萌芽表型植物中的基因下调(图。5.a) 是的。表达水平GA3ox公司和Ga0ox.在低萌芽的表型植物中下调(图。5.b)。细胞素蛋白和吉布林素的这些动态在旱地棉腋芽发芽期间发挥着重要作用[12.那15.那21.那55.].
其他激素在腋芽发育中的可能作用
除了细胞分裂素和胃肠杆菌蛋白外,与其他激素的信号转导相关的基因,包括唾液,脱落酸,乙烯,芸苔类化合物,茉莉酸和水杨酸,在HB-E,HB-G1和HB-G2中也差异表达(如图。6.)。蟾蜍素信号转导基因AUX1在HB-E和HB-G1中显著上调。内源生长素(IAA)在mZ571中含量高于Z571,但在HB-E到HB-G1期间IAA浓度下降,在HB-G2中保持稳定。这些生长素动态在腋芽胚胎发生的发育中起着非常重要的作用[56.].以前的研究也显示了芽活性和从芽中运输生长素之间的直接关系[14.].我们关于疾病信号转导和IAA浓度的结果与先前的研究一致。在脱钙酸信号转导相关基因中,PP2C.家庭在HB-E和HB-G1中上调;这塔在MZ571中,家族显着下降,除了脱落酸受体外Pyl4.和Pyl9.在HB-e;和ABF.家庭除了ABF5.在mZ571中表达下调。根据脱落酸在细胞凋亡中作用的研究拟南芥脱落酸对红光/远红光比的响应调节芽的生长,从而扩展了与分枝调节相关的已知激素途径[57.]. 我们的KEGG注释结果表明,光相关的途径,如光合作用,也明显丰富(表1)2,无花果。3.b)。
乙烯在植物中介导几种非生物胁迫[58.].在与乙烯信号转导相关的基因中,ETR在HB-G1中下调,EBF1 / 2在HB-E和HB-G2中上调,一个ERF1B型(LOC107893200)基因在HB-E和HB-G1中表达下调,1ERF1B型(LOC107936230)基因在HB-E和HB-G2中表达上调。油菜素内酯信号转导相关基因,如BZR1 / 2.那TCH4.和BKI1.(LOC107917087), mZ571中除1个外,其余均下调或不显著上调BKI1.(LOC107958111)基因在HB-E和HB-G2中表达上调。在茉莉酸信号转导相关基因中,jar1.在mZ571中被下调了,但是jaz.在MZ571中显着上调。与水杨酸信号转导和调节蛋白相关的基因NPR1.和PR1在MZ571上升了,和NPR3.和TGA.在MZ571中下调。这些激素可能在高地棉花的腋芽出现和发展中发挥不同作用,并将在未来的工作中讨论所涉及的确切监管机制。
糖在腋芽发展中的作用
除植物激素外,糖对于植物生长和发展也很重要,因为它们提供能量,是蛋白质和细胞壁合成的碳源[33.].最近的研究表明,糖是芽生长的一种重要调控因素,并充当早期信号触发芽活动[59.].根据我们的测量,随着棉花植株的生长发育,两种植物腋芽可溶性糖含量逐渐增加,HB-E、HB-G1和HB-G2的可溶性糖含量分别高于LB-E、LB-G1和LB-G2。这些发现支持了传统观点,即芽是养分积累和储存的场所,芽越多的植物,养分积累越多[60.].先前的研究也表明,块茎是马铃薯发育过程中积累淀粉的贮藏器官[61.].淀粉降解导致可溶性糖浓度的增加;因此,淀粉可能在细胞内源性可溶性糖的积累中发挥重要作用[62.].根据我们的淀粉和蔗糖新陈代谢分析结果,挪威那GN5-6那侏儒那Gbe1.而且最重要的是TPSmZ571、mZ571、mZ571、mZ571、mZ571、mZ571、mZ571蜡实在HB-E和HB-G2中显示出显着的下调(图。7.)。事实上,上调的侏儒促进淀粉的降解至D-葡萄糖1-磷酸盐,其将进一步转化为D-葡萄糖。TPS催化udp -葡萄糖转化为海藻糖- 6p,然后在由otsb.海藻糖最终转化为d -葡萄糖。这些基因表达模式与可溶性糖浓度的动态变化相一致,表明糖是高出芽表型棉花的能量来源或营养物质。
结论
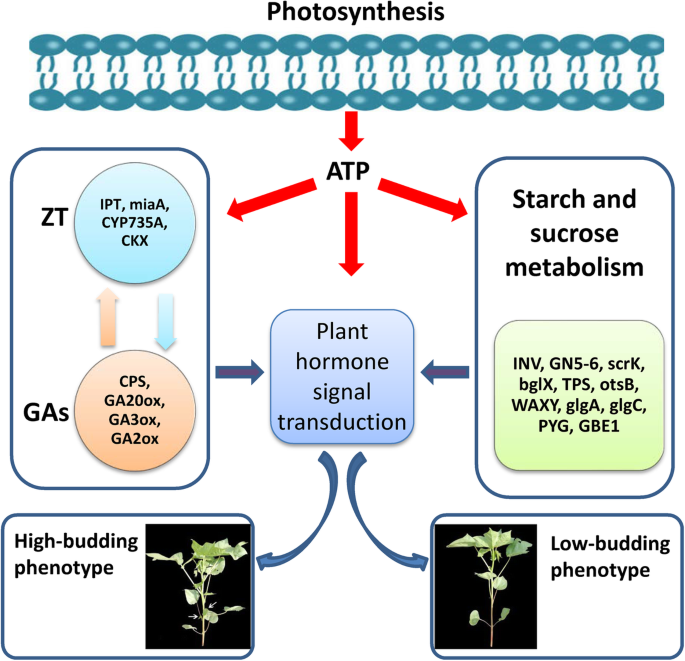
总之,我们通过转录组科对MZ571和Z571腋芽MRNA表达进行了比较分析。分析结果表明,一些激素代谢 - ,激素信号转导和淀粉代谢相关基因显示相互作用影响有助于MZ571和Z571之间的腋芽生长的发散。根据我们的结果和之前的报告,我们提出了一种与棉花腋芽出苗和发育有关的假想相互作用网络(图。8.)。在该模型中,我们提出糖是碳能源,这对于腋芽出现和发育期间的蛋白质和细胞壁合成是必不可少的,激素生物合成和信号转导是细胞分化和伸长率调节所需的顶层球员腋芽的发展。此外,根据Kegg分析,我们认为光合作用是在腋芽发展过程中出现的差异的重要因素,这将在将来的工作中讨论。这些结果进一步证实了先前报告的腋芽的主要发现,并揭示了参与激素生物合成,激素信号转导和淀粉和蔗糖代谢的重要作用。它为我们提供了更好地了解腋芽出现和发育中所涉及的基因网络的复杂性。
方法
植物材料
对Z571(CCRI 9A02,低萌芽表型)及其MZ571突变体(高萌芽表型)的旱地棉花植物用于本研究。Z571显示了一种理想的植物类型,用于简化栽培和机器收获,因为其腋芽芽和营养芽特征较少。MZ571显示了与Z571相比的腋芽发展的高萌芽表型。该植物在中国农业科学院棉花研究所(中国安阳,中国安阳)的生长室中生长。在28℃/ 25℃和12/12-H光/暗循环的条件下,在光培养箱中生长灭菌的种子,70%相对湿度和11,000Lx的光强度。将幼苗随机分为三组,每组包括九个盆。在第四周(早期),第五周(生长阶段1)和第六周(生长阶段2)中收集植物的第一个茎胚点。进行三种生物重复。收集后,将所有样品分为三个部分:一个用于RNA-SEQ,一个用于内源激素测定的RNA-SEQ,一个用于QRT-PCR。收集所有样品并储存在-80℃以进一步使用。
RNA分离和测序
根据改进的CTAB提取方案,从每个棉花样品中分离出总RNA [54.].使用核酸分析仪评价总RNA浓度。cDNA文库的构建是指以下方法。简而言之,使用RNA作为模板,用6-基碱随机引物和逆转录酶合成第一链CDNA。通过PCR扩增富集双链cDNA文库,并用Agilent 2100生物分析仪(Agilent Technologies,Ca,USA)评价,并通过QRT-PCR测定总和有效浓度。在RNA提取,纯化和文库浓度之后,基于Illumina HiSeQ测序平台的下一代测序(NGS)用于文库的配对端(PE)测序。
映射和序列注释
原始读取是预处理的质量滤波,其中低质量读数,例如3'末端的适配器的读数,并且读取的平均质量得分低于Q20,则被移除。最终,清洁读数被映射到整个基因组陆地棉(gcf_000987745.1)通过使用tophat2升级版本hisat2(http://ccb.jhu.edu/software/hisat2/index.shtml.)[30.].unigenes的表达水平由FPKM(每百万千次片段的片段)标准化,使得可以比较不同基因和样品的表达水平。
探测和分析DEGS
使用Deseq用于分析样品之间基因表达的差异,并且只有绝对原因的基因2(折叠变化)> 1和P.-Value <0.05被鉴定为DEGS。通过使用BLAST2GO计划进行基因本体(GO)注释。为注释的DEG计算基因列表和每个术语的数量。选择超细分布方法来计算P.- 值(显着富集的标准是p值<0.05),鉴定了具有显着富集的DEG的GO术语。基因和基因组(KEGG)注释的京都百科全书是从KEGG自动注释服务器获得的[63.].
确定内源激素和可溶性糖的测定
根据以往的研究,ZT是一种重要的细胞分裂素,用于促进植物再生[64.那65.]. 在陆地棉组织培养中,ZT诱导大量的芽原基形成,其中许多转化为单芽[31.].IAA和天然气通常用于植物生长调节研究[21.那33.].因此,采用高效液相色谱法(HPLC)测定腋芽中ZT、IAA和GAs的浓度,采用比色法测定可溶性糖的含量。进行了3次生物重复。
用qRT-PCR验证RNA-Seq
这里,为了验证转录组数据的有效性,选择QRT-PCR的16个基因。通过使用Primer Premier 5软件设计了特定的引物(表S.1),采用天根生物技术(Tiangen Biotech) Fast Quant RT Kit进行逆转录。qRT-PCR采用IQ5荧光定量PCR系统(Bio-Rad,美国),使用Ultra SYBR Mixture (with ROX 1)试剂盒(CWBIO,北京,中国)进行。结果由2−ΔΔCT方法与归一化对抗UBQ7基因[54.].每次扩增反应总体积为10 μL,其中2× Ultra SYBR Mixture为5 μL,基因特异性引物(10 μmol/L)各0.4 μL,稀释cDNA为0.7 μL,无菌蒸馏水为3.5 μL。每个反应程序为95°C for 10 min, 95°C for 20 s和65°C for 30 s循环40次。反应结束时,用熔融曲线法确定扩增产物的特异性。为了保证可靠性,进行了三个生物和技术重复试验。
可用性数据和材料
所有样品的RNA-SEQ数据已提交给国家生物技术信息中心的GenBank(NCBI:http://www.ncbi.nlm.nih.gov/sra), SRA登录号为PRJNA598982。
缩写
- 拍:
-
极地养羊贷运输
- IPT:
-
腺苷磷酸异戊二烯酰转移酶
- TCP:
-
Teosinte Branched1,Cycloidea,PCF
- BRC1.:
-
分支1
- FC1.:
-
精细的秆1
- RBOH1:
-
呼吸爆发氧化酶同源物1
- 去:
-
基因本体论
- WFI1.:
-
粉虱诱导1
- 销:
-
引脚形成
- QRT-PCR:
-
定量实时PCR
- ngs:
-
下一代测序
- 可见:
-
差异表达基因
- ZT:
-
玉米素
- 气体:
-
赤霉素
- IAA:
-
吲哚乙酸
- HPLC:
-
高效液相色谱法
- CKX.:
-
Cytokinin脱氢酶
- GN5-6:
-
葡聚糖肠胃1,3-β-葡糖苷酶5/6
- TPS:
-
海藻糖6-phosphate合酶/磷酸酶
- 蜡实:
-
颗粒结合淀粉合酶
参考文献
- 1。
陈杰、张琳、朱美杰、韩立杰、吕Y、刘YS、李平、景慧聪、蔡慧聪。非休眠腋芽1号调控高粱腋芽的生长。综合植物生物学杂志。2018;60(10):938–55.
- 2。
McSteen P, Leyser O.芽分枝。植物生物学杂志。2005;56:353-74。
- 3.
围啊,腋生分生剂启动和水稻芽生长。J植物BIOL。2017; 60(5):440-51。
- 4.
Waldie T,Hayward A,Beveridge CA.草本嫩枝中的腋芽生长:strigolactones如何适应图片?植物分子生物学。2010;73(1–2):27–36.
- 5。
Gonzalez-Grandio E,Poza-carrion C,Sorzano Cos,Cubas P。分支1促进腋芽休眠以应对阴影拟南芥. 植物细胞。2013;25(3):834–50.
- 6。
苟·jq,傅cx,刘sj,唐克,迪巴径s,佛兰白A,GE YX,唐耶,江QZ,Larson Pr等。这mir156-spl4.组件主要调节气生腋芽的形成和控制芽的结构。新植醇。2017;216(3):829 - 40。
- 7。
Dun EA,Hanan J,Beveridge Ca.计算建模与分子生理学实验揭示了豌豆枝条的新见解。植物细胞。2009; 21(11):3459-72。
- 8。
植物分枝的激素调节。植物杂志。2009;149(1):46-55。
- 9。
Minakuchi K,Kameoka H,Yasuno N,Umehara M,Luo L,Kobayashi K,Hanada A,Ueno K,Asami T,Yamaguchi S等人。精细CULM1.(FC1)作用于strigolactones下游,抑制水稻腋芽的生长。植物细胞生理学。2010;51(7):1127–35.
- 10。
Bennett T、Hines G、van Rongen M、Waldie T、Sawchuk MG、Scarpella E、Ljung K、Leyser O。生长素在茎中的连接运输促进了茎尖之间的通讯。公共科学图书馆。2016;14(4):e1002446。
- 11.
Booker J,Chatfield S,Leyser O.植物蛋白在木质相关或髓质细胞中起作用,以介导顶端优势。植物细胞。2003; 15(2):495-507。
- 12.
Prasad TK,Li X,Abdel-Rahman Am,Hosokawa Z,云NP,Lamotte Ce,Cline Mg。疾病在拍摄反演中发布了顶端主导地位的作用Ipomoea nil.?安乐伦敦。1993; 71(3):223-9。
- 13。
大厅SM,Hillman Jr。相关抑制侧芽生长菜豆L断头后芽生长的时间。足底。1975;123(2):137–43.
- 14。
穆勒D,Leyser O.植物素,细胞蛋白和射击分支的控制。安乐伦敦。2011; 107(7):1203-12。
- 15.
莫里斯Se,Cox MCH,Ross JJ,Krisantini S,Beveridge Ca.斩首后的生长动力学与腋芽的初始生长无关。植物理性。2005; 138(3):1665-72。
- 16。
Waldie T,Leyser O. cytokinin靶向养羊酸运输,促进射击分支。植物理性。2018; 177(2):803-18。
- 17。
倪j,赵ml,陈女士,潘bz,陶烨,徐紫夫。对腋芽响应芽支化调节剂胃肠杆菌素A3和6-苄基腺嘌呤的比较转录体分析麻风树图.SCI Rep-UK。2017; 7:11417。
- 18。
Ni J,Gao CC,Chen Ms,Pan Bz,Ye Kq,XU ZF。Gibberellin在多年生木本植物中促进射击分支麻风树图.植物细胞生理。2015; 56(8):1655-66。
- 19。
罗马H,Girault T,Barbier F,Peron T,Brourard N,Pencik A,Novak O,Vian A,Sakr S,Lothier J等人。细胞蛋白是对芽外产生的初始光的初始靶点。植物理性。2016; 172(1):489-509。
- 20。
Silva-Navas J, Moreno-Risueno MA, Manzano C, Tellez-Robledo B, Navarro-Neila S, Carrasco V, Pollmann S, Gallego FJ, del Pozo JC。黄酮醇通过调控增殖到分化的过渡来调节根系的向光性和生长。植物细胞。2016;28(6):1372 - 87。
- 21。
谭m,李gf,刘xj,程f,ma jj,赵cp,张d,韩。GA的外源性应用3.通过影响苹果中的分支抑制剂和芽调节激素,不行地调节腋芽过度生长(Malus Domestica.Borkh)。molecular Gen Genomics. 2018;293(6): 1547-63。
- 22。
Choubane D,Rabot A,MortReau E,Legourrierec J,Peron T,Foucher F,Ahcene Y,Pelleschi-Travier S,LEDUC N,Hamama L等。芽突发的光电子涉及嗜酸剂蛋白生物合成罗莎sp。J植物理性。2012; 169(13):1271-80。
- 23。
elfving dc,visser db。提高细胞素素应用刺激果园年轻甜樱桃树侧面分支发育的疗效。Hortscience。2007; 42(2):251-6。
- 24。
科托娃AA,科托娃LM。植物激素在豌豆腋芽生长调控中的相互作用。Russ J Plant Physl+。2018;65(5):628–41.
- 25
Braun N,De Saint Ga,Pillot JP,Boutet-Mercey S,Dalmais M,Antoniadi I,Li X,Maia-Grondard A,Le Signor C,Bouteiller N等人。豌豆TCP转录因子PSBRC1作用于杂珠酮的下游以控制射击分支。植物理性。2012; 158(1):225-38。
- 26
多玛加尔斯卡·马,莱瑟·O。枝梢分枝控制中的信号整合。Nat Rev Mol细胞生物学。2011;12(4):211–21.
- 27
Leyser O.拍摄分支的控制:植物信息处理的一个例子。植物细胞环境。2009; 32(6):694-703。
- 28
Gomez-Roldan V、Fermas S、Brewer PB、Puech Pages V、Dun EA、Pillot JP、Letisse F、Matusova R、Danoun S、Portais JC等。Strigolactone抑制枝条分枝。自然。2008;455(7210):189–U22。
- 29
Miyazaki J,Tan BH,Errington SG。通过治疗腋芽消除内生细菌矮牵牛织布达使用植物防腐剂(PPMTM)。植物细胞组织org。2010; 102(3):365-72。
- 30.
SirénJ,välimäkin,MäkinenV。用于路径查询的索引图,具有基因组研究中的应用。IEEE / ACM反式计算BIOL BIOINFORM。2014; 11(2):375-88 ..
- 31.
Tafvizi F,Farahanei F,Sheidai M,Nejadsattari T. Zeepin和活性炭在棉花(Gossypium hirsutum L.)中的直接再生中的影响。AFR J BIOTECHNOL。2009; 8(22):6220-7。
- 32.
陈亚、叶杰、张丽、王一赫、张×、陈德赫。转苏云金杆菌基因对棉花赤霉素和玉米素含量及铃发育的影响。2007年田间作物研究;103(1):5–10.
- 33.
Barbier FF,Dun EA,Kerr Sc,Chabikwa Tg,Beveridge Ca.控制拍摄分支信号的更新。趋势植物SCI。2019; 24(3):220-36。
- 34。
潘QC,徐yc,李克,彭y,zhan w,li wq,li l,yan jb。植物建筑遗传基础10玉米重组近交系群体。植物理性。2017; 175(2):858-73。
- 35。
Guo YF,McCarty Jc,Jenkins Jn,Saha S. QTLS用于高地棉花十字架的第一果枝节点的节点,陆地棉原始登录品种德州701。Euphytica。2008;163(1):113 - 22所示。
- 36。
齐香港,王铮,乔·奇,徐QH,周H,Shi JB,严gt,黄Q.用序列(GBS)对三种植物定量特征鉴定基因座的高密度遗传图谱高地棉花的形态特征(陆地棉L.)。Euphytica。2017; 213(4):83。
- 37。
王ZR,崔yy,vainstein a,陈国,马hq。图的调节(Ficus Carica L.)水果颜色:类黄酮化生物合成途径的代谢组和转录组分析。正面。植物SCI。2017; 8:1990。
- 38。
Tuttle Jr,Nah G,Duke MV,Alexander DC,Guan Xy,Song QX,Chen ZJ,Scheffler,Haigler Ch。代谢物和转录组洞察棉纤维如何转变为二次壁合成,抑制跛行,延长伸长率。BMC基因组学。2015; 16:477。
- 39。
Sorefan K,Booker J,Haurogne K,Goussot M,Bainbridge K,Foo E,Chatfield S,Ward S,Beveridge C,Rameau C,等。MAX4和RMS1.是调节射击分支的直替代二恶英酶样基因拟南芥和豌豆。基因开发。2003; 17(12):1469-74。
- 40.
Booker J,Auldridge M,威尔斯,麦卡蒂D,Klee H,Leyser O.MAX3 / CCD7.是一种类胡萝卜素裂解双加氧酶,是合成一种新的植物信号分子所必需的。咕咕叫医学杂志。2004;14(14):1232 - 8。
- 41.
艾蒿,伊赫沙玛k,Maekawa M,Nakajima M,Kojima M,Sakakibara H,Kyozuka J.矮人10., 一个RMS1 / MAX4 / DAD1垂直,控制水稻中的横向芽外。工厂J. 2007; 51(6):1019-29。
- 42.
Snowden Kc,Simkin Aj,Janssen Bj,Templeton Kr,Loucas HM,Simons JL,Karunairetnam S,Gleave AP,Clark DG,Klee HJ。这下降顶端统治者1 /喇叭花杂交语胡萝卜素切割二氧化碳酶8基因影响分支产量,并在叶片衰老,根本生长和花卉发育中发挥作用。植物细胞。2005; 17(3):746-59。
- 43。
Zou J,张某,张W,李G,陈Z,Zhai W,Zhao X,Pan X,Xie Q,Zhu L.稻米高耕作Dwarf1编码了Orthog拟南芥MAX3是负调节腋芽的过度的负调节所必需的。工厂J. 2006; 48(5):687-98。
- 44。
Chatfield SP,Stirnberg P,Forde BG,Leyser O.腋芽增长的激素调节拟南芥.植物j . 2000; 24(2): 159 - 69。
- 45。
Nordstrom A,Tarkowski P,Tarkowska D,Norbaek R,Astot C,Dolezal K,Sandberg G.植物蛋白的细胞素生物合成调节拟南芥:对生长素-细胞分裂素调控的发育具有潜在重要性的因素。P美国国家科学研究院。2004; 101(21): 8039 - 44。
- 46。
Doebley J,Stec A,Hubbard L.玉米顶级优势的演变。自然。1997年; 386(6624):485-8。
- 47。
谭m,李gf,qi sy,liu xj,陈xl,ma jj,张d,韩。鉴定和表达分析IPT.和CKX.苹果腋芽产物中的基因家族(男性有Borkh)。基因。2018; 651:106-17。
- 48。
Tanaka M,Takaa,Kojima M,Sakakibara H,Mori H.Auxin在顶端主导地位中对核心茎中的局部细胞素生物合成控制。工厂J. 2006; 45(6):1028-36。
- 49
Faiss M,ZalubìlováJ,Strnad M,SchmüllingT.条件转基因表达IPT.基因提示细胞分裂素在整个烟草植株旁分泌信号中起作用。植物j . 1997; 12(2): 401 - 15。
- 50。
Müllerd,waldie t,miyawaki k,JPC,Melnyk CW,Kieber Jj,Kakimoto T,Leyser O. cytokinin需要逃脱但不会从养肝介导的顶端主导地位释放。工厂J. 2015; 82(5):874-86。
- 51。
Haberer G,Kieber JJ。细胞蛋白。新洞察经典的植物激素。植物理性。2002; 128(2):354-62。
- 52。
jp,haberer g,ferreira fj。类型A.拟南芥响应调节剂是细胞分裂素信号传导的部分冗余负调节剂。植物细胞。2004; 16:658-71。
- 53。
赵Z,安德森苏,Ljung K,Dolezal K,Miotk A,Schultheiss Sj,Lohmann Ju。枝条茎细胞的激素控制。自然。2010; 465(7301):1089-U154。
- 54.
引用本文:史剑波,王宁,周慧,徐庆华,闫桂田。赤霉素合成酶基因的作用ghga2ox1在高地棉花(陆地棉l)对干旱和盐胁迫的响应。生物技术应用生物。2019;66(3):298-308。
- 55.
Smigocki AC。由重建的异戊基转移酶基因转化的植物中的细胞蛋白含量和组织分布。植物mol biol。1991; 16(1):105-15。
- 56.
程WH,朱·赫,天文,朱世,熊XP,孙紫置,朱QH,Sun J. de Novo转录组分析揭示了高地棉花(G-Hirsutum L.)体细胞胚胎发生的动态性稳态调控的见解。植物mol biol。2016; 92(3):279-92。
- 57.
Reddy Sk,Holalu SV,Casal JJ,Finlayson SA。脱落酸调节腋芽过度响应红色与远红光的比例。植物理性。2013; 163(2):1047-58。
- 58。
Rodrigues MA,Freeschi L,Purgatto E,Lima VFGAP,Kerbauy GB。乙烯调节体外生长的内华兰果实FIMBRIATUM中枝条和根系之间的发育可塑性和生长平衡。J工厂增长调节。2014; 33(3):513-25。
- 59。
Mason Mg,Ross JJ,Babst Ba,Wienclaw BN,Beveridge Ca.糖需求,而不是植物素,是顶级优势的初步调节因素。P美国国家科学研究院。2014; 111(16):6092-7。
- 60.
王世光,裴JL,李杰,唐GJ,赵JW,彭XP,聂SX,丁YL,王CM。云南箭竹新梢生长过程中蔗糖和淀粉的代谢。植物生理学。2020;168(1):188–204.
- 61.
Sergeeva L,Claassens M,Jamar D,PLAS L,Vreugenhil D.马铃薯块茎休眠和发芽期间的淀粉相关酶。Russ J植物Physl +。2012; 59(4):556。
- 62.
干旱胁迫对两个玉米品种可溶性蛋白的影响。中国生物医学工程学报。2008;32(1):23-30。
- 63.
Moriya Y, Itoh M, Okuda S, Yoshizawa AC, Kanehisa M. KAAS:一个自动基因组注释和路径重建服务器。核酸杂志2007;35:W182-W85。
- 64.
ikram-ul-haq。棉花愈伤组织增殖和体细胞胚胎发生(陆地棉L.)。AFR J BIOTECHNOL。2005; 4(2):206-9。
- 65.
张立,冯·刘炜,王QL。高频体细胞胚胎发生及精英中国棉花植物再生。Bot Bull Acad Sinica。2001; 42(1):9-16。
致谢
不适用。
资金
国家重点研发计划项目(no . 2018YFD0100300);国家现代农业产业技术体系项目(no . CARS-18-05);中央公益科研机构基础研究基金项目(no . 1610162019010104)。资助机构没有参与研究的设计、收集、分析、解释数据,也没有参与手稿的撰写。
作者信息
隶属关系
贡献
GY和JS设计了这个实验。NW和JS准备了这个实验。Hz和QX进行了数据分析。JS和NW编写并修订了这份手稿。所有作者都读过并批准了稿件。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
作者宣称没有利益冲突。
额外的信息
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
补充信息
附加文件1:图S1
.蛋白酒分类组装的unigenes。X轴:26个类别的蛋白,y轴:y轴的名称:类别中注释的Unigene数量。
附加文件2:表S1。
用于定量RT-PCR验证的基因的引物序列。
附加文件3:表S2。
原始数据分析综述。
附加文件4:表S3。
RNA-SEQ地图摘要。
权利和权限
开放访问本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。要查看本许可证的副本,请访问http://creativecommons.org/licenses/by/4.0/.Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有用入数据的信用额度。
关于这篇文章
引用这篇文章
Shi,J.,Wang,N.,周,H.et al。转录组分析为陆地棉腋芽的内环境平衡调控提供了洞见(G. Hirsutum.L.)。BMC植物BIOL.20,228(2020)。https://doi.org/10.1186/s12870-020-02436-x.
收到了:
公认:
发表:
关键字
- 旱棉
- 腋芽
- 转录组
- de