摘要
背景
在十字花科植物中,花粉与柱头的亲和相互作用的早期阶段被严格控制,早期的检查点调控花粉的粘附、水化和萌发,以及花粉管进入柱头表面。然而,在病耻感中触发这些兼容相互作用的早期信号事件仍然未知。
结果
一组耻辱表达的伪转基因基因,称为芸苔(BKNs),被确定,并发现存在于唯一的核心十字花科基因组。in.拟南芥蒂利亚纳COL-0,BKN1柱头特异表达BKN2基因在其他组织中也有表达。这两个串联的基因产生了CRISPR缺失突变BKNs在放置时,观察到野生型COL-0花粉中观察到非常温和的水合缺陷。bkn1/2变异的污名。进一步分析,主要转录本为柱头特异性BKN1在col0生态型中发现了一个过早终止密码子,但对1001拟南芥基因组揭示了三种编码全长BKN1蛋白的生态型。此外,系统发育分析在密切相关的异交中鉴定出完整的BKN1同源物拟南芥物种,答:lyrata和A. Halleri..最后,我们发现BKN假激酶通过肉豆蔻酰化和棕榈酰化的双重脂质修饰实现了质膜定位,这一定位与信号复合物的作用相一致。
结论
在本研究中,我们对十字花科的新科BKN.伪激酶基因,并检测其功能BKN1和BKN2在花粉 - 耻辱互动的背景下A. Thaliana.Col-0。此外,在预测的柱头特异性中发现了过早终止密码子BKN1基因中的1001个A. Thaliana.生态型基因组,这与异种杂交形成对比拟南芥携带完整副本的物种BKN1.因此,了解的功能BKN1这将是未来研究的关键方向。
背景
在十字花科植物中,花粉粘附和水合作用的早期授粉后阶段,以及花粉管进入柱头的阶段是高度调控的,是导致胚珠释放精子细胞进行受精的几个阶段中的第一个阶段。1,2,3.,4,5])。特征性的Brassicaceae“干柱”缺乏表面分泌物,以促进花粉水合和发芽;因此,耻辱是接受的花粉识别[6,7].十字花科柱头表面覆盖着单细胞柱头乳头,花粉捕获过程非常迅速,在亲和授粉后仅需30秒即可完成拟南芥蒂利亚纳(8].在此之后,花粉外套和柱头表面组分混合以形成“花粉脚”在花粉乳头接触的位置,并且这有助于花粉粘附过程[9].花粉接受下一个检查点是花粉水合,其中所述干燥的花粉粒占用由柱头乳头释放的水,成为具有代谢活性[6,10.,11.,12.].
尽管是导致施肥成功的关键步骤,但促进了早期花粉 - 耻辱互动的细胞 - 细胞通信事件尚不清楚。花粉涂层中有花粉水合需要的蛋白质如A. Thaliana.GRP17 Oleosin - 结构域蛋白,EXL4细胞外脂肪酶和花粉蛋白-B系列(PCP-B)[13.,14.,15.].pcp - b特别有趣,因为它们是小的富含半胱氨酸的蛋白质,代表未知柱头受体有希望兼容的花粉识别因子。A. Thilana PCP-Bα/β/γ三突变体显示野生型柱头上花粉水化受损和花粉管生长延迟[15.].在自交不亲和的十字花科植物中,受体激酶对肽配体的感知在下游亲和花粉-雌蕊相互作用和花粉管引导以及自交花粉的排斥中发挥着重要作用。1,2,4,5,16.])。
在这些早期授粉阶段的花粉侧鉴定的其他因素与反应性氧(ROS)的生产相连。Pollen NADPH氧化酶显示为CA很重要2+-依赖的ROS的产生A. Thaliana.花粉管延伸到柱头乳头细胞壁[17.,18.].活性氧的产生与A. Thaliana.T-DNA插入突变体扰乱了snf1相关蛋白激酶1复合物的β和γ亚基。突变体亲属βγ花粉粒显示的缩小ROS水平线粒体和过氧化物酶体缺陷的结果,而这是与在野生型柱头降低水合和萌发[相关联19.].最后,摇床花粉向内k+渠道(美籍西班牙人发现基因在下调亲属βγ突变花粉,和美籍西班牙人突变花粉粒在野生型柱头上也显示水合作用减少[20.].
在柱头乳突侧,花粉-乳突界面的超微结构研究揭示了柱头乳突的分泌活动和液泡扩张芸苔和拟南芥物种[21.,22.,23.,24.,25.].这个外囊复合体,一个由8个不同亚基(SEC3, SEC5, SEC6, SEC8, SEC10, SEC15, EXO70和EXO84)组成的囊泡栓系复合物,涉及介导柱头中的这种分泌活动[26.,27.,28.].通过敲除突变体和柱头特异RNA沉默结构,发现柱头中所有8个亚基都是兼容花粉接受所必需的。从外囊亚基敲除/敲除突变体中应用到柱头上的野生型花粉显示花粉水化和萌发减少,并显示分泌中断的迹象[22.,26.,27.,29.,30.].其他细胞反应芸苔和拟南芥柱头乳头也与囊泡贩运有关(在[31.])。例如,芸苔与花粉附着位点和微管解聚的耻骨乳头肌瘤重组有关携带粉粉末与微管解聚有关[25.,32.].最近,另一个与囊泡贩运相关的成分,芸苔磷脂酶Dα1已被证明在耻辱中需要兼容授粉[33.].还有,Ca的变化2+在小Ca2+在花粉附件现场增加A. Thaliana.丑恶的乳头状突起(34.].通过转录组分析A. Thaliana.柱头前后授粉时,ACA13钙2+鉴定ATP酶作为柱塞组分,并提出分泌CA.2+用于开发的花粉管[35.].最后,我们最近发现了这个秘密拟南芥E6-like 1蛋白作为这些早期授粉后阶段所需的柱头乳头的潜在结构成分[36.].
虽然PCP-BS代表兼容花粉识别潜在的花粉配体,在柱头相应的识别系统是未知的。花粉接受由柱头的过程被认为是在十字花科因为花粉从几个十字花科物种中是保守们能够水合物上发芽拟南芥而来自非十字花科物种的花粉未能水合物[37.].此外,当从各种物种的花粉中施加时A. Thaliana.或者B. Oleracea.柱头,在花粉粘附阶段有一定的特异性[8,38.].因此,在这项反向遗传学研究中,我们利用公开的转录组数据来寻找在十字花科中具有丰富的柱头表达和保守的潜在信号传递基因。通过这种方法,我们确定了一组新的十字花科特异性伪激酶基因,我们称之为芸苔(BKNs).
结果
BKN.S是柱头表达的受体样胞浆激酶
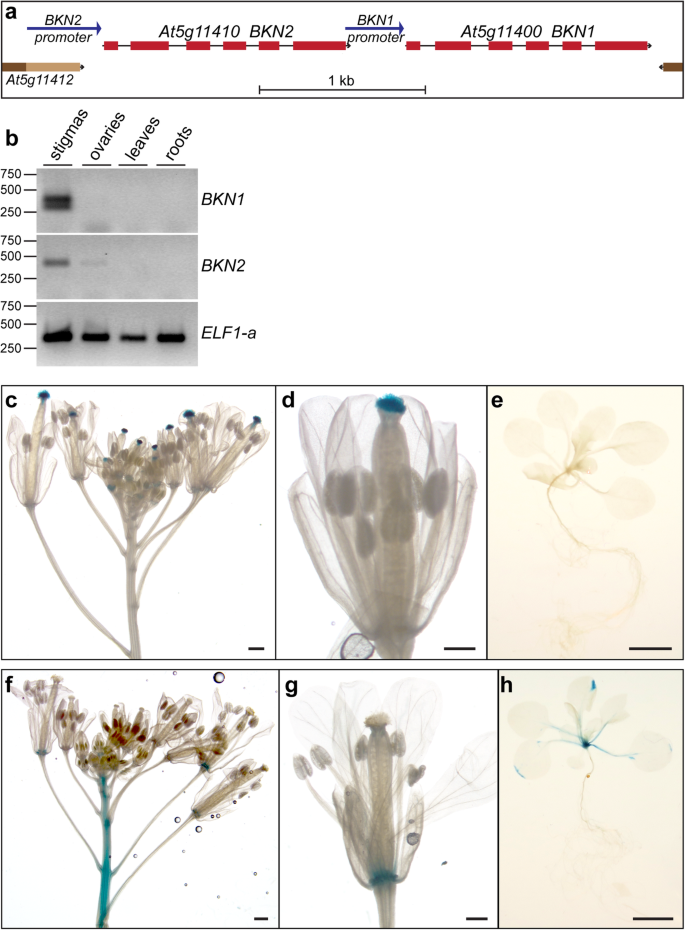
为了识别候选柱头信号的基因,我们使用了表达钓者工具植物生物学生物分析资源(39.].对于此搜索,我们使用了特定于耻辱SLR1.基因(40]作为诱饵,以识别在整个基因组中具有类似表达模式的其他基因A. Thaliana.发展系列微阵列数据集[36.,41.,42.].这个基因,At5g11400,是最受欢迎的(附加文件2:表S1),并显示在转录组数据集中的柱头特异性表达(附加文件1:图S1,[35.,43.,44.])。该基因预计编码一种新的受体样胞浆激酶(RLCK),我们将其命名为RLCKBRASSIKIN 1(BKN1).有趣的是,邻近的BKN1基因是串联连接旁系,At5g11410,命名BKN2在A. Thaliana.基因组(图。1a)。BKN2排名第64中的表达数据集垂钓者(附加文件2:表S1),在更广泛的组织中表达(附加文件1:图S1)。这两个BKN.基因也被预测编码伪激酶(下面讨论)[46.,47.].
的组织特异性表达模式BKN1和BKN2in.A. Thaliana..一个。基因结构为串联连接BKN1和BKN2基因。用于启动子区域BKNp:格斯结构用蓝色箭头表示。b。不同组织的RT-PCR分析显示BKN1和BKN2柱头上的表达。观察到双PCR条带BKN1是第三内含子未正确拼接在顶部带(通过测序确定)的结果。这也是在Carpel RNA-SEQ映射数据中看到的(图。5).c -e.格斯来自不同组织的染色BKN1p:格斯转基因植物。GUS活性在花序各个发育阶段的柱头中都能检测到(c,d),而在包括幼苗在内的其他组织中不能检测到(e)。f-h。来自不同组织的GUS染色BKN2p:格斯转基因植物。检测到GUS活性的主要花卉离层区和茎(f, g)。GUS染色也见过叶的叶柄和技巧大约一半的样品(h)。规模酒吧1厘米花序的图像(右),和500μm阶段12花(中心)和100μm的幼苗(左)
表达式模式BKN1和BKN2通过RTNA上提取的RT-PCR检查A. Thaliana.柱头(顶部½雌蕊),子房(底部½雌蕊),叶和根。这两个BKN1和BKN2在柱头样品中表达,其中BKN2卵巢标本(图。1b)。的BKN1和BKN2在启动子中也检测了表达模式格斯转基因植物(启动子区域用箭头表示。1a)转基因BKN1p:格斯a芥线,染色花序显示在柱头高水平GUS活性的来自整个发育阶段的花,但不是在花序或在幼苗其它组织(图1C-E)。转基因BKN2p:格斯花序主要显示在花脱落区域和茎中的GUS活动(图。1做减法)。部分菌体也有GUS活性BKN2p:格斯叶片边缘和叶柄处的幼苗(图。1h)。没有观察到GUS活动BKN2p:格斯组织污名;然而,这可能是由于BKN2柱头中表达较低,GUS染色可能无法检测(附加文件)1:图S1)。或者,相邻的柱头特异性BKN1启动子或其他未知的调控区域可能负责BKN2在耻骨组织中检测到的表达(图。1a、b)。
兼容花粉响应分析BKN1和BKN2在单,双敲除突变A. Thaliana.
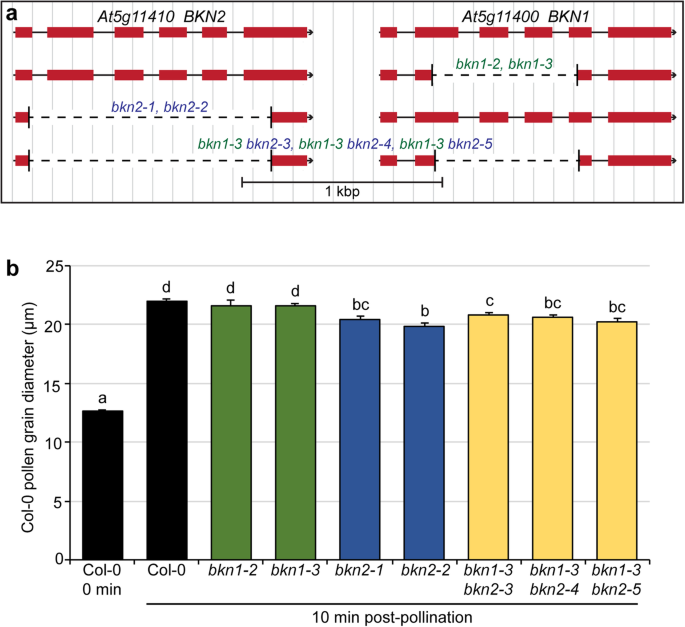
鉴于BKN1具体的耻辱表达,我们调查了吗?BKN1通过检测功能突变体的缺失,为亲和授粉提供了必要条件。在第五外显子中插入T-DNA的敲除线BKN1对授粉后的反应进行评估(bkn1-1;额外的文件1:图S2A,B)。的bkn1-1突变植物未显示任何可辨别的发育缺陷,并与野生型单件完全肥沃。此外,授粉bkn1-1苯胺蓝染色的雌蕊与野生型相似,花粉粒粘附和花粉管生长情况相似1:图S2C,D)。鉴于该突变体在T-DNA插入的上游显示了一些表达,另外BKN1利用CRISPR/Cas9基因组编辑系统生成突变体[48.].此外,对BKN2也采取了类似的方法,因为它可能会冗余地作用于BKN1。单个缺失突变体产生两个新的独立纯合子突变体BKN1和BKN2:bkn1-2和bkn1-3,和bkn2-1和bkn2-2(无花果。2a)。
花粉水合测定A. Thaliana.Col-0.bkn1和bkn2CRISPR缺失突变体。一个。串联连接的结构BKN1和BKN2基因组区域描绘CRISPR缺失的位置。的bkn1和bkn2单独产生缺失突变体,通过测序确认粘度生成的缺失。的bkn1-3然后用CRISPR构建体转化突变体以删除BKN2基因导致bkn1 bkn2双突变体。b。授粉后10分钟进行花粉水化试验。采用野生型col0花粉对col0柱头进行处理BKN.突变柱头,静置10分钟。花粉水化导致花粉直径的变化,这是在授粉后10分钟测定的。带有突变的柱头BKN2与col0柱头相比,col0花粉水合作用降低。n=每行30个花粉粒。字母表示具有统计学意义的分组p < 0.05 based on a one-way ANOVA with a Duncan post-hoc test
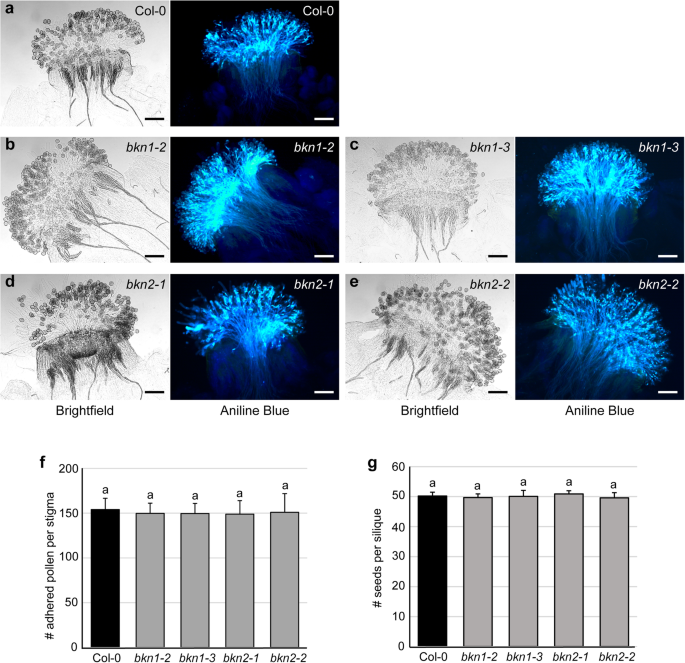
类似于bkn1-1,所有四个CRISPR缺失突变体bkn1-2,bkn1-3,bkn2-1和bkn2-2展示野生型花粉管生长苯胺蓝染色的雌蕊,其用野生型COL-0花粉手动授粉(图。3.A-E)。有在这个阶段,个人没有明显的表型bkn1和bkn2功能丧失的突变体。与Col-0相比,这些突变体附着在柱头或结实处的花粉粒数也没有明显的缺陷。3.做减法)。然后我们检查了最早的兼容性授粉阶段之一,花粉水合,这取决于耻辱的水释放[6,26.,27.].通过测量与水摄取的圆角的花粉颗粒的直径来评估COL-0 Pollen,并通过测量花粉颗粒的直径来评估花粉水合。Col-0在Col-0柱上的花粉在10分钟后的平均花粉粒径为21.9μm,粉末后10分钟,0分钟为12.6μm。的bkn1-2和bkn1-3与COL-0颗粒相比,突变液相支持类似于COL-0花粉水合物的相似水平(图。2b).相比之下,Col-0的花粉放在bkn2-1和bkn2-2突变体的柱头直径在授粉后10分钟显著减小。这提示在花粉上存在轻度的col0水化缺陷bkn2-1和bkn2-2突变体柱头(图2b)。
单次分析bkn1和bkn2Crispr突变体。A-E..13期雌蕊用野生型col0花粉授粉2 h,固定后苯胺蓝染色。Brightfield图像(左)显示花粉颗粒粘附在柱头乳头上,荧光图像(右)显示花粉管中胼胝质的苯胺蓝染色。col0授粉雌蕊的代表图像(a)bkn1-2(b)bkn1-3(c),bkn2-1(d)和bkn2-3(e)示出相似的花粉附着性和花粉管渗透。比例尺= 100 μm.F。在授粉后2小时苯胺蓝染色后,col0花粉粒粘附在柱头上的数量bkn1和bkn2突变体。在染色过程中,未发芽的花粉粒被洗掉,因此粘附的花粉粒的数量可以被量化。n = 10 stigmas per line.G。用col0花粉手工授粉后的结实率。所有bkn1或者bkn2突变体显示正常种子集,类似于Col-0。每条线= 10个单片机。字母代表基于具有Duncan后Hoc测试的单向ANOVA的P <0.05的统计显着分组。(f)和(g)没有观察到显着差异
为了测试潜在的功能冗余,双bkn1-bkn2产生突变体。自从此以来BKN1和BKN2基因是串联排列的,所采取的策略是转化一个无转基因的bkn1-3突变体与BKN2CRISPR构建来敲除这两个基因。从这个屏幕,三个新的bkn2突变体,bkn2-3,bkn2-4和bkn2-5,在bkn1-3背景(图。2a)。在这些双层上进行花粉水合测定bkn1-bkn2在纯合子突变体上,放置在这些突变体柱头上的col0花粉也有轻微但显著的减少(图。2b).类似于单一突变体,双授粉bkn1-bkn2苯胺蓝染色的突变体雌蕊表现出野生型水平的花粉粒黏附和花粉管生长(图。4).因此,两种物质都被敲除,似乎没有任何附加效应BKN1和BKN2,并建议高表达,柱头特定的BKN1在花粉-柱头相互作用中没有显示出明显的功能。
预测的蛋白质翻译产物的变化BKN1在不同的A. Thaliana.生态型
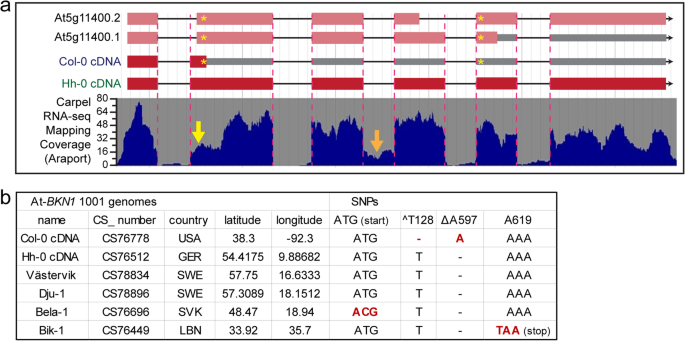
随着bkn1突变体呈现野生型授粉后表型,预测的蛋白序列编码BKN.基因被更仔细地检查。BKN.cdna从A. Thaliana.COL-0生态型并与TAIR / ARAPORT基因注释进行比较[45.,49.].而BKN2cDNA序列与预测的氨基酸序列与基因注释相符,为全长BKN1cDNA显示出一些差异(图。5一个额外的文件1:图S3)。重要的是,CDNA中的第二外显子包括在5'末端的另外的17bp,导致框架和过早止芯密码子(图。5一个星号)。结果,预测A. Thaliana.与预测的304 aa相比,Col-0 BKN1蛋白的长度只有42 aa1:图S4)。克隆的BKN1 cDNA与Araport上显示的心皮RNA-Seq图谱数据相匹配。5一个);然而,在第二个外显子的开始处似乎也存在潜在的替代剪接位点,可以恢复BKN1阅读框并编码更大的蛋白质(即BKN1基因注释;图中的黄色箭头。5A;额外的文件1:图S3,S4)。而两个BKN1图中观察到的RT-PCR条带。1B,更大的带是通过测序确定的,包括第三个内含子,而不是一个选择性剪接的转录本。在Araport上显示的心皮RNA-Seq图谱中也有未剪接的第三个内含子的迹象(图中橙色箭头)。5a)。尽管有几次尝试,我们无法克隆BKN1与TAIR/Araport基因注释对应的cdna。
A. Thaliana BKN1.基因模型和生态型多态性。一个。A. Thaliana BKN1.基因模型被示出具有心皮RNA测序映射覆盖率从Araport [45.].黄色的喧嚣(*)标记两个在col-0中的/ del snpsBKN1与h-0相比BKN1和A. Lyrata BKN1..对于BNK1 col0基因注释和cDNA,第一个星号表示1 bp的缺失(T),导致相邻的过早终止密码子,第二个星号表示1 bp的插入(a),导致at5g1140.0.1注释的过早终止密码子的下游。根据减小的心皮RNA-Seq覆盖在5 '末端BKN1外显子2,可能有备用剪接位点在使用(黄色箭头),这些潜在的备用剪接连接将恢复BKN1如at5g1140.0.1和at5g1140.0.2注释所预测的那样,col0阅读框产生更长的蛋白质。参见附加文件1:图S3和S4。橙色箭头描绘了在图3中的顶部RT-PCR条带中不适当拼接的第三内含子。1B..b。A. Thaliana BKN1.不同生态型的多态性。除了HH-0,预计Västervik和DJU-1还预测了全长BKN1蛋白(基于基因组测序)。Bela-1和Bik-1显示其他SNPS中断BKN1开放阅读框(另请参阅附加文件1:图S6)
搜索BKN.两种外交的基因种子拟南芥物种,答:lyrata,和A. Halleri.,揭开BKN1编码进行预测,地区是完全完好无损。这是通过从克隆相应的cDNA确认答:lyrata(附加文件1:图S3、S4和S5)。什么时候BKN1对齐序列,在其中鉴定了两种诱导A. Thaliana.Col-0.BKN1破坏阅读框的cDNA序列(图。5,星号),第一是1bp删除(Δt128),第二是1bp插入(^ a597;附加文件1:图S3)。然后我们通过1135个基因组数据集进行搜索,以确定这些普及BKN1indels在不同的不同A. Thaliana.指标(50.].大多数的生态型进行ΔT128导致过早终止密码子的Col-0BKN1(附加文件3.:表S2)。有趣的是,三个A. Thaliana.预计生态型已经完全完好无损BKN1编码区域。第一个确定的生态型为Hh-0,克隆了相应的cDNA并测序确认,编码一个与Al-BKN1类似的全长BKN1蛋白(图1)。5额外的文件1:图S3、S4和S5)。随后的搜索还发现了另外两个生态型,Dju-1和Västervik,它们也被证实携带与Hh-0相同的两个插入位点,以编码全长BKN1蛋白(图)。5b,额外的文件1:图S6,附加文件3.:表S2)。然而,在其他一些生态型中,两个orf -恢复位点(^T128, ΔA597)的存在与新的snp有关,这些snp将再次敲除orf -恢复位点BKN1编码区。This included the loss of the start methionine (ATG → ACG) and a new stop codon (TAA) downstream of ΔA597 (Fig.5额外的文件1:图S6,附加文件3.:表S2)。Hh-0表达完整的at - bkn1基因,对Hh-0花进行花粉水化试验,观察授粉后早期是否有变化,然后与col0在互花授粉中进行比较,但未观察到明显差异(附加文件)1:图S7)。
BKNS在芸苔属中保存,但在这个家庭之外的物种缺席
考虑到BKN1发现的多态性拟南芥物种基因组,我们也进行了相关研究BKN.其他植物的基因。bkn是第VII组rlck(附加文件)的一部分1:图S8;由[51.])包括许多重要的信号蛋白,例如Botrytis诱导的Kinase1(Bik1 [52.]),并用植物免疫信号相关联的各种PBS1样(PBL)的蛋白质[53.,54.].BKNS与Castaway最密切相关(CST [55.])和pbl31 [53.)(附加文件1:图S8)。RLCKs涉及植物受体激酶[51.,56],但它们缺乏胞外结构域,通常在与受体激酶的复合物中起作用[57,58,59].BKN1和BKN2与CST(一种参与花脱落的活性激酶)的比对[55.])清楚地表明,BKNs缺少几个关键残基为ATP结合和催化活性,包括富含甘氨酸的环路和VAIK,HRD和DFG基序,并且作为结果,被定义为pseudokinases [46.)(附加文件1:图S9)。尽管一些pseudokinases可以表现出局部激酶活性,BKNs被预测为不活动的,由于其所需的催化活性的残基缺失,特别是富含甘氨酸的环路和VAIK基序的数目[46.,60].
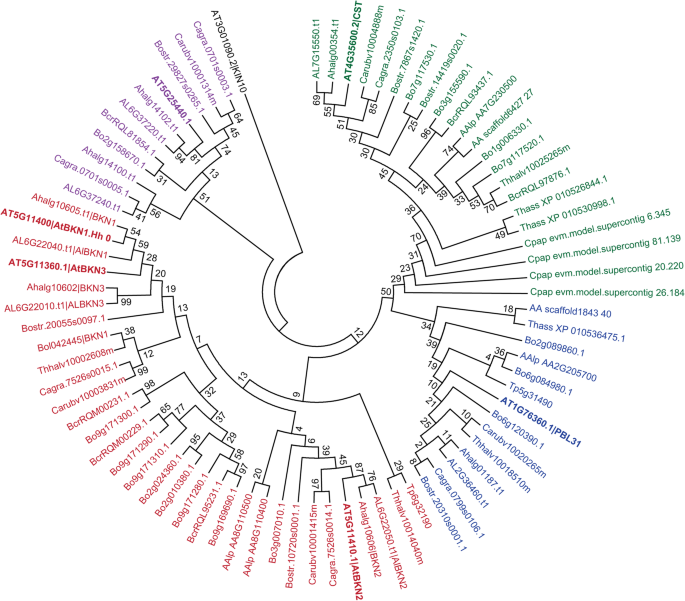
调查…的分布BKN.在植物基因组中进行BLAST搜索A. Thaliana.BKN氨基酸序列以及3个紧密相关的RLCK氨基酸序列:At5g25440、PBL31 (At1g76360)和CST (At4g35600)。这三个预测蛋白被选中,因为它们与RLCK-VII树中的bkn聚类(附加文件1:图S8)。在这些搜索中,三分之一A. Thaliana Bkn.ParaLogue在5G11360(BKN3;额外的文件1:图S4)。一般会员BKN3预测有大量~ 140个氨基酸的内部缺失,而答:lyrata和A. Halleri.编码一个完整的BKN3s(附加文件1:图S4和S5)。我们鉴定了所有十字花科基因组的BKN同源物,包括A.糊菜,A halleri,高山南芥,Boechera STRICTA,荠菜风疹,凌霄,甘蓝cretica,甘蓝,山嵛菜salsugineum(原Thellungiella halophila),Schrenkiella parvula.(原T. parvula.).同系物的数目从一到二不等S. parvula.九中B. Oleracea..有趣的是,bkn都被预测为伪激酶(附加文件1:图S9),且仅存在于核心十字花科基因组中,而不存在于基底十字花科物种基因组中,Aethionema arabicum(61].我们的搜索被扩展为包括其他芸苔属家庭的两个基因组(tarenaya hassleriana,醉蝶花科;卡里卡番木瓜,番木瓜),并且所检索的序列的系统发育分析表明不存在的BKN.这些基因组中的同源物(图。6).Brassicaceae核心的bknn与VIIa RLCKs的同源基因(At5g25440, CST, PBL31;无花果。6).
十字花科BKN及RLCK组VIIa蛋白序列的系统发育分析。序列是Arabidopsis Thaliana,A.Lyrata,A. Halleri,Arabis Alpina,Boechera Stricka,Brassica Cretica,B. Oleracea,风疹荠菜,大花荠菜,盐芥(原t . halophila),Schrenkiella parvula.(原T. parvula.),Aethionema树胶,Tarenaya hassleriana,和卡里卡番木瓜.红色分支代表BKN分支,品红色分支代表at5g25440相关的rlck,蓝色分支代表at1g76360相关的rlck,绿色分支代表CST (At4g35600)相关的rlck。A. Thaliana.选择At5g25440.1, At1g76360.1和at4g3560.2的蛋白序列,与RLCK-VIIa树中的bkn聚类进行搜索和系统发育分析(附加文件)1:图S7)。选择Kin10(AT3G01090.2,SNRK1激酶)作为除群。分析涉及90个氨基酸序列,序列使用CLUSTALW对齐[62]在mega7软件中[63].对排列的n端和c端进行修剪(序列和排列见补充文件),使用最大似然法构建树[64]在MEGA 7软件中。剔除所有包含缺口和缺失数据的位置,最终数据集中共有28个位置。mega7中生成的树表示从1000个重复推断的引导一致树[65]
通过预测n端豆蔻酰化和棕榈酰化位点对bkn的质膜定位
尽管缺乏激酶活性,但伪转酶确实在生物系统中发挥多种作用,并且通常与细胞膜处的其他信号蛋白相关联66,67,68,69,70,71,72,73,74].虽然bkn作为典型的rlck缺乏胞外和跨膜结构域,但它们具有n端肉豆蔻酰化和/或棕榈酰化的保守残基。这些n端脂质锚点可以将蛋白质定位到细胞膜上,在细胞膜上它们可能接近其他信号蛋白和受体[75,76,77].甘氨酸在2号位的存在是肉豆芽酰化所必需的,而半胱氨酸在4号位的存在是棕榈酰化所必需的[78].有趣的是,所有的十字花科BKN同系物有预测豆蔻网站(G2,附加文件1:图S9),而一些在n端也有一个预测的棕榈酰化位点(C4;额外的文件1:图S9)。具体地,A. Thaliana.BKN1,A. Thaliana.BKN2和答:lyrataBKN2同时具有G2和C4位点答:lyrataBKN1不仅具有G2豆蔻网站(附加文件1:图S5和S9)。中使用瞬态表达式系统烟草benthamiana叶表皮细胞,C末端YFP融合[79然后测试四种蛋白质的潜在血浆膜定位。HH-0的全长AT-BKN1与来自COL-0,Al-BKN1和Al-BKN2的AT-BKN2进行测试(图。7).所有四个BKN:YFP蛋白似乎主要定位于质膜(图。7A-D),AT-BKN1:YFP和Al-BKN1:YFP还显示对核的一些定位(图。7A-B)。目前还不清楚意想不到的部分核定位是否与蛋白质功能或人为造成的分裂和YFP的错误定位。同时,铝BKN1:定位于质膜的YFP的格局并没有显得紧张,因为其他BKNs,但是这可能与铝BKN1只具有豆蔻网站[81].豆蔻酰化允许与膜瞬态关联而棕榈酰化和豆蔻酰化的组合更有效地锚定蛋白至质膜,虽然这些蛋白质修饰保持可逆,以便瞬时膜协会[81].
共聚焦显微成像本塞姆氏用C末端BKN渗透叶子:YFP融合蛋白。A-B。BKN1主要定位于质膜(PM),对At-BKN1 (a)和Al-BKN1 (b)也有一些细胞核定位(N)。Hh-0生态型的BKN1 cDNA被用来表达At-BKN1蛋白(见正文)。C-d。BKN2主要定位于β-BKN2(C)和Al-BKN1(D)的血浆膜(PM)。e-g。质膜定位出现中断在豆蔻(G2A)和棕榈(C4A)网站突变铝BKN2版本。图像示出了用于单个G2A突变体(e)中,单突变体C4A(f)和一倍G2A突变体C4A(克)的Al-BKN2的版本。Localization is seen in the cytoplasm (CS = cytoplasmic strands) and nucleus (N).h。A. Thaliana.CAM4:YFP用于比较细胞质(CS =细胞质链)和核(N)中的YFP荧光的定位。我。用Al-BKN2渗透的细胞使用0.8M甘露醇渗透溶解。质子细胞中的定位主要在细胞周边仍然存在。在Applastic Space(A)中也有一些定位的Hechtian Strands。Hechtian Strands是连接到细胞壁的血浆膜小管[80].在OD600 = 0.5处渗透YFP融合构建体,并在接种后24小时进行图像。秤条=30μm
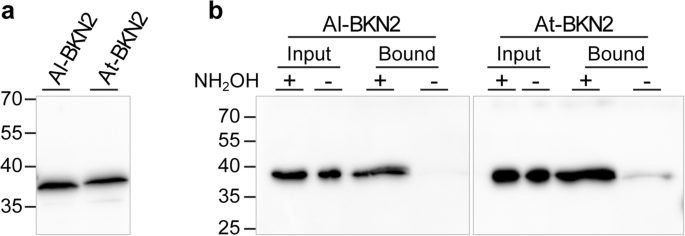
使用Al-BKN2:YFP和AT-BKN2:含有G2和C4位点的YFP并显示出强烈的血浆膜定位,如果在酵母细胞中表达时,这些蛋白质可以是棕榈酸盐的。将BKN2蛋白质与转化的酵母细胞分离(图。8A),然后测试年代- 使用体外酰基-RAC(树脂辅助捕获)测定进行戊酰胺[82].在封闭游离硫醇之后,用羟胺(+)处理蛋白质以除去棕榈酰酸盐并在棕榈酰基位点处暴露自由硫醇或未治疗( - )。在(+)泳道中检测到Al-BKN2和AT-BKN2,表明这些蛋白质已被S-棕榈酰化并被捕获在羟胺处理后的硫醇反应性树脂上(图。8b)。最后,由于Al-BKN2:YFP特别高的荧光水平以及血浆膜的强烈定位(图。7d),我们测试了破坏Myristoylation和Palmitoylation位点对其本地化模式的影响。氨基酸酵母(G2A)位点,棕榈酰化(C4A)位点或(G2A,C4A)中的(G2A,C4A):YFP中断其血浆膜定位,导致细胞核和细胞质的错误定位本塞姆氏叶表皮细胞(图。7e-g),类似于CAM4:YFP控制(图。7h).细胞被Al-BKN2:YFP通过用0.8M甘露醇处理来自细胞壁的细胞收缩和血浆膜解离,还通过处理水分溶解。BKN2:在血浆膜上观察到紫外线定位,在等离子体膜从细胞壁中脱离,并且在胎选空间中的Hechti股线(图。7i).其他bkn在质壁分解后也观察到类似的结果(附加文件1:图S10)。对于在MyRistoylation(G2A)和/或棕榈酸盐(C4A)位点突变的Al-BKN2版本中,在具有YFP信号中再次观察到破坏的血浆膜定位,YFP信号变得越来越弥漫,并且在核中发生一些定位(附加文件1:图S10)。因此,该数据强有力地支持了BKNs具有N-末端脂质锚定位于质膜,和脂肪酸修饰位点(G2,C4)的破坏导致的误定位到其他亚细胞区室。
Al-BKN2和At-BKN2的棕榈酰化。(一个)蛋白质表达和(bAl-BKN2和At-BKN2棕榈酰化分析。从酵母细胞中纯化BKN2蛋白并进行检测年代-palmitoylation使用体外酰基RAC测定法82].通过C末端V5表位标签检测BKN2蛋白质,并用抗V5抗体蛋白质印迹。在+ nh中存在带的乐队2OH绑定的泳道表明,在酵母细胞中表达时,BKN2蛋白均为棕榈酰胺
讨论
在这项研究中,我们研究了一个新的伪激酶基因家族芸苔(BKNs),只在核心十字花科物种中发现。十字花科的基因组通常携带两到三个不同的基因BKN.基因,除了芸苔往往有更高的基因组,最多九到九个预测BKN.二倍体物种的基因。bkn属于受体样胞浆激酶(RLCK)亚家族,因此缺乏外部信号感知所需的细胞外结构域。rlck在植物细胞信号转导中发挥多种作用,通常通过与受体激酶的相互作用[57,58因此,可以想象bkn在信号通路的受体激酶复合物中起作用。例如,A. Thaliana.CASTAWAY (CST)是一种质膜定位的RLCK,已被证明与HAESA和EVERSHED两种受体激酶相互作用,并作为花器官脱落的抑制剂[55.].CST也通过n端豆蔻酰化和棕榈酰化位点定位于质膜,当n端脂质锚定位点发生突变时,定位模式向细胞质转移[55.].在这里,我们已经表明BKN1和BKN2预测了n端棕榈酰化和/或肉豆蔻酰化位点,并定位于质膜本塞姆氏表皮细胞。同样,使用乙酰丙基-RAR测定法确认酵母表达的BKN2是棕榈酰基化。最后,我们观察到,MyRistoylation和棕榈酰基化位点的突变对于Al-BKN2中断膜定位本塞姆氏表皮细胞。因此,BKN1和BKN2的质膜定位可以定位这些rlck与受体复合物的相互作用。
虽然许多rlck,如CST,是功能性激酶,但bkn被预测为伪激酶,这意味着它们缺乏磷酸转移所需的催化基元[46.,60].存在具有非常低的自磷酸化活性的假转酶酶的实例,这通常需要Vaik基序的催化赖氨酸,通常也是HRD和DFG基序的天冬氨酸[46.].此外,虽然大多数伪激酶缺乏催化活性,但据估计,近40%的伪激酶能够结合核苷酸[46.].然而,BKNs缺乏所有ATP结合和催化活性所需的关键主题,包括VAIK与关键催化赖氨酸以及人力资源开发和DFG基序的46.,60].在最近的一项研究中,1005的168拟南芥预测激酶被分类为伪激酶[47.].其中一些拟南芥伪转基因酶(也称为非典型激酶[83)已被证明具有与信号传递有关的生物功能[66,67,68,69,70,71,72,73,74,84,85].其中一个例子是油菜素内酯信号激酶(bsk),它是一组12个密切相关的、功能冗余的胞浆伪激酶,通过与受体BRI1的相互作用参与油菜素内酯信号[66,67,86].在BR激素感知期间,BRI1受体激酶被Bri1受体激酶磷酸化,并提出用作信号复合物中的支架[67,87].另一个例子是干细胞信号蛋白CORYNE (CRN),它与受体CLAVATA 2相互作用,促进质膜定位[88],并与受体激酶一起调节茎和根尖分生组织中干细胞的命运[68,69,89].最后,在调节植物免疫反应的免疫复合物中定义了伪转基因酶的角色[70,84,85,90].有趣的是,刘等人。(91最近发现BKN2在植物免疫中的作用(ZED1-D2; SZE2的抑制剂),并发现它是作为免疫复合物的一部分的质膜局部化。因此,鉴于伪转基因酶在蛋白质复合物中起作用的趋势,需要在耻骨中鉴定潜在的交互运动,以进一步了解BKN的功能。
我们对BKN家族的兴趣始于对可能在兼容花粉反应中起作用的柱头富集信号蛋白的研究,这一研究导致了柱头特异性的鉴定BKN1in.A. Thaliana.Col-0。但是,这是bkn1col0生态型突变体的亲和花粉反应没有明显变化,当野生型col0花粉放在突变体上时,只观察到轻微的水合缺陷bkn2柱头(一个串联连接旁系同源物)。此外,减损的程度并没有增加对bkn1-bkn2双突变体的污名。这是相当令人困惑的,因为BKN2在病耻感中仅以较低水平表达,特别是与BKN1.进一步调查发现,该BKN1基因在大多数A. Thaliana.生态型携带了两个碱基,ΔT128和^A597,这将导致BKN1编码区域的帧移,从而导致全长蛋白的丢失。有趣的是,研究发现3个生态型Hh-0、Dju-1和Västervik携带两个ORF-restoring SNPs (^T128和ΔA597),并预测编码一个全长BKN1蛋白。此外,两个异型杂交拟南芥物种,答:lyrata和A. Halleri.,也携带BKN1预测编码全长BKN1蛋白的同源物。这些综合结果为进一步的研究提出了一些问题。温和的水化表型与什么有关bkn2突变体指向一个相关的函数BKN1在过渡到自我过渡时丢失了A. Thaliana.还是例如,BKN1的耻辱函数与花粉 - 耻辱的相互作用有关,在outcrossing物种中有关吗?从不同的选择性机制发生来自自行自行的进化,例如减少对与新环境的殖民化相关的粉丝簇或群体瓶颈的进入,并且与芸苔科物种中的自我不相容性的丧失有关(在[92,93])。向自交的转变还与一些被称为“自交综合症”的花特征的变化有关,包括花的大小和形状(小花)的变化和花粉数量的减少,这在异交的比较中可以看到A. Lyrata / a。哈默里和自行A. Thaliana.(93,94,95].与“自交综合症”相关的其他变化包括失去授粉者吸引特征(在[93,95])。
特异性与自行相关,存在有特征,在丢失自相不容的外,可以修改以改善转型到自行的自我授粉。这些包括二氯(花粉释放时间之间的时间差异和耻骨接收),疝气(耻辱和花药之间的高度差异,以防止自授粉)和饲养的纹理方向(经历裂开的花药表面取决于远离柱头)[93,95,96].答:lyrata和A. Halleri.是自交不亲和的物种吗S基因座蛋白11/S富含半胱氨酸和年代受体激酶多态基因(在[16.])。两种物种都携带完整BKN1基因,这将是一个有趣的研究,在这些不同的性状的背景下,旨在避免自花传粉的柱头-花粉相互作用的潜在作用。还有一些北美的答:lyrata伟大的湖区各地的人口也转向自相容性,但表明对自我综合征没有重大变化[97.,98.,99.].这些自相容答:lyrata比较功能缺失也很有趣BKN1自花授粉环境中的突变。最后,最近发现BKN2/SZE2在植物免疫中的作用[91]打开另一个调查方向。与此相关的相关,在植物繁殖和病原体反应中,已经发现了其他信号蛋白的双重作用[5].相对容易与CRISPR / Cas9技术可用于创建丧失功能突变体打开大门,就问这些问题BKN1函数在其他A. Thaliana.生态型和拟南芥未来的物种。
结论
在这项研究中,我们鉴定了十字花科特异性伪激酶基因的一个新家族,称为芸苔,并专门专注于Tandemly链接的功能BKN1和BKN2基因,在花粉-柱头相互作用的背景下A. Thaliana.Col-0。产生了CRISPR缺失突变体,野生型Col-0花粉置于植株上时,观察到非常轻微的水合缺陷bkn2和bkn1/2变异的污名。多态性导致过早终止密码子的发现BKN1在许多A. Thaliana.生态型包括col0,在异交中不存在拟南芥物种。因此,未来的研究应该集中在检验上BKN1函数在其他A. Thaliana.生态型和拟南芥物种。
方法
植物材料和生长条件
种子的答:芥bkn1-1T-DNA插入突变体(Col-0, SALKseq_039336)A. Thaliana.HH-0(CS76512),韦斯特维克(CS78834),DJU-1(CS78896)和贝拉-1从拟南芥生物资源中心(ABRC)获得(CS76696)生态型。种子的A. Thaliana.col-0生态型和本塞姆氏从Nambara博士和博士吉冈分别为(多伦多大学)获得。A. Thaliana.seeds were sterilized and cold stratified for at least 2 days at 4 °C, then transferred to soil or plated on ½ Murashige and Skoog (MS) medium plates with 0.4% (w/v) phytoagar at pH 5.8 at 22 °C under 16 h light. After 7–10 days, seedlings were transferred to soil supplemented with 1 g/L 20–20-20 fertilizer and grown at 22 °C under 16 h light. For the答:芥bkn1-1 T-DNA insertion mutant (SALKseq_039336), homozygous mutants were confirmed by PCR, and the location of the T-DNA was verified by sequencing of PCR products.本塞姆氏种子已经冷分层几天,并直接种植在土壤上,并在16小时内在22℃下生长。监测湿度并保持在生长室中的相对湿度20至60%之间。
质粒建设和植物转化
371 BP.BKN1预测的启动子由紧跟着的未翻译区域组成BKN2编码区域到BKN1起始密码子。的BKN2预测启动子覆盖上游465 bpBKN2起始密码子,包括AT5G11412的3'UTR。的BKN1和BKN2通过Geneart基因合成服务(Thermof Serior Scientific)合成5'预测的启动子区域。通过克隆到GUS编码区上游的孔-R2载体中的启动子XHO.我和不我的网站,100.),转换为拟南芥蒂利亚纳Col-0花卉浸[101.].在含50 μg/ml卡那霉素的½MS培养基上选择T1种子进行卡那霉素抗性筛选。从几个T1植株的花序或12期花染色检测GUS活性(见下文)。
对于CRISPR / CAS9产生的突变体,使用双SGRNA(单引导RNA)系统来产生基因组缺失BKN1和BKN2基因[48.].CRISPR sgRNA序列的靶向性BKN1或者BKN2使用CHOPCHOP软件搜索PAM位点附近的序列,避免在A. Thaliana.基因组(102.].PCR片段包含两个SGRNA(参见附加文件4引物序列见表S3),以及启动子和终止子序列由pCBC DT1T2载体模板使用Phusion聚合酶(ThermoFisher Scientific)生成。通过与BsaI酶的金门反应将纯化的sgrna片段克隆到最终载体pBEE401E中。该载体被修改为携带Basta抗性标记(BlpR从pBUE411103.])而不是原来HYGR.标记在pHEE401E [36.,48.].构念被转换成杆菌通过电穿孔,然后用来转化A. Thaliana.Col-0花卉浸[101.].T1种子被冷分层并播种在土壤上,如前所述[26.].一旦幼苗发芽,就会进行Basta™除草剂抗性的选择,移植耐药幼苗,并筛选PCR筛选Basta™选择标记和基因组缺失。用引物对分析T1植物,所述引物对被设计成放大缺失区内外或外部BKN1 / BKN2.为了鉴定携带各自基因缺失的杂合突变体和纯合突变体在随后的几代(T2-T5)中鉴定出表型化。覆盖缺失的PCR产物被测序以确认每个独立缺失突变的位置。对于两者来说BKNs,两个构建携带不同因组的靶位点进行筛选在T1缺失(附加文件4:表S3)。的BKN1_CR#1和BKN1_CR#3构造了bkn1-2和bkn1-3分别突变体。的BKN2_CR#3构建了bkn2-1和bkn2-2突变体。产生双突变体,无转基因bkn1-3突变体被转化为BKN2_CR#2建设产生三个新的bkn2突变体,bkn2-3,bkn2-4和bkn2-5,在这方面bkn1-3背景。
为…克隆cdnaA. Thaliana BKN2.(Col-0 At5g11410),A. Lyrata BKN1.(AL6G22040.t1)和A. Lyrata BKN2.(AL6G22050.t1),对顶½雌蕊组织提取的RNA进行RT-PCR。的A. Thaliana.Hh-0BKN1从第12阶段花芽RNA克隆cDNA。的BKN.使用PCR8/GW TOPO克隆试剂盒(ThermoFisher Scientific)将克隆引入TOPO进入克隆。为了生成Al-BKN2(G2A)、Al-BKN2(C4A)和Al-BKN2(G2A, C4A)结构,需要在n端进行豆蔻酰化(G2)和棕榈酰化(C4)位点答:lyrata用引物进行PCR破坏BKN2,替换G2和C4位点(附加文件)4:表S3)。使用LR Clonase II酶(Thermofisher)进行网关反应,进入含有C末端YFP(Earley等,2006)的目的地向量玻璃蛋白101中。然后将质粒转化为农杆菌属GV2260通过电穿孔进行农药滤波实验。从5周龄留下3或4本塞姆氏如Sparkes等人的协议所述,通过农业渗透转化叶片[104.].
Promoter-GUS染色
花序或阶段从12个花BKN1和BKN2根据Wang等人的方案,在37℃下在37℃下在GUS溶液中孵育启动子 - GUS转基因植物。(15.].然后将组织固定在乙醇中:冰醋酸并用氯水合物溶液清除,如[105.].组织在30%甘油中固定,在尼康sMz800显微镜下拍照。
共焦显微镜
在渗透后24至48小时,叶片磁盘被切割本塞姆氏并用莱卡TCS SP8共聚焦显微镜观察。使用徕卡LAS AF lite软件进行图像处理。如Lang等人所述,0.8 M甘露醇处理可实现质壁分解[106.]
表达谱分析,多序列比对和系统发育分析
BAR表达式垂钓者工具[39.](http://bar.utoronto.ca/)用于搜索富含耻骨的信号传导蛋白,如前所述[36.].简言之,柱头特异性基因SLR1作为诱饵(At3g12000,[40)来搜索AtGenExpress Plus-Extended Tissue Compendium数据集[39.,41.].BKN基因的表达谱1:图S1来自三个额外的转录组数据集:TRAVA RNA-SEQ数据集(http://travadb.org/(44.),柱头乳头RNA-Seq数据集[43.]耻辱微阵列数据集[35.];使用HeatMapper Plus工具显示数据[39.].
对1135个基因组进行生态型多态性搜索[50.],使用两个不同的数据库检索BKN1基因组序列:1001人基因组(https://1001genomes.org/),Salk拟南芥1001基因组(http://signal.salk.edu/atg1001/index.php).HH-0是鉴定用于携带T128和ΔA597的第一种生态型以编码全长BKN1蛋白。MEGA7软件[63]被用来产生从1135个生态型基因组中检索到的基因组BKN1序列的多重蛋白质序列比对。被列入的Col-0和HH-0 BKN1 cDNA序列以去除内含子并找到两个SNP的位置(附加文件5和附加文件6).将两个SNP区域从对齐复制到Excel文件中以进行进一步分析(请参阅附加文件3.:表S2)。利用基因组DNA样本对Västervik、Dju-1和bella -1生态型的BKN1基因进行PCR扩增和测序(附加文件)1:图S5)。
Brassicaceae BKNs的系统发育分析(图。6),氨基酸序列(附加文件7)从TAIR(获得A. Thaliana.)49.];植物血统(A.糊菜,甘蓝结球甘蓝,B. STRICTA,E. salsugineum -以前嗜盐赤眼蜂,风疹赤眼蜂,大花赤眼蜂,番木瓜)107.];NCBI (A. alpina, B. cretica, B. oleracea简历TO1000,T. hassleriana)108.];Ensemblplants(甘蓝简历TO1000) [109.];布拉德(答:arabicum)110.];或者thellungiella.org(S. parvula.- 原T. parvula.)服务器使用blastp或tblastn搜索与bkn或其他rlck相似的基因。拟南芥RLCK VII成员的系统发育分析(附加文件)1:图S8),由Lehti-Shiu和Shiu定义的第七届区议会成员[51.和氨基酸序列(附加文件8)从TAIR检索[49.].MEGA7软件[63]用于利用ClustalW [62].ClustalW排列在n和c端进行修剪,然后使用最大似然法生成共识树[64]与1000个引导重复[65在MEGA7]。附加文件中的对齐1图S3、S4、S5和S6是在MEGA7中生成的,并使用多个显示对齐工具(http://www.bioinformatics.org/sms/(111.]),使用基于侧链的氨基酸分组[112.].有关所有氨基酸序列和比对,请参阅附加文件。
RT-PCR和定量RT-PCR软件
花药和雌蕊组织(上半部:柱头,下半部:卵巢)和从台12花芽收集;叶和根从2周龄收集A. Thaliana.RT-PCR和定量RT-PCR应用的幼苗。使用SV总RNA提取试剂盒(PRomega)的改性方案提取RNA,其包括促进植物组织在液氮中的剧烈研磨。接下来,使用上标III逆转录酶(Thermofer Shor)和寡核苷酸引物进行cDNA合成。然后将cDNA与Taq聚合酶的RT-PCR反应中使用,以及具有Poftup 2X Sybr Green Master Mix(Thermof Siredher)的定量RT-PCR反应(在附加文件中列出的引物4:表S3)。
花粉水合作用、花粉粘附和花粉管生长和结实率的测定
第12阶段的花蕾被阉割,小心地用保鲜膜包裹起来,让它在一夜之间成熟。花粉水化后,次日在½MS培养基中竖立雌蕊,用少量col0花粉人工授粉。使用尼康sMz800显微镜,6倍放大,1.5倍物镜,在授粉后0分钟和10分钟立即拍摄照片。用尼康数码成像软件横向测量花粉粒直径,每株雌蕊随机取10粒花粉粒,每株基因型取3粒花粉粒。所有授粉都是在低于60%的环境湿度下进行的,以避免从周围环境自发吸收水分。
花粉粘附和花粉管生长,次日仔细打开雌蕊,用col0花粉或转基因花粉轻轻授粉,进行交互杂交。授粉后2小时,收集雌蕊,固定,用苯胺蓝染色,染色花粉管沉积的胼胝质,如Safavian et al.(2015)所述。利用Zeiss Axioskop2Plus显微镜在亮场下对授粉雌蕊进行成像,计数附着花粉粒的数量,并在紫外荧光下观察花粉管的生长情况。测定了花粉的粘附力n=每个杂交有10个雌蕊。
对于种子套装,晚期12芽被阉割并用Col-0雌蕊和每种转基因的Col-0花粉手工散发。用螺纹标记手工粉,并且在几天内使其充分地成熟。在衰老之前,除去绿色的单片机,并纵向切割以计算显影种子的数量。每次授粉都计数了10个单片机。
体外BKN2棕榈酰化分析
AT-BKN2和Al-BKN2网关进入克隆重新组合到网关目的地载体PYES-DEST52(C末端V5标记,Invitrogen)中,以分别产生酵母表达载体PYES-AL-BKN2和PYES-BKN2。转化野生型酵母BY4741(MATAHIS3Δ1LEU2Δ0MET15Δ0URA3Δ0)细胞,并在25℃下在选择性最小培养基中,以选择转基因酵母细胞。为了诱导蛋白质表达,在含有2%半乳糖的最小液体培养基中生长转化的酵母细胞。通过酰基-RAC法进行棕榈酰胺测定[82,113.].简单地说,总蛋白被丙酮沉淀法裂解和回收。用1%甲基甲硫磺酸盐(MMTS)阻断游离-SH,然后用1 M羟胺处理样品,pH 7.5 (+ nhh)2OH)除去棕榈酰盐并在棕榈酰基盐位点暴露游离硫醇。在阴性对照中( - nh2加入1 M Tris (pH 7.5)。硫丙基琼脂糖珠(Sigma)捕获棕榈酰化蛋白,用抗v5一抗和酶标二抗(CWBio,中国)用ECL western blotting检测BKN2蛋白的存在。
可用性数据和材料
所有数据都包含在这份手稿中。根据相应作者的请求,可以使用构造和种子。
缩写
- BIK1:
-
BOTRYTIS-INDUCED KINASE1
- BKN:
-
BRASSIKIN
- 中科:
-
CASTAWAY
- mmt:
-
甲基methanethiosulfonate
- 女士:
-
Murashige和斯库
- 出版广播公司:
-
PBS1-Like
- PCP-B:
-
花粉外套Protein-B
- rlck:
-
受体细胞质激酶
- 美籍西班牙人:
-
振动筛花粉向内K +频道
参考文献
- 1。
Dresselhaus T,Sprunck S,Wessel Gm。开花植物中的施肥机制。Curr Biol。2016; 26(3):R125-39。
- 2。
东山泰,杨卫东。配子体花粉管引导:引诱肽,配子对照和受体。植物杂志。2017;173(1):112 - 21所示。
- 3.
Chapman La,Goring Dr。花粉雌蕊相互作用调节碳粉术中的成功施肥。J Exp Bot。2010; 61(7):1987-99。
- 4。
Doucet J,Lee HK,Goring Dr。花粉验收或拒绝:两个途径的故事。趋势植物SCI。2016; 21(12):1058-67。
- 5。
李H,杨WC。RLKS在植物男性互动中策划信号传导。科学生中国生活SCI。2016; 59(9):867-77。
- 6.
迪金森H.干柱头,水和自交不亲中芸苔.性植物团体。1995; 8(1):1-10。
- 7.
被子植物柱头的接受表面。安机器人。1977;41(6):1233 - 58。
- 8.
关键词:拟南芥,花粉,柱头粘附,亲和分子,亲和分子发展。1999;126(23):5431 - 40。
- 9.
艾尔曼CJ,狄金森哈克。外来涂层在花粉 - 耻辱互动中的作用Brassica Oleracea L..新植醇。1990;114(3):511 - 8。
- 10。
Hiroi K, Sone M, Sakazono S, Osaka M, Masuko-Suzuki H, Matsuda T, Suzuki G, Suwabe K, Watanabe M. Time-lapse imaging of self- pollinations in芸芥(Brassica rapa)。安机器人。2013;112(1):115 - 22所示。
- 11.
马建峰,刘志辉,褚长平,胡志勇,王学林,张学森。不同的调控过程控制着拟南芥花粉的水化和萌发。植物生殖学报。2012;25(1):77-82。
- 12.
芸薹属植物花粉与柱头的相互作用。3花粉粒的水合作用。中华细胞杂志1985;76:321-36。
- 13。
updemavap ep,zhao f,Preuss d。拟南芥花粉有效水合需要细胞外脂肪酶EXL4。性植物团体。2009; 22(3):197-204。
- 14。
Mayfield Ja,抗议者D. Arabidopsis授粉的快速启动需要油蛋白域蛋白GRP17。NAT细胞BIOL。2000; 2(2):128-30。
- 15.
王LD,克拉克LA,陈奕迅RJ,帕克CC,齐BX,斯科特RJ,蒂J. PCP-B类花粉外壳蛋白是在拟南芥花粉柱头相互作用水合检查点的关键调节剂。新植物。2017; 213(2):764-77。
- 16.
Jany E,Nelles H,Goring Dr。黄铜痤疮自相色谱和自粉抑制的分子与细胞调节。INT Rev Cell Mol Biol。2019; 343:1-35。
- 17.
Kaya H,Nakajima R,Iwano M,Kanaoka MM,Kimura S,Takeda S,Kawarazaki T,Senzaki E,Hamamura Y,Higashiyama T,等。通过Arabidopsis RboHH和RBOHJ产生的CA2 +活化的反应性氧物种对于适当的花粉管尖端生长至关重要。植物细胞。2014; 26(3):1069-80。
- 18.
Kaya H,Iwano M,Takeda S,Kanaoka MM,Kimura S,Abe M,Kuchitsu K. raphhh和Rbohj在拟南芥中的授粉时的Applatic ROS生产。植物信号表现。2015; 10(2):E989050。
- 19.
高XQ,刘CZ,李德德,赵tt,李文,贾xn,赵xy,张xs。SNRK1复合物的拟南芥内βγ亚基通过介导花粉中的活性氧物种水平来调节耻骨上的花粉水合。Plos Genet。2016; 12(7):E1006228。
- 20.
李德德,关河,李文,刘民克,董耶,张奇,高Xq。Arabidopsis振动器在SNRK1复合调节的花粉水合的耻辱中调用内向K +通道尖峰功能。J Intent Plant Biol。2017; 59(9):604-11。
- 21.
在拟南芥中,ARC1 E3连接酶促进两种不同的自花粉回避特性。植物细胞,2014,26(4):1525 - 43。
- 22。
在十字花科中,亲和花粉能迅速诱导柱头乳头分泌活性,而自交不亲和花粉抑制分泌活性。《公共科学图书馆•综合》。2013;8 (12):e84286。
- 23。
陈志强,陈志强,陈志强:花粉与柱头的相互作用在水稻孢子体自交不亲和中的作用Brassica oleracea.见:开花植物自交不亲和和生殖发育的遗传控制.由威廉姆斯编辑,例如Clarke AE,诺克斯RB。DONDRECHT:斯普林克荷兰;1994年:67-87。
- 24。
acta botanica oleracea(云南植物研究中心),2009,34(4):553 - 558。新植醇。1996;133(2):197 - 205。
- 25.
Iwano M,Shiba H,Matoba K,Miwa T,Funato M,Entani T,Nakayama P,Shimosato H,Takaoka A,Isogai A等。在自我和交叉授粉期间Barassica Rapa乳头细胞中的肌动蛋白动态。植物理性。2007; 144(1):72-81。
- 26.
关键词:拟南芥,柱头外囊基因,RNA沉默,亲和花粉植物杂志。2015;169(4):2526 - 38。
- 27.
Samuel Ma,Chong Yt,Haasen Ke,Aldea-Brydges Mg,Stone Sl,Goring Dr。细胞途径调节在芸苔和拟南芥中的兼容和自我不相容的花粉中的反应在EXO70A1中交叉,缩放组成部分。植物细胞。2009; 21(9):2655-71。
- 28.
Vukasinovic N,在拟南芥内膜系统Zarsky五圈养复合物。前细胞发育生物学。2016; 4:46。
- 29.
高湿度在一定程度上挽救了拟南芥外部70a1的柱头缺陷,使其能够接受亲和花粉。植物繁殖。2014;27(3):121 - 7。
- 30.
Sankaranarayanan S,Jamshed M,Samuel Ma。甘蓝型卵糖颗粒中的乙醛酸酶I的降解导致自相残象的反应。自然植物。2015; 1(12):15185。
- 31。
十字花科花粉-柱头相互作用的外囊、外泌体和自噬调控。J Exp Bot 2017, 9月27日.https://doi.org/10.1093/jxb/erx340.[印刷前的Epub]。
- 32。
王志勇,王志勇,王志勇,王志勇。自交不亲和反应下芸薹属柱头蛋白的蛋白质组学分析及其在花粉响应中的作用。细胞蛋白质组学。2011;10(12)。
- 33。
Scandola S, Samuel MA。花特异性磷脂酶D是甘蓝型油菜自交不亲和反应的柱头亲和性因子。咕咕叫医学杂志》2019。
- 34。
Iwano M,Shiba H,Miwa T,Che Fs,Takayama S,Nagai T,Miyawaki A,Isogai A. Ca2 +在拟南芥授粉过程中花粉晶粒和乳头细胞。植物理性。2004; 136(3):3562-71。
- 35。
Iwano M, Igarashi M, Tarutani Y, Kaothien-Nakayama P, Nakayama H, Moriyama H, Yakabe R, Entani T, Shimosato-Asano H, Ueki M,等。在十字花科植物中,柱头乳头细胞中表达的可诱导的自抑制Ca2+ - atp酶是兼容授粉所必需的。植物细胞,2014,26(2):636 - 49。
- 36。
陈志强,王志强,王志强,等。E6-like 1基因在拟南芥花粉-柱头早期互作中的作用[J]。植物天线转换开关。2019。
- 37。
HULSKAMP M,Kopczak SD,Horejsi TF,Kihl BK,Pruitt Re。鉴定花粉耻辱识别所需的基因拟南芥蒂利亚纳.植物j . 1995; 8(5): 703 - 14所示。
- 38。
在十字花科植物中,花粉-柱头捕获不是种的鉴别。中国科学(d辑:生命科学)1998;321(9):747-55。
- 39。
toufight K, Brady SM, Austin R, Ly E, Provart NJ。植物阵列资源:e- northern,表达角度和启动子分析。植物j . 2005; 43(1): 153 - 63。
- 40。
Dwyer KG, Lalonde BA, Nasrallah JB, Nasrallah ME。拟南芥与芸薹属s位点相关基因AtS1的结构与表达中国科学(d辑:地球科学)1992;31(3):442-8。
- 41。
施密米,达维森Ts,Henz SR,Pape Uj,Demar M,Vingron M,Scholkopf B,Weigel D,Lohmann Ju。拟南芥发展的基因表达图。NAT Genet。2005; 37(5):501-6。
- 42。
Swanson R,Clark T,Preuss D. Arabidopsis Stigma组织的表达谱鉴定了耻骨特异性基因。性植物团体。2005; 18(4):163-71。
- 43.
Gao Z, Daneva A, Salanenka Y, Van Durme M, Huysmans M, Lin Z, De Winter F, Vanneste S, Karimi M, Van De Velde J,等。KIRA1和ORESARA1通过促进拟南芥柱头细胞死亡来终止花的接受能力。Nat植物。2018;4(6):365 - 75。
- 44.
Klepikova Av,Kasianov As,Gerasimov Es,Logacheva MD,Penin AA。基于RNA-SEQ分析的拟南芥拟南芥发育转录组的高分辨率图。工厂J. 2016; 88(6):1058-70。
- 45.
Krishnakumar V, Hanlon MR, Contrino S, Ferlanti ES, Karamycheva S, Kim M, Rosen BD, Cheng CY, Moreira W, Mock SA,等。Araport:拟南芥信息门户。核酸Res. 2015;43(数据库版):D1003-9。
- 46。
Hammaren HM,Virtanen at,Silvennoinen O.伪转基因酶中的核苷酸结合机制。Biosci Rep。2015; 36(1):E00282。
- 47。
权A,史志强,杨伟,杨志强,杨志强,杨志强,杨志强。假性激酶在生命树中的起源和进化。Sci信号。2019;12(578)。
- 48。
王ZP,邢HL,董升,张兴业,韩CY,王XC,陈QJ。卵细胞特异性启动子控制的CRISPR / Cas9有效地产生用于在一个单一的代拟南芥多个靶基因的纯合突变体。基因组Biol。2015; 16:144。
- 49.
Berardini TZ,Reiser L,Li D,Mezherity Y,Muller R,海峡e,Huala E.拟南芥信息资源:制作和开采“黄金标准”注释参考植物基因组。创世纪。2015; 53(8):474-85。
- 50。
1001基因组联盟。1135基因组揭示了拟南芥的多态性的全球模式。细胞。2016;166(2):481 - 91。
- 51。
李志强,李志强。植物蛋白激酶超家族的分化、分类和功能研究。中国生物科学(英文版);2012;367(1602):2619-39。
- 52。
Veronese P, Nakagami H, Bluhm B, Abuqamar S, Chen X, Salmeron J, Dietrich RA, Hirt H, Mengiste T.膜固定的botrytis诱导的KINASE1在拟南芥对坏死和生物营养病原体的抗性中发挥着独特的作用。植物细胞。2006;18(1):257 - 73。
- 53。
饶胜,周智,缪鹏,毕刚,胡敏,吴勇,冯飞,张旭,周建明。受体样胞浆激酶VII成员在模式触发免疫信号中的作用。植物杂志。2018;177(4):1679 - 90。
- 54。
张健,李W,湘T,刘Z,Laluk K,丁X,邹ÿ,高男,张X,陈S等人。受体样激酶胞质整合来自多个植物免疫受体的信号和由丁香假单胞菌的效应被靶向。细胞宿主微生物。2010; 7(4):290-301。
- 55。
Curr Ca,Leslie Me,Orlowski Sk,Chen I,Wright Ce,Daniels MJ,Liljegren SJ。抛弃膜相关的受体样激酶,抑制了拟南芥的器官脱落。植物理性。2011; 156(4):1837-50。
- 56。
植物受体样激酶基因家族的结构、功能和信号转导。Sci STKE:信号转导知识环境。2001;2001(113):re22。
- 57。
库托d,在植物模式识别受体信号传导的Zipfel C.调控。纳特冯免疫。2016; 16(9):537-52。
- 58。
Gish La,Clark Se。rlk / pelle kinases家族。工厂J1111; 66(1):117-27。
- 59。
Shiu Sh,Bleecker Ab。来自拟南芥的受体样激酶形成与动物受体激酶有关的单晶基因基因。Proc Natl Acad Sci U S A. 2001; 98(19):10763-8。
- 60.
墨菲JM,张Q,年轻Sn,Reese ML,Bailey FP,eyers Pa,Ungureanu D,Hammaren H,Silvennoinen O,Varghese Ln,等。基于其核苷酸结合特性亚分类伪转基因酶的鲁棒方法。Biochem J. 2014; 457(2):323-34。
- 61.
德国大町达。分类和系统学是生物信息的关键:Arabidopsis,Eutrema(Thellungiella),Noccaea和Schrenkiella(Brassicaceae)为例。前植物SCI。2013; 4:267。
- 62。
等。clusteral W和clusteral X 2.0版本。生物信息学。2007;23(21):2947 - 8。
- 63。
MEGA7:用于更大数据集的分子进化遗传学分析7.0版本。生物化学学报。2016;33(7):1870-4。
- 64。
琼斯DT,泰勒WR,桑顿JM。从蛋白质序列中快速生成突变数据矩阵。生物工程学报。1992;8(3):275-82。
- 65。
系统发育的置信限:一种使用bootstrap的方法。进化。1985;(4):783 - 91。
- 66。
Sreeramulu S, Mostizky Y, Sunitha S, Shani E, Nahum H, Salomon D, Ben Hayun L, Gruetter C, Rauh D, Ori N,等。bsk是拟南芥中部分冗余油菜素内酯信号转导的正调控因子。植物j . 2013; 74(6): 905 - 19所示。
- 67.
关键词:brassinosteroids - signaling KINASE 3, brassinosteroids - signaling KINASE 3,质膜相关支架蛋白公共科学图书馆麝猫。2019;15 (1):e1007904。
- 68.
一种进化上保守的假激酶介导植物干细胞的产生。植物细胞。2011;23(3):851 - 4。
- 69.
Somssich M,Bleckmann A,Simon R.拟南芥芽和根茎干细胞维持中伪转油酶Coryne(CRN)的共享和不同功能。J Exp Bot。2016; 67(16):4901-15。
- 70。
陈志强,王旭东,王志强,等。富亮氨酸重复受体激酶BIR2是植物免疫中BAK1的负调控因子。咕咕叫医学杂志,2014;24(2):134 - 43。
- 71。
Chevalier D,Batoux M,Fulton L,Pfister K,Yadav RK,Schellenberg M,Schneitz K. Strubbelig定义了一种受体激酶介导的信号通路调节器官开发的拟南芥。Proc Natl Acad SCI U S A. 2005; 102(25):9074-9。
- 72。
Vaddepalli P,Herrmann A,Fulton L,Oelschner M,Hillmer S,Stratil TF,Fastner A,Hammes Uz,Ott T,Robinson DG等人。C2-结构域蛋白Quirky和受体样激酶Strubbelig定位于血浆中,并在拟南芥中介导组织形态发生。发展。2014; 141(21):4139-48。
- 73。
作者简介:黄志刚,男,博士,主要从事生物医学工程研究,主要从事生物医学工程研究。类受体伪激酶GHR1是气孔关闭所必需的。植物细胞。2018;30(11):2813 - 37。
- 74。
Kumar D,Kumar R,Baek D,Hyun TK,Chung Ws,Yun DJ,Kim Jy。Arabidopsis Thaliana受体死亡激酶1作为对ABA的植物反应中的阳性调节剂。莫尔植物。2017; 10(2):223-43。
- 75。
昂斯莱P,泰勒L,格威尔森C.棕榈酰化影响在拟南芥多个进程。小样生物化学生理学分子INTEGR生理学。2008; 150(3):S143-3。
- 76。
Boyle PC, Martin GB。植物病原分子军备竞赛中的油腻战术。中国生物医学工程学报。2015;66(6):1607-16。
- 77。
李勇,齐斌。植物中s -酰化蛋白的研究进展。植物学报2017;8:346。
- 78。
山内S,Fusada N,林H,内海T,鱼住N,远藤Y,户泽Y的共有基序用于在小麦胚芽无细胞翻译系统的植物蛋白质的N豆蔻酰化。FEBS J. 2010; 277(17):3596-607。
- 79。
Earley KW, Haag JR, Pontes O, Opper K, Juehne T, Song KM, Pikaard CS。植物功能基因组学和蛋白质组学的门户兼容载体。植物j . 2006; 45(4): 616 - 29。
- 80.
胞质分裂-脱质分裂导致内质网形态、运动、流动和细胞骨架关联的改变。中国生物医学工程学报。2017;68(15):4075-87。
- 81.
Hemsley PA。脂质修饰蛋白在植物中的重要性。新植醇。2015;205(2):476 - 89。
- 82.
Forrester Mt,Hess Dt,Thompson JW,Hultman R,Moseley Ma,Stamler JS,Casey PJ。树脂辅助捕获的蛋白质S-酰化的特异性分析。J Lipid Res。2011; 52(2):393-8。
- 83.
Castells E, Casacuberta JM。通过激酶缺陷区域的信号转导:植物中非典型受体样激酶的流行。中国生物医学工程学报。2007;58(13):3503-11。
- 84.
Lewis JD,Lee Ah,Hassan Ja,Wan J,Hurley B,Jhingree JR,Wang PW,Lo T,Youn Jy,Guttman DS等。拟南芥ZED1伪转酶是ZAR1介导的催化剂III型效应霍普萨1A诱导的ZAR1介导的免疫所必需的。Proc Natl Acad Sci U S A. 2013; 110(46):18722-7。
- 85.
Lewis JD,Lo T,Bastedo P,Guttman DS,Desveaux D.亡灵的崛起:伪影蛋白酶作为效应引发的抗扰度的介质。植物信号表现。2014; 9(1):E27563。
- 86。
Tang WQ,Kim TW,Os-Prieto Ja,Sun Y,Deng ZP,朱SW,Wang RJ,Burlingame Al,Wang Zy。BSK在拟南芥中,从受体激酶Bri1中调解信号转导。科学。2008; 321(5888):557-60。
- 87。
金TW,王征。油菜素内酯从受体激酶到转录因子的信号转导。植物学报2010;61:681-704。
- 88。
Bleckmann A, Weidtkamp-Peters S, Seidel CA, Simon R.拟南芥干细胞信号传导需要CRN将CLV2定位到质膜上。植物杂志。2010;152(1):166 - 76。
- 89。
胡c,zhu y,cui y,cheng k,梁w,wei z,zhu m,yin h,zeng l,xiao y等。一组受体激酶对于Clavata信号,对于维持干细胞稳态是必不可少的。Nat植物。2018; 4(4):205-11。
- 90.
王继,王继,胡米,吴S,齐j,王g,汉z,qi y,gao n,wang hw等。配体触发的变构ADP释放植物NLR复合物。科学。2019; 364(6435)。
- 91.
刘C,Cui D,Zhao J,Liu N,Wang B,Liu J,Xu E,Hu Z,Ren D,Tang D,Hu Y.两种拟南芥受体样细胞质激酶Sze1和Sze2与ZAR1-ZED1复合物相关联并且是效应触发的免疫所必需的。莫尔植物。2019; 12(7):967-83。
- 92.
十字花科异交祖先自交的进化:我们从s位点的变异中学到了什么?中华流行病学杂志。2014;27(7):1372-85。
- 93。
Shimizu Kk,Tsuchimatsu T.自行的演变:分子适应中的复发模式。Annu Rev Ecol Evol Syst。2015; 46(1):593-622。
- 94。
罗Y,威德默A.雌雄异位及其对拟南芥交配格局的影响。Plos一个。2013; 8(2):e57902。
- 95。
Sicard A,Lenhard M.自我综合征:一种研究植物形态适应遗传和进化基础的模型。Ann Bot。2011; 107(9):1433-43。
- 96。
王志强,王志强,王志强,等。自交综合征的进化:花药取向和雌雄异体交配共同决定自交亲和植物的繁殖保证。进化。2017;71(9):2206 - 18。
- 97。
拟南芥(Arabidopsis lyrata, Brassicaceae)自交不亲和的分解及其遗传后果。进化。2005;59(7):1437 - 48。
- 98。
北美拟南芥(Arabidopsis lyrata)自交居群花冠大小和花粉:胚珠比的微小减少,但花朵形状没有变化。环境科学。2017;183(2):401 - 13所示。
- 99。
Mable BK,Hagmann J,Kim St,Adam A,Kilbride E,Weigel D,STIFT M.如何导致植物中的交配系统转换?Arabidopsis Lyrata是一个案例研究。遗传(EdInb)。2017; 118(1):52-63。
- One hundred.
Coutu C, Brandle J, Brown D, Brown K, Miki B, Simmonds J, Hegedus DD. PORE:一个适合单子叶和双子叶植物转化的模二进制向量序列。转基因研究》2007;16(6):771 - 81。
- 101.
农杆菌介导的拟南芥转化的一种简化方法。植物j . 1998; 16(6): 735 - 43。
- 102.
Labun K,Montague Tg,Gagnon Ja,百里香SB,Valen E.Chocchop V2:用于下一代CRISPR基因组工程的网络工具。核酸RES。2016; 44(W1):W272-6。
- 103.
邢海林,董磊,王志平,张海英,韩春英,刘波,王小春,陈庆军。用于植物多基因组编辑的CRISPR/Cas9工具箱。BMC Plant Biol. 2014;14:327。
- 104.
荧光融合蛋白在烟草植株中的快速瞬时表达和稳定转化植株的生成。Nat Protoc。2006;1(4):2019 - 25所示。
- 105。
Berleth T,更加与众不同g . Monopteros基因在组织中的作用的基体区域拟南芥胚胎。发展。1993;118(2):575 - 87。
- 106。
郎I,Sassmann S,Schmidt B,Komis G. Plasmolys:Turgor和超越的丧失。植物(巴塞尔)。2014; 3(4):583-93。
- 107。
古德斯坦DM,舒S,豪森R,Neupane R,海斯RD,FazoĴ,Mitros T,德克斯W,赫尔斯滕U,帕特南N,等人。Phytozome:绿色植物基因组比较的平台。核酸RES。2012; 40(数据库发行):D1178-86。
- 108。
协调员NR。国家生物技术信息中心的数据库资源。核酸RES。2017; 45(D1):D12-7。
- 109。
Kersey PJ, Allen JE, Allot A, Barba M, Boddu S, Bolt BJ, Carvalho-Silva D, Christensen M, Davis P, Grabmueller C,等。Ensembl基因组2018:非脊椎动物物种的集成组学基础设施。核酸Res. 2018;46(D1): D802-8。
- 110.
王X,吴俊,梁J,Cheng F,Wang X. Brassica Database(BRAD)版本2.0:整合和挖掘碳酸盐纤维物种基因组资源。数据库(牛津)。2015; 2015年。
- 111.
序列操作套件:用于分析和格式化蛋白质和DNA序列的JavaScript程序。生物学技术。2000;1104年28(6):1102。
- 112。
达斯JK,达斯P,雷KK,乔杜里PP,贾纳SS。使用图案作为氨基酸的化学基团的组合的蛋白质序列的数学表征。Plos一个。2016; 11(12):e0167651。
- 113。
Li Y,Scott R,Doughty J,Grant M,Qi B.蛋白质S-酰基转移酶14:拟南芥叶片衰老中的棕榈酸盐的特定作用。植物理性。2016; 170(1):415-28。
确认
我们感谢丽贝卡·希尔顿和贝蒂·耿的技术支持,以及戈林实验室成员对这篇综述的认真阅读。也感谢Yoshioka实验室提供CAM4:YFP结构。我们感谢拟南芥生物资源中心(ABRC)提供的序列索引拟南芥T-DNA插入突变体和Hh-0, Västervik, Dju-1和bella -1生态型的种子。
资金
J.D.和hkk.l获得安大略省研究生奖学金(OGS)的资助。本研究得到了加拿大自然科学与工程研究委员会和中国自然科学基金的资助(批准号31170233)。资助方不参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
从属关系
贡献
JD和DRG设计研究;JD、HKL、NU、JX、BQ进行研究;JD、DRG、HKL、BQ进行数据分析;JD和DRG准备数据并撰写文稿;由JD、HKL、DRG、BQ编辑。所有作者阅读并批准了最终的手稿。
通讯作者
伦理声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:图S1。
bkn在不同转录组数据集中的组织表达谱。图S2分析对bkn1-1 T-DNA mutant.图S3。序列比对拟南芥BKN1编码序列。图S4。拟南芥基因组区域BKN.基因和氨基酸对BKN1注释。图S5。A. Thaliana.,答:lyrata和A. Halleri.BKN1, BKN2和BKN3的氨基酸序列。图S6。比对四个BKN1编码序列A. Thaliana.生态型。图S7。在授粉后10分钟的Col-0和HH-0生态型中的花粉水合测定。图S8.系统发育分析拟南芥RLCK亚家族VII成员。图S9BRASSIKIN (BKN)序列与CASTAWAY (CST)序列的氨基酸序列比对图S10。共聚焦显微成像本塞姆氏叶c端BKN:YFP融合蛋白结构,用0.8 M甘露醇进行质粒分离
附加文件2:表S1。
BAR表达钓者使用柱头特异SLR1.基因作为诱饵
附加文件3:表S2。
在整个1001个基因组多态性网络普通搜索BKN1
附加文件4表S3。
使用的引物
附加文件6。
Rlck氨基酸序列额外;文件1:图。S7系统发育树
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
杜塞,李,香港,尤达加马,N。et al。对新型芸苔伪蛋白酶兼容的花粉 - 耻辱互动进行调查拟南芥蒂利亚纳.BMC植物BIOL.19,549(2019)。https://doi.org/10.1186/s12870-019-2160-9
收到:
接受:
发表:
关键字
- 兼容花粉
- 耻辱
- 信令
- Pseudokinase
- 受体细胞质激酶
- Brassicaceae.