摘要
背景
虽然对苹果中的严重细菌疾病进行了最常见的感染程度,是通过宿主植物花,用于火灾抗烈抵抗的定量特质基因座(QTLS)仅被拍摄接种后映射。尚不清楚同一机制是否下潜花和抗抗性。
结果
我们报道了在杂交抗性衍生的两个F1分离群体上独立人工接种花和芽后检测到的一个抗火疫病QTL马鲁斯×罗布斯塔在德国和新西兰的实验果园中分别发现了5种易感染的“Idared”和“Royal Gala”。“Idared”× Mr5群体人工花接种表型数据的QTL定位欧文氏菌amylovora结果表明,在Mr5连锁群3 (LG3)上存在一个控制花火枯萎病抗性的主效QTL。该QTL与之前报道的‘Idared’× Mr5群体和‘M9’× Mr5群体接种后在LG3上的QTL相对应。通过对两个抗性群体芽接种的表型数据进行区间定位,再次证实了抗性QTL在Mr5的LG3位点上与花接种QTL的位置相同。这些结果表明,Mr5的抗枯萎病性是由LG3上的一个主要QTL控制的,与侵染方式、砧木和环境无关。
结论
这项研究首次展示了抵抗火灾的第一次欧文氏菌amylovora是独立于接种方式的,至少在马鲁斯×罗布斯塔5.
背景
驯化的苹果(Malus Domestica.是一种梨果,是生长在温带气候区最重要的水果作物之一[1].影响苹果的最具破坏性的细菌性疾病是火疫病,由欧文氏菌amylovora(Burrill)Winslow等人。[2].火疫病可以通过花(花疫病)、枝(芽疫病)和吸盘感染寄主植物。花枯病导致作物产量下降,枝枯病破坏了为下一个季节结出果实的一年生木材,而随后细菌进入大树枝或树干可以杀死树木[3.].由于大多数商业砧木对该病高度敏感,通过吸盘或其他途径侵染砧木通常以砧木和接穗死亡告终[4].由于必须采取精心的卫生措施,降低产量,甚至消灭树木,火疫病侵袭果园可造成巨大的经济损失。Van der Zwet等[5]在几十年来的沼泽水果中审查了经济损失。他们列出的最后一项主要活动之一是2007年在瑞士的火灾爆发,与经济损失约为2750万美元。一些抗生素,这种链霉素,Kasugamycin或催产素,已被证明有效地对待火灾枯灭性;但是,它们在仅几个国家的植物保护中注册用于植物保护[6].它们的使用也可以减少出口机会当进口国实施非关税贸易壁垒。Gianessi等。[7报道称,美国苹果种植者每年花在抗生素喷雾剂上的费用约为280万美元大肠amylovora感染。基于拮抗剂,电阻诱导剂或化学物质消毒替代产品常常不太有效,或在有效性更大的变化[8].
另一种控制火疫病的方法是种植抗火疫病的苹果品种。目前,世界范围内的苹果生产主要由几个品种[9它们都或多或少容易受到火枯萎病的影响。培育既能在市场上具有竞争力又能抵抗火疫病的品种是一个挑战,因为强大的抗性主要是在野生植物中发现的马鲁斯物种 [3.,10.,11.,在育种中使用它们需要几代的伪回交。对火枯病抗性遗传的了解是目标抗性育种的前提;到目前为止,有几个数量性状位点(qtl)在不同程度上对火疫病具有抗性马鲁斯已报告。第一个抗枯萎病QTL可以解释高达40%的表型变异,被定位到‘Fiesta’连锁群(LG) 7 [12.,13.].从那时起,已经在MR5的LG3上检测到其他主要QTL [14.,15.在观赏海棠品种‘Evereste’和种的LG12上m .多花植物[16.),米.×arnoldiana[17.].一个非常强大的QTL地图到LG10M.裂孢菌解释高达66%的表型方差[18.].Mr5抗火疫病QTL的候选基因(FB_MR5)被确认[19.[Broggini等人。[20.]确认了其功能FB_MR5CC-NBS-LRR抗性基因在转基因嘎拉。近日,Emeriewen等。[21报道了一个候选抗性基因的鉴定M.裂孢菌,它具有不同的抵抗机制。
此外,给定的苹果品种的易感性也取决于压力大肠amylovora[22,23,24],其中一些已被确认可以克服野生物种对火枯萎病的抵抗力,如Mr5 [25,26].Vogt等人[27]提出了宿主病原体系统MR5中的基因基因相互作用 -e . amylovora其中单个核苷酸多态性(SNP)avrRPT2ea导致半胱氨酸转变为丝氨酸的效应决定了相容和不相容相互作用之间的差异。在分离株Ea3049中,相同的变化克服了LG3上的主要QTL,使其他连锁群上的次要QTL得以检测[26,28].最近,Wöhner等人提出了另一种基因对基因的关系[29谁报道了一个大肠amylovora Eop1缺失突变体能够在‘Evereste’和‘Evereste’上引起相当大的坏死m .多花植物821.
虽然树木被感染了E.amylovora主要是通过田野里自然条件下的花朵[30.,31[上面列出的遗传映射研究中的抗性表型通过人工接种玻璃容器中的接枝,使用切割叶[32,33或皮下注射针技术[34].在研究比较枝条和鲜花的抵抗,Thibault和Le lezec [35]报告了它们之间的弱相关性,而Maroofi和Mostafavi [36]找到了一个积极的关联。然而,在少量品种中发现了花和抗抗抗性之间的巨大差异。例如,'Reinette Clochard'拍摄非常易感,但鲜花易感性低,而相反的是'脸红的金色','mutsu'和'皇家Gala'[37].
开花时间和盛开的气候条件[38,39]、开花长度及花龄[40,41,花的形态[42]、花蜜生产及成分[43,44]挥发性有机化合物发射[31可能影响花枯萎病的发病率。到目前为止,尚不清楚芽和花对火枯萎病的抗性是否受相同的机制控制,还是所观察到的差异主要是基于不同的环境条件。在这里,我们报告了在两个国家的田间和温室分别人工接种花和芽后Mr5抗火枯萎病的地图。‘Royal Gala’× Mr5杂交的F1代在新西兰用一个砧木种植,而‘Idared’× Mr5杂交的后代在德国用两个不同的砧木种植。‘Idared’× Mr5群体的一部分以前曾被用于通过评价温室条件下的茎部感染来进行对火疫病抗性的遗传定位[14.,26,28,45].
结果
花表型
火灾枯萎的花感染分类(表1;无花果。1A,B)促进了在德国和新西兰症状的评估。
在德国,2011 - 2013年共接种了58个Mr5花簇,但没有一个花簇出现症状,而2015-2017年接种了297个花簇,感染率较低,为0.08 - 0.28(表)2).在2015-2017年同一时期,“Idared”的得分从2.01到3.71不等2).
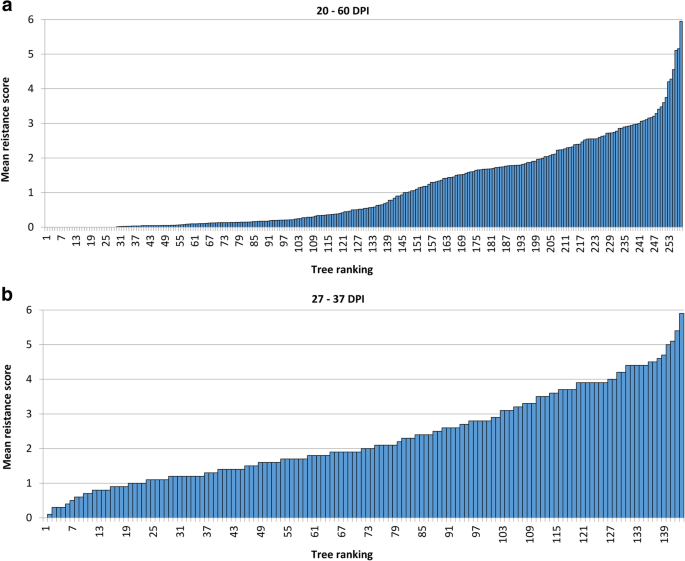
In total, 12,515 flower clusters were inoculated on the seedling progeny over the 6 years of the experiment, with 228 (95.4%) out of the initial 239 ‘Idared’ × Mr5 progeny on ‘M9’ rootstock, and 148 (98.7%) progeny out of 150 on ‘B9’ rootstock inoculated at least once in the periods 2011–2013 and 2015–2017, respectively (Table2).每种基因型接种花簇的数目在其他文件中示出4S1:表。2011年感染率最高,疾病平均得分为1.86,2013年最低,平均得分为0.47(表)2).每年约有三分之一的后代没有表现出任何症状,除了2016年,当时的比例为61.0%,258个基因型中有29个(11.2%)在任何一年都没有表现出任何症状。个体基因型的平均得分最高为:2012年6.0分,2013年3.2分,2015年3.0分,2016年4.0分,2017年6.0分。147个(57.0%)子代的平均得分为1分以下,最高平均得分为5.95分(图5)。2一种)。附加文件1图S1显示了每个子代的7个排名的比例。
一个德国‘Idared’×的基因型排序马吕斯×罗布斯塔5population ordered by degree of infection 20–60 days after inoculation of floral clusters with欧文氏菌amylovoraisolate ea222_jki。所有数据(2011年到2013年和2015年到2017年)为基因型提供了适用于平均分数。接种基因型列于附加文件中4S1:表。b新西兰'皇家佳拉'×中基因型排名 马吕斯×罗布斯塔接种花束后27-37天,5个群体按感染程度排序大肠amylovora孤立EA236。每种基因型都接种了十株簇。接种后DPI =天
由于不是所有的后代在每年持续接种由于备用开花和/或树木损失,在每年各时间段2011 - 2013年和2015 - 的接种,所述基因型进行的年效果的附加评价2017年,并结合为2011至2017年期间。显著年观察疗效(附加文件2中:图S2a中-c)中,以及显著基因型效应(附加文件3.:图S3A-C)在此分析中。Flower clusters of 131 genotypes of this German population were phenotyped at least once in each of the 2011–2013 (genotypes grafted on ‘M9’) and 2015–2017 (genotypes grafted on ‘B9’) periods, which showed a correlation of r = 0.76 for the mean scores of the genotypes between the two time periods.
来自新西兰的“皇家嘎拉”×MR5家庭的143家工厂中的单年度表型的平均疾病评分范围从0至5.95。这一人群显示感染(2.3)比德国家族的稍微较高的平均速率,只有一个后代中NZ家庭不显示任何症状(图的。2B),只有23例(16%)表现为平均感染评分为1或更低。
拍摄接种和评价
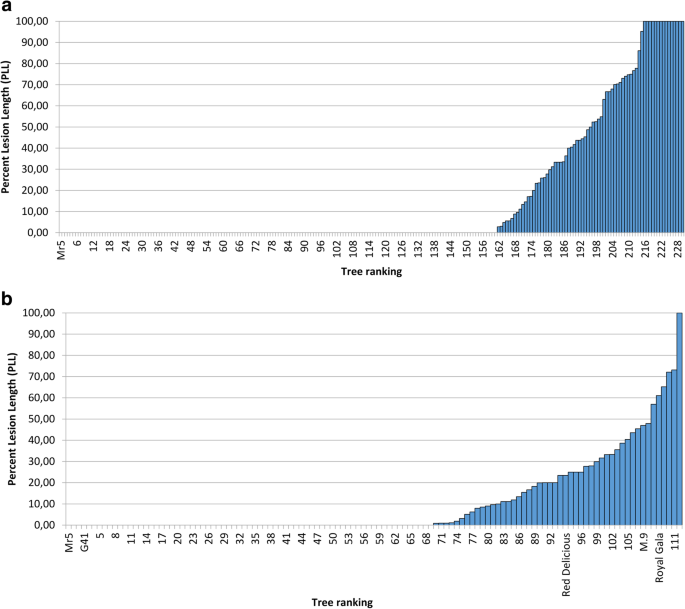
2012年“Idared”× Mr5种群230个后代的PLL均值排序显示出强烈的抗性偏倚(图2)。3.a). 15个子代接种接穗的PLL均为100%,但70%的子代接种苗与Mr5一起未出现任何坏死现象,平均PLL为16.2%。果园花的平均得分与幼苗PLL的相关系数为r = 0.61。
在新西兰温室中109个“Royal Gala”× Mr5后代的排名与德国家族的排名有非常相似的偏差(图。3.b),大多数基因型(61%)无症状,平均PLL为9.1%。虽然‘None’/‘Some’试验表明,感染在这两年是一致的,但在花和茎抗之间没有发现显著的相关性(Horner et al. 2014),但观察到一个微弱的年份效应。
砧木枯萎分析
从表现出根茎枯萎病典型症状的83个树木样本中(图。1c) 2012年秋季,并通过PCR进行筛查大肠amylovora,24砧木感染火疫病检测呈阳性。鲜花接种后在2012年这24个后代的平均得分为1.16,最高的4.12。The average PLL after shoot inoculation of the same genotypes was 23.8, with a maximum of 100. The correlation of scores and PLLs was r = 0.70. Four out of the 24 genotypes that tested positive for rootstock infection had previously exhibited no symptoms either in the scion or in any floral cluster following inoculation with Ea222_JKI.
花对火疫病抗性的遗传定位
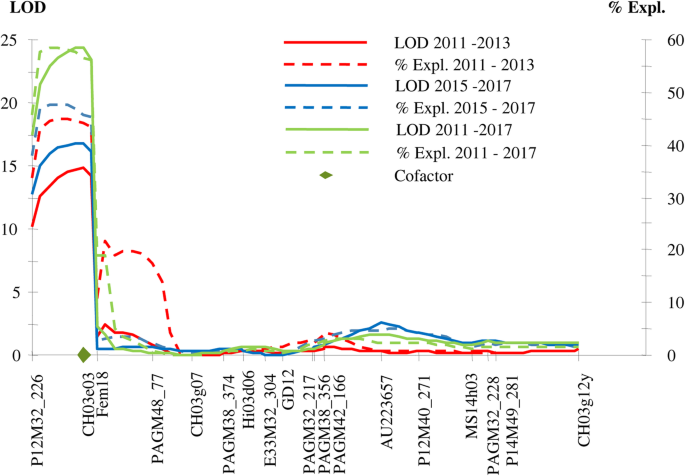
A subset of the ‘Idared’ × Mr5 family (Table2)在德国六年试验中的花卉抗性遗传绘图进行了基因分型。个人年份的评分数据以及2011-2013和2015-2017期间的平均分数以及全部持续的kruskal-wallis分析,排列测试和间隔和MQM映射。为了测试均质排序量表的稳健性,每年的原始(尺度0-8)和统一排名(级别0-6)进行间隔映射,2011-2013和2015-2017期间,以及两个周期在一起。所有单独的分析都显示了在LG3上识别的相同单个主要QTL,适用于3年期间以及所有6年,LOD分数范围为14至23(图。4).未检测到其他显著的抗火枯病qtl。
新西兰的皇家庆典×Mr5人口受到植物接种Ea236,我发现了一个QTL控制抗火疫病一样,在“伊”×Mr5人口接种Ea222_JKI在德国,尽管间隔(图略大。5).位于标记物FB_R5和CHO3E03上的床曲线的峰值> 24.使用IM或Kruskal-Wallis分析,在该群体中未观察到用于控制火焰抗性的其他显着QTL。
茎部抗火疫病的遗传定位
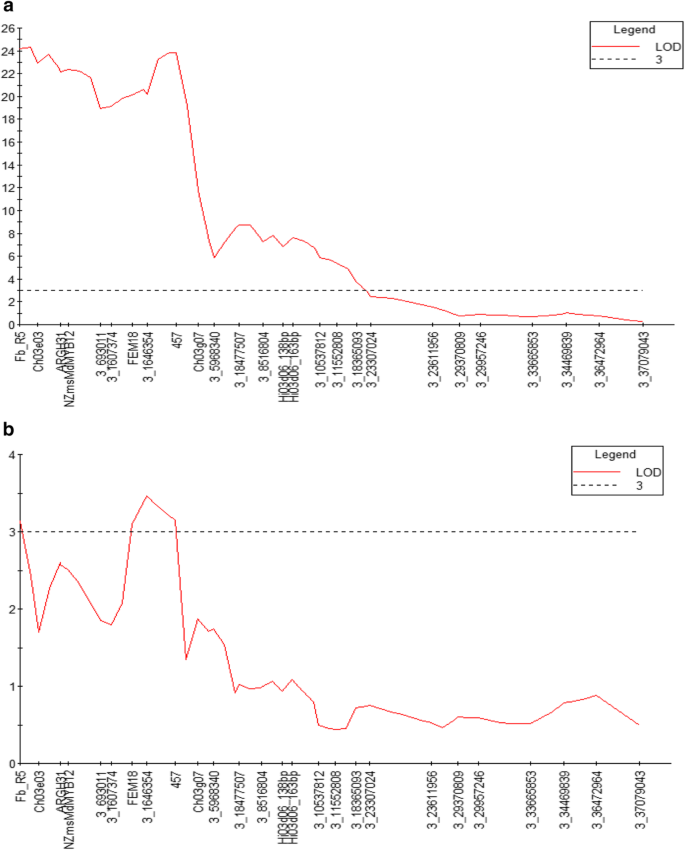
Kruskal-Wallis分析了‘Idared’× Mr5群体接种后的PLL数据,发现LG3与标记性状相关,标记CH03e03的K值最高。CH03e03等位基因在偶联期为185 bp,其平均PLL为0.2%,而在排斥期为207 bp,其平均PLL为37.5%。间隔映射导致CH03e03的LOD为9.8,远远超过2.8的阈值(数据未显示)。
由于基因型数据对于玻璃馆中的“皇家Gala”×MR5人口的所有拍摄的植物,IM在60株植物的子集上进行。该分析揭示了MR5的LG3上的宽,低显着性QTL,其与kruskal-wallis分析中的QTL对准“idared”×MR5群体(图。5).在“皇家加仑·××MR5群体中,没有其他表型与基因型相关联。
讨论
抗火枯萎病一直被认为是定量的,到目前为止,已经报道了来自各种来源的一些qtl [46].但是,火焰沉着的抗性马鲁斯完全是用人工芽接种产生的数据进行的[12.,14.,16.,17.,18.].根据Harshman等人使用射击枯萎严重程度的合理理由。[47的研究结果表明,随着时间的推移,芽孢感染通常会导致结构性破坏,并最终导致经济损失。然而,使用的惯例只拍摄接种映射火疫病抗性导致有限的理解花火疫病抗性的遗传控制:育种者已经不确定遗传标记Mr5抗火疫病源自QTL定位的拍摄接种数据(45[抗性后,还适用于花卉感染后的标记辅助选择(MAS),这是该领域的平常进入点。此外,玻璃容器中病原体的优化感染条件可能会高估易感性,而果园中的人工接种不保证这种疾病的感染或进展,如果对火灾枯萎的发病至次优。在后一种情况下,我们试图通过覆盖花卉来改善花感染条件,以保护它们免受德国和新西兰的不利天气条件。
消防白叶枯病抗性的遗传图谱关键可靠的表型评价方案获得通过我们的研究和疾病得分和谐一致,以便两国在两个不同人群的可比性。虽然有与两个研究之间的地理距离相关联的许多干扰因素(在差异大肠amylovora分离;一年中的时间;接种技术;数年),表型结果通常非常相似,并导致MR5基因组上相同的LG3 QTL。
在德国实验中,花芽接种结果之间的相关系数r = 0.61,高于Thibault和Le Lezec发现的弱相关系数(0.25 < r < 0.44) [35]“春晚”。这可能是由于Mr5 QTL的遗传效应较大,而敏感品种‘Gala’的结果可能主要受环境条件的影响。嫁接M9和B9砧木的后代抗花性相关性较高(r = 0.76),尽管不同时期接种时的气候条件不同。‘Idared’× Mr5子代和感病亲本‘Idared’花侵染6年平均分数的显著年效应进一步证明了环境条件对火疫病侵染的影响。Van der Zwet等[48],认为天气是影响其宿主火灾枯萎病发病的最重要因素之一。虽然这些环境影响没有被详细调查,但似乎条件更有利于E.amylovora2011年,当观察到最高的感染率,2013年的感染率不太有利,感染率最低。然而,由于也发生了易感树木的损失,第二和第三年接种的数据集具有额外的抗抗性树木。此前还举报了该病原体基因型之间反应的典型差异,用于玻璃院的射击枯萎性评价[18.].
大肠amylovora能够通过健康的接穗组织迁移到砧木,引起砧木枯萎病[49],会导致嫁接在易感砧木上的树木死亡[50].虽然'B9'易受枯火的影响,但它似乎是作为砧木,领先的Logiudice等。[51认为它抑制了…的增殖大肠amylovora。在我们的研究中,嫁接在‘M9’上的‘Idared’× Mr5群体中,相当一部分树木表现出明显的砧木枯萎症状,在砧木样品上的PCR结果证实了这一点,即使在某些情况下,接穗基因型没有表现出病害症状。而同一基因型嫁接到‘B9’上未出现根茎枯萎病。为了防止因火疫病感染造成的树木死亡,抗性砧木和接穗的组合似乎是必要的,这需要进一步研究。
使用表型数据集为每个6年人造花接种用的QTL定位大肠amylovora在“伊”×Mr5人口,一年的“皇家联欢晚会”×Mr5人口,导致一个重大QTL的检测控制花卉火疫病抗性Mr5 LG3,尽管QTL的“皇家联欢晚会”×Mr5人口。该花抗性QTL与之前报道的Mr5抗茎叶枯病QTL相同[14.,15.,45]并通过这些特征在德国的领域和新西兰的玻璃杯中的这些特征的子集进行了重新确认。在一起,目前研究的结果提供了强有力的证据,即MR5的火焰抗烈抗性由LG3上的相同主要QTL控制,与感染期间的受感染的宿主组织和一系列环境条件控制。
由于QTL解释了大部分表型变异[14.,15.,它可以被认为是一个主效应基因:这类基因通常受环境的影响较小。虽然我们的研究证实了茎部抗性的LG3 QTL适用于花部抗性,但在新西兰‘Royal Gala’× Mr5群体的初步分析中发现茎部抗性和花部抗性的筛选方法相关性很低[52]表明可能存在其他未检测到的阻力因素。
LG3 QTL在不同的表型条件下的鲁棒性使其成为开发用于MAR的火焰抗性的MAS高通量标记的实心选择。我们开发了Taqman™FB_R5标记[53提供一种具有成本效益的替代方案MxdRLP1在拍摄在“M9”×MR5人口中接种后的火焰抗性映射后,高分辨率熔化(HRM)标记提前发育,在“M9”×MR5人口45].在过去的一年里,Fb_R5标记在PFR砧木育种计划中被用于MAS群体。
结论
结果表明,Mr5在花中具有较强的抗枯萎病QTL,与通过芽侵染鉴定的QTL位于LG3上相同的位置。数据来自于接种花的方法大肠amylovora结果表明,在两种不同的环境下,每年LG3上都能准确检测到该位点。虽然这种方法不能排除通过靠近接种花的微创口感染组织,但获得的结果不太可能偏向于通过这些微创口而不是通过花接种的芽接种,特别是,因为不可能每年在两个国家都有相同基因型的伤口,这可能导致检测到完全相同的基因位点。
利用Mr5与在德国和新西兰生长和表型不同的苹果亲本杂交产生的两个后代,证明了QTL的位置与环境无关。在德国,QTL在田间接种花药6年以上稳定,且不依赖于砧木。然而,由于NZL种群的花部接种只有一次,而且在果园中感染取决于对病原菌有利的条件,但即使在最佳条件下,也不能保证感染。也不能排除病原体在渐近组织中的分布。无症状组织可能是病原菌内部迁移导致树木死亡的根茎枯萎病的来源,也可能是病原菌传递到其他树木的来源。如果可行,未来的研究应该确定耐药基因型和无症状组织之间的相关性。
据我们所知,这是首次鉴定出一个控制花抗枯萎病的QTL。为了确保MAS的有效应用,还需要对其进行精确的遗传控制。由于最强烈的qtl倾向于在野外发现马鲁斯我们预测,在将这些QTL导入驯化苹果的过程中,茎部表型仍将是抗花表型的一个合适的代理,并将QTL定位为MAS的前兆,从而实现持久抗性。
方法
植物材料
两个独立的隔离种群源于易感苹果品种和火焰抗性供体MR5之间的十字架。The German population consisted of 258 progeny derived from an ‘Idared’ × Mr5 cross, which were grafted onto ‘M9’ rootstock and planted in the Kirschgartshausen research orchard of the Julius Kühn-Institut (JKI) in 2010. Additional trees of a subset of 150 genotypes of the population grafted onto Budagovski9 (‘B9’) rootstock were planted there in 2014. Grafted plants of the respective parents were included as controls in both years, of which the susceptible control ‘Idared’ planted in 2010 did not establish. A subset of 140 progeny of the same population had been used previously to establish the genetic map [28],用于QTL定位。新西兰种群由287个后代组成,这些后代是由' Royal Gala ' × Mr5杂交嫁接在' M27 '砧木上,并种植在新西兰植物和食品研究所有限公司(PFR)的霍克湾研究果园中。对该居群的143个后代进行了花疫病抗性评价。其中112个(78%)接枝到‘M9’砧木上,每基因型10个重复,在温室中接种。
品种和野生马鲁斯自十年以来,加入MR5维持在新西兰国家新闻碱和JKI种质收集中;从各项研究所的交叉中获得种子,并从托儿所获得接枝的砧木。
海耕
在德国,菌株Ea222_JKI(内部收集大肠amylovora在奎德林堡JKI保存的菌株)从冷冻牲畜大肠amylovora接种。冷冻原料的制备方法是:将在28°C、140 rpm、StI培养基(Roth, Karlsruhe)中培养过夜的液体培养的细胞制成颗粒,并将细胞颗粒重新悬浮在15% v/v的无菌甘油中,在−80°C保存直到使用。将细胞悬液缓慢解冻,用无菌水稀释至1 × 10终浓度,制备接种物9使用光度测量的菌落形成单位(CFU)/ mL,并通过活细胞计数从ST1琼脂上的稀释电镀验证。大肠amylovora菌株ea222_jki [27先前使用过的是检测几个主要电阻QTL马鲁斯[14.,17.,18.],包括MR5对LG3后在温室人造枝条接种的QTL。
在新西兰,菌株EA236(来自植物(ICMP),Manaaki,Landcare Research新西兰有限公司的国际微生物收集)在王的B agar上生长[54]在26°C下保存48小时,从−80°C的库存。从培养基中收集细菌,悬浮至1 × 10的最终浓度,新鲜制备接种物9在pH 7.2的磷酸盐缓冲盐水(PBS)溶液中使用光度测量,并通过稀释镀在King’s B培养基上的活细胞计数进行验证。
花的接种和表型
在德国,从2011年到2013年为kirschgartshausen果园接受了“缺乏的'×MR5人口的人口,为嫁接在'M9'砧木的后代,从2015年到2017年嫁接在'B9'砧木上的后代。使用Ecospray TLC喷雾器(Roth,Karlsruhe)用EA222_JKI悬浮液接种幼小鲜花。将每个花簇喷涂,用约100μL接种物喷洒并用塑料袋袋装,接种后5天除去5天。在接种后20-60天进行疾病评估。
在再生能源霍克湾站点,10花集群在一个树中每个基因型被接种的果园与隔离Ea236在2009年9月期间2 - 30花集群达到标准集群成熟,使用DeVilbiss雾化器15最后加载的105.6cfu /花。每个花束都用塑料袋装好,然后用铝箔覆盖,以遮挡花朵,防止它们在阳光直射下过热。接种后3天取袋,接种后9-12天和27-37天进行疾病评估。
在新西兰的七级内部排名系统中评估了花卉簇的感染,并在德国九级内部系统中评估。要协调数据集,德国0-8规模被转变为新西兰尺度0-6(表1).在德国,每个赛季,通过在评估后通过广泛的修剪进行消毒树木。将症状组织移除并将受影响的枝条切割成健康区域。数字1A、b花接种后表现出枯萎病症状。
拍摄接种和表型
在2012年德国,果园中的230个基因型进行拍摄接种,以比较玻璃室实验中获得的结果与现场数据。接种物大肠amylovoraEa222_JKI是如上所述准备的,并被喷到一把剪刀上,这把剪刀是用来剪掉每棵树三个幼芽上两个最小叶子的尖端的。接种后24天评估疾病严重程度,用症状芽长除以总芽长,再乘以100计算成芽的病变长度百分比(PLL)。
在新西兰,143个花接种植株中的112个子集也被评估了茎部抗性。后代经过精心筛选,以确保所筛选的种群子集的植株数量均匀地落在0-6个花抗性等级中。在112个子代中,每个子代最多10个活跃生长枝条(最小长度16厘米)的重复,以及复制亲本和对照植株(' Royal Gala ', Mr5, ' M26 ', G41,2012年和2013年,在“M9”砧木上生长的“Red Delicious”和“M7”都被接种了,接种方法是用剪刀剪掉最上面两片展开的叶子的尖端,这些叶子已经浸入109 cfu/mL suspension of大肠amylovora.将接种的植物在玻璃容器中温育,每次芽的坏死长度和每次接种后28天测量总枝条长度(DPI)。使用Genstat的审查程序估计每种植物的平均坏死芽的长度,以解释完全感染枝条的感染,将在更长的拍摄时生长更长时间。疾病严重程度计算为PLL。后代也分为两组,这取决于任何复制是否被感染('有些')或不('无')。这是为2012和2013数据进行的,创建了2×2分类。
通过聚合酶链式反应砧木枯萎核实
在德国的野外评估期间,许多树木在砧木枯萎的症状发育出来(图。1c)尽管修剪。这在2012年夏季/秋季尤其普遍。确认存在大肠amylovora,样品是从83棵树展出这种症状的树木,在从移植联盟的健康和症状组织之间的过渡处。通过在1mL水中摇动几个小纤维来从组织中洗涤细菌10分钟。使用100μL所得悬浮液的等分试样接种每种用于通过聚合链反应(PCR)分析的1ml STI培养基培养物。用底漆组合#149(CCGAAGAACGATGCACTAC)和#150(CGGTTAGTAGCGCGTCTC)进行样品制备和PCR,如WINSING等人所述。[55].每个样品的稀释倍数从10倍到1000倍进行测试,以去除微量的PCR抑制化合物。
'皇家庆典×MR5人口的DNA提取和基因分型
根据制造商协议,使用QIAGEN DNeasy®Plant Mini Kit (QIAGEN GmbH, Hilden, Germany),从“Royal Gala”× Mr5种群及其亲本的109棵树的冷冻干燥嫩叶中提取基因组DNA。该DNA被扩增并与苹果和梨的Infinium®II 9k SNP阵列杂交[56]以下的Infinium®HD测定超协议(Illumina公司公司,圣地亚哥,USA)并使用Illumina HiScan扫描。使用Illumina®GenomeStudio V 1.0软件模块的基因分型数据进行了分析,用GenCall阈值为0.15。通过在群体中筛选LG3顶端的SSR标记,将本研究的结果与Gardiner等人报道的结果进行比较[45].Fb_R5是Taqman™标记物MxdRLP1标记(45],通常用于PFR育种计划中Mr5衍生的抗火疫病的标记辅助选择[57].Fb_R5标记由FB-MR5-NZsnEH034548_R249 SNP发展而来[58],可作为定制的Taqman™检测(assay AH21B92;热费希尔科学)。
遗传映射和统计分析
MR5地图由[28]作为QTL定位的模板,利用SNP阵列数据和M9 × Mr5遗传图谱LG3的补充标记,构建了‘Royal Gala’× Mr5遗传图谱[45].
mapqtl®5[59在本研究中使用了Kruskal-Wallis分析,间隔映射(IM)和多个QTL模型(MQM)映射的研究。通过置换试验确定阈值,具有α= 0.05的显着性水平。包含与QTL接近QTL的最高赔率(LOD)分数的标记作为MQM映射的共同因素。
使用SAS GLIMMIX(广义线性混合模型)程序进行统计分析,以确定试验年是否导致平均评分在显著性水平α = 0.05下的显著差异(SAS- institute 2013, [60].因此,我们计算了一年中所有聚类的平均分数的平均值。
可用性数据和材料
支持本研究结果的数据可在合理要求的情况下从作者处获得。
缩写
- BP:
-
基对
- CFU:
-
集落形成单位
- F1:
-
1孝子生成
- glimmix:
-
广义线性混合模型
- 即时通讯:
-
区间映射
- JKI:
-
朱利叶斯Kuhn-Institut
- LG:
-
联动组
- LOD:
-
概率的对数
- MAS:
-
标记辅助选择
- mL:
-
毫升
- MQM:
-
多个QTL模型
- Mr5:
-
马鲁斯×罗布斯塔5
- 新西兰:
-
新西兰
- PBS:
-
磷酸盐缓冲溶液
- 聚合酶链反应:
-
聚合酶链反应
- pH:
-
力Hydrogenii
- 锁相环:
-
百分比病变长度
- QTL:
-
数量性状位点
- 转:
-
轮每分钟
- SNP:
-
单核苷酸多态性
- V / V:
-
卷每卷
参考文献
- 1。
汉克M-V, Flachowsky H. Obstzüchtung和wissenschaftliche Grundlagen。Kapitel 13。Apfel (Malus Domestica.).柏林:施普林格出版社;2017年。
- 2.
温斯洛,布罗赫斯特J,布坎南RE,克鲁姆维德C,罗杰斯洛杉矶,史密斯GH。细菌科和属:美国细菌学家协会关于细菌类型特征和分类委员会的最终报告。J Bacteriol。1920;5(3):191 - 229。
- 3.
Peil A,Bus VGM,Geider K,Richter K,Flachowsky H,Hanke MV。苹果和梨的火灾抗性的改善。int j植物品种。2009; 3:1-27。
- 4.
Russo NL,Robinson TL,Fazio G,Aldwinckle HS。Budagovsky 9苹果砧木的火焰抗烈抵抗。植物DIS。2008; 92(3):385-91。
- 5.
王志强,王志强,王志强。火疫病:历史、生物学与管理。第三章。由于火枯萎病造成的损失和该疾病的经济重要性。37-41页。圣保罗:APS出版社/美国植物病理学学会;2012.
- 6.
Walsh F, Smith DP, Owens SM, Duffy B, Frey JE。限制链霉素在苹果园的使用并没有对土壤细菌群落产生不利影响。Microbiol前面。2014;4:383。
- 7.
Gianessi L, Silvers C, Sankula S, Carpenter J:植物生物技术对改善害虫管理的当前和潜在影响。美国农业:2002年40个案例分析,6月报告:32。
- 8.
Ngugi HK, Lehman BL, Madden LV。美国东部火疫病控制产品评估的多重处理元分析。植物病理学。2011;101(5):512 - 22所示。
- 9.
王志强,王志强,王志强,等。世界苹果品种动态。时间Hortic。2003;43:10-3。
- 10。
美国农业部苹果种质收集的核心子集对火疫病抗性的评价。Acta Hortic。1999;489:269 - 72。
- 11.
范德Zwet T,凯尔HL。火疫病,植物蔷薇科的一种细菌性疾病。USDA:Wahington DC;1979年。
- 12.
Calenge F,Drouet D,Denancéc,van de Weg We,Brisset Mn,Paulin JP,DUREL CE。将主要QTL的识别与几个次要添加剂或认识QTL一起用于抵抗两种相关的后代苹果的抗火。Al Appl Genet。2005; 111(1):128-35。
- 13.
王志强,王志强,王志强,等。苹果抗火疫病的QTL定位。摩尔繁殖。2006;17(4):299 - 306。
- 14.
Peil A,Garcia-Libreros T,Richter K,Trognitz Fc,Trognitz B,Hanke MV,Flachowsky H.强烈的抗抗抗性基因的证据马鲁斯×罗布斯塔位于连锁组3.植物品种。2007; 126(5):470-5。
- 15.
关键词:山火疫病,QTL定位,遗传多样性,遗传多样性马鲁斯×罗布斯塔5在3号连接基团上。Acta Hortic。2008;793:297 - 303。
- 16.
杜雷尔CE, Denancé C,布里塞特MN。两个不同的抗火疫病QTL共定位于苹果基因型‘Evereste’和‘Evereste’连锁群12上Malus floribunda.克隆821.基因组。2009; 52(2):139-47。
- 17.
艾瑞文,李志强,李志强,李志强,韩克马鲁斯×arnoldiana由位于连锁组12的远端的定量性状基因座控制。2017; 1011:1011-8。
- 18.
王志强,王志强,王志强,王志强。苹果品种抗火疫病主要数量性状位点的鉴定Malus fusca..摩尔繁殖。2014;34(2):407 - 19所示。
- 19.
FahrentrappĴ,Broggini GAL,Kellerhals男,Peil A,里氏K,紫坭E,盖斯勒C.的候选基因在火疫病电阻马鲁斯X罗布斯塔图5是CC-NBS-LRR的编码。树遗传学基因组织。2013; 9(1):237-51。
- 20。
Broggini GA, Wöhner T, Fahrentrapp J, Kost TD, Flachowsky H, Peil A, Hanke MV, Richter K, Patocchi A, Gessler C.工程抗火枯萎病的苹果品种'Gala'使用FB_MR5CC-NBS-LRR抗性基因马鲁斯X罗布斯塔5.植物Biotechnol J. 2014; 12(6):728-33。
- 21。
关键词:FB_Mfu10,受体样激酶候选基因,基因定位,克隆Malus fusca.Liblage Group 10的火焰抗烈抵抗轨迹10. Mol繁殖。2018; 38(8):106。
- 22。
Norelli JL, Aldwinckle HS, Beer SV。苹果品种与品系间寄主与病原菌互作差异欧文氏菌amylovora.植物病理学。1984; 74:136-9。
- 23。
Fazio G,Aldwinckle HS,Mcquin RP,Robinson T.差分吸入能力,在商业和实验苹果砧木品种中灭火。ACTA Hortic。2006; 704:527-30。
- 24。
Emeriewen作者,维纳尔T,Flachowsky H,Peil A.海棠主机-梨火疫病菌的相互作用:应变致病性和耐药机制。前植物科学。2019; 10:551。
- 25.
Norelli JL, Aldwinckle HS。微分磁化率马鲁斯品种罗布斯塔5,诺沃尔,渥太华523至欧文氏菌amylovora.工厂说。1986;70(1017):1019。
- 26.
Peil A,Flachowsky H,Hanke M-V,Richter K,Rode J.接种马鲁斯×罗布斯塔5个抗火枯病品系的后代在LG5上有一个较小的QTL。Acta Hortic。2011;896:357 - 62。
- 27.
Vogt I, Wöhner T, Richter K, Flachowsky H, Sundin GW, Wensing A, Savory EA, Geider K, Day B, Hanke MV,等。宿主-病原体系统中的基因对基因关系马鲁斯X罗布斯塔5 -欧文氏菌amylovora.新植醇。2013;197(4):1262 - 75。
- 28.
WöhnerW,Flachowsky H,Richter K,Garcia-Libros T,Trognitz F,Hanke MV,Peil A. QTL映射火焰抗烈抵抗马鲁斯X罗布斯塔5接种的不同菌株后欧文氏菌amylovora.摩尔繁殖。2014;34(1):217 - 30。
- 29.
WöhnerT,Richter K,Sundin GW,Zhao Y,Stockwell Vo,Sellmann J,Flachowsky H,Hanke MV,Peil A.与一套接受Malus基因型欧文氏菌amylovora菌株表明效应基因EOP1和两者之间的基因基因关系Malus floribunda.821和苹果' Evereste '。植物病理学研究。2018;67:938-47。
- 30.
汤姆森SV。火疫病流行病学。在:Vanneste JL,编辑。火疫病的疾病和病原体,梨火疫病菌。编辑。纽约:CABI Puplishing;2000. p。9-36。
- 31。
Cellini A,Giacomuzzi V,Donati I,Farneti B,Rodriguez-Estrada MT,Savioli S,Angeli S,Spinelli F.病原体诱导的花香变化可能会增加蜂窝介导的Erwinia Amylovora的分散。ISME J. 2019; 13(4):847。
- 32。
Lespinasse Y, Paulin JP。苹果抗火疫病育种计划:策略使用和初步结果。Acta Hortic。1990;273:285 - 91。
- 33。
叶面接种在水稻遗传抗性鉴定中的价值皮皮皮物种欧文氏菌amylovora(毛刺。)Winslow等人。ACTA Hortic。1981; 117:75-82。
- 34。
Kleinhempel H, Kegler H, Ficke W, Schaefer H- j。苹果抗火疫病的试验方法。Acta Hortic。1984;151:261-5。
- 35。
Thibault B, Le Lezec M. Sensibilité au feu bactérien des principales variétés de pommier et de poirier utilisées en Europe。In: Paulin JP,编辑。马铃薯科火疫病(Erwinia amylovora Burill Winslow et al)的应用研究(1978-88),EUR 12601。编辑。Brussels-Luxembourg;1990.欧洲共同体委员会。p . 96 - 109。
- 36。
Maroofi A,Mostafavi M.评估苹果,梨和柑橘品种的抵抗力爆发。ACTA Hortic。1996年; 411:395-9。
- 37.
李志强,李志强,李志强,等。苹果品种对火疫病的枝、花敏感性。Acta Hortic。1987;217:311-5。
- 38.
王志强,王志强,王志强,等。火疫病的植物遗传多样性及其防治。树木。2012;26(1):47 - 66。
- 39.
Pusey P,咖喱E.温度和粉末花年与埃尔维亚氨基莫洛拉和拮抗剂的定植相关。植物病理学。2004; 94(8):901-11。
- 40。
陈志强,陈志强。苹果花龄与苹果托杯侵染的关系。工厂说。2008;92(1):137 - 42。
- 41。
陈志强,陈志强。苹果花龄对番茄红僵菌生长及生物防治的影响。工厂说。2003;87(5):502 - 9。
- 42。
李志刚,李志刚,李志刚,等。柱头形态对番茄红僵菌(Erwinia amylovora)和聚团泛霉(Pantoea agglomerans)花定殖的影响。acta botanica sinica(云南植物学报),2005;11(4):395-405。
- 43。
斯皮内利楼VannesteĴ,Ciampolini楼Cresti男,拉德马赫W,Geider K,科斯塔G.潜力与酰基环己二酮为花腐病的在苹果和梨引起梨火疫病菌的控制的限制。植物别墅。2007; 56(4):702-10。
- 44。
花蜜对微生物拮抗剂防治梨果枯萎病的效果评价。植物病理学。1999;89(1):39-46。
- 45。
Gardiner Se,Norelli JL,De Silva N,Fazio G,Peil A,Malnoy M,Horner M,Bowate D,Carlisle C,Wiedow C等人。具有用于火焰抗性的定量性状基因座相关的推定性抗性基因标记马鲁斯'罗布斯塔5 '登记入册。BMC麝猫。2012;13:25。
- 46。
赵玉玲,王志强,王志强,等。水稻抗病性的分子机制及耐药机制欧文氏菌amylovora,火焰枯萎病的因果因子蔷薇科.植物MOL BIOL REP。2012; 30(2):247-60。
- 47。
Harshman JM,埃文斯公里,艾伦H,Potts R,Flamenco J,Aldwinckle HS,Wisniewski Me,Norelli JL。火灾抗烈抗性Malus Sieversii..植物DIS。2017; 101(10):1738-45。
- 48。
王志强,王志强,王志强。火疫病:历史、生物学与管理。第十一章。寄主条件、培养方法和环境对疾病发展的影响。页183 - 193。圣保罗:APS出版社/美国植物病理学学会;2012.
- 49.
Norelli JL, Jones AL, Aldwinckle HS。二十一世纪的火疫病管理:使用新技术提高苹果的寄主抗性。工厂说。2003;87(7):756 - 65。
- 50。
Aldwinckle H,Logiudice N,Robinson T,Holleran H,Fazio G,Johnson W,Norelli J. Apple砧木的抵抗通过内部运动引起的抗烈感染欧文氏菌amylovora从曲鞘感染。ACTA Hortic。2003; 663:229-34。
- 51。
LoGiudice N,Aldwinckle H,鲁宾逊T,则“B. 9'苹果砧木到火疫病的电阻姆法齐奥G.性质。ACTA Hortic。2004; 704:515-20。
- 52。
陈志强,陈志强,陈志强,等。抗火疫病筛选方法的比较。New Z Plant Prot. 2014; 67:145-50。
- 53。
Chagné D, Vanderzande S, Kirk C, Profitt N, Weskett R, Gardiner SE, Peace CP, Volz RK, Bassil NV.验证苹果果实品质和抗病基因的SNP标记(马鲁斯×家庭Borkh.)使用OpenArray®平台。Hortic杂志2019;6(1):30。
- 54。
王EO,沃德MK,雷尼DE。两个简单的媒体和绿脓菌素荧光素的示范。译水库。1954; 44(2):301-7。
- 55。
WINSING A,GERNOLD M,GEIDER K.通过全细胞的质谱和新型PCR引物的质谱和梨属植物从苹果和梨植物中检测Erwinia物种。J appl microbiol。2012; 112(1):147-58。
- 56。
Chagne d,Crowhurst RN,Troggio男,戴维MW,吉尔摩B,罗礼C,Vanderzande S,海伦斯RP,库马尔S,Cestaro A,等人。基因组范围的SNP检测,验证,和一个8K SNP阵列,用于苹果的发展。Plos一个。2012; 7:e31745。
- 57。
加德纳。新的遗传标记技术给苹果育种带来了革命性的变化。Acta Hortic。2017;1174:23-30。
- 58。
链接本文:Jänsch, Broggini GL, Weger J, Bus VM, Gardiner S, Bassett H, Patocchi A. 8个苹果抗病位点的SNPs鉴定。摩尔繁殖。2015;35(1):21。
- 59。
范ooijen JW。MAPQTL®5,实验群体定量特质基因座的映射软件。Kyazma B.V:荷兰Wagieningen;2004年。
- 60。
Schabenberger O.介绍广义线性混合模型的Glimmix程序,Sugi 30课程;2005. p。196-30。
确认
该项目的新西兰部分由新西兰商业、创新和就业部的战略科学投资基金资助。德国联邦通信委员会(DFG)的项目编号为AOBJ574457和AOBJ577770,支持该项目的德国部分。
资金
该项目的新西兰部分由新西兰商业、创新和就业部的战略科学投资基金资助。德国联邦通信委员会(DFG)的项目编号为AOBJ574457和AOBJ577770,支持该项目的德国部分。资助组织没有参与研究的设计、数据的收集、分析和解释以及手稿的撰写。
作者信息
隶属关系
贡献
AP, AW设计德国项目部分并进行统计分析。用VB设计了新西兰项目部分。SG设计并领导了新西兰项目的分子部分。DC、CO-T进行基因图谱构建。AP、DC、CO-T、TW进行QTL定位分析。AW、CH、KR和MH进行表型分析。AW、CO-T、CH和SM进行实验室分析。ES和MT进行Illumina基因分型。AP、AW、HF、MH、M-VH、O-FE、SG和VB参与了手稿的撰写。所有作者阅读并批准最终文件。
通讯作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
补充信息
附加文件1:
图S1.德国‘Idared’×的基因型排序马吕斯×罗布斯塔用EA222_JKI接种花卉簇后20-60天订购的5种人口。所有数据(2011年到2013年和2015年到2017年)为基因型提供了适用于平均分数。不同颜色表示基因型的花卉簇的分数0-6的百分比。
附加文件2:
图S2.Significant differences between mean resistance scores of individual years in the German ‘Idared’ × 马吕斯×罗布斯塔5人。只有在各个时期测试的所有年份的基因型被用于分析。显著性水平为α = 0.05。一个。2011 - 2013年。b。2015年至2017年。c。期间2011年至2017年
附加文件3:
图S3。德国‘Idared’×品种的平均抗性分值差异显著马吕斯×罗布斯塔5人。只有在各个时期测试的所有年份的基因型被用于分析。由于缺乏标准偏差,从分析中除去没有任何症状的基因型。右侧的不同字母表示α= 0.05水平的显着差异。一个。2011 - 2013年。b。2015年至2017年。c。期间2011年至2017年
附加文件4:
表S1。每个基因型的接种花簇数、年份和评分结果。
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Peil,A.,Hübert,C.,魔力,A。等等。火焰沉着抗性的映射马鲁斯×罗布斯塔5株人工接种后的花。BMC植物杂志19,532(2019)。https://doi.org/10.1186/s12870-019-2154-7
已收到:
接受:
发表:
关键词
- 马吕斯×罗布斯塔5
- 欧文氏菌amylovora
- 火焰抗抵抗力
- QTL作图
- 果园接种