- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发布:gydF4y2Ba
解剖学和RNA-SEQ揭示了调节功能性和粗糙树中的性别分化的重要基因途径,gydF4y2BaTapiscia sinensis.gydF4y2Ba
BMC植物生物学gydF4y2Ba音量gydF4y2Ba19gydF4y2Ba文章编号:gydF4y2Ba554.gydF4y2Ba(gydF4y2Ba2019gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
配子发生是高等植物胚珠或花粉产生的关键步骤。配子发生的性别决定方面已经在模式植物中得到了很好的描述gydF4y2Ba拟南芥gydF4y2Ba.然而,对雄雄异株植物的这一过程所知甚少。gydF4y2BaTapiscia sinensis.gydF4y2BaOliv。是一种功能性和雌雄性的树,具有男性和雌雄同体的个体。雌雄同体花(HFS)是雌性肥沃的花朵,可产生功能性花粉和设置水果。然而,与雄花(MFS)相比,HFS的花粉活力和每朵花粉粒的数量明显减少。MFS是女性无菌花,不能设置水果,最终下降。gydF4y2Ba
结果gydF4y2Ba
与HF相比,MF女性不孕症的发病原因更为显著gydF4y2Ba香椿gydF4y2Ba是早期雌蕊分生组织被破坏的时候。在HF发育的早期(第6阶段),环状分生组织开始在花中心周围形成脊状结构。在这个阶段,MF的内部四轮器官是茎状的而不是心皮状的。gydF4y2Ba
在MF和HF中鉴定了总共52,945个unigenes。检测到许多差异表达的基因(DEGS)和代谢途径,如雌蕊的发展所涉及的,尤其是胚珠,卡皮尔和风格。在早期的雌蕊发展阶段,DEGS显示出功能的代谢途径调节乙烯生物合成和信号转导(上游调节剂),植物生长素,细胞分裂素运输和信号传导,和性别确定(或花分生组织特征)。gydF4y2Ba
结论gydF4y2Ba
最初提出的雌性不育模型途径是为了阐明早期雌蕊发育的分子机制gydF4y2Ba制成。gydF4y2Ba
背景gydF4y2Ba
Agiosperm植物表现出各种育种系统[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].其中,雌雄同体被认为是被子植物的祖先繁殖系统[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba]并且似乎多次从雌雄同体发育出来的[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba5gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].尽管已经提出了雌雄异株进化的两种主要途径,但从祖先的雌雄同体或从雌雄同株物种进化而来的雌雄异株被认为是最常见的[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba].在这一途径上,人们相信雌雄同体的个体与失去了雄性(雌雄异株)或雌性(雄雄异株)功能的单性突变体共存[gydF4y2Ba8gydF4y2Ba].在开花植物中的各种生殖机制中,一种排列 - 雄体(男性和雌雄同体的混合物) - 由其罕见而区分,并且占所有Angiosperms的少于0.005%[gydF4y2Ba10.gydF4y2Ba].然而,雄雄异株被认为是相对不稳定的;交配系统进化的模型预测,雄花异株应该是雌雄同体和雌雄异株(分开的雄性和雌性)之间的一个短暂阶段,反之亦然[gydF4y2Ba5gydF4y2Ba,gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11.gydF4y2Ba,gydF4y2Ba12.gydF4y2Ba,gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba14.gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].功能丧失是不是一个很大的挑战。女sterilty最大的挑战是由于自然选择。通常,如果一个人失去女性的生育能力,它的健身会减半,和自然选择应该采取行动反对它,消除了突变。gydF4y2Ba
在开花植物中的雌雄同体祖先的许多独立场合都在演化[gydF4y2Ba16gydF4y2Ba].控制性别的机制可以是遗传的、表观遗传的(生理的和环境的)[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba,gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba或植物激素[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba25gydF4y2Ba:(1)雌雄异株植物性别决定的遗传控制是由染色体和性别决定基因驱动的。根据Heikrujam等人(2015)的研究,遗传性别的确定可能是由于常染色体上的一个或多个位点不相连或紧密相连[gydF4y2Ba2gydF4y2Ba].例如,在柿子中,只有一个基因位点负责性别决定[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba而芦笋中不同性别的进化引起两个相连基因座的不育突变[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba28gydF4y2Ba].(2)单性花发育的激素调控[gydF4y2Ba29gydF4y2Ba].单性花发育于gydF4y2BaCucumis巨大成功gydF4y2Ba(黄瓜)和gydF4y2BaCucumis梅洛gydF4y2Ba(甜瓜)由环境提示,植物激素和区分性别表型的遗传因素的相互作用来调节[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba30.gydF4y2Ba].在猕猴桃,一个女性化的Y编码的抑制器,gydF4y2Ba害羞的女孩gydF4y2Ba,是通过细胞分裂素反应调节因子的谱系特异性复制而产生的[gydF4y2Ba29gydF4y2Ba].目前,在一些植物中,如gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba32gydF4y2Ba], 棉 [gydF4y2Ba33gydF4y2Ba)、大米(gydF4y2Ba34gydF4y2Ba,番茄gydF4y2Ba35gydF4y2Ba],gydF4y2Ba硅宾latifoliagydF4y2Ba[gydF4y2Ba36gydF4y2Ba,gydF4y2Ba37gydF4y2Ba],gydF4y2Ba玉米gydF4y2Ba[gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba40gydF4y2Ba],gydF4y2BaDiospyros Lotus.gydF4y2Ba[gydF4y2Ba26gydF4y2Ba,黄瓜[gydF4y2Ba25gydF4y2Ba[已实现阐明雌蕊发育和性别测定的分子机制的显着进展[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].这些物种的分子研究导致了我们对植物性别测定和分化的理解的重要进步[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].例如,gydF4y2Ba蚂蚁gydF4y2Ba促进胚珠原基生长;的gydF4y2Ba杯子gydF4y2Ba-gydF4y2Ba形状的子叶gydF4y2Ba基因(CUCs)在胚珠原基边界的建立中起作用;当函数gydF4y2BastkgydF4y2Ba,gydF4y2Bashp1gydF4y2Ba, 和gydF4y2Bashp2gydF4y2Ba在三突变的丢失,减少胚珠启动,胚珠发育受到严重破坏。更值得注意的是,花的决心和发展的ABCDE模型表明,特定类的MADS-box基因是雌蕊发育的关键调节因子[gydF4y2Ba42gydF4y2Ba),如gydF4y2Ba无性生殖的gydF4y2Ba(gydF4y2BaAG)gydF4y2Ba),gydF4y2BaApetala 2.gydF4y2Ba(gydF4y2BaAP2gydF4y2Ba),gydF4y2BaBELL 1gydF4y2Ba,gydF4y2Ba内没有外gydF4y2Ba(gydF4y2Ba伊诺gydF4y2Ba),gydF4y2BaAINTEGUMENTAgydF4y2Ba(gydF4y2Ba蚂蚁gydF4y2Ba),gydF4y2BaSporocytelessgydF4y2Ba(gydF4y2BaSPL.gydF4y2Ba/gydF4y2Ba出处gydF4y2Ba), 和gydF4y2Ba超人gydF4y2Ba(gydF4y2BasupgydF4y2Ba)[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].gydF4y2Ba
AndrodioEcy演化的最新进展表明,由于一些雄花具有非功能性雌蕊,因此来自雌雄同体的雌雄同体来自雌雄同体,并且这些残留的器官是雌雄同体和雌雄同体的雌雄同体和雌雄生物中常见的雌雄同体[gydF4y2Ba13.gydF4y2Ba,gydF4y2Ba45gydF4y2Ba,gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba],而雄雄异株源自雌雄异株的物种则没有无功能雌蕊[gydF4y2Ba50gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].在功能雄雄异株中gydF4y2BaTapiscia sinensis.gydF4y2BaOliv。(Tapisciaceae)[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba]gydF4y2Ba,gydF4y2Ba雄性个体有雌蕊,其中一些有较短的柱和流产的胚珠,而绝大多数的雌蕊没有子房(fig .;gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba因此,这种植物可能提供了一个来自祖先雌雄同体的男性个体的完美模型。此外,雌蕊败育和由性染色体、性别决定基因或激素调节决定性别分化的阶段尚不清楚。gydF4y2Ba
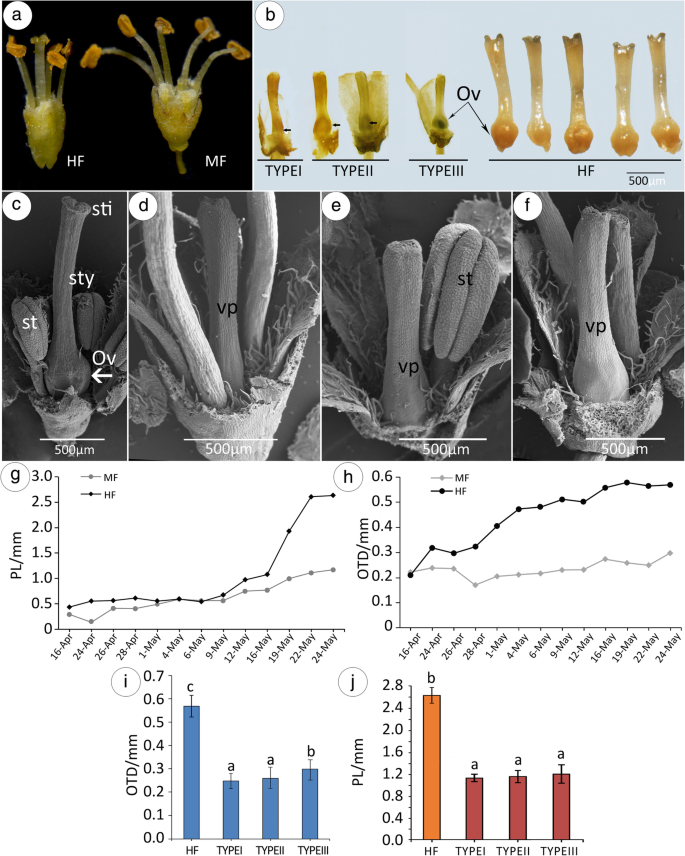
花的特征。gydF4y2BaAGydF4y2BaHF(左)和MF(右)的形态。gydF4y2BabgydF4y2Ba与HF(右)相比,MF中有三种类型的Gynoecia。gydF4y2BacgydF4y2Ba扫描电子显微镜(SEM)观察的HF。gydF4y2BadgydF4y2Ba-gydF4y2BafgydF4y2BaSEM观察三种类型的MF。gydF4y2BaggydF4y2Ba变化在雌蕊长度(PL)随着时间的推移。gydF4y2BahgydF4y2Ba随着时间的推移,卵巢横向直径(OTD)的变化;gydF4y2Ba我gydF4y2BaOTD在HF - I型,II型和III型比较。gydF4y2BajgydF4y2BaPL在HF - I型、II型和III型的比较。每个数据点代表30次技术重复的平均值gydF4y2Ba
为了确定雌性不育的男性个体的分子机制,我们比较了发育解剖学和执行成绩单使用HF和MF的雌蕊的RNA-Seq的技术剖析。许多候选基因和相关途径显露无遗,这提供了新的见解的雌蕊发育的早期阶段,遗传和生化控制,我们的结果将在的功能androdioecious树木性别分化的机制脱落光有帮助gydF4y2Ba本文从gydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
花的形态gydF4y2Ba
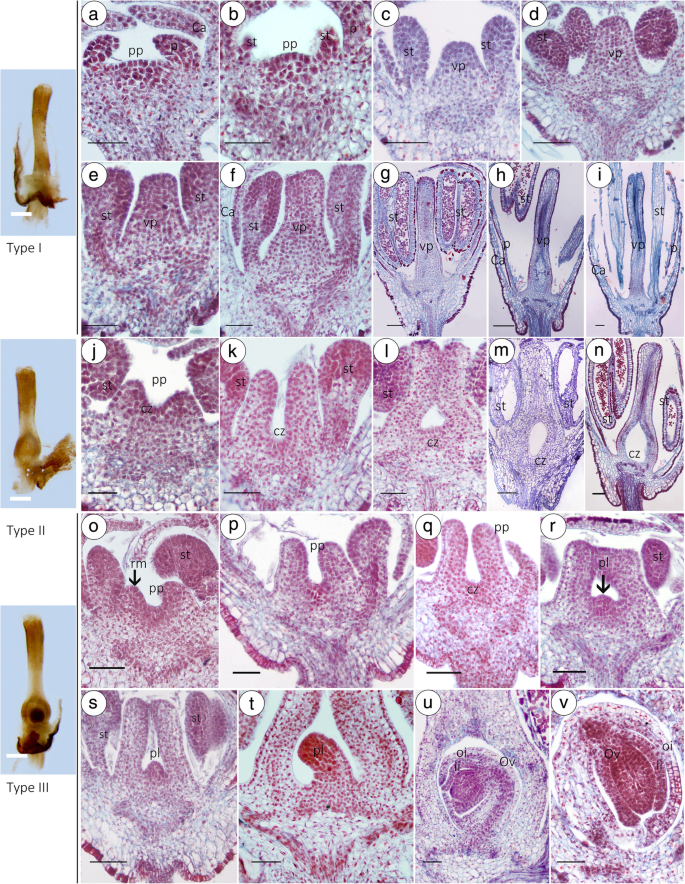
MFs的形态为漏斗状,而HFs的形态为水杯状(图2)。gydF4y2Ba2gydF4y2Baa)和有一个柱头,样式,和卵巢(图正常雌蕊。gydF4y2Ba2gydF4y2BaC)。在用HF进行比较,MF的雌蕊是生长缓慢的和从早期发展阶段短得多开花(图gydF4y2Ba2gydF4y2Bab,g)。在自然群体中,MFS有三种类型(图。gydF4y2Ba2gydF4y2BaB,D-F)。与III型相比,I型和II型中的卵巢横向直径较小(gydF4y2BapgydF4y2Ba< 0.05)(图gydF4y2Ba2gydF4y2Bai),而雌蕊长度(PL)无显著差异(图。gydF4y2Ba2gydF4y2Baj)。相应地,MF植物的开花时间的延长,直到HF的完成受精,因为他们没有结实并产生更多的花。MF具有更短的雌蕊,小胚珠比HF。一个tflowering time, MF bloomed at a PL of 1.17 ± 0.17 mm (Fig.2gydF4y2Bag)和0.518±0.05 mm的OTD(图。gydF4y2Ba2gydF4y2Bah)。相比之下,HF在PL为2.63±0.54 mm(图。gydF4y2Ba2gydF4y2Baj), OTD为1.15±0.08 mm(图。gydF4y2Ba2gydF4y2Ba我)。当OTD (T = -7.102, df = 12,PgydF4y2Ba < 0.01) and the PL (T = − 2.876, df = 12,PgydF4y2Ba< 0.05), MF明显短于HF。值得注意的是,在MFs中,当芽垂直直径增长到0.75±0.05 mm时(第9期,5月16日),PL和OTD保持不变。gydF4y2Ba2gydF4y2Bad)。随后,从9期到开花,MFs的心皮可能会继续有限的生长,通常只有HFs全长的1 / 4到1 / 2(图2)。gydF4y2Ba3.gydF4y2Baj)。gydF4y2Ba
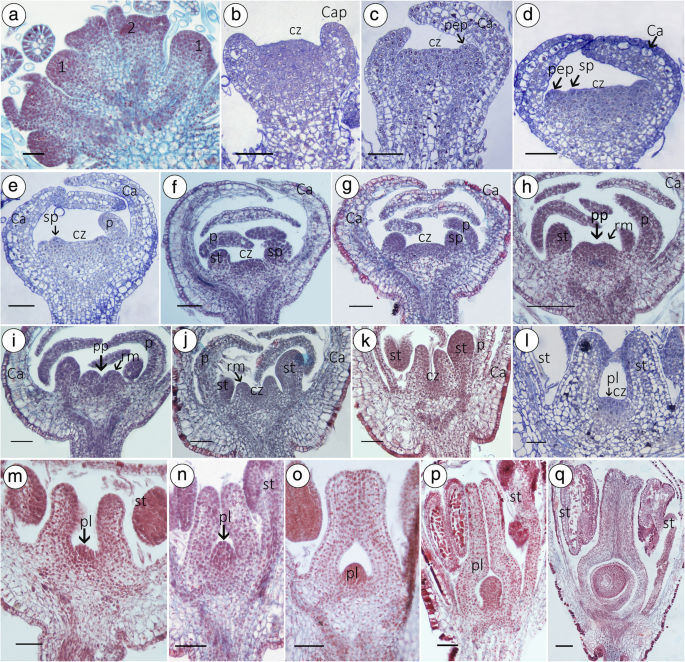
两性花与雄花的性别分化比较。在gydF4y2Ba香椿gydF4y2Ba只,雌雄两性花具有相同的花萼起始,花瓣起始和雄蕊开始图案(从级1到5),所以我们开始显示从阶段5分歧。gydF4y2BaAGydF4y2Ba5瓣5雄蕊形态。gydF4y2BaAGydF4y2Ba-gydF4y2BabgydF4y2Ba~gydF4y2BaggydF4y2BaHF的形态:gydF4y2BaAGydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba两个或三个古昔米·普通岛开始形成花朵中心的脊(环形公司);gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba第7期雌蕊以空心管状生长;第8期雌蕊管长得更高更宽;第10期,可见胚珠原基;gydF4y2BaggydF4y2Ba,gydF4y2BahgydF4y2Ba在开花时间时,雌蕊被施肥准备好,而雄蕊延伸出花瓣,则会发生施肥。gydF4y2BaAGydF4y2Ba-gydF4y2BabgydF4y2Ba~gydF4y2BaggydF4y2BaMF的形态:gydF4y2BaAGydF4y2Ba,gydF4y2BabgydF4y2Ba第6期雌蕊原基也开始形成,但花先端的中心区或雌蕊原基融合成一个小突起;gydF4y2BacgydF4y2Ba~gydF4y2BaegydF4y2Ba异常雌蕊原基生长迅速,呈指状。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba雌蕊的特征在于固体,干燥的结构。vp,痕迹雌蕊;oi,外形;第二,内珠;RM。,环营商;PP。,雌蕊原基;圣,雄蕊;pi,pistil;CZ,中心区gydF4y2Ba
SEM结果显示,在第5阶段之前,MF和HF之间没有明显的差异(图5)。gydF4y2Ba3.gydF4y2Ba然而,在第6阶段,在HFs中,雌蕊原基开始在花先端中心周围形成隆起的细胞脊(图2)。gydF4y2Ba3.gydF4y2BaA,B,C)。在阶段7中,雌蕊生长为中空管(图gydF4y2Ba3.gydF4y2BaC,D);在第8阶段,古代管生长较宽,更宽,伽克麻继续向上生长以形成连续的空心圆柱,并且胎盘原毛可观察到;在阶段10期间,在容器的中心,观察到胚珠原始(图。gydF4y2Ba3.gydF4y2Bae、f);在花期(11-14期),雌蕊为受精做好准备,当雄蕊伸出花瓣时,受精发生(图。gydF4y2Ba3.gydF4y2Bag h)。gydF4y2Ba
在大多数MFs中,在第6阶段,雌蕊原基开始形成(图。gydF4y2Ba3.gydF4y2Bab),但中央区融合为半球形凸起,并且没有戒指的分化存在(图。gydF4y2Ba3.gydF4y2BaC,d),这是从在中空纤维的分生组织环(图明显不同。gydF4y2Ba3.gydF4y2BaMF的雌蕊结构特征是形成一个坚实的茎状结构(图2)。gydF4y2Ba3.gydF4y2Ba电子克)。在发生胚珠败育的关键阶段是阶段6(图gydF4y2Ba3.gydF4y2Bab, b)。gydF4y2Ba
花的结构gydF4y2Ba
在gydF4y2Ba香椿gydF4y2Ba,个体花卉发育过程可分为五个阶段:早期分化,花萼引发,花瓣引发,雄蕊开始和查集。Perianth是在花香顶点上形成的第一个器官(图。gydF4y2Ba4gydF4y2Baa,b)。萼片同时分化并弯曲以覆盖中心区(图。gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba4gydF4y2Bac)晚期5,花瓣和雄蕊原基开始形成(图5)。gydF4y2Ba4gydF4y2Bad).雄蕊形成时,芽体垂直直径为76.92±1.98 μm,花先端呈宽凹状(图2)。gydF4y2Ba4gydF4y2Bae)。花卉凸出的中心区(花卉分生成品)形成一个平台,在该平台上,将产生古昔粒素原金菊(图。gydF4y2Ba4gydF4y2Baf,g和gydF4y2Ba3.gydF4y2Ba在第6阶段,萼片包围花芽,开始形成2 ~ 3个心皮原基,在花先端周围突起的细胞组成一个脊(环状分生组织)(图)。gydF4y2Ba4gydF4y2Ba第7期,内侧雄蕊在基部成柄状,环分生组织生长为中空管状(垂直切面)(图2)。gydF4y2Ba4gydF4y2Baj ~ l);第8期可见胎盘原基(图)。gydF4y2Ba4gydF4y2Bam〜o);然后,从胎盘形成卵子形式(图。gydF4y2Ba4gydF4y2Ba两个或三个心皮在两性体中逐渐融合,最终发育成一个正常的雌蕊,有柱头、花柱和子房(附加文件)gydF4y2Ba4gydF4y2Ba:图S1)。gydF4y2Ba
心衰的发育解剖。gydF4y2BaAGydF4y2Ba花原原始发起。gydF4y2BabgydF4y2BaCalyx原始启动。gydF4y2BacgydF4y2Ba当花萼覆盖着花的中心区域时,花瓣原基发起。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba花的位于中心的区域变宽,那么雄蕊原基发起的。gydF4y2BafgydF4y2Ba,gydF4y2BaggydF4y2Ba作为平台的花顶点的中心区(CZ)。gydF4y2BahgydF4y2Ba,gydF4y2Ba我gydF4y2Ba在第6阶段,萼片包围着花芽的中心区域,心皮原基开始形成,突起的细胞像山脊一样包围着花的顶端。gydF4y2BajgydF4y2Ba,gydF4y2BakgydF4y2Ba雌蕊继续向上生长,形成一个连续的空心圆柱体。gydF4y2BalgydF4y2Ba中央区域变宽,胎盘原基将在这里形成;gydF4y2Ba米gydF4y2Ba,gydF4y2BangydF4y2Ba第7期,内侧雄蕊基部呈柄状,雌蕊长出中空管状,可见胎盘原基。gydF4y2BaogydF4y2Ba胎盘原基和风格,形成单房的快速增长。gydF4y2BapgydF4y2Ba胚珠原基形成的时期。gydF4y2Ba问gydF4y2Ba在山脊的中心,胚珠将形成。酒吧=100μm。帽,花萼原始;PEP,花瓣原始;CZ,中心区;SP。,雄蕊原始;RM。,环营商;圣,雄蕊;p,花瓣;PEP,花瓣原始; pl, placenta primordium
从第1阶段到第5阶段,雌雄同体和雄性具有相同的发育过程和形态学结构(图。gydF4y2Ba4gydF4y2Baa-k)。然而,在第5阶段之后,MF中的花香顶点中心的Carpel原始呈现来自HFS的不同模式。来自同一树的MF的纵向显示,有三种类型的雌蕊。I型:没有胚珠或卵巢的大部分MFS的特征在于形成固体,干燥的残留雌蕊(图。gydF4y2Ba5gydF4y2Baⅰ)。II型:极少数(1.6%)MF只有一个子房,但没有胚珠结构(图;gydF4y2Ba5gydF4y2Baj-n)。III型:MFs的雌蕊发育良好,不育(3.33%);子房有一个房室,其中有一个胚珠,胚珠有双重珠被,是十字形的,倒生的(图。gydF4y2Ba5gydF4y2BaO-U);然而,当在成熟后MF脱落时,在三合会阶段发生胚囊发育的终止(图。gydF4y2Ba5gydF4y2Bav;附加文件gydF4y2Ba4gydF4y2Ba:图S1)。gydF4y2Ba
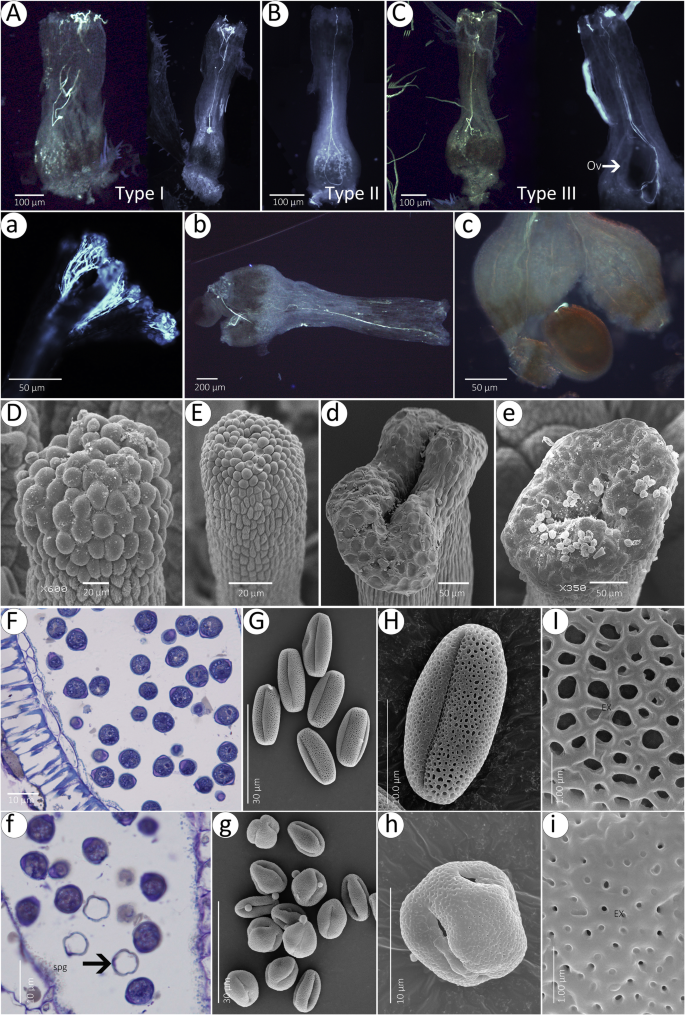
一个poll在一个t我on一个n一个lysis found that a few pollen grains from self or HF could germinate on MF stigmas 6 h after pollination. Remarkably, compared with HF (Fig.6gydF4y2Ba在MF中,虽然花粉管在乳头细胞表面呈螺旋状生长,但部分花粉管在授粉24小时后穿透柱头或花柱,成功到达异常胚珠(图1)。gydF4y2Ba6gydF4y2Baa - c)。进一步观察发现MF柱头上有乳头细胞(图。gydF4y2Ba6gydF4y2Bad, e)与HFs在成熟期相似(图。gydF4y2Ba6gydF4y2Bad,e)。花药和花粉颗粒部分表明,在HF中观察到许多无菌花粉晶粒(SPG)(图。gydF4y2Ba6gydF4y2Baf),而非MF(图。gydF4y2Ba6gydF4y2BaF)。雌雄同体花中有两种类型的花粉(图。gydF4y2Ba6gydF4y2Bag),而MF中只有一种类型的花粉(图。gydF4y2Ba6gydF4y2Bag)。与此相反的橄榄花粉在MF(图1中的穿孔顶盖。gydF4y2Ba6gydF4y2BaH,I),在HF花粉粒具有网状顶盖(图gydF4y2Ba6gydF4y2Ba你好)。gydF4y2Ba
花粉萌发,花粉管伸长和MF中的乳头细胞(gydF4y2BaAGydF4y2Ba-gydF4y2BaegydF4y2Ba)及HFs (gydF4y2BaAGydF4y2Ba-gydF4y2BaegydF4y2Ba).gydF4y2BaAGydF4y2Ba-gydF4y2BacgydF4y2Ba自花授粉后24小时,三种类型的MF的花粉管呈螺旋状,均能穿透乳头细胞。gydF4y2BaAGydF4y2Ba-gydF4y2BacgydF4y2Ba自花授粉24小时后,花粉管进入HF胚珠的珠孔。gydF4y2BadgydF4y2Ba,gydF4y2BaegydF4y2Ba不可分割的耻辱乳头细胞。gydF4y2BadgydF4y2Ba,Bilobed Stigma。gydF4y2BaegydF4y2Ba,三裂的耻辱。gydF4y2BafgydF4y2Ba,花药和花粉粒部分;观察到不育花粉粒。gydF4y2BaggydF4y2Ba,HF的球状花粉粒。gydF4y2BahgydF4y2Ba,球状花粉粒;gydF4y2Ba我gydF4y2Ba,穿孔构成细节。gydF4y2BafgydF4y2Ba,花药和花粉粒部分。gydF4y2BaggydF4y2Ba,橄榄花粉粒。gydF4y2BahgydF4y2Ba,橄榄花粉在MF;gydF4y2Ba我gydF4y2Ba,网状顶盖细节gydF4y2Ba
Illumina测序和序列组装gydF4y2Ba
在该项目中,Illumina Hiseq™4000测序平台用于转录组测序,获得962,641,935个清洁读数,平均长度为150碱基对(BP)。平均GC百分比为44.69%。干净的读数是使用Trinity组装的De Novo [gydF4y2Ba55gydF4y2Ba]为63,573个contigs,平均长度为1132 bp, N50为1892 bp。然后用TGICL (tiger Gene Indices聚类工具)软件使用contigs进行序列聚类,形成unigenes [gydF4y2Ba56gydF4y2Ba].unigenes的总数为52,945,平均长度为973 bp和1768 bp的N50。序列覆盖的平均深度为82.42%。总共36,353名植物,201〜2000年的植物内,百分之57.59%。一个dd我t我on一个lly, 7766 unigenes (14.67%) ranged from 1001 to 2000 bp in length, while 7408 of the unigenes (13.99%) were over 2000 bp in length.
差异表达的基因(DEGS)和富集分析gydF4y2Ba
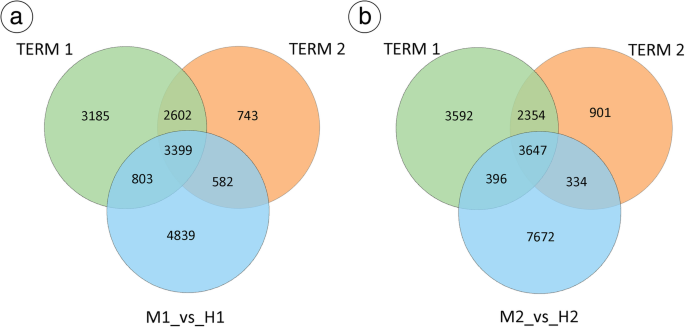
使用集群的系列测试(STC) [gydF4y2Ba57gydF4y2Ba],在M1-M2-M3项(TERM1)_vs_H1-H2-H3项(TERM2)中分别鉴定和转录9989个和7326个unigenes (Additional filegydF4y2Ba4gydF4y2Ba:图S3)。M1、M2、M3分别代表第5、6、10阶段的MF, H1、H2、H3分别代表第5、6、10阶段的两性花。在TERM1中,我们分析了13,761个基因的表达模式,并使用8个模型图谱进行了总结(附加文件)gydF4y2Ba4gydF4y2Ba:图S2);5种基因表达模式均有显著性差异gydF4y2BapgydF4y2Ba值(gydF4y2BapgydF4y2Ba < 0.05) marked with coloured boxes, including profile 3, profile 4, profile 5, profile 6, and profile 7 (Additional file4gydF4y2Ba:图S3)。在TERM2中,我们分析了16130个基因的表达模式,并使用8个模型图谱进行了总结(附加文件)gydF4y2Ba4gydF4y2Ba:图S2);基因的三种表达模式显示出显着gydF4y2BapgydF4y2Ba值(gydF4y2BapgydF4y2Ba < 0.05) marked with coloured boxes, including profile 1, profile 6, and profile 7 (Additional file4gydF4y2Ba:图S3)。每个框代表一个模型表达式概要文件,其中包含模型概要文件编号和p值。进一步澄清之间的功能差异MF 6和高频阶段,使用一个错误发现率(罗斯福)≤0.05和的绝对值| | log2比率≥1作为标准,9623年,14347年和12049年unigenes表现出明显不同的表达水平在M1_vs_ H1, M2 _vs_H2,分别和M3_vs_H3(附加文件gydF4y2Ba4gydF4y2Ba:图S4A-C)。gydF4y2Ba
要确定是否中频和高频之间的度的视角是显著相关的具体途径或生物学功能,GO和KEGG数据库被用于富集分析(附加文件gydF4y2Ba4gydF4y2Ba:图S4D-F)。对于TERM1, TERM2, M1_vs_H1 DEGs,显示富集的氧化石墨烯术语包括“类黄酮生物合成过程”(GO:0009813)、“二级代谢过程”(GO:0019748)、“激素生物合成过程”(GO:0042446)、“细胞分裂素生物合成过程”(GO:0009691)、“糖苷生物合成过程”(GO:0016138)、和《施肥调控》(GO:0080154)(附加文件gydF4y2Ba3.gydF4y2Ba).相反,对于术语,TEMP2,M2_VS_H2,富集的分类项是“细胞壁组织或生物生成”(GO:0071554),“外部封装结构组织”(GO:0045229),“葡萄糖代谢过程”(GO:0006006),“胚胎发展”(GO:0009790),“对无机物质的反应”(GO:0010035)和“对化学品的反应”(GO:0042221)(附加文件gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
途径分配是通过KEGG进行的,分析DEG的生物学功能。对于TERM1, TERM2和M1_vs_H1的比较(图。gydF4y2Ba7gydF4y2Baa)“苯丙素生物合成”(ko00940)、“植物-病原体相互作用”(ko04626)、“植物激素信号转递”(ko04075)、“硫代葡萄糖苷生物合成”(ko00966)、“二萜生物合成”(ko00904)、“淀粉和蔗糖代谢”(ko00500)、“玉米素生物合成”(ko00908)、“核糖体”(ko03010)、“类黄酮生物合成”(ko00941)进行了富集(补充文件)gydF4y2Ba3.gydF4y2Ba).对于TERM1, TERM2和M1_vs_H1的比较(图。gydF4y2Ba7gydF4y2Bab)、主要途径包括“糖酵解/糖异生”(ko00010)、“戊糖和葡萄糖醛酸的相互转化”(ko00040)、“色氨酸代谢”(ko00380)、“柠檬酸循环(TCA循环)”(ko00020)、“淀粉和蔗糖代谢”(ko00500)、“植物激素信号转导”(ko04075)和“玉米素生物合成”(ko00908)(补充文件)gydF4y2Ba3.gydF4y2Ba).富集分析显示,总共63只与植物激素信号转导有关。因此,“植物激素信号转导”的过程得出结论是一种推定的途径gydF4y2Ba香椿gydF4y2Ba花卉开发(附加文件gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
HF和MF在不同阶段的独特和共享的DEGs。gydF4y2BaAGydF4y2Ba在TERM1, M1_vs_H1, TERM2。gydF4y2BabgydF4y2BaTerm1,M2_VS_H2,TEST2中的参数数。使用在线工具Venn图(gydF4y2Bahttp://bioinformatics.psb.ugent.be/webtools/Venn/gydF4y2Ba)gydF4y2Ba
简而言之,DEGS使用GO和KEGG数据库进行了特征。基于最近的研究结果[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba29gydF4y2Ba,gydF4y2Ba31gydF4y2Ba,gydF4y2Ba42gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,主要研究与心皮和胚珠发育相关的基因调控网络模型、植物激素信号转导(ko04075)、玉米素生物合成(ko00908)、激素生物合成过程(GO:0042446)和细胞分裂素生物合成过程(GO:0009691gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
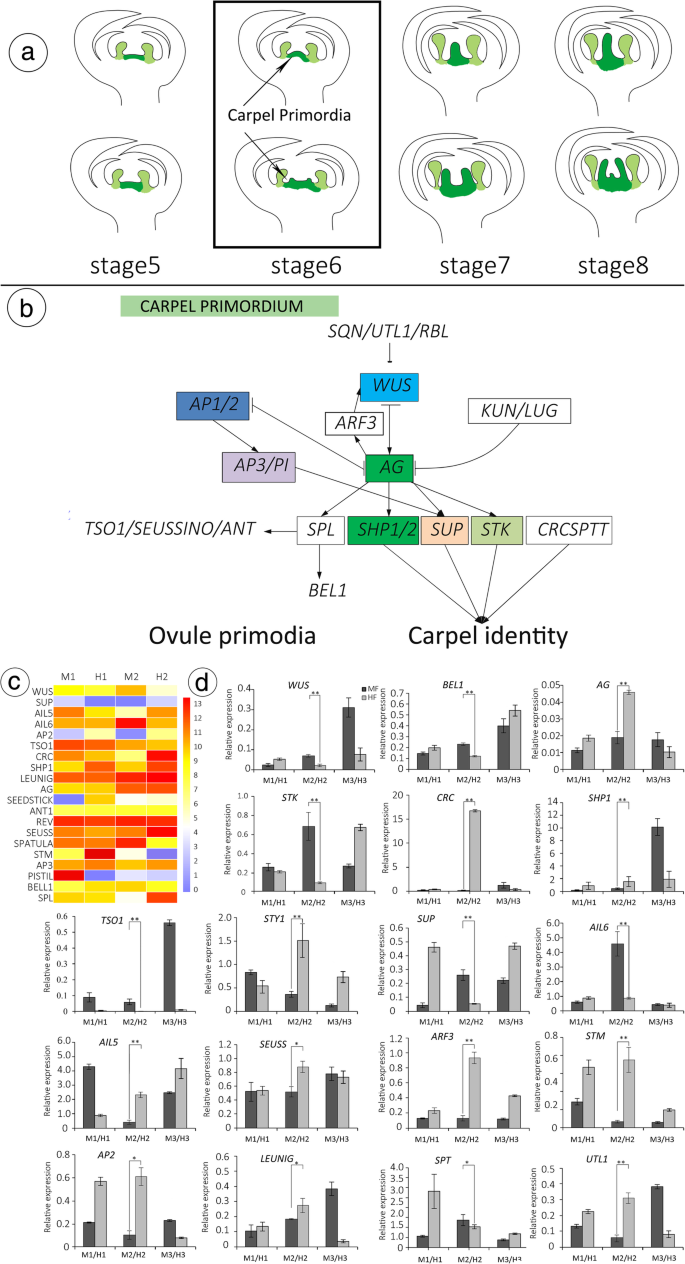
基因调控网络(GRN)与心皮和胚珠发展模式gydF4y2Ba
扫描电镜(SEM)和光镜(LM)结果表明,黄花菊的雌蕊大部分退化gydF4y2Ba香椿gydF4y2Ba没有卵巢或胚珠的手指状结构。花粉萌发和MF花粉管生长表明,花粉管可以在柱头/样式,并且它们是有功能的生长,因此,胚珠是从不存在负责的雄花雌性不育性的主要因素(图gydF4y2Ba8gydF4y2Ba一种)。在拟南芥中,胚珠细胞命运由胚珠同一性基因控制[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba].调节的途径gydF4y2Ba拟南芥gydF4y2Ba胚珠发育示于图。gydF4y2Ba7gydF4y2Ba,主要监管机构包括gydF4y2BaAG)gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba],gydF4y2BaSPL.gydF4y2Ba[gydF4y2Ba63gydF4y2Ba],gydF4y2Ba伊诺gydF4y2Ba[gydF4y2Ba64gydF4y2Ba],gydF4y2Ba蚂蚁gydF4y2Ba和gydF4y2BaBEL1gydF4y2Ba[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba65gydF4y2Ba].心皮是花中最复杂的结构;一个GRN(基因调控网络模型)是它们发展的基础gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba31gydF4y2Ba),在gydF4y2Bat . sinensis,gydF4y2Ba确定关键监管机构,包括gydF4y2Ba沃斯gydF4y2Ba(Unigene0010686),gydF4y2Ba无性生殖的gydF4y2Ba(Unigene0020941),gydF4y2BasupgydF4y2Ba(Uniene0047137),gydF4y2BaSPL.gydF4y2Ba(Unigene0006964),gydF4y2Ba伊诺gydF4y2Ba(Unigene0025624),gydF4y2Ba扫描隧道显微镜gydF4y2Ba(Unigene16944),gydF4y2BaANT1gydF4y2Ba(Unigene0002499),gydF4y2BaSTKgydF4y2Ba(gydF4y2BaAGL11.gydF4y2Ba)(Unigene0007536),gydF4y2BaSHP1gydF4y2Ba(Unigene0013614),gydF4y2BaAP2gydF4y2Ba(Unigene0015664),gydF4y2BaTSO1gydF4y2Ba(Ungene0002282),gydF4y2BaSPT.gydF4y2Ba(Unigene0034455),gydF4y2Ba耳舌gydF4y2Ba(Unigene0041412),gydF4y2BaπgydF4y2Ba(Unigene0020391),gydF4y2BasegydF4y2Ba(Unigene0033961)和gydF4y2BaBEL1gydF4y2Ba(Unigene0039261)(图。gydF4y2Ba8gydF4y2Bab, c).在MF-HF比较中,这16个基因的表达水平存在显著差异。结果表明,这些基因可能影响花的发育。gydF4y2Ba
雌蕊发育相关候选基因的表达。gydF4y2BabgydF4y2BaMF-HF差异模型中的花朵发展。gydF4y2BabgydF4y2Ba基于拟南芥的前期研究[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba61gydF4y2Ba,gydF4y2Ba62gydF4y2Ba,gydF4y2Ba63gydF4y2Ba,一个基因依赖途径在调控雌蕊发育中发挥潜在作用的模型。gydF4y2BacgydF4y2Ba胚珠发育相关候选基因的表达。gydF4y2BadgydF4y2Ba在MF和HF中选择的20个基因在花芽发育不同阶段的相对表达量。以肌动蛋白为标准,采用2-ΔΔCt法计算相对表达量。11-Apr。,21-一个pr., and 4-May represent the pistils of flowers at stage 5, stage 6, and stage 8, respectively. Different colours from blue to red show the relative log2 (expression ratio)
为了确认来自Illumina测序和生物信息学分析的独特匹配基因确实表达了差异表达,从与花发育(包括Carpel,Ovule,Pollen)有关的Degs中,共选出了总共16个基因的用于定量RT-PCR测定。对于16个基因,尽管有一些定量差异,但QRT-PCR分析显示出与RNA-SEQ数据相同的表达趋势。所有基因在阶段6处的MF和HF之间具有不同的表达水平(图。gydF4y2Ba8gydF4y2Bad)。例如,在第6阶段,UNIGENE0020941,调节Carpel发育的转录因子,在MF中,相对于HF通过QRT-PCR下调(0.018至0.045),与来自RNA的一个(39至338)相同的趋势 -SEQ。gydF4y2Ba
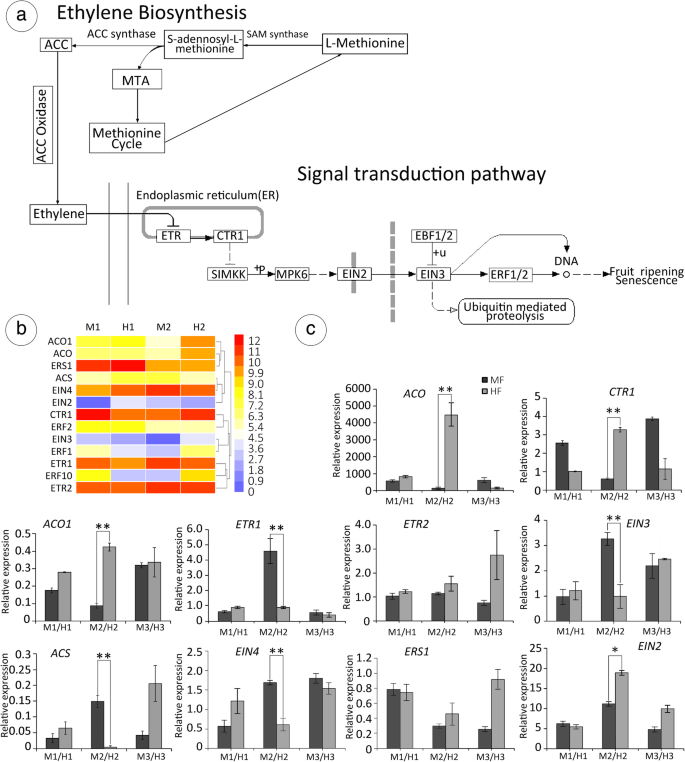
鉴定乙烯生物合成和信号转导的基因gydF4y2Ba
乙烯调节植物开发的许多方面和对生物和非生物胁迫的反应。我们鉴定了乙烯生物合成和信号转导过程中涉及的十次(图。gydF4y2Ba9gydF4y2Baa):gydF4y2BaACO.gydF4y2Ba(Unigene0029908),gydF4y2BaACO1.gydF4y2Ba(Unigene0037768),gydF4y2BaACS.gydF4y2Ba(Unigene0021193),gydF4y2BaERS1gydF4y2Ba(Unigene0024060),gydF4y2BaCtr1.gydF4y2Ba(Unigene0036282),gydF4y2BaTIR1gydF4y2Ba(Unigene0037222),gydF4y2BaETR1gydF4y2Ba/gydF4y2Ba2gydF4y2Ba(Unigene0020715,Unigene0027393),gydF4y2BaEIN2 / 3/4gydF4y2Ba(Unigene0029458, Unigene0050718, Unigene0003076)gydF4y2Ba9gydF4y2Bab).为了确认RNA测序结果,选取与心皮发育相关的10个deg进行qRT-PCR分析(图)。gydF4y2Ba9gydF4y2BaC)。结果表明转录组分析的表达趋势,仅为2/16基因(gydF4y2BaEIN2.gydF4y2Ba和gydF4y2BaEIN3.gydF4y2Ba)QRT-PCR与RNA-SEQ有不同的结果,确认RNA-SEQ数据的可靠性。1-氨基环丙烷-1-羧酸(ACC)合成酶(ACS)是乙烯合成中的速率限制酶,并且在调节乙烯生物合成中是重要的。Unigene0021193在M-H比较中在第6阶段下调。二gydF4y2BaACC.gydF4y2Ba氧化酶同源基因表现出不同的表达模式,但gydF4y2BaACO.gydF4y2Ba和gydF4y2BaACO1.gydF4y2Ba在MF-HF比较中,均在6期上调。gydF4y2Ba
胚珠发育相关候选基因的表达。gydF4y2BaAGydF4y2Ba乙烯生物合成和信号转导途径,来自KEGG途径富集分析[gydF4y2Ba76gydF4y2Ba,gydF4y2Ba77gydF4y2Ba].gydF4y2BabgydF4y2Ba亚乙基生物合成和信号转导参与候选基因的表达。通过LOG2RATIO测量基因表达。11月11日至4月,21日至4月,4月,11月11日和21日 - 可分别代表其发展阶段分别为5,6,10,12和14时的花病。然而,在这里,我们主要讨论第6阶段,这是T.Inensis中性别分化中最重要的发展阶段(有关详细信息,请参阅“花的结构”)。从蓝色到红色的不同颜色显示相关系数的大小。gydF4y2BacgydF4y2Ba10个基因在MF和HF花芽发育不同阶段的相对表达量。以肌动蛋白为标准,采用2-ΔΔCt法计算相对表达量。*代表了gydF4y2BaPgydF4y2Ba< 0.05水平差异显著,**表示gydF4y2BaPgydF4y2Ba独立样本间差异< 0.01水平gydF4y2BatgydF4y2Ba- 最低gydF4y2Ba
在gydF4y2Ba拟南芥gydF4y2Ba在美国,乙烯的感知是由内质网膜结合受体家族的五个成员实现的:gydF4y2BaETR1gydF4y2Ba,gydF4y2BaETR2gydF4y2Ba,gydF4y2BaERS1gydF4y2Ba,gydF4y2BaERS2gydF4y2Ba和gydF4y2BaEIN4.gydF4y2Ba,其中一些具有组氨酸激酶活性[gydF4y2Ba72gydF4y2Ba].从mRNA测序中,我们获得了四种乙烯受体:gydF4y2BaEIN4.gydF4y2Ba(Unigene0003076),gydF4y2BaETR2gydF4y2Ba(Unigene0027393),gydF4y2BaETR1gydF4y2Ba(Unigene0020715),gydF4y2BaERS1gydF4y2Ba(Unigene0024060)。在阶段6,Unigene0020715的相对表达显示显著差异,但Unigene0027393和Unigene0024060是不明显。Unigene0020715,乙烯信号转导的阻遏,上调相对于HF MF,但Unigene0027393显示不醒目的表达。同样,Unigene0003076显示几乎相同的趋势gydF4y2BaETR1gydF4y2Ba在舞台上6gydF4y2Ba,gydF4y2Ba而Unigene0024060是不明显的。gydF4y2BaERF1/2gydF4y2Ba(UNIGENE0025860,UNIGENE0005688),乙烯信号转导途径中的下游基因,在M1-M2和H1-H2比较中显示差异表达,在关键阶段的HF中在MF中上调。显然,在第6阶段,gydF4y2BaACO.gydF4y2Ba(Unigene0029908),gydF4y2BaACO1.gydF4y2Ba(Unigene0037768),gydF4y2BaCtr1.gydF4y2Ba(Unigene0036282),和gydF4y2BaEIN2.gydF4y2Ba(Unigene0029458)在MF-HF比较中上调,同时进行上调gydF4y2BaACS.gydF4y2Ba和gydF4y2BaEIN3.gydF4y2BaMF相对于HF下调。gydF4y2Ba
证实乙烯在两性分化中的作用gydF4y2BaTgydF4y2Ba.gydF4y2BasisensisgydF4y2Ba,我们以150mg /L的浓度喷洒乙烯利。我们发现乙烯利对MF转化为HF有显著影响。gydF4y2Ba
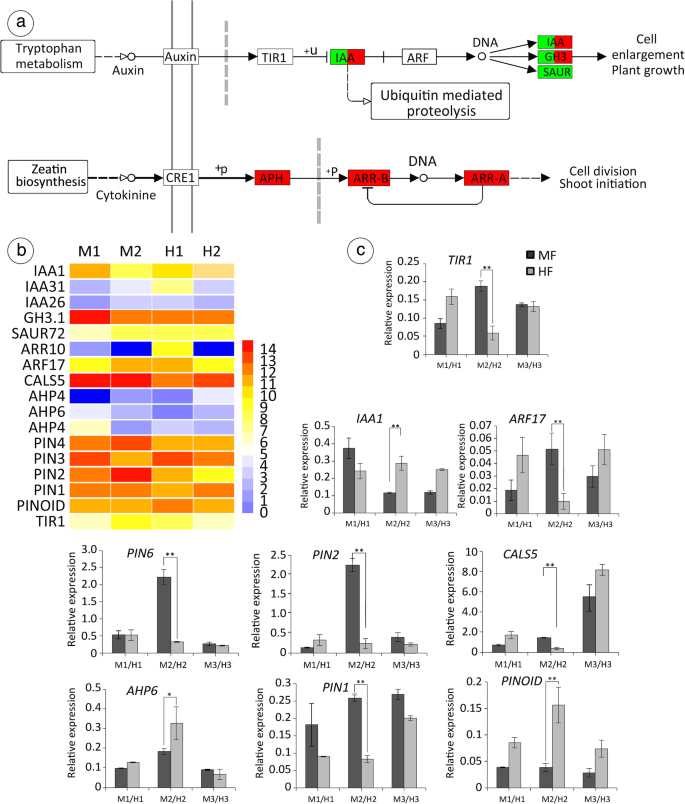
鉴定疾病和细胞素信号转导的基因gydF4y2Ba
第三个相关途径为生长素运输和信号转导途径。作为研究的第一种植物激素,生长素对整个植物的生长发育有广泛的影响,包括雌蕊和胚珠形态发生[gydF4y2Ba73gydF4y2Ba,gydF4y2Ba74gydF4y2Ba,gydF4y2Ba75gydF4y2Ba].在我们的研究中,我们发现参与生长素和细胞分裂素的信号转导(图24度的视角。gydF4y2Ba10.gydF4y2Baa、b):gydF4y2BaIAA31gydF4y2Ba(Unigene0018133),gydF4y2BaIAA26gydF4y2Ba(Unigene0035359),gydF4y2BaIAA15gydF4y2Ba(Unigene0001116)gydF4y2Ba, IAA19gydF4y2Ba(Unigene0025767),gydF4y2BaGH3.1gydF4y2Ba(Unigene0015426),gydF4y2BaSAUR2gydF4y2Ba(Unigene0017779),gydF4y2BaSaur14.gydF4y2Ba(Unigene0050945),gydF4y2BaSAUR72gydF4y2Ba(Unigene0005319),gydF4y2BaSAUR50gydF4y2Ba(Unigene0010084),gydF4y2BaSaur12.gydF4y2Ba(Unigene0018267),gydF4y2BaSAUR31gydF4y2Ba(Unigene0049968),gydF4y2BaSAUR53gydF4y2Ba(Unigene0019490),gydF4y2BaKUP3gydF4y2Ba(Unigene0005158)gydF4y2Ba,mir397b.gydF4y2Ba(Unigene0025946),gydF4y2BaARR10gydF4y2Ba(Unigene0049560),gydF4y2BaAHP4gydF4y2Ba(Unigene0004154),gydF4y2BaAHP6gydF4y2Ba(Unigene0011561),gydF4y2BaAHP4gydF4y2Ba(Unigene0004325),gydF4y2BaIAA1gydF4y2Ba(Unigene0001116),gydF4y2BaARF17gydF4y2Ba(Unigene0029174),gydF4y2BaCALS5gydF4y2Ba(Unigene0019058),gydF4y2BaPIN6.gydF4y2Ba(Unigene0020253)gydF4y2Ba, PIN2gydF4y2Ba(Unigene0033811),gydF4y2BaPIN1.gydF4y2Ba(Unigene0000533)。为了确认Illumina测序和生物信息学分析中所获得的独特匹配基因确实存在差异表达,我们从与花发育相关的DEGs中共选择了9个基因进行定量RT-PCR检测。在MF和HF之间表达水平不同的24个基因中,有9个基因(图。gydF4y2Ba10.gydF4y2Bac)在第6阶段,MF相对于HF有6个基因上调,3个基因下调。gydF4y2Ba
讨论gydF4y2Ba
雄花gydF4y2Ba香椿gydF4y2Ba起源于祖先雌雄同的花朵gydF4y2Ba
已经提出了各种假设的进化途径,用于从雌雄同体中的二氧化性的演变,并且只有双性恋花的生产是Angiosperms的祖先病症[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba7gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba78gydF4y2Ba,gydF4y2Ba79gydF4y2Ba,gydF4y2Ba80gydF4y2Ba,gydF4y2Ba81gydF4y2Ba,gydF4y2Ba82gydF4y2Ba,gydF4y2Ba83gydF4y2Ba].理论预测,至少需要两种突变才能进化成不同的性别[gydF4y2Ba11.gydF4y2Ba].一种必然导致男性不育,而另一种必然导致女性不育[gydF4y2Ba27gydF4y2Ba,gydF4y2Ba29gydF4y2Ba].因此,我们研究了雄雄异株是否gydF4y2Ba香椿gydF4y2Ba导致从雌花转型,雌雄异株植物,恢复男性功能,或由雌蕊不育两性花引起的。gydF4y2Ba
在gydF4y2Ba香椿gydF4y2Ba中,在每个自然种群雄花具有的残留雌蕊的特性,并且接受柱头由乳头细胞覆盖。虽然雌蕊不育的程度是不同的,男性有形成胚珠的潜力。此外,在自然种群,没有花粉上的再现限制gydF4y2Ba香椿gydF4y2Ba[gydF4y2Ba84gydF4y2Ba,gydF4y2Ba85gydF4y2Ba].因此,从女性花中演变的女性花朵不太可能恢复他们的男性功能以确保再现[gydF4y2Ba15gydF4y2Ba].显然,如果雄细胞从Diocy出现,MF也是不合理的。另外,如同gydF4y2Ba桂花雀族gydF4y2Ba, MF有一个退化的雌蕊,也表明雄性从雌雄同体中的雌性不育突变体进化而来[gydF4y2Ba13.gydF4y2Ba].gydF4y2Ba
繁育系统和其他性状映射的系统发育树gydF4y2Bafraxinus.gydF4y2BaL.(木犀科)表明雌雄异株有三个独立的起源;在一个例子中,雌雄异株从雌雄同体进化而来,随后从昆虫授粉到风媒授粉[gydF4y2Ba45gydF4y2Ba,gydF4y2Ba86gydF4y2Ba].雌雄异株也可能演变结合风媒传粉的某些先前昆虫花授粉物种进化[gydF4y2Ba87gydF4y2Ba,gydF4y2Ba88gydF4y2Ba].gydF4y2Ba香椿gydF4y2Ba是一种风授粉和昆虫授粉的物种[gydF4y2Ba52gydF4y2Ba,gydF4y2Ba53gydF4y2Ba],这种混合授粉模式可能是雌雄同体向雌雄异株进化的可能途径[gydF4y2Ba55gydF4y2Ba].TECTUM雕塑性格的趋势从穿孔的变化似乎在Angiosperms中似乎是常见的[gydF4y2Ba66gydF4y2Ba,gydF4y2Ba67gydF4y2Ba,gydF4y2Ba89gydF4y2Ba].在gydF4y2Ba香椿gydF4y2Ba,TECTUM雕塑是在MF花粉颗粒中的网状物,而HF的孔是穿孔的。此外,球状花粉晶体具有最大的体积到表面积比,但具有最小的调节功能,这是一个相对基本的特征[gydF4y2Ba68gydF4y2Ba].橄榄花粉粒可由HF的球状花粉粒转化而成。从进化的角度来看,这一结果也暗示了雌雄同体更古老[gydF4y2Ba69gydF4y2Ba].gydF4y2Ba
雌蕊发育的关键调控因子可能与之相关gydF4y2Ba香椿gydF4y2Ba性别分化gydF4y2Ba
不可否认,从胎盘出现胚珠原基;然而,在大多数MF中,胚珠和胎盘都完全不存在gydF4y2Ba香椿gydF4y2Ba.转录组分析表明,在MF雌蕊败育的关键阶段,16个与心皮和胚珠发育相关的基因有差异表达,并通过qRT-PCR进行了验证。胚珠发育的分子机制gydF4y2Ba拟南芥gydF4y2Ba,棉花和大米相对众所周知[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba90gydF4y2Ba].C类基因gydF4y2BaAG)gydF4y2Ba(gydF4y2Ba无性生殖的gydF4y2Ba)属于疯狂的盒子家族,它决定了雄蕊和卡皮尔身份,并在胚珠发展中发挥作用[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].当gydF4y2BaSHP1gydF4y2Ba(gydF4y2Ba防碎的1gydF4y2Ba),gydF4y2BaSHP2gydF4y2Ba(gydF4y2Ba防碎的2gydF4y2Ba), 和gydF4y2BaSTKgydF4y2Ba(gydF4y2BaSerifstick.gydF4y2Ba)基因一起gydF4y2Ba9月gydF4y2Ba(gydF4y2Basepallata.gydF4y2Ba)基因的表达模式与gydF4y2BaAG)gydF4y2Ba在一个gydF4y2BaAG)gydF4y2Ba独立的方式(gydF4y2Ba31gydF4y2Ba].gydF4y2Ba蚂蚁gydF4y2Ba(gydF4y2BaAINTEGUMENTAgydF4y2Ba),gydF4y2Ba高级语言gydF4y2Ba(gydF4y2BaHuellenlos.gydF4y2Ba),gydF4y2BaSIN2(短INTEGUMENT 2)gydF4y2Ba,gydF4y2Ba内没有外gydF4y2Ba(gydF4y2Ba伊诺gydF4y2Ba), 和gydF4y2Ba超人gydF4y2Ba(gydF4y2BasupgydF4y2Ba)作为胚珠生长的调节因子[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba76gydF4y2Ba,gydF4y2Ba90gydF4y2Ba,gydF4y2Ba91gydF4y2Ba].gydF4y2BaAG)gydF4y2Ba对于花卉公司活动的确定和终止是必要的。在gydF4y2BaAGgydF4y2Ba突变,延迟的花分生组织活动导致雄蕊和心皮被花取代[gydF4y2Ba61gydF4y2Ba].gydF4y2BaWuschel.gydF4y2Ba(gydF4y2Ba沃斯gydF4y2Ba),指定干细胞标识和gydF4y2BaAG)gydF4y2Ba在调节花分生组织的起始或终止中起关键作用[gydF4y2Ba92gydF4y2Ba,gydF4y2Ba93gydF4y2Ba].gydF4y2Ba
以前的研究表明gydF4y2BaSPL /喷嘴gydF4y2Ba是启动孢子发生所必需的,并通过拮抗的表达在珠心形成中起核心作用gydF4y2Ba贝尔gydF4y2Ba,gydF4y2Ba蚂蚁gydF4y2Ba和gydF4y2Ba内没有外gydF4y2Ba[gydF4y2Ba94gydF4y2Ba].在这里,有4个基因在MF中相对于6期HF有差异表达。此外,gydF4y2BaSPL.gydF4y2Ba抑制的表达gydF4y2Ba蚂蚁gydF4y2Ba和gydF4y2Ba伊诺gydF4y2Ba控制胚珠原基形成[gydF4y2Ba95gydF4y2Ba].gydF4y2BaSPL.gydF4y2Ba在MF相对于HF的雌蕊流产的关键阶段下调,这表明了作用gydF4y2BaSPL.gydF4y2Ba促进胚珠发育。然而,在胚珠发育期间,gydF4y2BaBEL1gydF4y2Ba和gydF4y2BaSPL.gydF4y2Ba是细胞分裂素和生长素信号通路正确形成胚珠所必需的[gydF4y2Ba96gydF4y2Ba].gydF4y2Ba
除此之外gydF4y2Ba扫描隧道显微镜gydF4y2Ba基因被认为在维持花顶端分生组织干细胞功能中起关键作用(gydF4y2Ba扫描隧道显微镜gydF4y2Ba是需要维护的gydF4y2Ba沃斯gydF4y2Ba表达但独立于gydF4y2Ba沃斯gydF4y2Ba表达式)和控制gydF4y2Ba诺克斯gydF4y2Ba基因表达独立于转录阻遏物gydF4y2BaAS1gydF4y2Ba[gydF4y2Ba97gydF4y2Ba,gydF4y2Ba98gydF4y2Ba].更确切地说,gydF4y2Ba扫描隧道显微镜gydF4y2Ba起着通过诱导产生细胞分裂素(CK)和ARR转导途径[防止分生组织细胞分化至关重要的作用gydF4y2Ba31gydF4y2Ba].渐进式损失gydF4y2Ba扫描隧道显微镜gydF4y2Ba导致从胎盘组织形成减少和心皮融合抑制到心皮发育完全丧失的花表型[gydF4y2Ba99gydF4y2Ba].在gydF4y2Ba香椿gydF4y2Ba,gydF4y2Ba扫描隧道显微镜gydF4y2Ba也表现出差异表达,说明STM在促进胚珠发育方面的作用。gydF4y2Ba
在gydF4y2Ba拟南芥gydF4y2Ba,胚珠原基出现来自侧翼的胎盘,同时gydF4y2BaleuniggydF4y2Ba(gydF4y2Ba耳舌gydF4y2Ba)gydF4y2BaaintegumentagydF4y2Ba(gydF4y2Ba蚂蚁gydF4y2Ba)双突变体缺乏内侧组织,且双突变体gydF4y2BaSEUgydF4y2Ba-3gydF4y2Ba蚂蚁gydF4y2Ba-1导致胚胎发育中严重缺陷引起的胚珠引发的完全丧失[gydF4y2Ba100.gydF4y2Ba].gydF4y2Ba蟹爪gydF4y2Ba(gydF4y2BaCRC.gydF4y2Ba)是YABBY基因家族的成员,其表达主要局限于心皮和蜜腺,表达35SCaMV::CRC的植物产生变异花,萼片部分转化为心皮,花器官数量减少。心皮短而实(胚珠完全无),主要由花柱组织组成。MF的雌蕊形态gydF4y2Ba香椿gydF4y2Ba和gydF4y2Ba拟南芥gydF4y2Ba35 scamv: CRC雌蕊(gydF4y2Ba71gydF4y2Ba].gydF4y2Ba
乙烯可能是雄性花中雌性不育的上游因子gydF4y2Ba
乙烯作为雌蕊或胚珠形成的上游因子,已在许多种植物中得到证实;例如,烟草、石榴和黄瓜[gydF4y2Ba42gydF4y2Ba,gydF4y2Ba101.gydF4y2Ba,gydF4y2Ba102.gydF4y2Ba].gydF4y2Ba
ETR1蛋白作为乙烯反应的负调控因子[gydF4y2Ba103.gydF4y2Ba],具有促进细胞伸长的功能。在gydF4y2Ba香椿gydF4y2Ba,gydF4y2BaETR1gydF4y2Ba(UNIGENE0020715)相对于HF在MF中调节上调。gydF4y2BaERF1.gydF4y2Ba和gydF4y2BaERF2.gydF4y2Ba作为乙烯响应信号因子,在MF和HF之间差异表达。ERF1 / 2的下调和上调gydF4y2BaETR1gydF4y2Ba可能与花的发展。ACO和ACS(ACS和ACO是限速酶)在雌蕊形成蚂蚁级6共同在乙烯生物合成中的关键酶,它们表现出显著表达水平,我们的研究结果表明,乙烯可以作为上游调节因子之一作用影响雌蕊的发展。此外,gydF4y2Ba蚂蚁gydF4y2Ba, 一个gydF4y2BaAPETALAP2gydF4y2Ba类基因在胚珠形成和大孢子发生中起重要作用[gydF4y2Ba38gydF4y2Ba,gydF4y2Ba104.gydF4y2Ba,gydF4y2Ba105.gydF4y2Ba],的下调gydF4y2Ba蚂蚁gydF4y2Ba可能对乙烯有反应。然而,的表达gydF4y2Ba蚂蚁gydF4y2Ba和gydF4y2Ba伊诺gydF4y2Ba(gydF4y2Ba内没有外gydF4y2Ba)可以由gydF4y2BaAG)gydF4y2Ba和gydF4y2BaSPL.gydF4y2Ba.gydF4y2Ba
胚珠原金属形成所需的植物蛋白和细胞蛋白gydF4y2Ba
生长素最大值是原基形成的基础,生长素作用已被很好地描述为侧根和原基花[gydF4y2Ba44gydF4y2Ba,gydF4y2Ba106.gydF4y2Ba,gydF4y2Ba107.gydF4y2Ba].生长素通量的方向性主要取决于PIN蛋白的极性定位。在gydF4y2Ba拟南芥gydF4y2Ba,有八种PIN蛋白(gydF4y2BaPIN1.gydF4y2Ba- - - - - -gydF4y2Ba8gydF4y2Ba),只有gydF4y2BaPIN1.gydF4y2Ba和gydF4y2BaPIN3.gydF4y2Ba在雌蕊和胚珠中表达。例如,极性助线传输主要由介导gydF4y2BaPINFORMED1.gydF4y2Ba(gydF4y2BaPIN1.gydF4y2Ba)Efflux载体[gydF4y2Ba83gydF4y2Ba].基于的表型gydF4y2Ba别针gydF4y2Ba突变体,Gynoecia显示一系列从几乎正常的结构的表型,用两个阀门,风格和柱头,秸秆样Gynoecia,细长的羊皮树上配备了款式和耻辱[gydF4y2Ba108.gydF4y2Ba].蛋白质激酶gydF4y2BaPINOIDgydF4y2Ba(gydF4y2BaPIDgydF4y2Ba)正调控生长素外流,控制分生组织发育的早期一般步骤。在gydF4y2Bapid-lgydF4y2Ba花,内部的第四轮器官茎状而不是心皮状,尽管它被顶有一圈柱头乳头。此外,还对MF的退化雌蕊形态进行了研究gydF4y2Ba香椿gydF4y2Ba和gydF4y2Ba拟南芥pid-lgydF4y2Ba雌蕊(gydF4y2Ba109.gydF4y2Ba].相似地,gydF4y2BaPINOIDgydF4y2Ba是水稻柱头和花柱形成所必需的[gydF4y2Ba110.gydF4y2Ba].此外,CK和生长素之间的串扰在花序分生组织和胚珠原基形成的边界上起着关键作用[gydF4y2Ba44gydF4y2Ba].同时,这是gydF4y2Ba拟南芥gydF4y2Ba组氨酸磷酸转移蛋白6 (AHP6)是一种抑制剂,介导生长素-细胞分裂素串扰,调节茎尖分生组织器官启动的时间。在本研究中,MF相对于HF表达不同的基因也支持这一观点。gydF4y2Ba
结论gydF4y2Ba
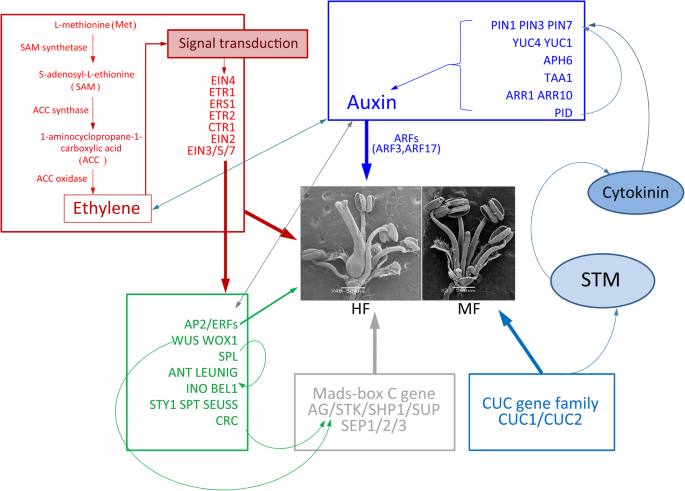
在52945个unigenes中,29585个被注释,KEGG富集分析将为性别分化提供有价值的信息gydF4y2Ba香椿gydF4y2Ba.首先,乙烯是在上游因子gydF4y2Ba香椿gydF4y2Ba雌蕊原基发育、生长素和细胞分裂素的信号转导是雌蕊原基形成的基础;MADS-box基因也参与了四轮花器官的测定。此外,生长素信号通路被认为参与了花粉败育(部分花粉败育)gydF4y2Ba香椿gydF4y2Ba高频的人群;无花果。gydF4y2Ba5gydF4y2Ba)并且是用于大配子体发育(雄性突变型III在MF重要的图。gydF4y2Ba1gydF4y2Ba).总的来说,一个有价值的性别分化模型gydF4y2Ba香椿gydF4y2Ba因此,进一步研究两性相关基因的功能将有助于阐明雄雄异株植物的性别决定机制gydF4y2Ba香椿gydF4y2Ba(无花果。gydF4y2Ba11.gydF4y2Ba).gydF4y2Ba
乙烯、生长素、同一性基因和CUC基因家族依赖途径的雌蕊发育模型。图中显示的所有基因均与本研究中的deg相对应;其他没有差异的相关基因在这里没有显示。不同颜色的矩形代表不同的路径或因素;红色:乙烯合成代谢;蓝色:生长素极性转运;浅蓝色:CUC基因家族;灰色:MADS-box C基因。箭头和条形分别表示正向和负向的调节相互作用。这些调控网络来自拟南芥中确定的关系[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba44gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba105.gydF4y2Ba,gydF4y2Ba118.gydF4y2Ba,gydF4y2Ba119.gydF4y2Ba,gydF4y2Ba120gydF4y2Ba,gydF4y2Ba121gydF4y2Ba,gydF4y2Ba122gydF4y2Ba]gydF4y2Ba
方法gydF4y2Ba
花的样品采集gydF4y2Ba
香椿gydF4y2Ba在自然群体中有2种性类型:男性个体(MF,雄花)和雌雄同体(HF,雌雄同体花)与冬季水果。两种类型的花朵gydF4y2Ba香椿gydF4y2Ba从神农鸡国家自然保护区的自然地理分布中取样(31°38'N,110°25'e;湖北,中国)和凭证标本在西北大学结构植物学实验室(SBL)的植物假单中存放。刘文鹤教授承担了样品的正式识别。为我们的研究收集了不同的花朵的增长阶段。用于微观观察的花液在2.5%戊二醛中立即固定,用于转录组分析的那些储存在-80℃的液氮(LN)中。gydF4y2Ba
共对18个样本进行测序,包括3个不同发育阶段的雄性和雌雄同体(每个发育阶段有3个生物重复)。为了更清晰地描述样品,我们分别用M1、M2和M3来表示MF芽在发育第5阶段、第6阶段和第8阶段的发育情况(图5)。gydF4y2Ba1gydF4y2Baa e)。桑德斯等人描述的阶段被编号。(1999)[gydF4y2Ba111.gydF4y2Ba].主要根据解剖结果采集三个阶段的样品(图。gydF4y2Ba3.gydF4y2Bad, e和gydF4y2Ba4gydF4y2Ba);这些阶段代表了暗示性别二态性形成的关键阶段gydF4y2Ba香椿gydF4y2Ba.类似地,H1,H 2和H3分别在其显影处于第5阶段5,第6阶段和第8阶段时表示HF芽。拍摄照片包括显示花的一般发育阶段(图。gydF4y2Ba1gydF4y2Baa e)。gydF4y2Ba
RNA测序文库构建,Illumina测序,数据处理gydF4y2Ba
使用Trizol套件(Promega,北京,中国)和用RNA酶DNase(Takara Biotech Incorporation,Otsu,Japan)治疗,从M1,M2,M3和H1,H 2和H3样品中分离出总RNA(40μg)和H3样品中分离出来的H3样品.使用Nanodrop 1000分光光度计(Thermo Sciencific,Waltham,Ma,USA)评估RNA的量和纯度。使用具有RNA 6000纳米(Agilent)的生物分析仪2100(Agilent)测定RNA完整性(> 8.0)。富集mRNA的方法,除去rRNA,RNA片段,随机血烷基灌注cDNA合成,尺寸选择和PCR扩增如前所述[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba112.gydF4y2Ba,gydF4y2Ba113.gydF4y2Ba]并使用Illumina Hiseqtm 4000(Gene Denovo Biothnology Co.,Geneovo Biotechnology Co.)进行测序。gydF4y2Ba
从头组装和功能注释gydF4y2Ba
使用Perl脚本处理原始数据,以确保进一步分析中使用的数据的质量。采用的过滤准则如Zhang et al. (2018) [gydF4y2Ba55gydF4y2Ba,gydF4y2Ba114.gydF4y2Ba].对过滤后得到的干净数据进行质量统计分析,包括Q30,数据数量和质量,基础内容统计。使用Trinity-v2.6.5软件进行从头组装[gydF4y2Ba55gydF4y2Ba].Transdecoder识别转录序列中的候选编码区,例如由Trinity组装的De Novo RNA-SEQ转录物产生的那些。通过包括的三特原酸盐管道进行转录物组件的功能注释(gydF4y2Bahttp://trinotate.sourceforge.net/gydF4y2Ba)识别开放阅读框架,并将最佳匹配结果分配给UniProtKB (1e-03)、PFAM-A (1e-03)、Gene Ontology (GO)和eggNOG类别。gydF4y2Ba
筛选差异表达基因gydF4y2Ba
识别跨样品或组的DEGS,EDGER封装(gydF4y2Bahttp://www.r-project.org/gydF4y2Ba)使用。在比较中,我们将大于2倍变化和错误发现率(FDR) < 0.05的基因识别为显著差异基因。然后对DEGs进行氧化石墨烯功能和KEGG通路的富集分析。每个样本中每个基因的读计数由HTSeq (v0.6.0;gydF4y2Bahttp://www-huber.embl.de/users/anders/htseq/doc/overview.html.gydF4y2Ba),然后计算RPKM(每千碱基每百万标记reads),以估计每个样本中基因的表达水平[gydF4y2Ba115.gydF4y2Ba].RPKM方法能够消除不同基因长度和测序数据量对基因表达计算的影响。因此,计算出的基因表达量可以直接用于比较样本间基因表达的差异。gydF4y2Ba
使用DESeq进行MF和HF三个阶段的差异表达分析[gydF4y2Ba116.gydF4y2Ba].deseq2 v1.4.5用于差异基因表达分析,以及agydF4y2BapgydF4y2Ba-value可以分配给每个基因,并通过Benjamini和Hochberg的方法进行调整,以控制错误发现率。q≤0.05和|log2_ratio|≥1为DEGs。将所有样本的基因表达模式与已知的表达谱进行比较gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2Ba玉蜀黍属gydF4y2Ba和gydF4y2Ba选用gydF4y2Ba心皮发育或性别决定基因[gydF4y2Ba31gydF4y2Ba,gydF4y2Ba58gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba,gydF4y2Ba70gydF4y2Ba,gydF4y2Ba78gydF4y2Ba,gydF4y2Ba106.gydF4y2Ba,gydF4y2Ba115.gydF4y2Ba].gydF4y2Ba
GO和DEGs的通路富集分析gydF4y2Ba
GO(基因本体;gydF4y2Bahttp://geneontology.org/gydF4y2BaDEGS的)富集由超几何试验,其中的p值被计算并调节作为q值执行,并且所述数据的背景是在全基因组的基因。GO terms with q < 0.05 were considered to be significantly enriched. GO enrichment analysis could reveal the biological functions of the DEGs [112.gydF4y2Ba],我们专注于基因,在特定生物功能,即那些其途径富集分析(KEGG,京都基因与基因组百科)主要关注的代谢途径或信号转导途径中发挥作用。P一个thway analyses were performed with the KEGG pathway database using BLASTx with an E-value < 1 e-5 [117.gydF4y2Ba].计算公式是相同的,在GO分析。gydF4y2Ba
这里N是用Kegg注释的所有基因的数量,n是n的次数,m是向特定途径注释的所有基因的数量,并且m是m的次数。计算出的gydF4y2BapgydF4y2Ba-value进行FDR校正,以FDR≤0.05为阈值。满足这一条件的通路被定义为显著富集的DEGs通路。gydF4y2Ba
实时rt - pcr分析gydF4y2Ba
QRT-PCR不仅进行分析DEG的表达水平,还进行了验证包括十个基因的RNA-SEQ分析(gydF4y2BaCtr1.gydF4y2Ba,gydF4y2BaACS.gydF4y2Ba,gydF4y2BaACO.gydF4y2Ba,gydF4y2BaACO1, ETR1gydF4y2Ba/gydF4y2Ba2gydF4y2Ba,gydF4y2BaERS1gydF4y2Ba,gydF4y2BaEIN2 / 3/4gydF4y2Ba)有关乙烯生物合成和信号转导,9个基因参与生长素和细胞分裂素的信号转导,和16倍相关的心皮和胚珠形成的基因。引物序列使用Primer 5.0软件设计,并引物序列和β - 肌动蛋白(作为内部对照来标准化基因的表达水平)的内部参照基因的序列在其他文件中列出的gydF4y2Ba1gydF4y2Ba.RNA从gydF4y2Ba香椿gydF4y2Ba三个发育阶段,和RNA提取,cDNA合成,和实时PCR方法如相关参考文献[描述gydF4y2Ba116.gydF4y2Ba,gydF4y2Ba123gydF4y2Ba].gydF4y2Ba
可用性数据和材料gydF4y2Ba
目前的研究过程中使用和/或分析数据集已被列入补充数据内。植物材料可从上合理要求通讯作者。gydF4y2Ba
缩写gydF4y2Ba
- ACO.gydF4y2Ba:gydF4y2Ba
-
AMINOCYCLOPROPANE-1-CARBOXYLATE氧化酶gydF4y2Ba
- ACS.gydF4y2Ba:gydF4y2Ba
-
1-氨基环丙烷-1-羧酸合成酶gydF4y2Ba
- AG)gydF4y2Ba:gydF4y2Ba
-
无性生殖的gydF4y2Ba
- AHP4/6gydF4y2Ba:gydF4y2Ba
-
HPT PHOSPHOTRANSMITTER 4/6gydF4y2Ba
- 蚂蚁gydF4y2Ba:gydF4y2Ba
-
AINTEGUMENTAgydF4y2Ba
- 美联社gydF4y2Ba:gydF4y2Ba
-
Apetala 2.gydF4y2Ba
- BEL1gydF4y2Ba:gydF4y2Ba
-
BELL1gydF4y2Ba
- CRC:gydF4y2Ba
-
蟹爪gydF4y2Ba
- Ctr1.gydF4y2Ba:gydF4y2Ba
-
铜运输蛋白1gydF4y2Ba
- CUC1/2gydF4y2Ba:gydF4y2Ba
-
杯子gydF4y2Ba-gydF4y2Ba子叶的1/2gydF4y2Ba
- 度:gydF4y2Ba
-
差异表达基因gydF4y2Ba
- EIN2.gydF4y2Ba/gydF4y2Ba3.gydF4y2Ba/gydF4y2Ba4gydF4y2Ba:gydF4y2Ba
-
乙烯不敏感蛋白2/3/4gydF4y2Ba
- ERS1gydF4y2Ba:gydF4y2Ba
-
乙烯反应传感器1gydF4y2Ba
- ETR1 / 2.gydF4y2Ba:gydF4y2Ba
-
乙烯受体1/2gydF4y2Ba
- 心力衰竭:gydF4y2Ba
-
雌雄同体的花gydF4y2Ba
- IAA.gydF4y2Ba:gydF4y2Ba
-
生长素/吲哚gydF4y2Ba-gydF4y2Ba3.gydF4y2Ba-gydF4y2Ba醋酸gydF4y2Ba
- 伊诺gydF4y2Ba:gydF4y2Ba
-
神经网络没有外gydF4y2Ba
- KUP3 /72分之50gydF4y2Ba:gydF4y2Ba
-
K+摄取转运体3/50/72gydF4y2Ba
- 耳舌gydF4y2Ba:gydF4y2Ba
-
leuniggydF4y2Ba
- MF:gydF4y2Ba
-
雄花gydF4y2Ba
- 定单计划:gydF4y2Ba
-
卵巢横向直径gydF4y2Ba
- πgydF4y2Ba:gydF4y2Ba
-
PISTILLATAgydF4y2Ba
- 别针gydF4y2Ba:gydF4y2Ba
-
PINOIDgydF4y2Ba
- PIN1.gydF4y2Ba:gydF4y2Ba
-
PINFORMED1.gydF4y2Ba
- PL:gydF4y2Ba
-
雌蕊长度gydF4y2Ba
- Saur.gydF4y2Ba:gydF4y2Ba
-
小型助线上调gydF4y2Ba
- 扫描电镜:gydF4y2Ba
-
扫描电子显微镜gydF4y2Ba
- 建gydF4y2Ba:gydF4y2Ba
-
segydF4y2Ba
- SHP1/2gydF4y2Ba:gydF4y2Ba
-
SHATTERPROOF1/2gydF4y2Ba
- SPL.gydF4y2Ba/gydF4y2Ba出处gydF4y2Ba:gydF4y2Ba
-
SporocytelessgydF4y2Ba
- SPT.gydF4y2Ba:gydF4y2Ba
-
抹刀gydF4y2Ba
- STKgydF4y2Ba:gydF4y2Ba
-
Serifstick.gydF4y2Ba
- STY1gydF4y2Ba:gydF4y2Ba
-
STYLISH1gydF4y2Ba
- supgydF4y2Ba:gydF4y2Ba
-
超人gydF4y2Ba
- 沃斯gydF4y2Ba:gydF4y2Ba
-
Wuschel.gydF4y2Ba
参考gydF4y2Ba
- 1。gydF4y2Ba
张志强,李志强,李志强,等。木犀科稀有自交不亲和系统长期维持的证据。新植醇。2016;210(4):1408 - 17所示。gydF4y2Ba
- 2.gydF4y2Ba
Heikrujam男,夏尔马K,普拉萨德M等人。回顾在雌雄异株作物的性别鉴定和性别相关的分子标记不同的机制:当前的更新。Euphytica。2015; 201(2):161-94。gydF4y2Ba
- 3.gydF4y2Ba
endress pk。祖传鲜花中的鲜花和祖先的花朵。int j植物sci。2001; 162:1111-40。gydF4y2Ba
- 4.gydF4y2Ba
endress pk。Angiosperm Opules:多样性,发展,进化。Ann Bot。2011; 107(9):1465-89。gydF4y2Ba
- 5.gydF4y2Ba
Vassiliadis C,Saumitou-Laprade P,Lepart J,Viard F.雌雄同体的高雄性生殖成功雌雄同体gydF4y2BaPhillyrea angustifoliagydF4y2Ba.进化。2002; 56(7):1362至1373年。gydF4y2Ba
- 6.gydF4y2Ba
王志强,王志强。月桂科雌雄异株的重复进化。系统医学杂志。2001;50:700-12。gydF4y2Ba
- 7.gydF4y2Ba
Torites R,Mendez M,Gomez JM。单体性的性系统在哪里适合DIOECY的演变?来自最大的Anviospers家族的见解。新植物。2011; 190:234-48。gydF4y2Ba
- 8.gydF4y2Ba
Charlesworth B,Charlesworth D. Diocy和牙科的演变模型。上午纳特。1978; 112(988):975-97。gydF4y2Ba
- 9.gydF4y2Ba
劳埃德DG。被子植物雌雄异株和雄雄异株的维持。45遗传。1975;(3):325 - 39。gydF4y2Ba
- 10。gydF4y2Ba
Bradley D,Carpenter R,Copsey L等。抗饲料中的花序结构控制。自然。1996; 379(6568):791-7。gydF4y2Ba
- 11.gydF4y2Ba
一种功能性雄雄异株的性别比例和遗传变异,gydF4y2BaSchizopepon bryoniaefoliusgydF4y2Ba(葫芦科)。我是J机器人。1999; 86:880-6。gydF4y2Ba
- 12.gydF4y2Ba
弗莱明,莫里斯,哈姆里克。育种系统的地理变异和三种种的进化稳定性gydF4y2BaPachycereus pringleigydF4y2Ba(仙人掌)。EVOL ECOL。1998年; 12(3):279-89。gydF4y2Ba
- 13.gydF4y2Ba
徐永昌,周丽华,胡树青,等。雄雄异株雌雄同体和雄性雌蕊的分化和发育gydF4y2Ba桂花雀族gydF4y2BaL.对进化对雄细胞的影响。植物系统中的Evol。2014; 300(5):843-9。gydF4y2Ba
- 14.gydF4y2Ba
Charlesworth D. Androdiocy和Diocy的演变。Bot J Linn Soc。1984年; 22:333-48。gydF4y2Ba
- 15.gydF4y2Ba
雄雄异株的进化与维持。acta Ecol Syst. 2002;33(1): 397-425。gydF4y2Ba
- 16.gydF4y2Ba
罗素JRW,潘内尔JR。性别决定于雌雄异株gydF4y2Ba是Mercurialis禾gydF4y2Ba以及它的二倍体和多倍体近亲。遗传。2015;114(3):262 - 71。gydF4y2Ba
- 17.gydF4y2Ba
王志刚,王志刚。花粉限制与雄雄异株的进化。Nat。2004;163(1):122 - 37。gydF4y2Ba
- 18.gydF4y2Ba
孔DM。荷尔蒙调节对高等植物性别分化的进展。J安徽农业科学。2009; 37(12):5352-5354,5378。gydF4y2Ba
- 19.gydF4y2Ba
雌雄同株和雌雄异株植物的性别决定。植物细胞。1989;1(8):737 - 44。gydF4y2Ba
- 20.gydF4y2Ba
Khryanin VN。植物激素在植物性别分化中的作用。植物学报2002;49(4):545-51。gydF4y2Ba
- 21.gydF4y2Ba
托马斯TD。体外,修饰桑树的性表达(gydF4y2Ba森菊属gydF4y2Ba)通过物质和硝酸银。植物细胞组织org。2004; 77(3):277-81。gydF4y2Ba
- 22.gydF4y2Ba
乙烯知觉对甜瓜性表达的影响gydF4y2BaCucumis梅洛gydF4y2Ba通过突变的乙烯受体的表达来评估,gydF4y2Ba在-ETR1-1gydF4y2Ba,在构成型和花型靶向启动子的控制下。植物生殖学报。2007;20(3):123-36。gydF4y2Ba
- 23.gydF4y2Ba
Soldatova NA, Khryanin VN重金属盐对大麻植物激素状况和性别表达的影响。acta botanica yunnanica(云南植物研究). 2010;57:96-100。gydF4y2Ba
- 24。gydF4y2Ba
Martin A, Troadec C, Boualem A, Rajab M, Fernandez R, Morin H, Pitra M, Dogimont C, Bendahmane A.转座子诱导的表观遗传改变导致了甜瓜性别的决定。大自然。2009;461:1135-8。gydF4y2Ba
- 25。gydF4y2Ba
作者等。瓜类雄激素基因揭示了单性花是如何发育和雌雄异株形成的。科学。2015;350(6261):688 - 91。gydF4y2Ba
- 26。gydF4y2Ba
Akagi T, Henry IM, Tao R, Comai LA。在柿子中,y染色体编码的小RNA起着决定性别的作用。科学。2014;346(6209):646。gydF4y2Ba
- 27。gydF4y2Ba
关键词:不育基因,性别决定,失序性咕咕叫医学杂志。2018;28 (2):R80-3。gydF4y2Ba
- 28。gydF4y2Ba
周建军,徐超,王志强,等。芦笋的基因组揭示了一个年轻Y染色体的起源和进化。Nat Commun。2017;8(1):1279。gydF4y2Ba
- 29.gydF4y2Ba
王志强,王志强,王志强,等。在猕猴桃中,通过家族特异性复制细胞分裂素反应调节因子,产生了一个y编码的女性化抑制因子。植物细胞。2018;30 (4):tpc.00787.2017。gydF4y2Ba
- 30.gydF4y2Ba
Doggle Pk,Stilio VSD,GSCHWend Ar,等。多种发育过程下降性心脏分化。趋势类型。2011; 27(9):368-76。gydF4y2Ba
- 31。gydF4y2Ba
作者简介:陈志强,男,博士,主要研究方向为生物医学工程。花的发育。gydF4y2Ba拟南芥gydF4y2Ba书。2010;8 (3):e0127。gydF4y2Ba
- 32。gydF4y2Ba
罗德尔·艾哈克,Yanofsky MF。水果开发gydF4y2Ba拟南芥gydF4y2Ba.拟南芥书2006;4:e0075。gydF4y2Ba
- 33。gydF4y2Ba
Lee J,Hassan O,Gao W等人。棉赤裸种子突变体的发育和基因表达分析。Planta。2006; 223(3):418-32。gydF4y2Ba
- 34。gydF4y2Ba
久保T,藤田男,高桥H,等人。在水稻显影胚珠转录组分析分离通过激光显微切割。植物细胞生理。2013; 54(5):750-65。gydF4y2Ba
- 35。gydF4y2Ba
Hao S,Ariizumi T,Ezura H.性育性对番茄中的男性和女性配子至关重要。植物细胞生理。2017; 58(1):22-34。gydF4y2Ba
- 36.gydF4y2Ba
法尔博斯我,oliveira m,negrutiu i等。DIORECIOUS植物中的性器渣测定和分化gydF4y2BaMelandrium专辑gydF4y2Ba(gydF4y2Ba硅宾latifoliagydF4y2Ba):细胞学和组织学分析。植物生殖学报。1997;10(3):155-67。gydF4y2Ba
- 37.gydF4y2Ba
白松子上性别决定位点的定位(gydF4y2Ba硅宾latifoliagydF4y2BaY染色体扩增片段长度多态性。遗传学。2002;160(2):717 - 25所示。gydF4y2Ba
- 38.gydF4y2Ba
埃文斯MMS。玉米配子体1基因编码胚囊和叶片发育所需的lob结构域蛋白。植物细胞。2007;19(1):46 - 62。gydF4y2Ba
- 39.gydF4y2Ba
等。gydF4y2BaTasselseed1.gydF4y2Ba是影响玉米性别测定中茉莉酸信号转导的脂加氧酶。科学。2009;323(5911):262 - 5。gydF4y2Ba
- 40。gydF4y2Ba
Li D,Blakey Ca,Dewald C等人。玉米和野生亲属雌性堕胎的常见性别测定机制的证据gydF4y2BaTripsacumgydF4y2Ba.美国国立科学院。1997年,94(8):4217 - 22所示。gydF4y2Ba
- 41。gydF4y2Ba
中华绒螯蟹雄性雄异株种群的遗传和环境性别决定gydF4y2Ba是Mercurialis禾gydF4y2Ba.遗传。1997;78(1):50-6。gydF4y2Ba
- 42。gydF4y2Ba
Chen L,张J,Li H,等。转录组分析揭示了石榴花中女性无菌的候选基因。前植物SCI。2017; 8:1430。gydF4y2Ba
- 43。gydF4y2Ba
付文奇,赵志刚,葛晓华,丁磊,李志勇。不育雌性雌蕊发育的解剖学和转录谱分析gydF4y2Ba芸苔属植物显著gydF4y2Ba由一个来自gydF4y2BaOrychophragmus violaceusgydF4y2Ba.BMC基因组学,2014;15(1):61。gydF4y2Ba
- 44.gydF4y2Ba
胚珠发育:一种新的侧器官形成模式。植物学报,2014;5(4):1-12。gydF4y2Ba
- 45.gydF4y2Ba
韦兰德gydF4y2Bafraxinus.gydF4y2Ba(木犀科)和雌雄异株的进化。植物系统中的Evol。2008; 273(1-2):25-49。gydF4y2Ba
- 46.gydF4y2Ba
王志强,王志强,王志强,等。雄雄异株与雄雄异株的重复进化。新植醇。2005;165(2):633 - 40。gydF4y2Ba
- 47.gydF4y2Ba
法尔博斯我,oliveira m,negrutiu i等。DIORECIOUS植物中的性器官测定与分化gydF4y2BaMelandrium专辑gydF4y2Ba(gydF4y2Ba硅宾latifoliagydF4y2Ba):细胞学和组织学分析。植物生殖学报。1997;10(3):155-67。gydF4y2Ba
- 48。gydF4y2Ba
杨丽丽,陈敏,刘凤强,等。黄瓜雄花萼片形态、代谢及遗传表达特征研究。科学通报,1999;44:2509-13。gydF4y2Ba
- 49。gydF4y2Ba
关键词:单性花,败育,生殖器官,发育gydF4y2Ba葡萄gydF4y2BaSSP。silvestris。性植物团体。2003; 15:291-300。gydF4y2Ba
- 50.gydF4y2Ba
Datiscaceae的戴维森C.解剖学和形态学研究。阿利索:SYST EVOL博特的第j。1973; 8(1):49-110。gydF4y2Ba
- 51.gydF4y2Ba
听一个,rieseberg lh,elias ts。在开花植物Datisca glomerata中的功能性雄细胞。自然。1990; 343(6259):641-2。gydF4y2Ba
- 52.gydF4y2Ba
Lü W,刘文忠。雄雄异株的传粉生物学gydF4y2BaTapiscia sinensis.gydF4y2Ba(省沽油科)。植物学报。2010;45:713-22。gydF4y2Ba
- 53。gydF4y2Ba
周晓军,马琳,刘文忠。稀有特有树种的功能性雄雄异株gydF4y2BaTapiscia sinensis.gydF4y2Ba.acta optica sinica, 2016; 40(4): 591 - 594。gydF4y2Ba
- 54。gydF4y2Ba
杨凯,周昕,王勇,等。雄雄异株乔木花药发育过程中的碳水化合物代谢和基因调控gydF4y2BaTapiscia sinensis.gydF4y2Ba.安机器人。2017;120(6):967 - 77。gydF4y2Ba
- 55。gydF4y2Ba
Manfred GG.不含参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29:644-52。gydF4y2Ba
- 56。gydF4y2Ba
Pertea G,Huang X,Liang F,等。TIGR基因指数聚类工具(TGICL):用于快速群集大型EST数据集的软件系统。生物信息学。2003; 19(5):651-2。gydF4y2Ba
- 57。gydF4y2Ba
Ramoni MF, Sebastiani P, Kohane IS。基因表达动态的聚类分析。中国科学院院刊。2002;99(14):9121-6。gydF4y2Ba
- 58。gydF4y2Ba
吕璐,李德志,王浩,王浩。被子植物花粉的进化。2.基底被子植物。Ann Mo Bot Gard. 2015; 100:227-69。gydF4y2Ba
- 59。gydF4y2Ba
沃克JW。“原始”被子植物花粉外壁结构的进化。[美]J Bot. 1974; 61:891-902。gydF4y2Ba
- 60。gydF4y2Ba
Muller J.表单和功能在Agiosperm Pollen。安莫僵尸加德。1979年; 66:593-632。gydF4y2Ba
- 61。gydF4y2Ba
辛国良,贾国良,任晓丽,王媛媛,赵鹏,刘文忠。雄雄异株乔木的花发育gydF4y2BaTapiscia sinensis.gydF4y2Ba:进化到雄雄异株的意义。J系统另一个星球。gydF4y2Bahttps://doi.org/10.1111/jse.12517gydF4y2Ba.gydF4y2Ba
- 62。gydF4y2Ba
Skinner DJ, Hill TA, Gasser CS。胚珠发育的调节。植物细胞。2004;16 (suppl_1): S32-45。gydF4y2Ba
- 63。gydF4y2Ba
Eshed Y,鲍姆SF,鲍曼JL。不同的机制促进极性建立的心皮gydF4y2Ba拟南芥gydF4y2Ba.细胞。1999;99(2):199 - 209。gydF4y2Ba
- 64。gydF4y2Ba
Losa A,Colombo M,Brambilla V,Colombo L.之间的遗传相互作用gydF4y2BaaintegumentagydF4y2Ba(gydF4y2Ba蚂蚁gydF4y2Ba)和胚珠同源基因gydF4y2BaseedstickgydF4y2Ba,(gydF4y2BastkgydF4y2Ba),gydF4y2Ba碎片擦拭gydF4y2Ba,(gydF4y2Bashp1gydF4y2Ba),gydF4y2Ba防碎2gydF4y2Ba,(gydF4y2Bashp2gydF4y2Ba).植物生殖学报。2010;23(2):115。gydF4y2Ba
- 65。gydF4y2Ba
等。控制胚珠原基形成的综合模式。植物j . 2013; 76(3): 446 - 55。gydF4y2Ba
- 66。gydF4y2Ba
西方TL,豪恩GW。gydF4y2BaBELL1gydF4y2Ba和gydF4y2Ba无性生殖的gydF4y2Ba基因促进胚珠身份gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.工厂J. 1999; 18(3):329-36。gydF4y2Ba
- 67。gydF4y2Ba
Yanofsky Mf,Ma H,Bowman JL,Drews Gn,Feldmann Ka,Meyerowitz Em。由此编码的蛋白质gydF4y2Ba拟南芥gydF4y2Ba同源转化基因gydF4y2Ba无性生殖的gydF4y2Ba像转录因子。大自然。1990;346:35-9。gydF4y2Ba
- 68.gydF4y2Ba
Drews GN, Bowman JL, Meyerowitz, EM.负调控gydF4y2Ba拟南芥gydF4y2Ba同源转化基因gydF4y2Ba无性生殖的gydF4y2Ba由这件事gydF4y2BaAPETALA2gydF4y2Ba产品。细胞。1991;65:991 - 1002。gydF4y2Ba
- 69.gydF4y2Ba
ITO T,Wellmer F,Yu H,Das P,ITO N,Alves-Ferreira M.通过调节来控制宿主孢子菌gydF4y2BaSporocytelessgydF4y2Ba.自然。2004; 430:356-60。gydF4y2Ba
- 70。gydF4y2Ba
L’em - kloosterziel KM, Keijzer CJ, Koornneef M. A种子形状突变体gydF4y2Ba拟南芥gydF4y2Ba这受到整数开发的影响。植物细胞。1994年; 6:385-92。gydF4y2Ba
- 71。gydF4y2Ba
Brown RH, Nickrent DL, Gasser CS。檀香植物胚珠缩小后胚珠及珠被相关基因的表达。另一个星球Dev。2010;12:231-40。gydF4y2Ba
- 72。gydF4y2Ba
胡永波,刘伟,徐光华。植物生长素与乙烯信号转导及生长素对植物乙烯反应的影响研究进展(综述)。植物学报。2011;46(3):338-49。gydF4y2Ba
- 73.gydF4y2Ba
李文英,马MD,郭宏文。植物激素乙烯作用研究进展(综述)。科学学报。2013;43:854 - 63。gydF4y2Ba
- 74.gydF4y2Ba
LeCTR2是一种类似ctr1的蛋白激酶,在乙烯信号、发育和防御中起重要作用。植物j . 2010; 54(6): 1083 - 93。gydF4y2Ba
- 75.gydF4y2Ba
Nemhauser JL, Feldman LJ, Zambryski PC。生长素和gydF4y2Baetin.gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba雌蕊形态发生。发展。2000;127(18):3877 - 88。gydF4y2Ba
- 76.gydF4y2Ba
吴YF,里德GW,田CQ。拟南芥microRNA167控制模式gydF4y2BaARF6gydF4y2Ba和gydF4y2BaARF8gydF4y2Ba表达,并调节女性和男性繁殖。发展。2006; 133(21):4211-8。gydF4y2Ba
- 77。gydF4y2Ba
Bencivenga S, Simonini S, Benková E, Colombo L.转录因子gydF4y2Babel1gydF4y2Ba和gydF4y2BaSPL.gydF4y2Ba在胚珠开发期间,Cytokinin和Auxin信号传导需要gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2012; 24(7):2886-97。gydF4y2Ba
- 78。gydF4y2Ba
陈志强,陈志强,陈志强,等。d系MADS-box基因gydF4y2Baosmads13gydF4y2Ba控制水稻中的胚珠同一性。工厂J. 2007; 52(4):690-9。gydF4y2Ba
- 79。gydF4y2Ba
柯南道尔农协。维管植物的系统发育。台湾大学学报(自然科学版)1998;29:567-99。gydF4y2Ba
- 80.gydF4y2Ba
罗斯博士。gynodioecy,subdioecy和雌雄异株的进化过程中的演变和超显性的衰减。上午纳特。1980; 116:607-20。gydF4y2Ba
- 81.gydF4y2Ba
近雌雄异株的五个进化途径。Nat。1982;119:297 - 318。gydF4y2Ba
- 82.gydF4y2Ba
韦伯CJ。实证研究:二维育种系统的演化与维护。开花植物中的性别和性别二态性。Springer Berlin Heid。1999:61-95。gydF4y2Ba
- 83。gydF4y2Ba
Tanurdzic男,银行JA。性别决定在陆地植物机制。植物细胞。2004; 16:S61-71。gydF4y2Ba
- 84。gydF4y2Ba
吕德植物生物学和维持策略在雄细胞生物gydF4y2BaTapicia sinensis.gydF4y2Ba.2010西北大学。gydF4y2Ba
- 85。gydF4y2Ba
MA L.在花和水果同步在雄细胞的植物中同步时的性分配gydF4y2BaTapiscia sinensis.gydF4y2Ba(Tapisciaceae)。西北大学。2013;p.23-24。gydF4y2Ba
- 86。gydF4y2Ba
库利TM,威勒SG,酒井AK。被子植物中风媒传粉的进化。生态学报。2002;17(8):361-9。gydF4y2Ba
- 87。gydF4y2Ba
Tao ZB,Wortley Ah,Lu L等人。Angiosperm Pollen的演变。6. CelaStrales,oxidalales和Malpighiales(COM)的疏口和Zygophyllales。安莫僵尸加德。2018; 103(3):393-442。gydF4y2Ba
- 88。gydF4y2Ba
木犀科风媒传粉和性别专门化的进化和适应。Göteborg大学,Göteborg,瑞典。2001。gydF4y2Ba
- 89。gydF4y2Ba
伊藤T,魏默尔女,于H,达斯P,伊藤N,阿尔维斯-费雷拉M的同源异型蛋白gydF4y2Ba无性生殖的gydF4y2Ba通过调控小孢子发生gydF4y2BaSporocytelessgydF4y2Ba.自然。2004; 430:356-60。gydF4y2Ba
- 90。gydF4y2Ba
SIEBER P,Petrascheck M,Barberis A,Schneitz K.器官极性gydF4y2Ba拟南芥gydF4y2Ba.gydF4y2Ba喷嘴gydF4y2Ba与YABBY家庭成员进行身体上的互动。植物杂志。2004;135:2172 - 85。gydF4y2Ba
- 91。gydF4y2Ba
刘志强,于旭,王飞,胡树华,刘玉华,陆国刚。一种新的萝卜雌性不育突变体的生理生化特性及分子生物学特性。植物生长规律。2012;68(2):239-48。gydF4y2Ba
- 92。gydF4y2Ba
王志强,王志强,王志强,等。通过相互作用终止拟南芥花分生组织干细胞维持gydF4y2BaWuschel.gydF4y2Ba和gydF4y2Ba无性生殖的gydF4y2Ba.细胞。2001; 105(6):805-14。gydF4y2Ba
- 93。gydF4y2Ba
Balasubramanian S,Schneitz K.gydF4y2Ba喷嘴gydF4y2Ba调节在胚珠发育过程中的近端 - 远端图案形成,细胞增殖和早期产孢gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.发展。2000;127(19):4227 - 38。gydF4y2Ba
- 94。gydF4y2Ba
Wei B,张J,Pang C等人。分子机制gydF4y2BaSporocytelessgydF4y2Ba/gydF4y2Ba喷嘴gydF4y2Ba在控制gydF4y2Ba拟南芥gydF4y2Ba胚珠发育。细胞研究》2015;25(1):121 - 34。gydF4y2Ba
- 95。gydF4y2Ba
Bencivenga S,Simonini S,BenkováE等。转录因素gydF4y2BaBEL1gydF4y2Ba和gydF4y2BaSPL.gydF4y2Ba在胚珠开发期间,Cytokinin和Auxin信号传导需要gydF4y2Ba拟南芥gydF4y2Ba.植物细胞。2012; 24(7):2886-97。gydF4y2Ba
- 96。gydF4y2Ba
斯科菲尔德S,Dewitte W,穆雷JA。gydF4y2Ba扫描隧道显微镜gydF4y2Ba维持干细胞功能gydF4y2Ba拟南芥gydF4y2Ba拍摄顶端公司和控制gydF4y2Ba诺克斯gydF4y2Ba基因表达独立于转录阻遏物gydF4y2BaAS1gydF4y2Ba.植物信号表现。2014; 9(6):E28934-1-5。gydF4y2Ba
- 97.gydF4y2Ba
普约尔CC,Lertpiriyapong K,雷维尔K,弗莱彻JC。当gydF4y2BaULTRAPETALA1gydF4y2Ba基因早期职能gydF4y2Ba拟南芥gydF4y2Ba发育限制茎尖分生组织的活动和通过gydF4y2BaWuschel.gydF4y2Ba调节花分生组织的确定性。遗传学。2004;167:1893 - 903。gydF4y2Ba
- 98.gydF4y2Ba
斯科菲尔德S,Dewitte W,穆雷JA。诺克斯基因gydF4y2Ba拍摄MERISTEMLESSgydF4y2Ba是生殖分生组织发育所必需的gydF4y2Ba拟南芥gydF4y2Ba.植物j . 2007;(5): 767 - 81。gydF4y2Ba
- 99.gydF4y2Ba
Azhakanandam S,Nole-Wilson S,Bao F等人。gydF4y2BasegydF4y2Ba和gydF4y2BaAINTEGUMENTAgydF4y2Ba在雌蕊内侧区域发育过程中介导模式和胚珠起始。植物杂志。2008;146(3):1165 - 81。gydF4y2Ba
- One hundred.gydF4y2Ba
结果表明,乙烯形成酶基因沉默对烟草胚珠发育具有可逆抑制作用。植物细胞。1999;11:1061 - 72。gydF4y2Ba
- 101.gydF4y2Ba
陈辉,孙军,帅林,崔强,张辉,辛峰,等。黄瓜心皮发育的acc氧化酶基因。摩尔。2016;9(9):1315 - 27所示。gydF4y2Ba
- 102。gydF4y2Ba
Hua J,Meyerowitz em。受体基因家族对乙烯反应产生负面调节gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.细胞。1998;94:261 - 71。gydF4y2Ba
- 103。gydF4y2Ba
Shigyo M, Hasebe M, Ito M.分子进化gydF4y2BaAP2gydF4y2Ba亚家族。基因。2006; 366(2):256-65。gydF4y2Ba
- 104。gydF4y2Ba
Bohn-courseau I.植物征:有机组织的主要调节因子。Cr Biol。2010; 333(4):290-6。gydF4y2Ba
- 105。gydF4y2Ba
吴文敏,王春梅,王志强,等。生长素介导的花原基起始的分子框架。Dev细胞。2013;24(3):271 - 82。gydF4y2Ba
- 106。gydF4y2Ba
贝纳德F,罗齐尔F,维诺tgydF4y2BaAHP6gydF4y2Ba细胞分裂素信号抑制剂介导生长素-细胞分裂素串扰,调控茎尖分生组织器官起始的时间。植物学报。2014;9(6):e28788-1-4。gydF4y2Ba
- 107。gydF4y2Ba
goto n,katoh n,kranz ar。花卉ogans的形态发生gydF4y2Ba拟南芥gydF4y2Ba:主要的销形成突变体的占状弹药片。基因类型系统。2006; 66(5):551-67。gydF4y2Ba
- 108。gydF4y2Ba
Bennett Srm,Alvarez J,Bossinger G,Smyth Dr。形态发生gydF4y2BapinoidgydF4y2Ba突变体的gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba.工厂J. 2010; 8(4):505-20。gydF4y2Ba
- 109。gydF4y2Ba
何玉波,严玲,葛森,等。PINOID是水稻柱头和花柱形成所必需的。植物杂志。2019;180(2):926 - 36。gydF4y2Ba
- 110。gydF4y2Ba
王志强,王志强,王志强,等。花性植物的性别决定:以番木瓜为模型系统。植物科学。2014;217 - 218(1):56 - 62。gydF4y2Ba
- 111。gydF4y2Ba
苏啊,刘烨,张Xs。蟾蜍素 - 细胞素蛋白相互作用调节分生开发。莫尔植物。2011; 04(4):616-25。gydF4y2Ba
- 112。gydF4y2Ba
Reyesolalde JI,ZúñigamayoVM,MarschmartínezN,Folter SD。卵巢生长素和细胞分裂素和转录因子锅铲的参与之间的协同关系。植物信号表现。2017; 12(10):e1376158。gydF4y2Ba
- 113。gydF4y2Ba
等。同源性蛋白AGAMOUS通过调控无孢子细胞的小孢子发生。自然(伦敦)。2004, 430(6997): 356 - 60。gydF4y2Ba
- 114。gydF4y2Ba
Uemura A,Yamaguchi N,Xu Y等。通过相互作用调节花卉公司活动gydF4y2Ba无性生殖的gydF4y2Ba,gydF4y2Ba超人gydF4y2Ba, 和gydF4y2BaCLAVATA3gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba.植物天线转换开关。2017;31:89 - 105。gydF4y2Ba
- 115。gydF4y2Ba
桑德斯下午,裴AQ,Weterings K,等人。在花药发育缺陷gydF4y2Ba拟南芥蒂利亚纳gydF4y2Ba败突变体。植物生殖学报。1999;11(6):297-322。gydF4y2Ba
- 116.gydF4y2Ba
杜晓明,倪晓林,任晓林,等。利用转录组分析方法鉴定通气组织形成过程中的差异表达基因gydF4y2Ba香蒲angustifoliagydF4y2Ba,离开了。基因。2018;662:66 - 75。gydF4y2Ba
- 117.gydF4y2Ba
叶PF,李男,廖W,凯歌K,金SH,张成,陈XY,诏谕耿ZY。下丘脑转录组分析揭示了番鸭的控制就巢性神经内分泌机制(gydF4y2BaCairina moschatagydF4y2Ba).《公共科学图书馆•综合》。2019;14 (5):e0207050gydF4y2Ba
- 118.gydF4y2Ba
张勇,等。昼夜节律晚复合物抑制茉莉酸诱导的叶片衰老gydF4y2Ba拟南芥gydF4y2Ba.莫尔植物。2018; 11(2):326-37。gydF4y2Ba
- 119.gydF4y2Ba
Mortazavi A,威廉姆斯BA,麦丘K,等人。通过RNA-SEQ映射和定量哺乳动物转录om。NAT方法。2008; 5(7):621-8。gydF4y2Ba
- 120.gydF4y2Ba
刘y,郭cc,gui-xia xu,等。花卉发展的监管网络进化模式:两者比较中获得的见解gydF4y2Ba拟南芥gydF4y2Ba物种。J系统另一个星球。2011; 49(6):528-38。gydF4y2Ba
- 121。gydF4y2Ba
李清林,刘伯斯。玉米花发育的遗传调控与性别决定。足底。2017;245:1-14。gydF4y2Ba
- 122.gydF4y2Ba
Kanehisa M,Araaki M,Goto S等人。Kegg用于将基因组联系到生命和环境。核酸RES。2007; 36(SUPPLY_1):D480-4。gydF4y2Ba
- 123.gydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2−ΔΔCT方法分析相关基因表达数据。方法。2001;25 (4):402 - 8。gydF4y2Ba
致谢gydF4y2Ba
我们感谢张欣博士和周亚福博士所作的宝贵讨论。gydF4y2Ba
资金gydF4y2Ba
国家自然科学基金资助项目(no . 31770413)。创始机构在研究的设计、收集、分析和数据的解释以及手稿的撰写中没有作用。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
贡献gydF4y2Ba
GL, XM和WZ构思了研究和设计实验。GL、JQ、JL进行实验;XL、JQ、JL提供技术支持和数据分析;GL起草了手稿。WZ修改了原稿。所有作者阅读并批准了最终的手稿。gydF4y2Ba
通讯作者gydF4y2Ba
道德声明gydF4y2Ba
伦理批准和同意参与gydF4y2Ba
本研究项目由国家自然科学基金项目批准,花样采集由湖北省神农架国家自然保护区管理局批准。gydF4y2Ba
同意出版物gydF4y2Ba
不适用。gydF4y2Ba
利益争夺gydF4y2Ba
两位作者宣称他们没有相互竞争的利益。gydF4y2Ba
附加信息gydF4y2Ba
出版商的注意事项gydF4y2Ba
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。gydF4y2Ba
补充信息gydF4y2Ba
附加文件1gydF4y2Ba
:底漆序列和DEG的结果gydF4y2Ba
附加文件2:gydF4y2Ba
GO分析M1_vs_H1,M2_vs_H2和M3_vs_H3。gydF4y2Ba
附加文件3:gydF4y2Ba
TERM1和TERM2中GO和KEGG通路富集分析。gydF4y2Ba
额外的文件4:gydF4y2Ba
图S1gydF4y2Ba.成熟HF与III型MF之间的差异。(gydF4y2Ba一个gydF4y2Ba)HF的纵向部分。(gydF4y2BaBgydF4y2Ba)成熟的胚囊在HF。(gydF4y2BaCgydF4y2Ba)III型MF,胚囊发育停在黑社会阶段。(gydF4y2BaDgydF4y2BaIII型MF的纵断面。Sy,助细胞;锡、二次核;hy, hypostase;第二,内珠;oi,表示“外在的皮肤;mi,珠孔。gydF4y2Ba图S2gydF4y2Ba.TEST1和TEMP2中的八种模型专业工具。在Term1中,分析了13,761个基因的表达模式,用于总结8个模型曲线,并且五种基因的表达模式显示出显着的p值(gydF4y2BapgydF4y2Ba< 0.05)(彩色盒)。在TERM 2中,我们分析了16130个基因的表达模式,并使用8个模型谱进行了总结。三种基因表达模式的p值显著(gydF4y2BapgydF4y2Ba< 0.05)(彩色盒)。每个框代表一个模型表达式概要文件,模型概要文件编号和gydF4y2BapgydF4y2Ba价值。色框表明花期间存在显著差异。没有彩盒意味着没有区别。M1、M2、M3分别代表第5、6、10阶段的MF, H1、H2、H3分别代表第5、6、10阶段的两性花。“意义重大”的含义gydF4y2BapgydF4y2Ba-value’在花期间差异显著。gydF4y2Ba图S3gydF4y2Ba.差异表达基因的数量。(gydF4y2Ba一个gydF4y2Ba) TERM1 -趋势均由基因数决定,趋势均由基因数决定gydF4y2BaPgydF4y2Ba价值。在概要3:2364基因(2.6e-19gydF4y2BaPgydF4y2Ba-value)在花期5、6期表达稳定,10期表达减少;在图4中,1664个基因(1.1e-11gydF4y2BaPgydF4y2Ba-value)在花期5、6期表达稳定,10期表达增加;在5,2320个基因(3.7e-17gydF4y2BaPgydF4y2Ba-value)的表达量在花期5、6期增加,在花期10期减少;在图6中,2170个基因(6.2e-06)gydF4y2BaPgydF4y2Ba-value)在花期第5、6期表达增加,而在花期第10期表达稳定;在概要7:1471个基因(7.7e-18gydF4y2BaPgydF4y2Ba-Value)在花卉阶段5到10中的表达增加了gydF4y2BaBgydF4y2Ba) TERM2 -均由基因数趋势,均由p值趋势。在基因型1中,2308个基因(3.6e-47gydF4y2BaPgydF4y2Ba- value)呈现第一次下降的趋势,然后从第5阶段保持稳定;简介6:3179基因(1.2E-79gydF4y2BaPgydF4y2Ba-value)在花期第5、6期表达增加,而在花期第10期表达稳定;简介7:1839基因(5.2E-39gydF4y2BaPgydF4y2Ba- value),趋势总是向上。(gydF4y2BaCgydF4y2Ba) TERM1和TERM2中GO和KEGG通路富集分析。“意义重大”的含义gydF4y2BapgydF4y2Ba-value’在花期间差异显著。gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
鑫,GL。,刘,JQ。,刘,J.gydF4y2Ba等等。gydF4y2Ba解剖学和RNA-SEQ揭示了调节功能性和粗糙树中的性别分化的重要基因途径,gydF4y2BaTapiscia sinensis.gydF4y2Ba.gydF4y2BaBMC植物杂志gydF4y2Ba19,gydF4y2Ba554(2019)。https://doi.org/10.1186/s12870-019-2081-7gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
迪伊gydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-019-2081-7gydF4y2Ba
关键词gydF4y2Ba
- 形态和解剖学gydF4y2Ba
- Androdioecious树gydF4y2Ba
- Tapiscia sinensis.gydF4y2Ba
- 性别分化gydF4y2Ba
- 转录组分析gydF4y2Ba