抽象的
背景
雌雄异株是一个重要的性系统,其中,雄花和雌花在单独的单性植物承担。的性别差异知识可以提升我们在分子生物学和发育过程导致单性花发展的认识。Coccinia Grandis.是葫芦科雌雄异株的一种,葫芦科以多样的性形态而闻名。雄性和雌性植物分别有22A + XY和22A + XX染色体。之前,我们曾报道过一种雌雄同株(22A + XX)的柚轴承形态两性花(GYM-H)和雌花(GYM-F)。此外,我们还发现,叶面喷施硝酸银的3.在雌性植物上诱导形态学上的雌雄同体芽芽(AG-H)尽管没有Y-染色体。
结果
采用无标记蛋白质组学方法,对雄性、雌性、GyM-H和Ag-H花蕾发育早期和中期的总蛋白质组进行了分析,以确定性别相关差异。蛋白质搜索黄瓜蛋白序列(Phytozome)以及在硅翻译柚flower bud transcriptome database, resulted in the identification of 2426 and 3385 proteins (FDR ≤ 1%), respectively. The latter database was chosen for further analysis as it led to the detection of higher number of proteins. Identified proteins were annotated using BLAST2GO pipeline. SWATH-MS-based comparative abundance analysis between Female_Early_vs_Male_Early, Ag_Early_vs_Female_Early, GyM-H_Middle_vs_Male_Middle and Ag_Middle_vs_ Male_Middle led to the identification of 650, 1108, 905 and 805 differentially expressed proteins, respectively, at fold change ≥1.5 andP ≤ 0.05. Ethylene biosynthesis-related candidates as highlighted in protein interaction network were upregulated in female buds compared to male buds. AgNO3.治疗在银-H芽与花粉发育雌株诱导蛋白。此外,治花粉萌发和花粉管生长的几个蛋白质高度富集雄性花蕾相比的Ag-H和健身房-H芽。
结论
总体而言,目前的蛋白质组学分析在经济意义方面提供了第二大园艺系列葫芦科治疗葫芦科的关键蛋白质的关键蛋白质的见解。此外,我们的结果表明,乙烯介导的雄蕊抑制可能在脱型中被保守柚类似于它雌雄同株葫芦亲戚。与花粉萌发和这里确定管生长相关此外,男性偏好的蛋白质可以理解花粉育性帮助。
背景
开花植物表现出三大性系统即。两性畸形,雌雄同株和雌雄异株。在被子植物中大约90%是具有男性两性的轴承完美的花朵,以及女性生殖性器官[1].米onoecy exists at a frequency of ~ 5% in angiosperms, wherein unisexual male and female flowers are produced on the same individual plant. Remaining ~ 5% angiosperm species are dioecious, having separate unisexual plants bearing either only male or female flowers [2,3.,4].在被子植物科中,雌雄异株种的系统发育分布呈斑块状,约占3 / 4。这表明在不同的科中,雌雄异株的进化已经独立地发生过多次,因此,性别决定的分子机制可能在遥远的雌雄异株物种之间存在差异,这是一个值得研究的问题[5,6,7].在200个家庭中占〜14,600名已知的,植物性染色体均为左右左右报告植物性染色体,直到迄今为止8].植物中性别测定的机制可以复杂,也可能涉及与遗传因素外的环境因素[9].
Coccinia Grandis.(L.)voigt,是葫芦科的巨型成员,一个以其多样化的性系统而闻名[10].一般来说,柚不广泛用作模型系统,以了解性表达和修改。俗称常春藤葫芦,柚也用作蔬菜。男性和女性单性花承担在不同的植物。相似SILON LATIFOLIA.(石竹科),雄性植物中大y染色体的存在决定了性别[11,12,13].男性和女性的染色体构成柚分别为22A + XY和22A + XX [14,15,16].雄性花的特征在于存在三种旋转(酸涩)雄蕊,而且没有卡皮克,而女性花具有三个基本的雄蕊,围绕具有劣质卵巢的三个熔融的心皮[17,18].
可以针对单调的花卉开发提出两种可能的解释。(1)在花开发的早期阶段期间发起男性和女性性器官的原始性,其中一个人在后期阶段中止(例如:美国latifolia).(2)花蕾是双语,从初始起始,初始发起两种性器官中的一个(例如:thalIctrum dioicum.) [19,20.].在某些物种中,不适当的性器官保留在基本形式,而不是中止(例如:酸模) [21].以前,我们已经证明了Agno的应用3.在女性柚植物通过诱导导致雌雄同类花的形成导致血管发育(此类花作为AG-H)的形成(此后)进行修改性表达[18].Ag)+离子是乙烯反应的已知抑制剂[22].银的结合+离子与乙烯受体锁定构象使得其保持连续活性并抑制所述乙烯反应[23].银化合物(硝酸银3.和Ag2年代2O3.)对雌雄同株植物雄性化效应(Cucumis巨大成功)及雌雄异株物种的雌性植物(美国latifolia和大麻苜蓿) [24,25,26].然而,硝酸银的分子机制3.- 直到日期仍然未知26]。
目前,我们对植物性别决定机制的了解相当有限。研究植物性别决定机制的主要限制是,大多数雌雄异株植物都是没有基因组序列的非模式生物。因此,从雌雄异株植物物种中识别出性连锁基因的几率非常低[27].然而,NGS(新一代测序)技术的出现,使从雌雄异株植物物种的性别偏见基因的高通量鉴定近来[27].此外,先进的蛋白质组学方法可能导致新型性联合蛋白质的鉴定,这些蛋白质最终可以扩大我们在与性别测定和修饰相关的进化,发育和分子机制中的理解。
Muyle,等等。[27]采用RNA-SEQ方法来识别性偏见的基因表达美国latifolia并展示了首次在植物中的剂量补偿。同样,在这家工厂的其他转录组研究,在了解Y染色体退化和新的性连锁基因鉴定[有帮助28,29].柿子的另一个研究(Diospyros Lotus.)显示,ogi.(鲇鱼的压迫者),一种y染色体编码的小RNA通过靶向同源结构域转录因子控制花粉的育性梅吉以剂量依赖性方式[30.].在采取了比较从头转录的方法芦笋导致参与花粉孢子和绒毡层发育的基因特别是在雄花[有人认为,鉴定31].类似的转录组的研究也已在木瓜,黄瓜进行这导致了性别决定更好地理解[32,33,34].值得注意的是,近年来,我们对菊科植物的雄性、雌性、GyM-H和Ag-H花蕾进行了从头转录组分析柚并发现了许多性别偏见的基因,这些基因可以为雄蕊阻滞、花粉育性和性别改变机制提供关键的见解[35].
通过使用转录在基因组学,能够以捕获可能由于环境线索/信号的变化产生或基于植物的性别为雌雄异株物种的情况下,差动基因法规。然而,转录具有缺点,即mRNA丰度可能不总是准确地反映蛋白质水平,其是最终产品中的实现的遗传信息进行各种结构和功能职责[36,37].此外,只有蛋白质组学可以捕获的翻译后修饰,这是非常公知的,以控制蛋白质的功能。然而,蛋白质组学研究通常依赖于基因组/转录组数据,这限制了大多数雌雄异株种类的可用性。因此,只有少数的研究,其中已采用蛋白质组学,以了解性别决定和分化雌雄异株植物[做法38].在进行中进行了一个这样的研究芦笋以来自雄性和女性植物花的2-D凝胶的斑点形式鉴定差分累积蛋白[39].在另一项研究Pistacia Vera.纯化27kDa糖蛋白特异于雌性花序[40].还试图识别蛋白质组学方法来识别性联合的蛋白质银杏毕洛巴巴.一种针对雄性的28 kDa蛋白和针对雌性花序的36 kDa以及92 kDa蛋白已经被鉴定[38].最近,曼扎诺,等等。[41]显示来自脱衣植物的空气蛋白样蛋白的过度表达R. acetosa.诱导转基因烟草雄性不育。
为了男性,女性,gynomonoecious和化学花蕾中的蛋白质丰度的译码差异男性化的雌株柚总蛋白质组分析在花发育的早期和中期阶段进行。蛋白用IDA(信息依赖性获取)衍生的使用在计算机芯片上的数据确定的被翻译的内部柚花芽转录组[35]数据库,然后使用SWATH-MS(序列窗口获取所有理论质谱)分析进行无标记定量。不同性别间蛋白质丰度的差异柚研究,以确定潜在的玩家参与性的表达和修改。我们的研究已确定可能参与雄蕊逮捕的过程中关键蛋白,硝酸银3.介导性修改和花粉育性雌雄异株柚.
结果
花芽蛋白质组柚
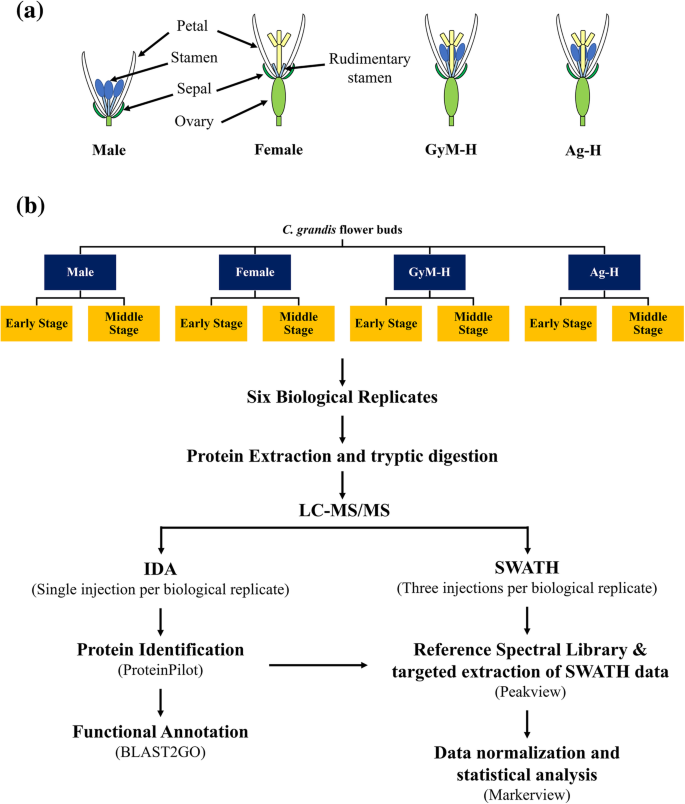
通过IDA模型中的串联LC-MS分析胰蛋白酶消化的蛋白质样品,并且根据图1所示的实验方案,通过Paragon TM处理所获得的数据。1.总共1193777个光谱(68.8%的总光谱)对应66842个不同的多肽,代表总3387个蛋白质(附加文件1:数据S1)从不同类别中识别柚flower buds with FDR ≤ 1% (Unused ProtScore Cutoff > 2.0) using in silico translated in-house柚花芽转录组(表1).同时,蛋白质鉴定使用Cucumis巨大成功以蛋白质序列作为数据库,共鉴定了2426个蛋白质,其中434个是在内部翻译的硅蛋白中未检测到的新蛋白柚花蕾转录组(附加文件1:数据S1)。这进一步改善了从中鉴定的蛋白质的数量柚在本研究中。然而,下面所有的分析都是使用柚转录组作为数据库,因为它导致检测到更多的蛋白质。
注释鉴定的蛋白质
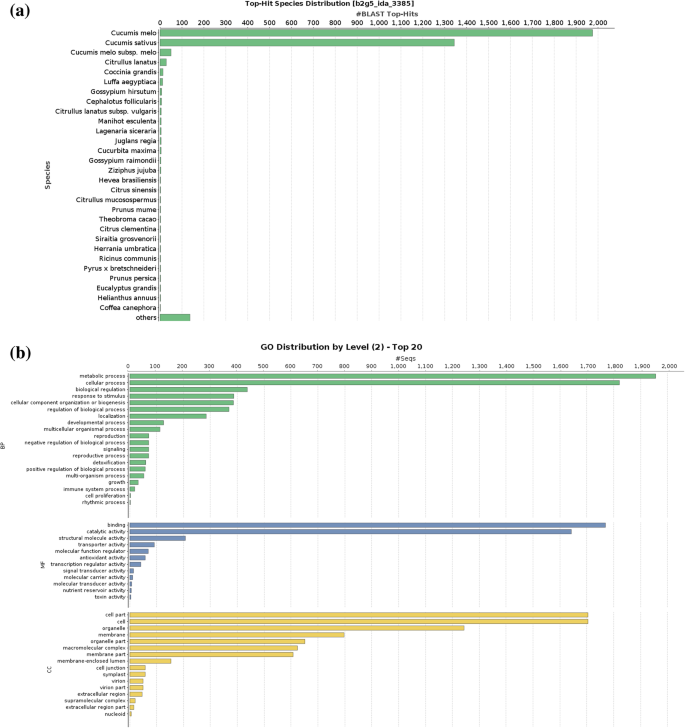
使用蛋白质软件鉴定的蛋白质使用具有1E-3的E值阈值的BLASTP对NR(非冗余蛋白)数据库的Viridiplantae子集进行搜索(图。2一种)。共有3377种蛋白质提取至少一个爆击。蛋白质的95%以上给了顶爆击抵抗C. Melo.(甜瓜)或C. Sativus.(黄瓜)。BLAST2GO用于注释并将所鉴定的蛋白质分为三个主要基因本体类别(分子功能,细胞成分和生物过程)(附加文件2:数据S2)。在生物过程中,大部分蛋白质参与了代谢过程(1956蛋白质)和细胞过程(1821蛋白质)(图。2b).有趣的是,我们可以检测到71个带有reproduction (GO:0000003)术语的蛋白(图。2b)。结合(1769种蛋白质)和催化活性(1642种蛋白质)的两个主要类别的分子功能(图2b)。此外,检测到(图41克的蛋白质与转录调节活性。2b)。中的细胞成分,细胞器与相关联的1243克蛋白质,而797用膜(图有关。2b)中的功能。最常见的酶是在基于酶代码分布分析所识别的蛋白质组水解酶,转移酶和氧化还原酶(附加文件3.:图S1)。
差异表达参与花发育的蛋白质
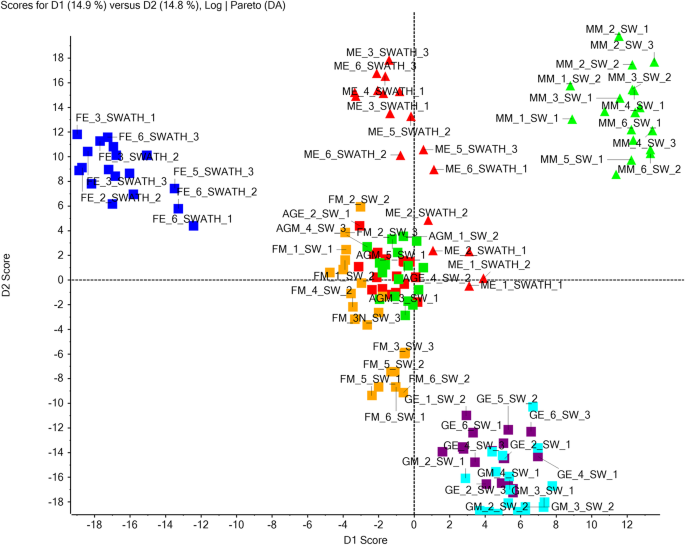
为了了解蛋白质的表达如何在与雌花的雄性花的发育过程中,使用无标记的SWATH-MS进行定量蛋白质组学,以鉴定DEPS(差异表达蛋白质)。基于来自所有样品的鉴定的蛋白质,SWATH-MS分析导致检测总量的2262蛋白,这些蛋白质从144个SWATH数据文件量化。PCA-DA(主成分分析和判别分析)显示属于每个类别的样本的重复相当聚集在一起。另外,在PCA-DA分析时,根据组织和/或发育阶段的不同样品之间的关系或差异是显着的。例如,与花卉类型的其余部分相比,雌性_hearly和Maly_middle花蕾进行了分歧(图。3.).这清楚地反映了鉴定的蛋白质,以及不同的组织和他们的发育阶段中的表达水平的显著变化(附加文件4:图S2)。然后使所有成对比较进行折叠变化≥1.5和P ≤ 0.05. Pairwise comparisons between the proteome profiles of different flower buds at early and middle stages of development are summarized in Table2.通过雌蕊早期与雄蕊早期的比较,确定雌蕊发育过程中雄蕊阻滞的关键因素。有趣的是,参与乙烯生物合成的蛋白,如UBA2A (ubp1相关蛋白2A)(1.61倍)、UBA2C (ubp1相关蛋白2C)(2.1倍)和EFE(乙烯形成酶)(1.64倍)在早期雌芽中较雄芽上调(图1)。4A&B)。相比雄性花蕾(图此外,ERS(乙烯响应传感器)(4.83倍中)中富集中间阶女性芽。4B)(附加文件5:数据S3)。我们观察到,AMS(ABORTED孢子)(0.46倍)的表达下调在相比雄性花蕾(图中上演女性芽。5A,B)(附加文件5:数据S3)。同样,以确定硝酸银的影响3.雌性植物治疗导致雄蕊发育,我们比较了Ag-H_Alearly对雌性芽的蛋白质谱。这种比较导致鉴定在AgNo上上调的许多男性函数相关蛋白质3.在早期阶段进行治疗,如UGP2(UTP-葡萄糖-1-磷酸尿嘧啶三转移酶2)(2.41倍),EDA9(胚胎囊发育4)(2.05倍),TKPR1(四丙酮α-吡喃酮还原酶1)(2.72-折叠),C4H(肉桂酸4-羟化酶)(3.53倍),TPLE(1.56倍),CDC2(细胞分裂控制蛋白2同源物A)(3.52),Ann5(annexin d5)(1.88倍),Rab1c(Ras相关蛋白质Rabd2C)(3.13倍),OASA1(O-乙酰碱巯基酶1)(3.56倍),ATKDSA1(推定醛糖酶型TIM桶家庭蛋白)(4.05倍),TCTP(翻译控制肿瘤蛋白质)(2.52倍)和ACAT2(乙酰乙酰-CoA硫基酶2)(2.71倍)(图。5B)(附加文件5:数据S3)。此外,许多其他雄性功能蛋白,如USP (udp -糖焦磷酸化酶)(1.69倍)、RPN10(调节粒子非atp酶10)(1.39倍)和LAP5 (LESS ADHESIVE花粉5)(1.69倍)在Ag-H中期芽中富集(图)。5B)(附加文件5:数据S3)。另外两组比较(GyM-H_middle vs. male_middle和Ag-H_middle vs. male_middle)发现了可能参与花粉萌发和花粉管生长的潜在靶点。有趣的是,AMS (ABORTED micro孢子)(0.24倍于GyM-H, 0.14倍于Ag-H), UNE5(未受精胚囊5)(0.47倍于Ag-H), iPGAM2(0.49倍于GyM-H, 0.46倍于Ag-H), ACOS5 (Acyl-CoA Synthetase)(0.1倍于GyM-H, 0.03倍于Ag-H)和QRT3 (QUARTET 3)(0.14倍于GyM-H, 0.03倍于Ag-H)。与GyM-H和Ag-H芽相比,Ag-H中Ag-H的高表达量为0.11倍(图2)。5B)(附加文件5:数据S3)。类似地,与健身-H和Ag-H芽相比,富含FUM1(富马酸水溶酶1)(在型HY-H中的0.65倍,0.65倍,Ag-H中的0.65倍)(图。5B)(附加文件5:数据S3)。此外,在所有两两比较中,对发展的早期和中期阶段进行了重复分析(补充文件)6:图S3)。有趣的是,66种蛋白质所特有的所述Ag-H_early与female_early比较(附加文件7:数据S4)。这些蛋白可能对理解AgNO引起的所有变化特别有意义3.导致雌性植物的性别改变。同样,对中期花蕾的分析显示,Ag-H_middle vs. male - middle和GyM-H_middle vs. male - middle分别有47和73个dep是独特的。这些蛋白可以作为未来了解雌雄异株瓜类雄蕊花粉育性的潜在研究对象8:数据S5)。
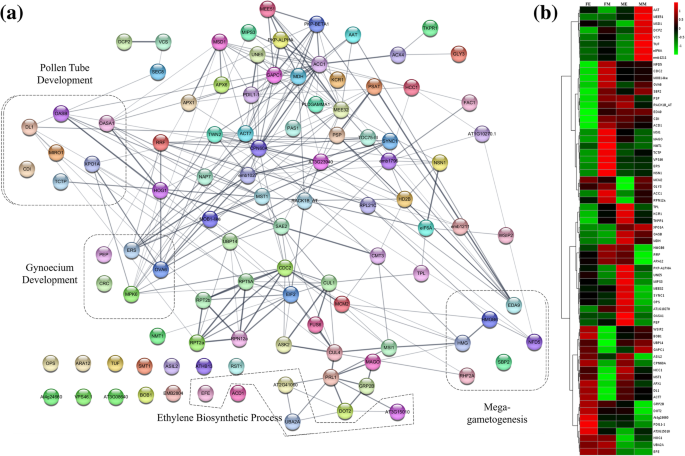
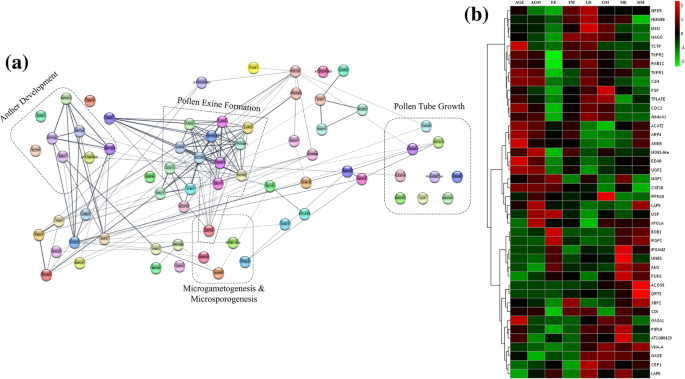
雄性生殖器官发展中蛋白质的功能相互作用和丰度谱。一个使用STRING生成的蛋白质-蛋白质功能相互作用网络。b分级聚类热图显示所选蛋白质表达谱。在互动地图上线的厚度指示的药物相互作用的预测置信度。带标签的虚线框强调在各个过程的蛋白质的子集。Z分数或每种蛋白质的表达经缩放值在红 - 绿色标作图。瓷砖的红色表示较高的水平,绿色表示较低的水平。AGE(红色),早期Ag-H;FE(蓝色),早期女性;GE(粉色),早期健身- h;GM(黄色),中期健身- h;ME(灰色),早期男性; MM (Black), Middle-staged Male; AGM (Green), Middle-staged Ag-H; FM (Turquoise), Middle-staged Female
转录物丰富分析
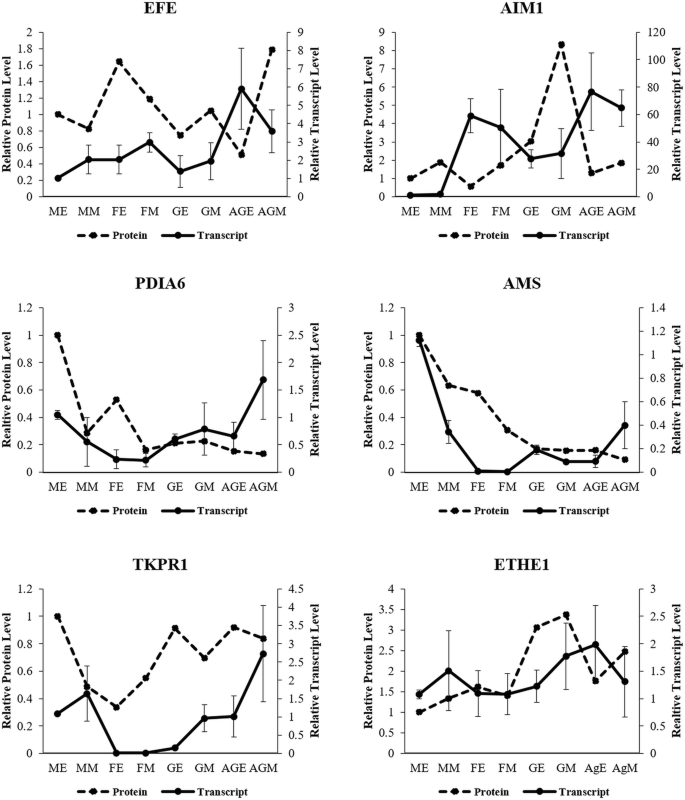
通过使用相同组织通过QRT-PCR分析验证所选蛋白质的转录水平。Coccinia同源染色体的AIM1,EFE.,ETHE1,自动对盘及成交系统,TKPR1和PDIA6显示有趣的转录物丰富曲线相对于花蕾类型(图。6).EFE.与雄性芽相比,在早期的女性芽中显示出两倍的表达。花粉开发相关转录物自动对盘及成交系统,TKPR1和PDIA6与女性芽相比,富含雄性,健康-H和Ag-H芽。TKPR1相比女性芽表现出超过100倍的表达中间阶雄性花蕾和在富集中间阶健身房-H和Ag-H芽。自动对盘及成交系统同源物在表现出100倍表达早期阶相比雌性雄性花蕾芽;> 5-fold levels compared to GyM-H buds and 10-fold increase compared to Ag-H buds. However, there were marginal differences between the transcript and the protein levels in some of the genes. For example, PDIA6 protein levels were highest in early-staged male buds, while Ag-H buds showed very low levels. However, in contrast to protein abundance,PDIA6转录本在Ag-H芽中富集最多。此外,与转录水平相比,在雄性芽样品中发现eth1蛋白水平最低。
通过qRT-PCR对选定的DE蛋白进行转录丰度分析,采用3个生物重复。将早期男性(ME)样本中转录本(基于qRT-PCR)和蛋白(基于SWATH分析)的相对丰度设为1,绘制数据。误差柱表示标准差。AgEA,早期Ag-H A;AgEB,早期Ag-H B;FEA,早期女性A;FEB,早期女B;GEA,早期健身- h A;GEB,早期健身- h B;GMA:中级健身- h A; GMB, Middle-staged GyM-H B; MEA, Early-staged Male A; MEB, Early-staged Male B; MMA, Middle-staged Male A; MMB, Middle-staged Male B; AgMA, Middle-staged Ag-H A, AgMB, Middle-staged Ag-H B; FMA, Middle-staged Female A; FMB, Middle-staged Female B
蛋白质相互作用网络揭示了生殖器官发展的潜在目标的存在
关于生殖器官,胚胎和种子发育的蛋白质进一步用于蛋白质 - 蛋白质功能相互作用映射。42种雄性生殖器官显影相关蛋白质的字符串分析导致功能性相互作用图,表明花粉和花粉发育,花粉管生长以及微杀菌剂和微孢子发生相关功能蛋白(图。5一)(附加文件9:数据S6)。这些蛋白质的表达分析表明,与雌性芽相比,富含雄性,体育-H和Ag-H芽的大多数(图。5b)。类似地,66克与女性生殖器官,胚胎和种子发育导致理事雌蕊发展,乙烯生物合成,大配子体和花粉管发展蛋白相互作用网络的标识(图鉴定的蛋白质的另一个STRING分析。4一)(附加文件9:数据S6)。重要的是,雌蕊发育和乙烯生物合成相关簇的蛋白质在雌蕊芽中富集(图。4b).这可能导致了雌蕊中雄蕊的抑制,并解释了雄蕊中雌蕊的缺失。
讨论
女性生殖功能中涉及蛋白质的比较谱
我们的研究是为数不多的蛋白质组学报道一家专注于从事单性花发育的蛋白质的鉴定。我们比较了男性和女性的芽的蛋白质谱Coccinia早期以及中期阶段的发育和鉴定与男性和女性生殖器官发展有关的蛋白质。在早期,女性花蕾的柚同时表现出雄蕊和心皮的生长。然而,鲜花达到发展的中期阶段之前,雄蕊被女性芽被捕。雄蕊逮捕的机制已得到很好的研究在雌雄同株亲属Coccinia如甜瓜,黄瓜和西瓜。但是,我们没有关于单调花的稳定性逮捕的线索Coccinia[42,43,44,45].ACS(ACC合酶),参与乙烯生物合成的酶被发现在非常高的水平,甜瓜,黄瓜,西瓜的女性芽中表达比雄性花蕾。乙烯的高水平雌芽充当雄蕊发展的抑制剂[42,43,44,45,46].然而,如果ACS函数在脱衣型葫芦中保守,则不知道。以前,我们已经表明,与乙烯信号传导相关的术语富含女性芽柚[35].然而,在目前的研究中,我们无法从花蕾中检测到AC。相反,我们发现ACS的诱导剂,即UBA2A(UBP1相关蛋白2A)和UBA2C(UBP1-相关蛋白2C)在女性中具有很高的丰富柚芽与雄芽相比(图。4A&B)。在拟南芥,金,等等。[47表明UBA2A和UBA2C过表达诱导了多种ACS基因的表达。乙烯生物合成的另一种酶EFE(乙烯形成酶)在雌芽早期和中期也比雄芽富集(图)。4a,b)。CsACO2基因,一个EFE同源物是黄瓜心皮发育所必需的[48].近日,陶,等等。[49]报道,乙烯响应因子的性别决定(ERF110)介导的乙烯 - 调节的转录相关的直系同源基因ACS11在瓜和黄瓜。这些证据进一步支持乙烯在治理中葫芦性别表达中的作用。此外,我们观察到的女性芽柚还显示出与雄性芽相比,在显影中的中间阶段的乙烯受体中升高的较高积聚(图。4a和b)[50].这表明,乙烯水平以及乙烯反应中的雌雄异株的女性芽甚至更高柚类似于单种式葫芦的女性芽。这也许解释了雄蕊逮捕的原因柚;然而,需要进一步的功能研究来验证这一假设。除此之外,参与胚珠发育的OVA6(胚乳流产6)富集在女性芽和雄花中柚没有表现出女性生殖器官的任何迹象(图4a和b)[51].参与胚胎发育等MAGO蛋白质的水平,VPS46(液泡蛋白分选相关蛋白46),PDIL1-1(蛋白质二硫键异构酶类1-1),GRP2B(甘氨酸富含蛋白质2B),At4g24660(锌指同源蛋白2)在雌性芽也增加相比男性相对(图4a和b)[52,53,54,55].花粉管引导蛋白MAGO在发育中期的雌芽中表达,表明雌芽成熟支持受精(图2)。4a和b)[56].
AgNO3.治疗会诱导影响性修改的蛋白质谱的变化
在之前的研究中,我们已经证明了叶面喷施AgNO3.在最佳浓度(35毫米),可以在雌性植物的新出现的花蕾中诱导雄蕊发育,导致性修饰[18].形态学上的雌雄同体花(AG-H)都有全尺寸的雄蕊围绕着心皮。基于先前的De Novo转录组织研究和文献可用于单一神秘亲属的性别决定机制Coccinia(甜瓜,黄瓜和西瓜),我们假设AG+离子通过抑制乙烯信令带来性修饰[35,42,43,44,45,48,57,58].cmacs7.通过乙烯生物合成作用抑制甜瓜雄蕊发育[42].通过转录组研究中,我们已经表明,硝酸银3.喷雾导致抑制乙烯信号传导柚[35].在本报告中,我们注意到Coccinia许多蛋白质的同性恋参与了花粉发育,如USP(UDP-糖焦磷酸化酶),RPN10(调节颗粒非ATP酶10),UGP2(UTP-葡萄糖-1-磷酸尿苷转移酶2),EDA9(胚胎囊发育逮捕9),TKPR1(四丙酮α-吡喃酮还原酶1),C4H(肉桂酸4-羟化酶),TPLE,CDC2(细胞分裂对照蛋白2同源物A),ANN5(annexin d5),RAB1C(RAS相关蛋白Rabd2c)富集-h芽与女性芽相比[59,60,61,62,63,64,65,66,67,68,69] (图。5a & b).参与孢粉素生物合成和花粉外壁形成的LAP5 (LESS ADHESIVE POLLEN 5)、TKPR1和TKPR2 (Tetraketide - α -pyrone reductase 2)在AgNO上上调3.治疗(图。5A,B)[63,64,70,71].还,Coccinia与雌芽相比,参与花粉萌发和花粉管生长的OASA1 (O-acetylserine巯基化酶1)、AtkdsA1(推测醛缩酶型TIM barrel家族蛋白)、TCTP(翻译控制肿瘤蛋白)、ACAT2 (Acetoacetyl-CoA thiolase 2)、ANN5和RAB1C蛋白的同源物在Ag-H芽中丰富(图)。5a和b)[68,69,72,73,74].虽然,这些蛋白质在Agno上表达3.治疗,Ag-H芽的花粉未在体外发芽,也没有施肥雌性芽[18].有趣的是,Ag)+即使在没有y染色体的情况下,离子也能够诱导雄蕊的发育,否则就会在雌性植物中受阻[18].我们推测,Y染色体可以是用于提供花粉育从银-H花花蕾花粉在本质上是无菌至关重要。
在雄性,健身房-H和Ag-H芽花粉成熟
从男性芽那些健身房-H和Ag-H芽的蛋白质积累分布的比较导致了在不同层次的这些花卉种类中表示,许多蛋白质的鉴定。Coccinia蛋白质如LAP6(较少粘合剂花粉6),CEP1(KDEL-尾半胱氨酸内肽酶),OASB(O-乙酰丝氨酸硫化氢解酶B),VHA-A的同源物(V型质子ATP酶亚基a3)和PIRL9(植物细胞内RAS-组相关的LRR蛋白9)在雄性和健身房-H芽富集相比的Ag-H和阴芽(图5A&B)。已知LAP6蛋白参与在花粉外壁形成/孢粉生物合成拟南芥发现与Ag-H和女性芽相比,被发现富含雄性和健康的芽柚(无花果。5a和b)[70,71].与此相反,LAP5,(也参与花粉外壁形成)被视为在雄性和Ag-H芽在健身房-H和阴芽(图中富集但不是。5a和b)[70,71].的突变拟南芥CEP1,一个KDEL尾半胱氨酸内肽酶,已被证明表现出中止绒毡层PCD和与异常花粉外壁减少花粉育[75].在另一方面,VHA-A(V型细胞质子ATP酶催化亚基A)蛋白是严格必需的雄配子体的正常发育[76].一致的是,VHA-A曾在雄性和健身房-H芽(高表达图。5A&B)。植物细胞内RAS组相关的LRR蛋白(PIRL9)已被证明在微酰胺发生和花粉发育过程中起重要作用[77].PIRL9有雄性和健身房花蕾(高表达图。5A&B)。已知花粉管伸长和施肥所需的OASB(O-乙酰丝氨酸巯基酶)蛋白拟南芥在男性和健身房-H花芽(呈高表达图。5v)的[74].
然而,许多蛋白质在雄性芽中富含雄性芽,在健身房-H,Ag-H和女性芽中非常低。AMS(中止幼儿孢子),UNE5(未受精胚胎5)和IPGAM2Coccinia同源物富含中间血芽(图。5a & b). UNE5在花粉管发育过程中起重要作用[78].转录因子AMS(中产孢子)的突变导致绦虫发育缺陷,微微孢子异常和不行性花粉[79].相似地,Coccinia涉及花粉外壁形成同系物ACOS5(酰基-CoA合成酶)和QRT3(四重峰3)也富含中等上演雄芽(图5a和b)[64,80,81.].另一种蛋白质FUM1(延胡索酸水合酶1),参与花粉管发展中的早期阶雄芽相比健身房-H和Ag-H芽(图富集。5a和b)[78].所有这些观察结果表明,这些蛋白质可能控制花粉活力,缺乏在健身房-H和Ag-H芽中的表达导致无菌花粉。
结论
目前的研究已导致许多蛋白质的鉴定的男性,女性和gynomonoecious形式花蕾表示Coccinia Grandis.在发育的早期和中期阶段。蛋白质在硅中搜索翻译柚花蕾转录组数据库已导致3385种蛋白质的鉴定。同时,对黄瓜的蛋白质序列的蛋白质搜索分析(Phytozome)导致无法通过检测到434种新的蛋白质柚花芽转录组。这进一步改善了从中鉴定的蛋白质的数量柚本研究中的花蕾。此外,Agno蛋白质组概况的变化3.揭示了女性植物中的性修饰。通过蛋白质相互作用网络地图,我们观察到参与乙烯生物合成等乙烯生物合成的蛋白质在雌性芽中升高了UbA2a,Uba2c和Efe柚表示高水平的乙烯类似于甜瓜,黄瓜和西瓜等单一的含葫芦的雌性芽。这可能表明乙烯在雄蕊抑制中的作用可能不仅在单一的葫芦中而且在雌雄同体中被保守柚。AgNO3.治疗能够在女性植物中诱导雄蕊发育柚.然而,来自Ag-H和Gym-H芽的花粉本质上是无菌的。可能有两种可能性来解释Gym-H和Ag-H花蕾的花粉无菌原因。妊娠和雄性植物的花蕾可能在基因表达的时序或水平方面有所不同,导致花粉不完全发展。或者,治疗花粉生育能力的基因可能是y型与健身 - H和Ag-H形式的y键合。直到现在,完整的基因组序列Coccinia不可用,这将是难以确定这一点。未来研究需要解开Y染色体的花粉育性的作用乙烯介导的雄蕊抑制之间的关联机制,以及。总体而言,在这种非模型雌雄异株种类有限分子的资源来看,我们目前的花芽蛋白质组数据集将作为宝贵的新资源,用于参与的单性花葫芦科的发展,第二大园艺关键分子球员未来的识别植物家族在经济上的重要性方面。
方法
花蕾集合
野生型雄性,女性和孕妇(健身房,Herbarium凭证:Tripura大学校园,Karmakar,433)形式的克隆柚在IISER印度Pune [试验区生长18].叶片喷施35mm AgNO使部分雌株发生化学雄性化3.解决了基生叶,导致形态两性花的发展(AG-H)。早期和中上演的男,女,gynomonoecious和化学男性化雌株花芽柚根据Provoius协议收获[35].每个样品的六次生物学重复在此研究中使用。Each biological replicate consisted of a pool of 4–5 flower buds of uniform size, crushed in liquid nitrogen and stored at − 80 °C until further use. Overall, experimental plan is depicted schematically in Fig.1.提前上演本研究选择雄性花蕾表现出雄蕊intitials发展没有心皮缩写的迹象,而早期上演雌花芽(阶段3-4)有两个心皮和雄蕊的缩写。我们注意到,在雌花雄蕊发育得到周围阶段4-5被捕18].选择早期的花蕾,使得可以研究雄蕊抑制调控[35].然而,在两种类型的雌雄同体花(AG-H和GEAM-H)中,雄蕊和心皮在早期和中间阶段同时发生。花粉成熟过程也是有益的,因为只有雄花产生了活性的花粉。两种类型的雌雄同体花(AG-H和GYM-H)产生了不可行的花粉[18].因此,中间阶花芽选择为使得花粉成熟过程可以调查[35].
蛋白质提取
对黄花菊花芽进行蛋白质提取柚按艾萨克森,等等。[82.经过一些修改。花蕾在液氮中被碾碎,每个生物复制使用50 mg粉状样品,在15 mL试管(TARSONS)中称重。将5ml冷冻的10%三羧酸/丙酮与2% β-巯基乙醇加入到这些试管中,在−20°C下涡旋并孵育至少4h。试管以10000 rpm进一步离心20分钟,小心丢弃上清。颗粒中过量的丙酮在通风柜中蒸发掉了。10毫克的不溶性PVPP (Polyvinylpolypyrrolidone)被添加到这个球之后,添加5毫升的包含0.7蔗糖提取缓冲,0.1氯化钾,0.5 Tris-HCl, pH值7.5,50 mM EDTA, 0.5% SDS和β巯基乙醇的最终浓度为2% (v / v)和涡大力15分钟。试管在4°C、10000 rpm下离心20分钟。将上清转移到一个新鲜的15ml管中,加入5ml Tris平衡酚(pH 8.0),并剧烈旋转15min。相分离采用25°C, 10000 rpm离心20分钟。将上面的酚相转移到一个新鲜的管中,用萃取缓冲液(不含SDS)洗涤。 The process was repeated twice and the protein was precipitated using 3–5 volumes of chilled 0.1 M ammonium acetate in methanol containing 2% β-mercaptoethanol. Pelleting and washing of the protein was performed as described previously [82.].将干燥的蛋白质沉淀物在0.1%RapiGest SF(Waters)上复原并使用Bradford方法(微量滴定板方法,BioRad公司)定量。
溶液消化和肽纯化
在溶液中消化提取的蛋白,取100 μg重组蛋白在1.5 mL LoBind管(Eppendorf)中,用0.1% RapiGest SF(在新鲜的50 mM碳酸氢铵溶液中制备)稀释至100 μL。该蛋白质溶液在80°C加热15分钟在1250 rpm的热混合器上。将5 μL的100mm DTT(现制备的二硫苏糖醇)加入到预热的蛋白溶液中,在60℃、1250 rpm下孵育15分钟。将蛋白溶液冷却至室温,加入5 μL 200 mM碘乙酰胺,室温避光孵育30分钟。在蛋白中加入3 μg胰蛋白酶(trypsin GOLD, Promega, MS-Grade)进行消化,37℃、1250 rpm孵育16 h。加入2 μL甲酸(Sigma, ms -级)终止反应,37℃静置45min。试管在4°C下15000 rpm离心30分钟,上清收集在新鲜的1.5 mL LoBind试管中,在−80°C保存直到进一步使用。按照制造商的说明使用C18 ZipTip (Milipore)纯化胰蛋白酶肽。肽段真空干燥,用3% ACN和0.1%甲酸复配,最终浓度为1 μg/μL。
对于IDA和SWATH MS数据采集
进一步稀释重构的肽以产生3μg/5μl的浓度,对于IDA采集,1μg/5μl的速度采集。通过使用配备有Eksegent C18-反向相塔(100×0.3mm,3μm,120)的盲肠剂微液体200系统分离肽消化物。在AB-SCIEX三重TOF上分析样品5600质谱仪。根据Korwar的协议,已经遵循了MS采集的LC分离方法和参数设置,等等。[83.].通过骄傲将质谱蛋白质组学数据沉积在Proteomexchange联盟中[84.] Partner存储库与DataSet标识符PXD011064。
使用Proteinpilot软件,使用Protogo算法,使用Protover算法,在硅片算法中,搜索肽光谱库和数据库搜索 - IDA质谱文件。(AB SCIEX)。柚flower bud transcriptome at FDR (false discovery rate) ≤ 1%. The ProteinPilot output file (.group) was used as a standard peptide spectral library. In order to identify proteins that might have gone undetected due to the limitation ofCoccinia转录组数据库的覆盖范围,IDA质谱文件也对搜索Cucumis巨大成功在Phytozome可用的蛋白序列[85.].SWATH分析进行了六种生物重复和技术三次含量,每种药物,女性,AG-H和GAM-H芽以及中期的男性,女性,AG-H和GYM-H芽。使用PeakView软件,版本2.2(AB SCIEX)进行SCATH-MS数据的频谱对准和目标数据提取。肽数据(.mrkvw)文件用于使用markerview软件,版本1.3(ab sciex)量化蛋白质。使用β-半乳糖苷酶和肌动蛋白-7(Trinity_dn116897)峰面积,然后进行标准化进行标准化。肽与aP ≤ 0.05 were considered for quantification. PCA-DA analysis was carried out using Markerview in order to study the relationship between all the samples and replicates followed by t-test to identify DEPs among each pairwise comparisons in which fold change was set as ≥1.5, and significance ofP ≤ 0.05 was chosen as cut-off.
蛋白质相互作用网络分析
加入ID拟南芥通过蛋白组分析鉴定的蛋白同源物使用Cytoscape 3.6研究蛋白-蛋白相互作用[86.].字符串数据库拟南芥使用STRING App 1.2.2导入注释、交互并进行进一步分析[87.].通过基因富集分析,将生殖过程和花发育过程中的蛋白质分组,生成网络表示。
转录物丰富分析
为了估计所选差异富集蛋白的转录水平,qRT-PCR使用了用于蛋白质组学的相同组织样本。用SuperScript IV逆转录酶(Invitrogen)用寡核苷酸(dT)引物合成两微克总RNA的互补DNA (cDNA)。采用BIO-RAD CFX96机器进行基因特异性正、反引物的qRT-PCR(附文件)10:表S1)。Takara SYBR预混料Taq.采用II (Takara Bio Inc.)进行反应,PCR板在95℃孵育3 min, 95℃15 s, 58℃15 s, 72℃15 s共40个循环。采用熔融曲线分析确定PCR的特异性。数据分析使用2-ΔΔCT方法和方法CgACT2被选为标准化的内参基因[88.].
可用性数据和材料
通过与数据集标识符PXD011064的骄傲伙伴存储库沉积到ProteomexChange联盟的质谱蛋白质组学数据。
缩写
- AG-H花蕾:
-
用硝酸银处理过的植物的雌雄同体花
- 去:
-
基因本体论
- 健身:
-
Gynomonoecious
- 健身房 - H花蕾:
-
雌雄同株植物的两性花
- 艾达:
-
信息依赖习得
- 质:
-
液相色谱 - 质谱法
- NGS:
-
下一代测序
- NR:
-
非冗余蛋白质数据库
- PCA-DA:
-
主成分分析和判别分析
- QRT-PCR:
-
定量实时聚合酶链反应
- SWATH-MS:
-
所有的理论质谱的连续采集窗口
参考
- 1.
yampolsky c,yampolsky h. phanerogamic flora中性别形式的分布。Bibliotheca Genetica。1922; 3:1-62。
- 2.
开花植物雌雄异株及其相关植物。acta botanica sinica(云南植物学报),2012;
- 3.
查尔斯沃思D.植物性别决定和性染色体。遗传。2002; 88:94。
- 4.
Renner SS。AgeniSperm性系统的亲属和绝对频率:Diocy,Monoecy,GynodioEcy和更新的在线数据库。我是J机器人。2014; 101(10):1588-96。
- 5.
Ainsworth C.男孩和女孩出来演奏:Diocious植物的分子生物学。Ann Bot。2000; 86(2):211-21。
- 6.
Ainsworth C,Parker J,Buchanan-Wollaston V.植物中的性别测定。在:Pedersen Ra,Schatten GP,编辑。发展生物学的当前主题。38:学术出版社;1997. p。167-223。https://doi.org/10.1016/S0070-2153(08)60247-1.
- 7.
古特曼DS,查尔斯沃思D.一种X连锁的基因与在雌雄异株植物中的简并Y连锁同源物。自然。1998; 393:263。
- 8。
明R,Bendahmane A,伦纳SS。性染色体在陆生植物。Annu Rev植物Biol。2011; 62(1):485-514。
- 9。
acta botanica sinica(云南植物研究)。植物细胞。1993;5(10):1241。
- 10.
王志强,王志强,王志强,王志强。雄性间有性生殖的生物学研究进展Cucumis Melo.亚普。Agrestis(Cucurbitaceae)。Ann Bot。2009; 104(6):1129-39。
- 11.
库马尔L,的Deodikar G.性染色体红瓜籼稻怀特岛和攻击。咕咕叫科学。1940;9(3):128 - 30。
- 12.
Bhaduri PN,百色PC。在一些常见的葫芦细胞遗传研究,并特别提及染色体碎裂为形态的物理基础。J Genet。1947; 48(2):237。
- 13.
《细胞学》的编辑红瓜籼稻W.&A.参照其性染色体的行为。科学-B节的印度科学院院刊;1948年:斯普林格。
- 14.
库马尔L,在Viseveshwaraiah S.性别机构红瓜籼稻怀特岛和攻击。自然。1952; 170(4321):330。
- 15.
瓜类雌雄异株的染色体分析Coccinia Grandis.(L.)福格特。染色体科学。2012; 15(1 + 2):9-15。
- 16.
Sousa的A,福斯Ĵ,伦纳SS。分子细胞遗传学(FISH,GISH)Coccinia Grandis.:一个约在开花植物最大的Y /常染色体发散葫芦科的3 MYR老品种。Cytogenet基因组RES。2013; 139(2):107-18。
- 17.
Bhuskute S,Makde K,Deshpande P. Staminal组织Coccinia Grandis.(L.)福格特。安1986:415-8机器人。
- 18.
Ghadge AG,Karmakar K,Devani RS,班纳吉Ĵ,Mohanasundaram B,辛哈RK。等人。花发育,花粉育性和性表达的三种性的表型分析Coccinia Grandis..BMC植物BIOL。2014; 14(1):325。
- 19。
di stilio vs,kramer em,baum da。花卉疯子盒基因和古典性别二态thalIctrum dioicum.毛茛科雌雄异株研究的新模式。植物j . 2005; 41(5): 755 - 66。
- 20。
Hardenack S,Ye D,Saedler H,Grant S. MADS箱基因表达的比较疯狂植物白露天的男性和女性花卉。植物细胞。1994年; 6(12):1775。
- 21。
answorth C, Crossley S, Buchanan-Wollaston V, Thangavelu M, Parker J.雌雄异株植物酢浆草的雄性和雌性花表现出不同的MADS box基因表达模式。植物细胞。1995;7(10):1583。
- 22。
拜尔EM。乙烯作用的植物的有效抑制剂。植物理性。1976; 58(3):268。
- 23。
McDaniel BK, Binder BM。乙烯受体1 (ETR1)在银离子介导的乙烯反应抑制中起主要作用拟南芥.J Biol Chem。2012; 287(31):26094-103。
- 24。
(2)银离子和赤霉酸对雌花诱导的影响大麻植物。经验。1979; 35(3):333-4。
- 25。
阴T,奎因JA。一种激素的一种机械模型的试验调节两种性别中Cucumis巨大成功(葫芦)。我是J机器人。1995年:1537年至1546年。
- 26。
法律TF,Lebel-Hardenack S,Grant SR。银增强女性白菜中的雄蕊开发(SILON LATIFOLIA.[蛛网]))。我是J机器人。2002; 89(6):1014-20。
- 27。
Muyle A,Zemp N,Deschamps的C,Mousset S,Widmer分馏A,沼泽GA。的X染色体剂量补偿的快速从头进化SILON LATIFOLIA.与年轻的性染色体的植物。Plos Biol。2012; 10(4):e1001308。
- 28。
奇巴利娜玛格丽塔v,Filatov da。通过单倍体净化选择,植物Y染色体变性延迟。Curr Biol。2011; 21(17):1475-9。
- 29。
Bergero R,在10亿年历史的老厂的性染色体系统在Y转录的查尔斯沃思D.保护。Curr Biol。2011; 21(17):1470-4。
- 30。
赤城T,亨利IM,道R,L. Comai的一个Y染色体编码的小RNA充当柿子性别决定因素。科学。2014; 346(6209):646。
- 31.
Harkess A,Mercati F,Shan H-Y,Sunseri F,Falavigna A,Leebens-Mack J.性别偏见的芦笋(芦笋officinalis.).新植醇。2015;207(3):883 - 92。
- 32.
吴涛,秦志,周晓霞,冯志华,杜勇。黄瓜花性决定的转录组分析。植物生理学报。2010;167(11):905-13。
- 33.
浦崎N,Tarora K,修道A,上野H,玉置男,宫城N,等人。在木瓜推测性别决定基因的数字转录组分析(番木瓜).Plos一个。2012; 7(7):E40904。
- 34.
郭S,郑Y,祯J-G,刘S,张Z,Crasta OR等。转录组测序和黄瓜花不同性别类型的比较分析。BMC基因组学。2010; 11(1):384。
- 35.
Devani Rs,Sinha S,Banerjee J,Sinha RK,Bendahmane A,Banerjee Ak。De Novo转录组大会从Diocious,Gonnomoeocious和Chexive上阳性女性的花蕾组装Coccinia Grandis.揭示与性表达和修改相关的基因。BMC植物BIOL。2017; 17(1):241。
- 36.
张B,王静,王X,朱Ĵ,刘谦,石Z,等人。人类结肠癌和直肠癌的Proteogenomic表征。自然。2014; 513:382。
- 37.
酵母中mRNA丰度与蛋白质丰度的相关性。中国生物医学工程学报。1999;19(3):1720-30。
- 38.
杨L,龚˚F,熊E,王W.蛋白质组学:对雌雄异株植物性别差异研究一个行之有效的手段。前植物SCI。2015; 6:954。
- 39.
Bracale男,加利男,Falavigna A,索阿韦C.性分化芦笋officinalis.L.性植物的成长。1990; 3(1):23-30。
- 40。
Golan-goldhirsh A,Peri I,Birk Y,Smirnoff P.花序芽蛋白Pistacia Vera..树木。1998;12(7):415 - 9。
- 41。
刘志强,刘志强,刘志强,等。雌雄异株植物中花特异性溶气素样蛋白的过度表达酸模变造花的发育和诱导雄性不育转基因烟草。植物杂志2017; 89(1):58-72。
- 42。
Boualem A,Fergany M,Fernandez R,Troadec C,Martin A,Morin H,等。乙烯生物合成酶中的保守突变导致甜瓜中的andromono2。科学。2008; 321(5890):836。
- 43。
Boualem A,Lemhemdi A,Sari M-A,Pignoly S,Troadec C,Abou Choucha F,等。andromoOnious的性别测定基因预测分离cucumis.和Citrullus genera..Plos一个。2016; 11(5):e0155444。
- 44。
Boualem A,Troadec C,Camp C,Lemhemdi A,Morin H,Sari M-A等人。葫芦科技基因揭示了单调的花朵如何发展和突然出现。科学。2015; 350(6261):688。
- 45。
Boualem A, Troadec C, Kovalski I, Sari M-A, Perl-Treves R, Bendahmane Acucumis.物种。Plos一个。2009; 4(7):E6144。
- 46。
Switzenberg JA,小HA,Hammar的SA,格鲁梅特R.花原基靶向ACS(1-氨基环丙烷-1-羧酸合酶)的转基因表达Cucumis Melo.暗示乙烯生产中介单性花的发展微调。Planta。2014; 240(4):797-808。
- 47。
金CY,波夫Ĵ,阿斯曼SM。伤口响应RNA结合蛋白诱导叶片衰老和过敏样细胞死亡的表达。新植物。2008; 180(1):57-70。
- 48。
陈辉,孙建军,李树华,崔强,张辉,辛峰,等。黄瓜心皮发育的ACC氧化酶基因。摩尔。2016;9(9):1315 - 27所示。
- 49。
陶Q,牛H,王Z,张W,王H,王S等人。乙烯响应因子ERF110在两个中介导乙烯调节的乙烯调节转录两种性别判定相关的正交基因cucumis.物种。J Exp Bot。2018; 69(12):2953-65。
- 50。
O'Malley RC,Rodriguez Fi,Esch JJ,Binder Bm,O'Donnell P,Klee Hj等。乙烯 - 结合活性,基因表达水平和乙烯受体家庭成员的受体系统输出拟南芥和番茄。植物杂志2005; 41(5):651-9。
- 51。
伯格男,罗杰斯R,城墙R,Meinke D.氨酰-tRNA的要求为合成酶配子和胚胎发育中拟南芥.植物杂志2005; 44(5):866-78。
- 52。
AndèmeOndzighi C,克里斯托弗DA,赵EJ,张S-C,施特赫林LA。拟南芥蛋白二硫异构酶5抑制半胱氨酸蛋白酶运输到液泡之前的内皮细胞程序性死亡的种子。植物细胞。2008;20(8):2205。
- 53。
Spitzer C,Reyes Fc,Buono R,Sliwinski Mk,Haas TJ,Otegui Ms。ESCRT相关的CHMP1A和B蛋白介导无助性载体的多猪体分类拟南芥和所需要的植物发育。植物细胞。2009; 21(3):749。
- 54。
杨扬,卡尔森DT。过度表达AtCSP4影响胚胎发展的后期阶段拟南芥.J Exp Bot。2011; 62(6):2079-91。
- 55。
Pagnussat GC,Yu H-J,Ngo QA,Rajani S,Mayalagu S,Johnson CS等。雌性配子素发育及功能所需基因的遗传和分子鉴定拟南芥.发展。2005; 132(3):603。
- 56.
约翰逊MA,冯贝赛尔K,周Q,史密斯E,辅助G,巴顿d,等。拟南芥突变倒霉蛋定义至关重要配子体功能。遗传学。2004; 168(2):971-82。
- 57.
齐藤S,藤井N,宫泽Y,山崎S,松浦S,水泽H,等人。雌花芽的发育和表达之间的相关性CS-ACS2.黄瓜植物中的基因。J Exp Bot。2007; 58(11):2897-907。
- 58.
李Z,黄S,刘某,潘j,张z,陶琦,等。分子隔离米基因表明保守 - 残基转化诱导黄瓜植物中双性恋花的形成。遗传学。2009; 182(4):1381。
- 59.
Kotake T,Hojo S,Yamaguchi D,Aohara T,Konishi T,Tsumuraya Y. UDP-糖溶解酶的性质和生理功能拟南芥.Biosci Biotechnol Biochem。2007; 71(3):761-71。
- 60。
Smalle J,Kurepa J,Yang P,Emborg TJ,Babiychuk E,Kushnir S等人。26s蛋白酶体亚单元RPN10的抗脂肪作用拟南芥生长和发育支持在脱钙酸信号中的基质特异性功能。植物细胞。2003; 15(4):965-80。
- 61。
Park J-I,Ishimizu T,Suwabe K,Sudo K,Masuko H,Hakozaki H,等。UDP-葡萄糖焦磷酸化酶是植物和生殖阶段的速率限制拟南芥.植物细胞生理。2010; 51(6):981-96。
- 62。
Toujani W,Muñoz-Bertomeu J,Flores-Tornero M,Rosa-Téllezs,Anoman Ad,Alseekh S等人。塑性3-磷酸糖脱氢酶家族的功能表征拟南芥.植物杂志。2013;163(3):1164 - 78。
- 63。
Grienenberger E,金SS,拉勒曼德B,弗鲁瓦P,海因茨d,Souza的CA,等人。在拟南芥TETRAKETIDEα吡喃酮还原酶功能的分析揭示了一个先前未知的,但保守的,生化的孢粉素单体合成途径。植物细胞。2010; 22(12):4067-83。
- 64。
Dobritsa A, Geanconteri A, Shrestha J, Carlson A, Kooyers N, Coerper D, et al.;大规模的基因筛选拟南芥鉴定涉及花粉外壁生产的基因。植物理性。2011; 157(2):947-70。
- 65。
范达姆d,Coutuer S,德Rycke R,Bouget F-Y,Inzéd,Geelen D.体细胞胞质分裂和成熟花粉中拟南芥取决于TPLATE,其具有类似于外壳蛋白结构域。植物细胞。2006; 18(12):3502-18。
- 66。
Schilmiller AL,烈性黑啤酒Ĵ,翁J-K,堪Ĵ,吕埃格尔MO,Chapple的C.突变在肉桂酸4-hydroxylase基因影响代谢、生长发育拟南芥.植物j . 2009; 60(5): 771 - 82。
- 67。
杨克,王H,Xue S,曲X,Zou J,Le J.要求型细胞周期蛋白依赖性激酶和周边末端的周边血管谱系拟南芥.J Exp Bot。2014; 65(9):2449-61。
- 68。
朱军,吴旭,袁胜,钱东,南强,安磊,等。附件5起着至关重要的作用拟南芥通过钙依赖膜贩运花粉的发育。Plos一个。2014; 9(7):e102407。
- 69。
Peng J,Ilarslan H,Wurtele Es,Bassham DC。ATRABD2B和ATRABD2C在花粉发育和花粉管生长中具有重叠的功能。BMC植物BIOL。2011; 11(1):25。
- 70。
王志强,王志强,王志强,等。LAP5和LAP6编码与查尔酮合酶(Chalcone synthase)相似的花药特异蛋白拟南芥.植物杂志。2010;153(3):937 - 55。
- 71。
Kim Ss,Grienenberger E,Lallemand B,Colpitts CC,Kim Sy,Souza Ca,等。LAP6 /聚酮化合物合酶甲和LAP5 /酮化合物合酶B编码花粉发育所需的羟基烷基α-吡喃酮合成酶和孢子醇素生物合成拟南芥.植物细胞。2010; 22(12):4045-66。
- 72。
Berkowitz O,Jost R,Pollmann S,Masle J.表征TCTP,翻译肿瘤蛋白,来自拟南芥.植物细胞。2008; 20(12):3430-47。
- 73。
Delmas F, Séveno M, Northey JGB, Hernould M, Lerouge P, McCourt P, et al.;鼠李体半乳糖醛酸II组分3-脱氧-d -甘露-2-八烯酸(Kdo)的合成是花粉管生长和伸长所必需的。中国生物医学工程学报。2008;59(10):2639-47。
- 74。
Birke H,Heeg C,Wirtz M,地狱R.成功的施肥需要至少一个主要的存在O- 用于花粉中的半胱氨酸合成的乙酰丝氨酸(硫醇)裂解酶拟南芥.植物理性。2013; 163(2):959-72。
- 75。
张d,刘d,吕X,王Y,迅Z,刘Z,等人。半胱氨酸蛋白酶CEP1,参与绒毡层的主要执行程序性细胞死亡,在调节花粉发育拟南芥.植物细胞。2014; 26(7):2939-61。
- 76。
Dettmer J,Schubert D,Calvo-Weimar O,Stierhof Y-D,Schmidt R,Schumacher K. V-ATP酶在雄性配子上发育的基本作用。工厂J. 2005; 41(1):117-24。
- 77。
Forsthoefel NR,弗农DM。孢子体PIRL9基因型对的减数分裂后表达的影响拟南芥Pirl1;pirl9突变花粉表型。足底。2011;233(2):423 - 31所示。
- 78。
Boavida LC, Shuai B, Yu H-J, Pagnussat GC, Sundaresan V, McCormick S. A collection ofDs与男性配子体发育和功能缺陷相关的插入突变体拟南芥.遗传学。2009; 181(4):1369至1385年。
- 79。
徐军,杨C,袁Z,张d,Gondwe MY,丁Z,等人。这中流动孢子雄性减数分裂后的生殖发育需要调控网络拟南芥.植物细胞。2010;22(1):91 - 107。
- 80.
de Azevedo SC, Kim SS, Koch S, Kienow L, Schneider K, McKim SM,等。在植物花粉发育和孢粉素生物合成中需要一种新的脂酰辅酶A合成酶拟南芥.植物细胞。2009;21(2):507 - 25所示。
- 81.
李承晚SY,奥斯本E,波因德克斯特PD,萨默维尔CR。在小孢子分离四重奏3.突变体拟南芥由缺陷在花粉母细胞壁降解所需发育调节果胶酶削弱。植物理性。2003; 133(3):1170至1180年。
- 82.
作者简介:何颖,e - mail: zhang@163.com, e - mail: zhang@163.com植物组织增强蛋白质组分析的样品提取技术。Nat Protoc。2006;1:769。
- 83.
Korwar Am,Vannuruswamy G,JagadeSheShaprasad Mg,Jayaramah Rh,Bhat S,Regin BS等。人血清白蛋白糖化肽诊断片段离子文库的研制:平行反应监测,SWATH和MSE的预脂肪,糖尿病和微蛋氨酸血浆中靶向定量。Mol细胞蛋白质组学。2015; 14(8):2150-9。
- 84。
VizcaínoJA,Csordas A,Del-Toro N,Dianes Ja,Griss J,Lavidas I等。2016年更新自豪数据库及其相关工具。核酸RES。2016; 44(D1):D447-D56。
- 85。
等。植物群落:绿色植物基因组学的比较平台。核酸学报2011;40(D1): D1178-D86。
- 86。
Shannon P,Markiel A,Ozier O,Baliga NS,Wang JT,Ramage D等人。Cytoscape:用于生物分子交互网络的集成模型的软件环境。Genome Res。2003; 13(11):2498-504。
- 87。
Szklarczyk D,Morris Jh,Cook H,Kuhn M,Wyder S,Simonovic M等。2017年的字符串数据库:质量控制的蛋白质 - 蛋白质关联网络,广泛访问。核酸RES。2017; 45(D1):D362-D8。
- 88。
Livak KJ,Schmittgen TD。分析使用实时定量PCR和2-ΔΔCT方法相对基因表达数据。方法。2001; 25(4):402-8。
致谢
诚挚的作者感谢Mahesh Kulkarni博士和他的博士学生,生化科学部门,CSIR-NCL浦那进行了整个研究的关键讨论和建议。我们感谢Nitish Lahigude先生为维护柚植物在温室以及在外地。纳兰德Kadoo博士与问候蛋白分离技术输入也承认。关于从Shanthakumari博士,CSIR-NCL普纳收到LC-MS技术的投入也值得庆幸的确认。
资金
R.S.D.确认来自CSIR,HRDG,新德里获得研究奖学金。从DST,官立财政支持。印度(批准号-SR / WOS-A / LS-1233/2014),以及董事,IISER浦那是令人欣慰的确认。资助机构并没有参与这项研究的设计;收集,分析数据,并以书面稿件解释。
作者信息
隶属关系
贡献
RSD,JB,AKB和SS计划和设计了研究。RSD和TC执行实验并分析了数据。RSD,TC,JB,BBD和AKB写了稿件。AB,BBD和SS有助于批判性讨论,解释数据并编辑稿件。所有作者都已经阅读并赞成最终的手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用
同意出版物
不适用
利益争夺
两位作者宣称他们没有相互竞争的利益。
附加信息
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
数据S1。从蛋白质鉴定的详细报告柚花蕾使用Paragon算法与ProteinPilot v5.0.1。(XLSX 12245 kb)
附加文件2:
数据S2。BLAST2GO注释表柚本研究检测花芽蛋白。(XLSX 640 kb)
附加文件3:
图S1。对于所检测的酶代码分布分析柚花芽蛋白使用BLAST2GO v5。(TIF 1214 kb)
附加文件4:
图S2。热图从不同阶段的描绘2262种分层群集蛋白的表达谱柚花芽样本。AGE(红色),早期Ag-H;AGM(绿色),中间阶段Ag-H;FE(蓝色),早期女性;FM(绿松石),中期女性;GE(粉色),早期健身- h;GM(黄色),中期健身- h;ME(灰色),早期男性;MM(黑色),中年男性。(TIF 56 kb)
附加文件5:
数据S3。所有样品中每种量化蛋白质的标准化峰面积和成对差异表达分析结果以及各自的折叠变化以及P值。折数变化≥1.5和P ≤ 0.05 are shown in highlighted cells for all pairwise comparisons. (XLSX 7759 kb)
附加文件6:
图S3。维恩图显示了花发育早期(A)和中期(B)所有两两比较中差异表达蛋白的重叠。(PDF 343 kb)
附加文件7:
S4数据。在花发育早期阶段的所有成对比较之间的差异表达蛋白质重叠。(XLSX 42 KB)
附加文件8:
数据S5。在花发育中间阶段的所有成对比较之间的差异表达蛋白质重叠。(XLSX 38 KB)
附加文件9:
数据S6。对于蛋白质标准化峰面积参与的男性和女性生殖器官发育,种子发育和胚胎发育各自的沿拟南芥加入ID。(XLSX 144 KB)
额外的文件10:
表S1。在目前的研究中用于定量RT-PCR引物。(PDF 39 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Devani,R.S.,Chirmade,T.,辛哈,S.等等。花芽蛋白质组揭示了性偏置蛋白质的调节,可能与性表达和脱衣型进行修饰相关Coccinia Grandis..BMC植物杂志19,330(2019)。https://doi.org/10.1186/s12870-019-1937-1
收到了:
接受:
发表:
关键词
- Coccinia Grandis.
- 雌雄异株
- 性别修改
- 雄蕊逮捕
- 花粉生育
- 蛋白质组学