摘要
背景
花青素是一种有色色素,由于其潜在的健康益处,长期以来一直被用作食品和药物成分,但环境或发育线索调节花青素生物合成的中间信号仍然知之甚少。肉质果实已成为研究花青素生物合成调控的良好体系,探索色素代谢机制对果实成熟调控具有重要意义。
结果
本研究揭示了ABA的积累过程枸杞果实成熟过程中,花青素的积累与花青素含量呈正相关LbNCED1转录水平。外源ABA的施用和ABA生物合成抑制剂氟里冬的施用,均能提高和降低花青素的含量枸杞水果,分别。这是第一个报告表明ABA促进花青素的积累枸杞水果。花青素含量的变化与编码MYB-bHLH-WD40转录因子复合物基因或花青素生物合成相关酶的表达变化一致。占据LbNCED1基因沉默显著减缓果实着色,降低花青素和ABA的积累枸杞水果成熟。qRT-PCR分析显示LbNCED1基因沉默明显降低了类黄酮生物合成途径中结构基因和调控基因的转录水平。
结论
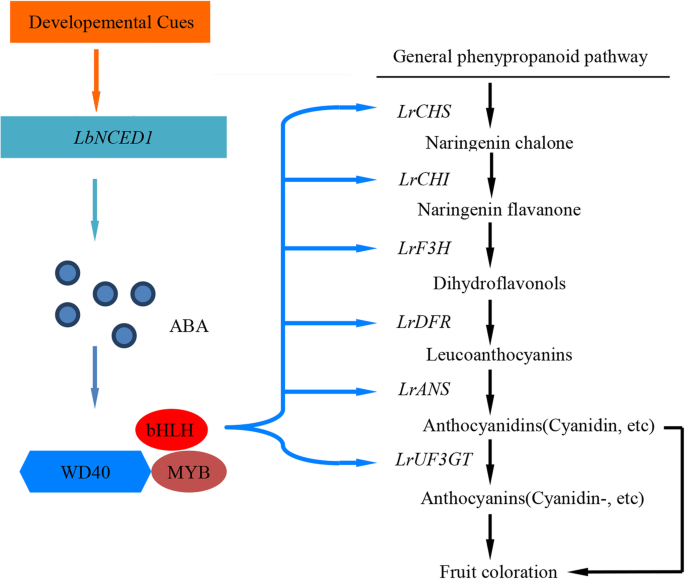
在此基础上,建立了aba介导的发育依赖花青素生物合成和果实着色的模型枸杞提出了果实成熟。在这个模型中,发育线索在转录上被激活LbNCED1从而促进植物激素ABA的积累,积累的ABA刺激MYB-bHLH-WD40转录因子复合物的转录,上调类黄酮生物合成途径中结构基因的表达,从而促进花青素的产生和果实着色。本研究结果为调控药用和食用植物新鲜果实的成熟和品质提供了一种有价值的策略。
背景
果实发育和成熟机制与果实品质密切相关,是目前重要的研究热点。果实成熟是植物生命周期中的一个自然生理过程,涉及一系列物理、生理和生化反应[1].在这些反应中,色素沉着导致着色是水果成熟表观程度的天然优良表型标记物,也可作为研究水果成熟和着色调控机制的模型系统[2].花青素被认为是类黄酮化合物,是广泛存在于植物花瓣和果实中的水溶性天然色素。花青素根据液泡的pH值产生红色、蓝色和紫色的色调[3.,4].人们普遍认为,果实中花青素的积累伴随着果实的成熟,并受到发育和环境因素的调控。花青素生物合成的结构基因,属于经典的类黄酮合成途径[5],在许多植物的果实中,如西红柿、樱桃、草莓和苹果,已被鉴定和克隆[6,7,8].此外,先前的研究表明,花青素的生物合成主要受转录因子MYB-bHLH-WD40复合物在转录和翻译后水平的调控[9,10,11].然而,发育和环境因素与这些转录因子之间的联系仍然未知。
众所周知,植物激素还可以通过调节类黄酮生物合成途径相关基因的表达来介导花青素的生物合成。脱落酸(ABA)、乙烯(Eth)和茉莉酸(JA)促进花青素的生物合成,促进果实成熟,而生长素和赤霉素(GA)抑制花青素的产生,从而延缓果实成熟[5,12,13].ABA在植物生长、气孔运动、种子休眠和萌发以及植物对生物和非生物胁迫的响应中起着重要作用[14].这些ABA介导的生理过程主要受到生物活性ABA池大小调控的影响[15,16].ABA的生物合成途径已经通过分子遗传学方法得到了广泛的研究和验证,其关键反应是9-顺-环氧类胡萝卜素双加氧酶(NCED)氧化裂解9-顺-环氧叶黄素生成黄硫素[14],这是一个不可逆反应,是ABA生物合成中的限速步骤。大量研究表明ABA一般都参与了更年期和非更年期果实的成熟调控[2,6,16],其中数控基因起着重要作用[8,15,17,18,19,20.,21,22,23].然而,nced来源的ABA是否参与药用和食用植物花青素介导的果实成熟仍不清楚[24].
枸杞(枸杞(茄科)是一种多年生落叶灌木,生长于中国西北部及地中海地区[25].它的果实——枸杞,在中国作为一种传统草药和珍贵的滋补品已经使用了几个世纪。26].近年来,医学研究表明,这些水果具有许多药理作用,如提高视力、滋补肝肾、降低血糖水平、降低癌症和细胞衰老的风险、提高免疫力[4].人们生活水平的提高和健康意识的增强增加了枸杞的市场需求。此外,人们的消费模式也将逐渐从干果向新鲜水果转变,其他果树的水果也是如此。在枸杞植物的果实成熟时间和果实品质调控不仅是一个基础研究课题,也是一个重要的农艺性状。然而,与其他果树果实的研究相比,对其成熟和着色调控的研究较少枸杞水果仍然稀少[27].
存在着一种自然的变化枸杞因此,这些植物是研究色素代谢的良好材料[28].研究表明,花青素是植物的主要色素枸杞具有成熟黑色(BF)的水果,而类胡萝卜素负责的颜色枸杞成熟后呈红色的水果[27,29].枸杞黄色水果(YF),是另一种天然存在的代表性品种枸杞,据报道所含的类胡萝卜素含量约为RF中类胡萝卜素含量的十分之一[30.],表明花青素和类胡萝卜素共同影响了YF成熟后的颜色。为了通用性,枸杞本研究以BF和YF两种不同颜色的果实为研究对象,研究了果实中花青素生物合成与ABA水平的关系枸杞水果成熟。我们的目的是将发育线索与花青素生物合成中的ABA信号联系起来,并为调控花青素生物合成提供一种可行的策略枸杞果实成熟及品质的实际应用。
结果
ABA与花青素的关系枸杞水果成熟
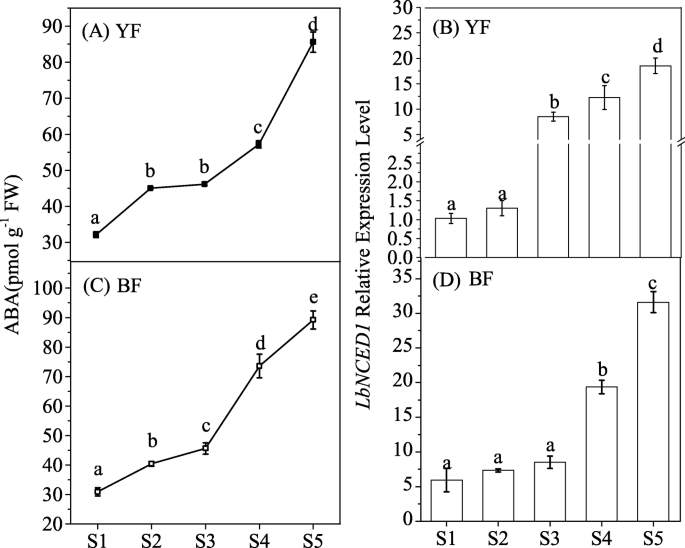
LbNCED1,的同源序列SlNCED1在番茄和StNCED1在马铃薯中,是以前分离出来的枸杞研究方面,枸杞而且枸杞ruthenicum[29,31].因为它们之间的关系LbNCED1的转录量和ABA水平枸杞研究方面是红色的枸杞水果(31],本研究进一步发现了这种关系枸杞还有另外两种重要的颜色YF和BF。结果表明,内源激素ABA的含量和幼苗的生长发育有一定的关系LbNCED1两种颜色果实的基因表达量均随果实成熟而增加。YF中ABA含量由32.17±0.76 pmol·g增加−1FW在S1期为85.57±2.66 pmol·g−1S5期间,BF中ABA含量从30.94±1.36 pmol·g增加−1FW在S1期为89.23±2.88 pmol·g−1S5期间的FW(图;1a、c)。的表达式LbNCED1YF基因从S1期到S5期增加了15.87倍,而BF基因从S1期到S5期增加了4.88倍(图5)。1b, d)。这些结果表明LbNCED1果实发育和成熟过程中ABA的积累具有普遍的作用枸杞水果。
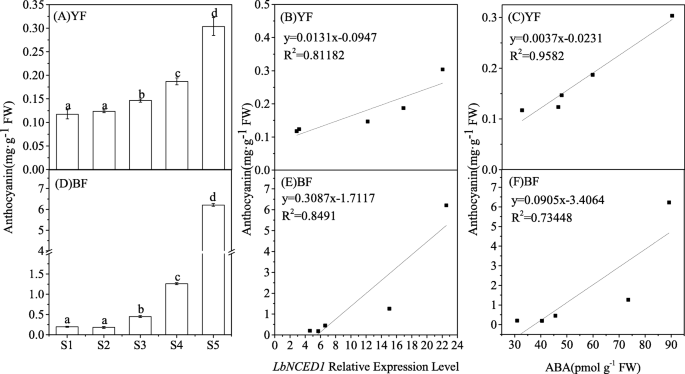
两者中花青素的含量枸杞在果实成熟过程的五个阶段(S1-S5)中,该色素的含量随着果实成熟度的增加而显著增加(图5)。2a, d).对两种果实的动态进行详细分析,发现花青素在S3阶段开始增加,在S5阶段达到峰值。此外,BF的最大花青素含量与YF相差约20倍。结果表明,花青素水平受发育阶段和基因型的影响枸杞水果。在本研究中,花青素的含量与花青素的含量之间进行了线性相关分析LbNCED1基因转录本(图;2b, e)或ABA水平(图。2c, f),结果表明,两种不同果实中花青素与ABA之间存在显著的正线性关系枸杞水果,不论颜色。
外源ABA处理及抑制内源ABA合成对花青素生物合成的影响枸杞水果
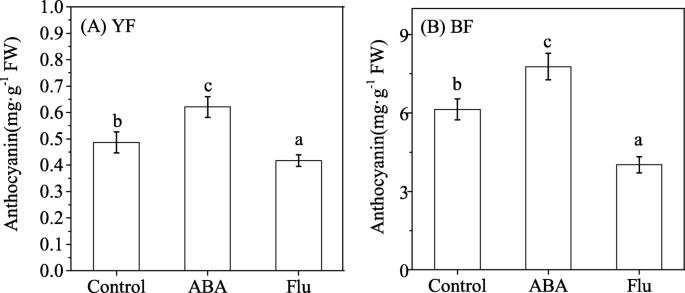
为进一步探讨ABA与花青素的关系,将ABA或其生物合成抑制剂氟里冬(Flu)喷洒在其表面枸杞测定S1期果实的花青素含量。与对照组(0.49±0.04 mg·g−1FW), ABA处理15 d后,YF成熟果实(S5)花青素浓度提高了27.81%(0.62±0.04 mg·g)−1经Flu治疗后FW降低14.09%(0.42±0.04 mg·g)−1弗兰克-威廉姆斯)(无花果。3.a).同样,外源ABA的施用使BF花青素浓度从6.14±0.40 mg·g提高−1FW在S1期为7.77±0.50 mg·g−1FW在S5期增加了26.65%,而Flu使BF花青素浓度降低了34.58%(4.02±0.11 mg·g)−1FW)与对照组比较(图;3.b)。
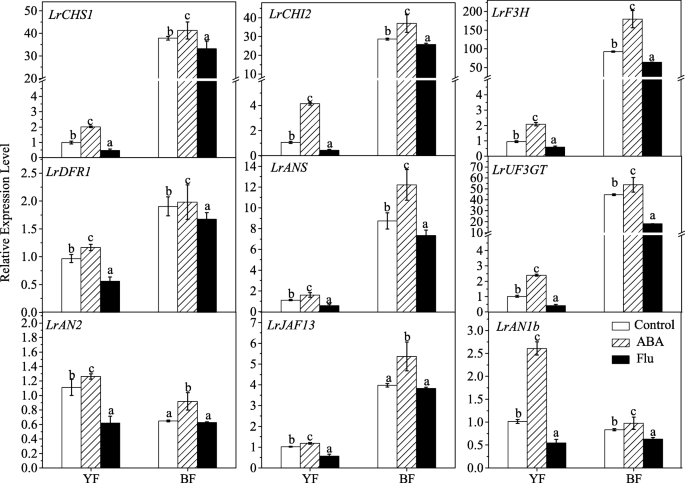
ABA处理显著上调了黄酮生物合成途径中相关结构基因的表达(图2)。4),例如,LrCHS1(查尔酮合成酶1b, KC794742),LrCHI2(查尔酮异构酶,KF031377),LrF3H(黄酮3-羟化酶,KC794744),LrDFR1(dihydroflavonol-4-reductase-like KF031379),伊朗(花青素合成酶,KC794745)LrUF3GT(UDP glucose flavonoids 3- glucosytransferase, KF768073),已从该菌株中分离得到枸杞ruthenicum[27].相比之下,这些基因转录物在流感治疗后显著减少。据报道,花青素的生物合成在转录水平上受到MYB-bHLH-WD40蛋白复合物的调控[5].因此,我们进一步检测了这些已分离的转录因子的转录水平枸杞植物(27].与结构基因的结果相似,ABA的应用也显著上调了调控基因的表达,包括LrAN2(花青素2,KF768075)在R2R3 MYB家族,LrJAF13(KF768076)和LrAN1b(花青素1b, KF768077)在bHLH家族[27],而流感治疗显著下调了这些基因的表达(图。4)。
静音LbNCED1基因抑制枸杞水果的颜色
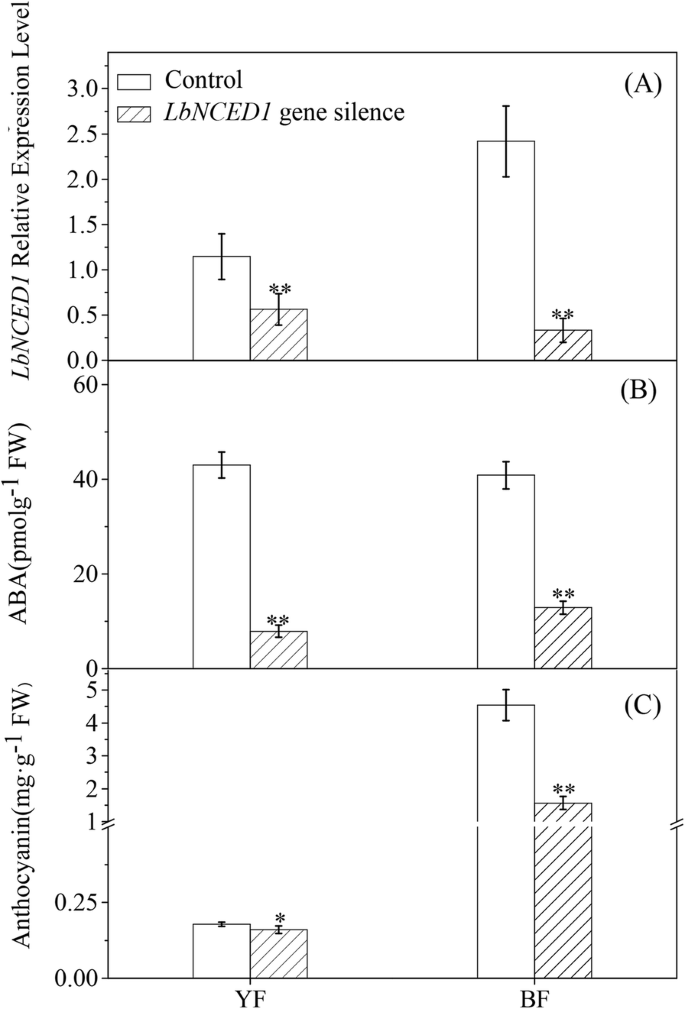
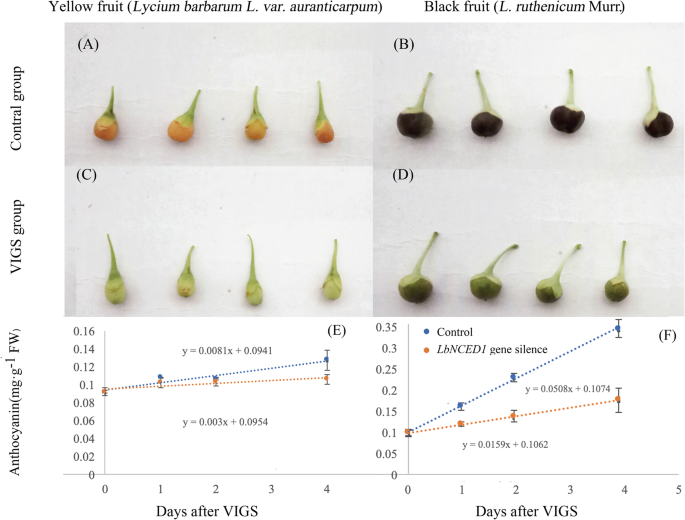
进一步探讨ABA对枸杞在分子遗传水平上,我们构建了病毒诱导基因沉默(VIGS)的果实LbNCED1.表达水平LbNCED1VIGS后YF和BF的阳性率分别仅为对照值的49.12和13.74%。5a).此外,LbNCED1基因沉默使YF和BF果实中ABA含量分别比对照降低了81.65和68.43%(图5)。5b).这些结果表明我们的VIGS构建是可信的,并且LbNCED1基因在这两种类型中被成功沉默枸杞水果。如图所示。5c,LbNCED1基因沉默显著降低YF和BF果实花青素含量,分别降低10.48和65.48%。
对照组果实成熟过程的比较(图;6a, b)与VIGS组(图;6C, d,揭示LbNCED1沉默显著延迟了果实着色。结果表明,无论是YF还是BF,注射4 d后,花青素含量呈直线增长。然而,从第4天到第6天,花青素含量呈指数增长(数据未显示)。因此,采用原4天花青素的变化率作为显色速率(CR, mg·g−1弗兰克-威廉姆斯·d−1)枸杞水果。我们发现LbNCED1基因沉默显著降低了两种果实的CR,其中YF的CR从0.008 mg·g下降−1弗兰克-威廉姆斯·d−1降到0.003毫克·克−1弗兰克-威廉姆斯·d−1(无花果。6e),而BF从0.051 mg·g开始下降−1弗兰克-威廉姆斯·d−1至0.015 mg·g−1弗兰克-威廉姆斯·d−1(无花果。6f)。
静音LbNCED1基因改变花青素生物合成相关基因的表达
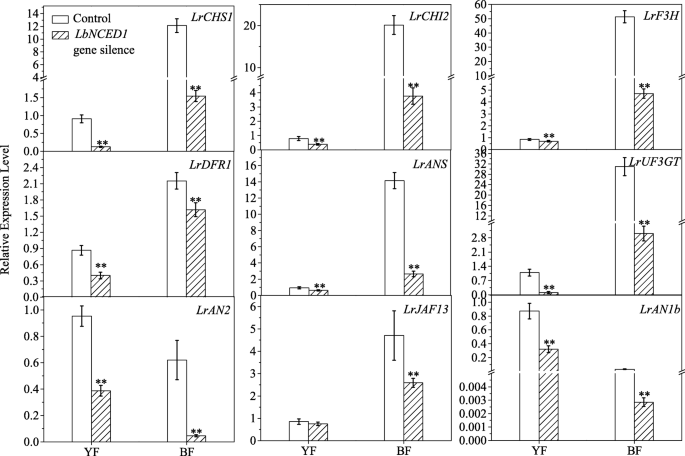
探讨lbnced衍生ABA对花青素合成的影响机制枸杞利用qRT-PCR技术测定了vigs修饰果实中类黄酮生物合成途径相关基因的转录量。LbNCED1沉默显著下调了该通路相关结构基因的表达,如:LrCHS1,LrCHI2, LrF3H,LrDFR1,伊朗,而且LrUF3GT(无花果。7).YF和BF基因转录水平下降幅度分别为17.57 ~ 84.96%和24.86 ~ 90.83%。因此,与YF相比,BF表现出更明显的下降。除了这种遗传变异外,在这些参与黄酮类生物合成途径的结构基因中也观察到对内源性ABA的基因特异性敏感性枸杞水果。
与结构基因相似,LbNCED1沉默也显著下调了调控基因的表达(图。7),包括LrAN2,LrJAF13而且LrAN1b.在YF和BF中,这些基因的水平分别下降了11.47 ~ 63.36%和69.60 ~ 92.45%。此外,转录量与转录因子有关LrAN2, LrJAF13而且LrAN1b下降幅度分别为59.31 ~ 92.45%、11.47 ~ 69.60%、21.07 ~ 90.99%.这些结果表明,这些调节基因的变化趋势与植物中结构基因的变化趋势相似枸杞以下品种LbNCED1沉默和对应他们不同的花青素水平。此外,这些转录因子对内源性ABA的转录应答表现出一定程度的多样性。
讨论
因为肉质水果对传播种子的动物来说变得有吸引力和营养,从未成熟的水果到成熟的水果的转变代表了植物生存策略的巨大转变。1].在果实成熟过程中,次生代谢产物积累,色素之一花青素增加,导致果实着色[6].同样,在果实生长和成熟过程中,ABA水平也会增加[8].在当前的研究中,我们使用枸杞果实为模型,ABA水平与花青素含量呈较强的正相关。这些结果表明,在果实成熟过程中,ABA与花青素的关系在两种果树和蔬菜中都得到了很好的保存,包括更年期果实和非更年期果实。由于RF(作为稳定品种)花青素含量的基线值很低,ABA处理效果不明显(数据未显示)。鉴于RF中的主要色素是类胡萝卜素[27], ABA介导RF中类胡萝卜素生物合成的机制应该在未来得到迫切的解决。
我们的结果表明,花青素水平枸杞果实受发育阶段和基因型的影响。虽然品种间的差异主要是由源区的地理变量(纬度、海拔)决定的,但发育依赖性的差异可能受到内源植物原素的影响[3.,5].在中国,野生BF主要分布在柴达木盆地(青海省境内,平均海拔2700 m),而野生YF主要分布在银川郊区(宁夏回族自治区境内,平均海拔1100 m) [28].相对于低海拔地区,高海拔地区光照强度高,日照时间长,UV-B强,温度低。这些环境因素已被证明有利于花青素的生物合成[5].植物激素在调节果实发育和成熟中起着至关重要的作用,因此在花青素生物合成中具有潜在的影响[3.,5].本研究结果表明枸杞水果在成熟过程中不断上升,然而,其他报告显示在这个过程中没有Eth爆发[30.],表示枸杞果实属于非更年期水果。已知ABA与其他植物激素(如JA、生长素、GA和细胞分裂素)的相互作用可促进或抑制其他水果中花青素的生物合成[5的问题,今后应在枸杞水果。此外,由于果实的成熟通常伴随着衰老,活性氧也与果实成熟有关,不论果实是更年期或非更年期[32].这些小分子是如何与ABA协调和相互作用来控制葡萄的成熟过程的枸杞水果也需要被强调。
NCED一般由一个小基因家族编码[14].在番茄的三个NCED基因中,SlNCED1可能在调节ABA生物合成中发挥重要作用,以响应ABA的施用和果实成熟过程中的脱水[15].沉默VmNCED1,成熟越橘ABA生物合成的关键基因,伴随花青素生物合成关键基因表达下调[24].在本研究中,我们使用VIGS技术沉默ABA生物合成相关基因LbNCED1在枸杞进一步验证果实成熟过程中ABA功能与果实颜色的关系。的LbNCED1- rnai处理的果实与Ji等人报道的结果相似。[15],果实成熟受到抑制,也不能完全着色和软化。基于这一发现,可以得出结论,与对照水果不同,经过vigs修饰的水果没有经历正常的成熟过程。上述所有数据表明LbNCED1基因起着积极的调节作用枸杞通过调节ABA生物合成和花青素积累来促进果实成熟。ABA在分子遗传水平上也与果实颜色调控和色素合成密切相关。
水果已成为研究MYB-bHLH-WD40转录因子复合物调控花青素生物合成的良好系统,如番茄、苹果、甜樱桃、黑莓、草莓和梨等植物[33,34,35,36,37,38].在本研究中,这类转录因子的转录本随着结构基因和花青素含量的变化呈现出类似的变化趋势LbNCED1基因沉默枸杞水果。由此可见,nced衍生的ABA具有转录调控转录因子的作用LbAN2,LbJAF13而且LbAN1b在枸杞这些转录因子激活了花青素生物合成相关基因的表达,促进了花青素的生成。这些aba介导的花青素生物合成途径最近在甜樱桃中得到了验证[34]和苹果植物[21].未来的研究应精确探索哪些通路负责调控不同类黄酮亚通路共同的早期生物合成相关基因,或花青素或原花青素亚通路特有的晚期基因,如中所示拟南芥[37].
花青素和原花青素作为类黄酮化合物,具有很强的抗氧化能力[5].因此,花青素不仅是水果颜色的决定因素,而且是水果质量的标志,特别是对于药用和食用水果。在这种情况下,对果实颜色的调节也对应着对果实品质的调节。众所周知,ABA是一种应激植物激素,其水平可以被环境因素,特别是水分亏缺所精细调节[14].因此,在果实成熟过程中控制水分亏缺可以通过调节内源性ABA稳态来影响花青素的合成和果实质量,这在赤霞珠葡萄中已得到证实[39].此外,人工合成ABA或ABA类似物对果实成熟和品质改良的影响是实践中另一个有前途的方向[17,18],正如作物对干旱胁迫的反应所观察到的那样[40].分子机制枸杞环境因素对果实着色和成熟的调控是今后研究的重点。有趣的是,枸杞果实因其颜色多样性和明显的表型变化,有可能成为中药地草药学研究的潜在模型系统。
结论
本研究构建了aba介导的发育依赖性花青素生物合成和果实着色的模型枸杞水果成熟。在这个模型中,发育线索被转录激活LbNCED1从而促进了植物激素ABA的积累。在这一步之后,通过转录刺激MYB-bHLH-WD40转录因子复合物,上调类黄酮生物合成途径相关结构基因的表达,最终促进花青素的产生和果实着色(图2)。8)。我们的研究结果可能填补了发育信号和转录因子在花青素合成调控中的空白,为提高花青素的营养质量和药用价值提供了有价值的信息枸杞果实通过ABA信号工程。
方法
植物材料
枸杞两种不同颜色的果实,即黑果、黑果、枸杞ruthenicumMurr。该样品由王玉珍首次鉴定,现保存于中国科学院植物研究所植物标本室。沉积号:PE 00672229),黄色果实(黄果,枸杞。该标本由程坤峰首次鉴定,现保存于中国科学院植物研究所植物标本室。沉积号:PE 00031412),分别采自枸杞(枸杞)中国宁夏回族自治区农林科学院宁夏种质资源库(北纬38°380,东经106°090,海拔1100 m)。我们的实地研究是根据当地法例和适当的许可进行的。
如Zeng等人所述,为了分析果实的成熟动态,果实在自然状态下的五个成熟阶段(S1-S5)取样。[27],只做了一些小改动。将成熟过程详细划分为两个品种的未成熟青果期(开花后S1、9 d);YF为淡黄色果期,BF为淡粉色果期(S2, 14 DAA);两个品种的连续成熟果期(S3, 20 DAA);两个品种果实色素加深的阶段(S4, 30 DAA);成熟期为BF成熟果实呈黑色,YF成熟果实呈黄色(S5, 34 DAA)。所有水果样本在收获后立即在液氮中冷冻,并在−80°C保存,直到进一步分析。
外源性激素和激素抑制剂治疗
为了避免强烈的蒸腾作用,处理在晚上之前进行。在未成熟的健康果实(S1期)表面喷施50 mg·L的ABA−1)或ABA生物合成抑制剂氟酮(Flu, 50 μM),对照组喷ddH2O(含0.05% Tween 20)。试剂用ddH稀释2O含量0.05% Tween 20,确保增加叶片表面附着力。我们的实验设计基于随机完全块设计(RCBD)。每个处理确保3棵生长条件相似的树,每个品种总共需要9棵树。根据果实的多少,对整棵树或一棵树内的部分树枝进行喷洒。为每一个枸杞品种,每棵树至少喷洒200个健康果实,以确保果实100%浸透,并确保果实无病虫害和机械损伤。每个品种每次处理至少包括600个健康果实。果实在喷洒后15 d取样,立即在液氮中冷冻,并在−80°C保存,直到进一步分析。
病毒诱导基因沉默(VIGS)载体构建
的LbNCED1(KF957694.1)基因从NCBI数据库中筛选。CDS的序列LbNCED用引物5 ' -CGACGACAAGACCCT-ATGGCCACTTCTTCTCCTGCTAC-3 '和5 ' -GAGGAGAAGAGCCCT-TTAGGCCTGATTTGCCAAGTCTT-3 '扩增基因。PCR产物用TIANquick Midi纯化试剂盒(DP204, TianGen, Beijing, China)进行纯化。将共50 ng的纯化PCR产物放入含有5 mM dATP和0.1 M二硫苏糖醇的10× T4 DNA聚合酶缓冲液中,在22℃下处理30 min,然后在75℃下灭活20 min。TRV2-LIC载体然后用PstI消化,用T4 DNA聚合酶进行类似处理,除了使用dTTP而不是dATP。处理后的PCR产物与载体等体积混合,22℃孵育10 min,进行结扎。然后将10 μL的混合物转化成大肠杆菌DH5α活性细胞。采用引物5 ' -ATGGCCACTTCTTCTCCTGCTAC-3 '和5 ' -TTAGGCCTGATTTGCCAAGTCTT-3 '进行PCR扩增。对阳性克隆的质粒进行纯化和测序。
VIGS沉默载体表达
对于VIGS TRV1 [41], TRV2, TRV2- lic或其衍生物被引入根癌土壤杆菌对GV3101进行热休克应变。为了筛选TRV2-LIC集合,在28°C下,在适当的抗生素(50 mg·L)的存在下培养25 ml过夜培养物−1利福平50 mg·L−1卡那霉素)。第二天,将培养物离心,细胞重悬于浸润培养基(10 mM MES, 10 mM MgCl)中2200 μM乙酰丁香酮)。的OD600调至1.0,室温孵育3~4 h。随后,将pTRV1和pTRV2(或pTRV2- lic)溶液按1:1的比例混合注射。
按照Dong等人的描述进行注射[42],只做了一些小改动。简单地说,用1ml注射器将未成熟的果实(S1期)注射到果实生长点(位于果实尾部)。注射量取决于农杆菌溶液在果实中的扩散程度,注射成功的果实色泽鲜艳,易于区分。注入空载体作为对照。每种载体被注射到每个品种的至少三棵树的果实中,每棵树至少200个健康果实。在注射后6 d内测定水果颜色变化的比例,6 d后采集样品。所有水果样品在收获后立即在液氮中冷冻,并在−80°C保存,直至进一步分析。
ABA提取与测定
根据Fan等描述的方法从果实中提取内源ABA。[43],只做了一些小改动。简单地说,0.2 g水果样品用1 mL预冷的80%甲醇萃取液(含200 mg·L)充分研磨−12,6-二叔丁基对甲酚,500 mg·L−1一水合柠檬酸)。4℃浸出过夜后,以10000 rpm、4℃离心15 min,上清重复上述步骤。然后将两次处理的上清液混合,用可见氮气鼓风机(KD200, ALLSHENG, China)将研磨好的水果浓缩并干燥。最后,在干粉中加入0.8 mL预冷的80%甲醇,用涡流振捣器混合,得到ABA粗提物。
根据制造商的说明,使用phytodetector Immunoassay Kit (PDK 09347/0096, Agdia, USA)测定ABA。首先,将ABA粗提物用TBS缓冲液稀释11倍(ABA粗提物与TBS缓冲液体积比1:10)。将抗体标记板在室温下预置15 min后,加入100 μL的溶液。迅速加入等体积稀释的示踪剂,然后将平板混合均匀,在4°C下孵育3小时。孵育后,将微孔板中的反应溶液迅速倒出。滤纸吸干(确保无液体残留)后,用1× PBST冲洗微孔2次30 s,在微孔中加入200 μL底物反应液(新鲜配制,使用前充分混合),37℃浸泡1 h。注意,这个过程应该在黑暗中进行。测量405nm处的吸光度,并根据标准曲线计算ABA浓度。
花青素的决心
果粉迅速称量(0.2 g),放入1.5 ml离心管中。加入1 mL花青素提取液(1%盐酸加甲醇),摇匀后置于4℃冰箱中提取一夜(16 h以上)[44].在2500×g离心10 min后,将400 μL上清液转移到另一个1.5 ml离心管中,加入400 μL氯仿和dH2O被添加。在2500×g离心10分钟后,取600 μL上清液移至另一1.5 ml离心管中,使用Microplate Reader (Spectra Max M2, Molecular Devices, USA)测量530 nm处的吸光度值。以cyanidin-3-glucoside (626B021, Solarbio, China)为标准,按标准曲线计算花青素浓度。对每个品种和每个处理进行3个生物重复试验。
水果着色率的测定
分别在注射后0、1、2、4、6 d测定果实花青素水平的变化。果实显色率报告为毫克花青素(mg)每克鲜重水果(g−1FW)每天(d−1)。
定量反转录pcr (qRT-PCR)
使用RNA制备纯植物试剂盒(DP432,天根,北京,中国)从样品中提取总RNA,并根据制造商的说明使用禁食cDNA第一链合成试剂盒(天根,北京,中国)通过反转录合成cDNA。相对基因表达测定中,管家基因β-actin [45]被用作内部控制,因为假设该基因在枸杞[27].根据制造商的建议,使用BioRad CFX96实时PCR检测系统(美国)和qRT-PCR试剂盒(天根,北京,中国)进行qRT-PCR过程。每个20 μL反应含有10 μL 2x SuperReal Color PreMix (SYBR Green), 0.8 μL正向引物(10 μM), 0.8 μL反向引物(10 μL), 1.5 μL cDNA模板(20 ng)和6.9 μL H2O.设计并测试了qRT-PCR的以下三步分析条件:一个95°C/15 min的循环,然后是40个95°C/10 s、55°C/30 s和72°C/32 s的循环。数据分析采用2——ΔΔCt方法(46].相对表达量用三个重复的均值±SDs表示。
qRT-PCR所用引物如下:Actin1- f, GGAAACATAGTGCTCAGTGGTG;Actin1 -R, GCTGAGGGAAGCCAAGATAG;LbNCED1 -F GCAGCAGCAATGGCTTTAGALbNCED1 -R, GGTGACCGGAAGTGATTGAGT;伊朗- - - - - -F, GATCCACCTCGATTCCCACC;而且伊朗- - - - - -R, TGTTCATCCTTTTTGGCGGC。结构基因的引物LrCHS1,LrCHI2,LrF3H,LrUF3GT而且LrDFR1对于转录因子LrAN2,LrJAF13,LrAN1b如Zeng等人所描述的那样设计。[27].
统计分析
采用邓肯多范围检验(IBM SPSS Statistics 19.0)进行统计分析,以评估两个样本之间差异的显著性。方法之间的差异被认为是显著的P方差分析得到的-value值小于0.05。采用t检验(“*”表示p值< 0.05;**表示p值< 0.01)。采用Pearson相关系数评价外源ABA水平、花青素水平与花青素含量之间的关系LbNCED1果实成熟时转录本丰富。柱状图和折线图使用Origin 9.0绘制。
数据和材料的可用性
支持本文结果的数据集包含在本文中。
伦理批准并同意参与。
水果样本的采集得到了中国宁夏农林科学院的同意。收集这些样本不需要其他权限。
缩写
- 阿坝:
-
脱落酸
- 一个:
-
花青素
- 答:
-
花青素合成酶
- 气:
-
查耳酮异构酶
- CHS:
-
查耳酮合酶
- DFR:
-
Dihydroflavonol-4-reductase-like
- F3H:
-
黄烷酮3-hydroxylase
- nc:
-
9-cis-epoxycarotenoid加双氧酶
- 存在:
-
定量逆转录pcr
- UF3GT:
-
udp -葡萄糖类黄酮3-葡萄糖转移酶
- 中收取:
-
病毒引起的基因沉默
参考文献
- 1.
王晓明,王晓明,王晓明,王晓明。果实成熟表观基因组与转录动力学的研究进展。植物学报。2017;68:61-84。
- 2.
贾华,九松,张超,王超,Tariq P,刘忠,等。脱落酸和蔗糖通过脱落酸胁迫成熟转录因子调控番茄和草莓果实的成熟。中国生物工程学报,2016;14(2):344 - 344。
- 3.
黄志刚,李志刚。生殖器官花青素合成调控的研究进展。植物科学进展(英文版);2011;
- 4.
何卓,阿志兰,唐世峰,林明敏。花青素和花青素:有色色素作为食品、医药成分,以及潜在的健康益处。食品营养法令2017;61:1361779。
- 5.
水果花青素生物合成调控的新认识。植物科学进展,2013;18:477-83。
- 6.
贾海峰,柴玉明,李春林,陆东,罗俊杰,秦玲,等。脱落酸在草莓果实成熟过程中起着重要的调控作用。植物学报。2011;157:188-99。
- 7.
Rafique MZ, Carvalho E, Stracke R, Palmieri L, Herrera L, Feller A,等。黄树莓花青素合成酶基因无义突变控制色素沉着(悬钩子属植物idaeusl .)。前沿植物学报2016;7:1892-904。
- 8.
Teribia N, Tijero V, Munne-Bosch S.在甜樱桃的自然发育和成熟过程中,糖和花青素含量的变化与激素的关系。新生物技术,2016;33:824-33。
- 9.
Oglesby L, Ananga A, Obuya J, Ochieng J, Cebert E, Tsolova V. MYB转录因子MybA1和MYBCS1表达对muscadine果实皮花青素积累的影响抗氧化剂(巴塞尔)。2016; 5:35。
- 10.
翟锐,王震,张松,孟G,宋林,王震,等。两个MYB转录因子调节梨果实(Pyrus bretschneideri Rehd.)中类黄酮的生物合成。中国科学(d辑),2016;
- 11.
陆勇,卜勇,郝松,王勇,张娟,田娟,等。myb影响果皮和果肉中花青素和黄烷醇比例的变化,以响应遮荫。中国生物工程学报(自然科学版),2017;
- 12.
Murcia G, Fontana A, Pontin M, Baraldi R, Bertazza G, Piccoli PN。ABA和GA3调节与缓解葡萄生物和非生物胁迫有关的初级和次级代谢产物的合成。Phytochem。2016;135:34-52。
- 13.
Olivares D, Contreras C, Munoz V, Rivera S, Gonzalez-Aguero M, Retamales J,等。脱落酸和蔗糖处理“深红无籽”葡萄颜色发育、花青素和色素相关基因表达的关系中国生物医学工程学报,2017;
- 14.
脱落酸的合成和反应。拟南芥之书。2013;11:e0166。https://doi.org/10.1199/tab.0166.
- 15.
季凯,凯伟,赵波,孙勇,袁波,戴松,等。SINCED1和SICYP07A2:参与番茄果实成熟过程中ABA代谢的关键基因。中国科学(d辑),2014;
- 16.
廖旭,李敏,刘波,闫敏,于旭,紫红,刘荣,Yamamuro C. ABA分解代谢和生物合成调控环对林地草莓果实生长和成熟的调控作用。中国科学院学报(自然科学版),2018;
- 17.
Tijero V, Teribia N, Munoz P, Munne-Bosch S.脱落酸对甜樱桃成熟和品质的影响:收获前和收获后的差异影响。前沿植物学报2016;7:602-17。
- 18.
Miret JA, Munne-Bosch S. aba和pyrabactin能提高树莓中维生素c的含量。食品化学,2016;203:216-23。
- 19.
Symons GM, Chua YJ, Ross JJ, Quittenden LJ, Davies NW, Reid JB。草莓非更年期成熟过程中激素的变化。中国科学(d辑),2012;
- 20.
villaloos - gonzalez L, Pena-Neira A, Ibanez F, Pastenes C. ABA对葡萄莓苯丙烷途径的长期影响:基因表达和代谢物含量。植物物理与生物化学,2016;
- 21.
安建平,姚建峰,徐瑞仁,游彩霞,王晓峰,郝玉军。苹果bZIP转录因子MdbZIP44调控脱落酸促进花青素积累。植物细胞环境学报,2018;41:2678-92。
- 22.
吴高清,余锦江,钟文文,谢淑娟,李海杰。脱落酸刺激花青素积累在'泽西'高丛蓝莓果实成熟期间。食品化学,2018;244:403-7。
- 23.
张勇,李强,姜林,凯伟,梁波,王杰,等。抑制2C型蛋白磷酸酶改变番茄果实成熟和胁迫反应。植物细胞物理学报,2018;59:142-54。
- 24.
Karppinen K, Tegelberg P, Haggman H, Jaakola L.脱落酸调控成熟越橘花青素生物合成及细胞壁修饰相关基因表达(Vaccinium myrtillusl .)水果。植物科学,2018;9:1259。
- 25.
赵娟,李辉,席伟,安伟,牛玲,曹颖,王辉,王颖,尹颖。枸杞中糖和有机酸的变化(枸杞l)果实在发育和成熟期间。食品化学,2015;173:718-24。
- 26.
Potterat O. Goji (枸杞而且l .摘要):从传统用途和最近流行的角度来看,植物化学、药理学和安全性。植物医学杂志。2010;76:7-19。
- 27.
曾硕,吴敏,邹超,刘旭,沈霞,Hayward A,等。两种枸杞果实发育过程中花青素生物合成的比较分析。中国生物医学工程学报。2014;
- 28.
姚锐,海因里希M,韦克尔CS。属枸杞作为食物和药物:植物学,民族植物学和历史回顾。《中华民族药典》2018;212:50-66。
- 29.
刘勇,曾松,孙伟,吴明,胡伟,沈霞,等。两种枸杞类胡萝卜素积累的比较分析(枸杞l .,l . ruthenicumMurr)。水果。BMC植物生物学,2014;14:269。doi: 10.1186。
- 30.
米娟,卢琳,戴刚,何霞,李霞,闫燕,等。枸杞肤色与类胡萝卜素含量的相关性研究。食品科学,2018;39:81-6。
- 31.
田霞,季军,王刚,金成,管成,吴东,李哲。参与枸杞果实成熟和非生物胁迫响应的9-顺式环氧类胡萝卜素双加氧酶基因1的克隆与表达分析。中国植物学报。2015;34(4):366 - 366。
- 32.
盖普NE,麦奎因RP,乔凡诺尼JJ。果实成熟的分子和遗传调控。中国生物医学工程学报,2013;
- 33.
Schaart JG, Dubos C, Romero De La Fuente I, van Houwelingen AM, De Vos RC, Jonker HH,等。控制草莓原花青素合成的MYB-bHLH-WD40调控复合物的鉴定与鉴定。新植物,2012;197:454-67。
- 34.
谢欣,李松,张荣,赵娟,陈勇,赵强,等。bHLH转录因子MdbHLH3在低温下促进苹果花青素积累和果实着色。植物生态学报。2012;35:1884-97。
- 35.
夏妮D,林旺K, Espley RV, Volz RK, How NM, Rouse S,等。一种古老的苹果MYB转录因子复制导致了新的红色果肉表型。中国生物医学工程学报,2013;
- 36.
沈旭,赵凯,刘林,张凯,袁宏,廖旭,等。PacMYBA在aba调控红樱桃花青素生物合成中的作用。邓宏(李属鸟结核l .)。中国生物医学工程学报。2014;
- 37.
Chezem WR, Clay NK。myb和bHLHs对植物次生代谢和相关特化细胞发育的调控植物化学。2016;131:26-43。
- 38.
高原,刘杰,陈勇,唐辉,王勇,何勇,等。番茄SlAN11通过与bHLH蛋白相互作用调控类黄酮生物合成和种子休眠,而不与MYB蛋白相互作用。Hortic Res. 2018;5:27。
- 39.
Caceres-Mella A, Talaverano MI, villaloos - gonzalez L, Ribalta-Pizarro C, Pastenes C.成熟过程中水分亏缺对赤霞珠葡萄皮原花青素合成、浓度和组成的影响。中国生物医学工程学报,2017;17(4):344 - 344。
- 40.
曹明杰,张玉良,刘旭,黄红,周晓霞,王文良,等。结合化学和遗传方法来提高植物的抗旱性。Nat Commun. 2017; 8:1183-95。
- 41.
刘勇,薛夫,马兰瑟,Dinesh-Kumar SP.烟草Rar1、EDS1和NPR1/NIM1样基因在烟草花叶病毒n介导抗性中的作用。植物学报,2002;30:415-29。
- 42.
董杨,Burchsmith TM,刘杨,Mamillapalli P, Dineshkumar SP.烟草拨浪鼓病毒诱导基因沉默的非结扎克隆载体鉴定nbmads1 -1和−2在花发育中的作用。植物科学进展。2007;
- 43.
范伟,赵敏,李松,薛波,贾林,孟H,等。对比玉米幼苗叶片和根系中PYR1/PYL ABA受体对ABA或脱水胁迫的转录响应。BMC Plant biology, 2016; 6:99-112。
- 44.
庞勇,Peel GJ, Sharma SB,唐勇,Dixon RA。一种转录谱分析方法揭示了一种表儿茶素特异性糖基转移酶在切花苜蓿种皮中表达。中国科学院学报(自然科学版),2008;
- 45.
吴东,季军,王刚,管成,金昌。枸杞乙烯响应转录因子LchERF在转基因烟草中的应用。植物细胞,2014;33:2033-45。
- 46.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相关基因表达数据。方法。2001;25:402-8。
致谢
我们感谢清华大学的Yule Liu教授慷慨地提供pTRV1和pTRV2载体。我们也感谢宁夏大学任晨教授提供的光盘序列伊朗基因。
资金
本课题由国家高新技术研发计划(863计划,2013AA102606-04)资助YC,国家自然科学基金(31660220)资助JZ,宁夏枸杞新品种农业选育项目(2013NYYZ0101)资助WA,宁夏农林科学院自主选择基金(NKYJ-18-16)资助JZ。资助机构在研究设计、数据收集、分析和解释以及撰写手稿方面没有任何作用。
作者信息
从属关系
贡献
YC, ZM和JZ设计了研究。GL、JZ和BQ进行实验。GL和BQ进行数据分析。WA和YY进行现场管理工作。ZM, GL和YC撰写了手稿。所有作者都已阅读并批准了手稿。
相应的作者
道德声明
发表同意书
不适用。
相互竞争的利益
作者宣称他们之间没有利益冲突。
额外的信息
出版商的注意
施普林格自然对出版的地图和机构从属关系中的管辖权主张保持中立。
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
李,G.,赵,J.,秦,B。et al。ABA介导发育依赖性花青素生物合成和果实着色枸杞植物。BMC植物生物学19日,317(2019)。https://doi.org/10.1186/s12870-019-1931-7
收到了:
接受:
发表:
关键字
- 枸杞
- 水果成熟
- 花青素
- 阿坝
- 中收取