抽象的
背景
与年度草本植物相比,木质多年生植物需要更长的少年阶段到开花,并且许多特征可以在成年期仅表达,这严重使得新品种的育种效率较慢。对于杨树早花期的研究,主要集中在研究上拟南芥同系物的基因有限公司/FT..基于研究拟南芥近年来,NF-Y亚基调控花期的研究取得了一些重要进展。然而,关于NF-Y调节在杨树中的功能毫无熟知的。
结果
在目前的研究中,我们已经确定PtNF-YB并着重介绍了杨树家族成员的功能PtNF-YB1利用转基因调控花期拟南芥和番茄。要了解这种机制,三种已知的开花基因的表达水平(有限公司,FT.和SOC1)用RT-PCR检查转基因拟南芥.我们使用Y2H和BiFC检测PtNF-YB1和PtCO (PtCO1和PtCO2)蛋白之间的相互作用。最后,潜在的分子机制模型PtNF-YB1讨论了在调节杨树的开花中发挥作用。
结论
在本研究中,我们对杨树进行了表征NF-YB.并证实了基因家族的功能PtNF-YB1调节开花时间。与此同时,我们发现PtNF-YB1改善早花可以克服物种障碍。所以,PtNF-YB1可作为一种潜在的候选基因,通过对杨树和其他作物的遗传转化,促进其早花。
背景
与一年生草本植物相比,木本多年生植物需要较长的幼年期才能进入花期,许多性状只能在成年期才能表达,这将严重影响木本植物的育种效率。以杨树为例,它的幼年期一般持续7到10年,然后开始开花[1,2,3.,4].在达到生殖生长期之前,选择效率是有限的,因为无法为旨在提高效率,质量和稳健性的繁殖遗传开发关系的植物材料。
促进树木提早开花,缩短幼嫩期,可有效缩短传统杂交周期,加快育种进程,提高育种效率[5].因此,对植物早花诱导机制的研究不仅是促进林业科学发展的需要,也是了解植物有性生殖分子机制的关键。然而,有关杨树诱导花的生理和遗传因素的研究还很少。
NF-Y(核因子Y)转录因子是与基因启动子上游的CCAAT盒结合以调节基因转录,并且存在于几乎所有真核基因组中,调节许多基因的表达[6,7,8].在哺乳动物和植物中,NF-Y是由三个亚基组成的异三聚体:NF-YA (HAP2/CBF-A)、NF-YB (HAP3/CBF-B)和NF-YC (HAP5/CBF-C),这是形成NF-Y- dna复合体所必需的;而在酵母中,该复合物包括4个亚基:HAP2、HAP3、ha4和ha5 [9].在酵母和哺乳动物中,每个NF-Y亚基由单个基因编码;但在植物中,它由多种基因编码,编码单个亚基的基因数量也与物种不同。例如,在拟南芥,有10个基因编码NF-YA亚基,编码NF-YB亚基的13个基因,以及编码NF-YC亚基的13个基因。但在水稻中,编码每个NF-Y亚基的基因分别为10,11和7 [10.].相对于对酵母和哺乳动物中的NF-Y亚基和它们的复合物的函数的详细和广泛研究,关于它们在植物中的生物学功能几乎是知之甚少。
近年来的研究表明,植物中单个NF-Y亚基参与了许多重要的生长过程,特别是胚胎发生[11.,12.[种子成熟[13.,14.,15.,叶绿体合成[16.,17.,18.]组织划分[19.和其他过程。同时,NF-Y亚基在逆境响应中也起着重要作用,如干旱胁迫[20.,21.,22.,23.,24.,25.].值得注意的是,越来越多的研究发现NF-Y亚基参与了开花感应途径的光/周期调节,并且不同的亚基函数不同[26.,27.,28.,29.,30.,31.,32.,33.,34.].例如,Cai等人。发现了ATNF-YB2.通过增加开花关键基因开花轨迹T(FT)和过度表达的抑制剂的表达来促进开花过程(SOC1)[27.].同时,ATNF-YB2和ATNF-YB3可以与AT-NF-YC3,4,9相互作用,其在通过光周期途径控制开花时间中起重要作用[33.].此外,Hackenberg等人。证明了ATNF-YC1.和ATNF-YC2.过表达诱导早熟开花,而转录水平FT.植物中的基因显着增加[30.].有趣的是,NF-Y对水稻开花时间的调控正好相反拟南芥.转录因子NF-YB11通过下调开花相关基因的表达负调控开花时间[35.,36.,37.].这也说明了NF-Y对开花时间的调控机制在不同物种中存在差异。
基于研究拟南芥,水稻和其他植物物种,采用NF-Y亚基的开花时间调节并揭示分子机制的一些重要研究进展。然而,关于NF-Y调节在杨树中的功能毫无熟知的。在本研究中,我们对杨树进行了表征NF-YB.并证实了基因家族的功能NF-YB1(PtNF-YB1)利用转基因调控花期拟南芥和番茄。最后,建立了潜在的分子机理模型PtNF-YB1讨论了参与开花监管。
结果与讨论
杨树PtNF-YBs的鉴定
为了鉴定杨树PtNF-YB蛋白类似物,对PtNF-YB蛋白的氨基酸序列进行了分析拟南芥和水稻NF-YBs序列在Phytozome数据库中进行检索Populus Trichocarpa.v3.0(https://phytozome.jgi.doe.gov/pz/portal.html).根据NF-YBs的命名拟南芥和米饭,基因被命名如下(表1).
确定PtNF-YB杨树基因编码的蛋白质长度为143 ~ 295个氨基酸,平均192个氨基酸。详细资料:PtNF-YB杨树中的家庭基因,包括序列ID,染色体位置,氨基酸长度(AA),蛋白质等电点(PI)值和蛋白质分子量(MW)(DA)列于表中1.
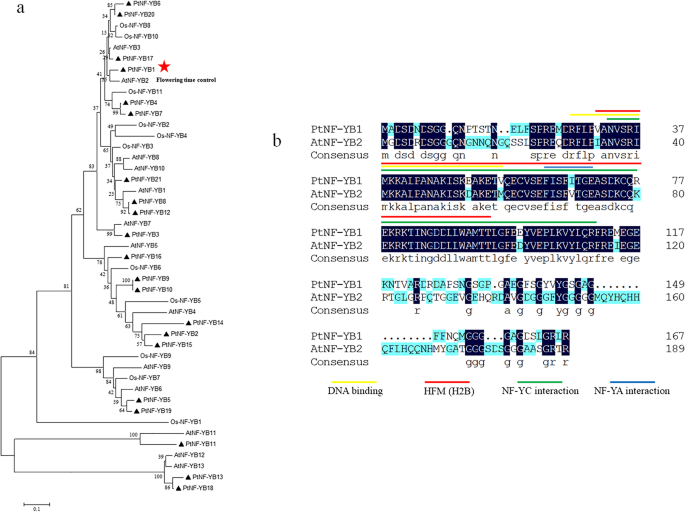
为了研究杨树中NF-YBs蛋白之间的系统发育关系,我们对杨树中NF-YBs蛋白全长序列进行比对,构建了一棵无根树(附加文件1a).采用MEGA V5.5基因Neighbor-Joining (NJ)构建系统发育树。系统进化树显示,PtNF-YBs家族蛋白分为两个不同的亚群。
为了更好地理解PtNF-YBs的功能预测,我们使用MEME V4.12.0(附加文件1b)。如预期的那样,我们发现系统发育树的大多数紧密相关成员共享一个共同的基序组合物,表明在同一亚家族中的NF-YBS蛋白之间存在明显的功能相似性。
PTNF-YB1推导氨基酸序列分析
为了研究进化关系,使用来自杨树的推导的氨基酸序列进行系统发育分析,拟南芥以21个PtNF-YBs、13个AtNF-YBs和11个OsNF-YBs的编码序列为基础,对其进行了分析。1a).当与拟南芥和米饭NF-ybs,它表明了这一点PtNF-YB1形成一个紧密的簇ATNF-YB2.,这与花期有关[27.,38.] (图。1一个)。PtNF-YB1基因编码具有167个氨基酸残基的预测多肽,蛋白质分子量(MW)为18,193.2Da,蛋白质等电点(PI)值为5.04(表1).就像拟南芥AtNF-YB2,氨基酸序列比对表明,杨树PtNF-YB1包含DNA结合域、NF-YC相互作用域和NF-YA相互作用域[39.,40,41.].核心组蛋白H2B的组蛋白折叠基元(HFM)也在PtNF-YB1中被观察到[42.] (图。1b)。
时间和空间表达模式PtNF-YB1基因
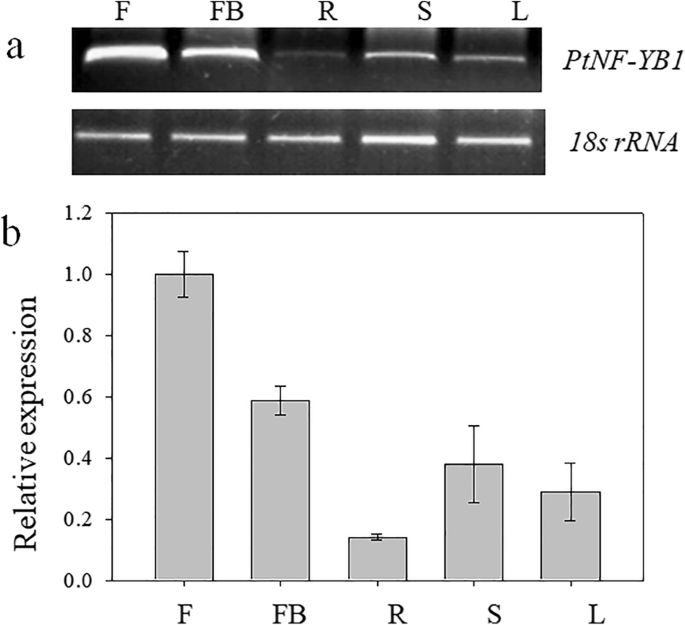
识别时间和空间表达式模式PtNF-YB1进行基因,进行半定量RT-PCR.结果表明PtNF-YB1在5种组织中,开花(F)、胚芽(FB)、根(R)、茎(S)和叶(L)均有表达。在5种组织中,开花(F)和胚芽(FB)产生较高的PtNF-YB1转录本中,根(R)生成最低水平(图。2a).同时进行qRT-PCR验证结果。结果与半定量rt - pcr的趋势相似。2b)。这表明这一点PtNF-YB1可能是开花途径调节的一部分,就像ATNF-YB2.[25.,39.].
异位表达PtNF-YB1提高转基因的早花性拟南芥
确定杨树的效果PtNF-YB1对开花时间进行基因分析PtNF-YB1过度表达的转基因拟南芥植物。因此,获得了超过10种独立的转基因系。其中,使用6个独立线进行进一步分析(图。3.一个)。T2 generation per line ware grown in the long day conditions (LD, 16 h light/8 h dark) and their phenotypes were examined. The transgenic拟南芥线(A2和A4)比野生型(COL)显着开花(图。3.b,附加文件2).例如,PtNF-YB1转基因线-A4与7.1玫瑰花叶和3.4甘氨酸叶子开花,野生型(Col)与12.5玫瑰花叶和5.1尾叶(附加文件)开花2).结果表明PtNF-YB1异位表达明显改善转基因的早期开花拟南芥.
PtNF-YB1异位表达验证了其促进番茄早花的作用
验证PtNF-YB1促进早期开花的功能,我们也产生了PtNF-YB1-Overexpressing转基因番茄。我们获得了8根独立的转基因系,5种独立线用于进一步分析(图。4a). T2代在苗圃土盆和温室条件下,白天(25°C)和夜间(20°C)生长。的PtNF-YB1- 在相同生长环境下,大表达番茄素(T3和T4)也比野生型(WT)植物显着提前开花(图。4b)。例如,PtNF-YB1转基因线-T4在移植后50天开花,而野生型(WT)植物在移植后65天开花。过度表达PtNF-YB1促进转基因番茄早花,表明其促进早花的能力可以跨越物种障碍。因此,杨树PtNF-YB1可以作为改善通过遗传转化改善杨树和其他作物的早期开花的潜在候选基因。
转基因植物开花途径基因的调控拟南芥以及潜在的分子机理模型PtNF-YB1表达可促进杨树早花
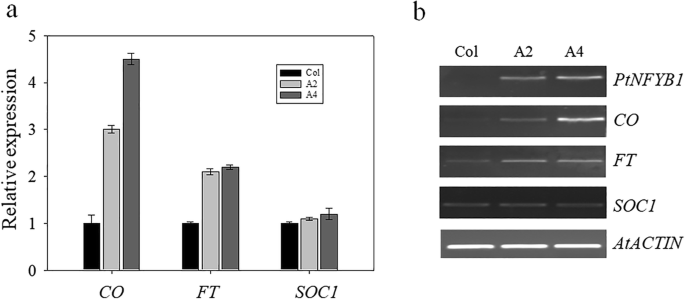
如何PtNF-YB1调节杨树早期开花的机制?要了解这种机制,表达水平拟南芥三个已知的开花基因(有限公司,FT.和SOC1)对野生型(Col)和转基因植物(A2、A4)进行RT-PCR检测(图1)。5).其中2个基因表达上调,包括拟南芥概念(有限公司) 和FT..CO是光周期依赖性开花时间的关键调节器拟南芥[43.].FT部分作用于CO的下游,促进植物开花[44.,45.].的SOC1基因在野生型(Col)和转基因植物之间没有差异。的SOC1基因是一种疯狂的转录因子,Photopheriod途径中的关键积分器[46.].这个结果与以前的研究结果一致[38.].
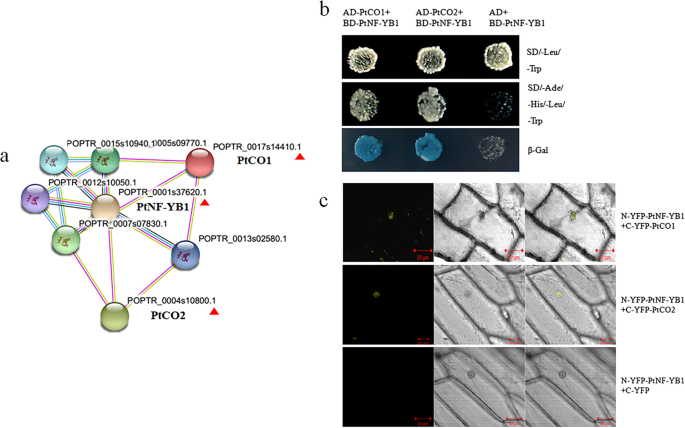
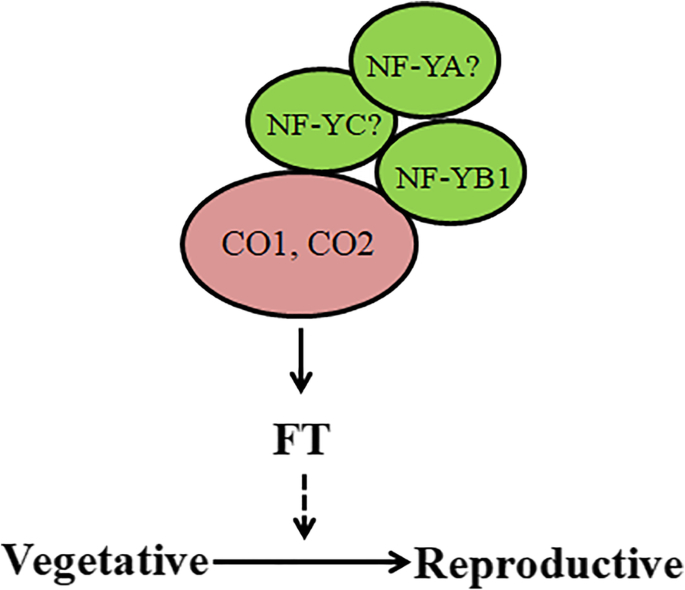
对于杨树早花期的研究,主要集中在研究上拟南芥同源基因CO/FT [1,2,47.,48.,49.].通过模型植物的研究拟南芥,表明AtNF-YB2和AtCO相互作用调节FT,促进早熟开花[27.,38.].在poplar中,两个CO-like基因PTCO1(POPTR0017S14410.1)和PTCO2(POPTR0004S10800.1)是ATCO最近的结构直播(AT5G15840)(附加文件3.).蛋白质串相互作用表明pTNF-YB1和PTCO(PTCO1和PTCO2)在杨树中的可能链接(图。6a).我们使用Y2H和BiFC检测验证了杨树PtNF-YB1和PtCO (PtCO1和PtCO2)蛋白之间相互作用的假设(图2)。6b、c)。PtNF-YB1促进开花可能是通过与PtCO1和PtCO2蛋白相互作用实现的(图5)。7).我们也生成了PtNF-YB1过度表达的转基因杨树。到目前为止,转基因杨树没有显示预期的早期开花(附加文件4).可能至少有三个原因可以解释这一现象:(i)表观遗传机制。先前的证据支持NF-Y转录因子是控制开花的表观遗传标记的重要调节因子[50,51,52,53].(ii)木本多年生植物开花开始的多年延迟。(iii) PtNF-YA/PtNF-YC是否参与PtNF-Y复合物的形成以调控杨树开花。我们未来的工作需要通过表观遗传学和蛋白质组学来分析这些问题。
总之,为了阐明NF-Y转录因子在杨树开花诱导和分子调节机制中的作用对于人们了解NF-Y转录因子家庭在木质植物中的作用和功能是重要的,并为调节提供重要的理论依据开花时间和缩短繁殖周期。
结论
在目前的研究中,我们已经鉴定了杨树NF-YB.并证实了基因家族的功能PtNF-YB1利用转基因调控花期拟南芥和番茄.为了了解这种机制,我们研究了三种已知的开花基因(有限公司,FT.和SOC1通过转基因的RT-PCR检查)拟南芥.我们还使用Y2H和BIFC测定杨树PTNF-YB1和PTCO(PTCO1和PTCO2)蛋白之间的相互作用。一种潜在的分子机制模型PtNF-YB1讨论了在调节杨树的开花中发挥作用。所以,PtNF-YB1可作为一种潜在的候选基因,通过对杨树和其他作物的遗传转化,促进其早花。
方法
杨树鉴定PTNF-YB家庭成员
的拟南芥和水稻NF-YB序列拟南芥TAIR数据库(https://www.arabidopsis.org.)和米orygenesdb数据库(http://orygenesdb.cirad.fr/), 分别。BLASTN程序与1.0E的电子值截止- 5利用Phytozome数据库鉴定预测的PtNF-YB序列Populus Trichocarpa.v3.0(https://phytozome.jgi.doe.gov/pz/portal.html).
系统发育树和保守的主题分析
系统发育树采用MEGA V5.5 Neighbor-Joining (NJ)方法构建,参数为p-distance模型和1000个bootstrap重复。多序列比对采用Clustal X软件实现。利用多重期望最大化Motif Elicitation (MEME V4.12.0)对21株杨树PtNF-YBs保守Motif进行分析(http://meme-suite.org/tools/meme.)根据指令上传编码序列。
植物材料和生长条件
的6-year-old poplar 84K flowering (F), foral buds (FB), root (R), stem (S) and leaf (L) were collected from the Wei River planting base in Xi’an city (N33°42′44.37″; E 107°39′36.62″; with altitude 500–550 m), Shannxi province, China. For transformation, wild-type拟南芥使用生态型哥伦比亚(COL)。它在20-22°C的漫长的日期条件下(LD,16小时/ 8小时暗)生长。对于番茄遗传转化,“微米”番茄用作张和布鲁瓦德描述的方法[54].它生长在苗圃土壤花盆和温室条件下的白天(25°C)和夜晚(20°C)。
PtNF-YB1超表达的矢量建筑
开放阅读框(ORF)的PtNF-YB1通过RT-PCR扩增基因,然后用于构建过表达载体。的PtNF-YB1将基因插入载体PBI121中,并在花椰菜马赛克病毒(CAMV)的35升启动子下。特异性引物显示在附加文件中5.
拟南芥和番茄转型
的杨树PtNF-YB1用花浸染法将过表达的结构物导入Col农杆菌菌株GV3101 [55].携带阳性转基因植物的种子PtNF-YB1构建物是单独收获的。采用纯合子转基因株系进行进一步研究。对“小汤姆”番茄的子叶进行了转化农杆菌含有菌株LBA4404PtNF-YB1作为张和布鲁瓦德描述的方法的超表达构造[54].
酵母双杂交(Y2H)测定
根据制造商的说明(CLONTECH,USA),我们使用基于GAL4的双混合系统进行了酵母双杂交(Y2H)实验。首先,杨树PtNF-YB1将基因ORF插入诱饵载体pGBKT7中。将得到的载体PGBKT7-PTNF-YB1用作诱饵。orfsPtNF-CO1和PtNF-CO2将基因克隆到载体pGADT7中。具体引物见附加文件6.然后,使用PGBKT7-PTNF-YB1的PGADT7的共转化用作对照,PGBKT7-PTNF-YB1构建体与PGADT7-PTNF-CO1和PGADT7-PTNF-CO2一起使用,共转化酵母菌株AH109。最后,使用SD / -TRP-Leu-His-Ade培养基选择阳性菌落并用β- 半乳糖苷酶确认阳性菌落。
双分子荧光互补(BIFC)测定
我们使用vectors pspyne-35s和pspyce-35s和Cot转盐染色载体35s:p19构建双分子荧光互补(bifc)质粒载体。这是第一次,杨树PtNF-YB1将ORF基因插入载体pspyene - 35s中,获得ORF基因PtCO(PtCO1和PtCO2)基因ORF插入载体pSPYCE-35S。两种载体均含有编码黄色荧光蛋白(YFP)的N-或c -端。具体引物见附加文件7.然后,如Walter等人所述。,我们使用了农杆菌介导的感染方法将基因载体的不同组合引入洋葱表皮细胞[56].最后,在24℃温育后,使用激光共焦显微镜(Zeiss LSM510 Meta,德国)观察YFP在洋葱表皮细胞中的表达。我们使用波长为488nm,并在500-530 nm下用带通道滤波器进行检测,用于YFP。
逆转录PCR (RT-PCR)
采用半定量反转录PCR (RT-PCR)检测PtNF-YB1在杨树,拟南芥和番茄。采用实时荧光定量RT-qPCR (Quantitative real-time reverse transcription PCR, RT-qPCR)对结果进行验证。RT-qPCR反应在Step One Plus Real- time PCR系统(Applied Biosystems,美国)中进行,使用superreal PreMix试剂盒(SYBR Green)(天根生物技术,中国)。根据2计算各基因的RNA相对表达量-ΔΔct方法,如先前详细报道的[57].在RT-QPCR分析中,18 s rRNA(杨树),attint.(拟南芥) 和T-ACT.(番茄)作为内部对照基因。RT-PCR反应重复三次。特异性引物显示在附加文件中8和9.
可用性数据和材料
所有支持本研究结果的数据和材料都包含在文章和附加文件中。
缩写
- BIFC:
-
双分子荧光互补
- CaMV:
-
花椰菜马赛克病毒
- HFM:
-
Histone-fold主题
- MW:
-
分子量
- nf-y:
-
核因子Y.
- NJ:
-
Neighbor-Joining
- orf:
-
开放阅读框架
- PI:
-
等电点
- RT-PCR:
-
半定量逆转录PCR
- RT-QPCR:
-
实时定量反转录PCR
- Y2H:
-
酵母2台混合动力
参考
- 1。
Hsu Cy,Adams JP,Kim H,No K,Ma C,Strauss Sh,Drnevich J,Vandervelde L,Ellis JD,Rice BM等。开花基因座T复制坐标坐标植入多年生杨树的生殖和营养生长。PROC NATL ACAD SCI。2011; 108(26):10756-61。
- 2。
Hsu Cy,Liu Y,Luthe DS,玫瑰花C. Poplar FT2缩短了少年阶段,促进了季节性开花。植物细胞。2006; 18(8):1846-61。
- 3.
Petersen R,Krost C.追踪植物建筑规则的关键球员:苹果树的柱状生长习惯(Malus x Domestica).Planta。2013; 238(1):1-22。
- 4.
Peterle A,Karlberg A,Bhalerao RP。多年生树木季节性生长模式的昼夜长度介导控制。CurrOp植物BIOL。2013; 16(3):301-6。
- 5.
关键词:木本植物,转基因,育种,研究进展植物品种。2009;128(3):217 - 26所示。
- 6.
Edwards D,Murray Ja,Smith AG。编码保守的CCAAT箱转录因子复合物的多个基因表达拟南芥.植物杂志。1998;117(3):1015 - 22所示。
- 7.
Siefers N, Dang KK, Kumimoto RW, WEt B, Tayrose G, Holt BF。拟南芥NF-Y转录因子的组织特异性表达模式表明其具有广泛的组合复杂性。植物杂志。2009;149(2):625 - 41。
- 8.
Maruyama K, Todaka D, Mizoi J, Yoshida T, Kidokoro S, Matsukura S, Takasaki H, Sakurai T, Yamamoto YY, Yoshiwara K, et al。中低温和脱水诱导转录通路中顺式启动子元件的鉴定拟南芥,米饭和大豆。DNA Res。2012; 19(1):37-49。
- 9.
Dolfini D,Gatta R,Mantovani R. NF-Y以及CCAAT启动子的转录激活。Crit Rev Biochem mol Biol。2012; 47(1):29-49。
- 10.
关键词:水稻,亲和基因,亲和基因,互作特性中国生物医学工程学报,2008;
- 11.
Mei X,Liu C,Yu T,Liu X,Xu D,Wang J,Wang G,Cai Y.父优先表达基因的鉴定与表征NF-YC8在玉米胚乳中。Mol Gen Genomics。2015; 290(5):1819-31。
- 12.
Zhai L,Xu L,Wang Y,Zhu X,Feng H,Li C,Luo X,Everlyne mm,Liu L.在萝卜中胚胎发生相关的转录鉴定与差异表达基因的表征(萝卜L). Sci rep 2016;6:21652。
- 13。
胡萝卜HAP因子与胚胎特异性转录因子C-LEC1形成复合物的鉴定与表征实验机器人。2007;58(13):3819-28。
- 14。
穆杰,谭浩,郑琴,付锋,梁勇,张杰,杨欣,王涛,崇康,王新军。叶子叶don1是脂肪酸生物合成的关键调控因子拟南芥.植物杂志。2008;148(2):1042 - 54。
- 15。
Junker A, Monke G, Rutten T, Keilwagen J, Seifert M, Thi TM, Renou JP, Balzergue S, Viehover P, Hahnel U,等。叶子叶1在发育过程中的伸长相关功能拟南芥.工厂J. 2012; 71(3):427-42。
- 16.
Stephenson TJ, McIntyre CL, Collet C, Xue GP。转录因子NF-Y家族的全基因组鉴定及表达分析Triticum aestivum..中国生物医学工程学报,2007;
- 17.
Stephenson TJ, Mcintyre CL, Collet C, Xue GP。TaNF-YC11,其中一个轻型的NF-YC成员Triticum aestivum.,与光合相关基因共同调节。Funct综合基因组学。2010; 10(2):265-76。
- 18.
Stephenson TJ, Mcintyre CL, Collet C, Xue GP。TANF-YB3.是参与调节光合作用的基因吗Triticum aestivum..功能与综合基因组学。2011; 11(2):327-40。
- 19.
Combier JP, Frugier F, De BF, Boualem A, El-Yahyaoui F, Moreau S, Vernié T, Ott T, Gamas P, Crespi M。MtHAP2-1是MicroRNA169中调节的共生结节发育的关键转录调节因子Medicago truncatula.基因Dev。2006;20(22):3084 - 8。
- 20.
Nelson de,Repetti Pp,Adams Tr,Creelman Ra,Wu J,Warner DC,Anstrom DC,Bensen RJ,Castiglioni PP,Donnarummo Mg等。植物核因子Y(NF-Y)B亚基赋予干旱耐受性,导致水有限亩的玉米产量提高。Proc Natl Acad Sci U S A. 2007; 104(42):16450-5。
- 21.
李WX,Oono YJ,他XJ,Wu JM,Iida K,Lu xy,Cui X,Jin H,Zhu JK。的拟南芥NFYA5转录因子通过转录和转录后调控促进抗旱性。植物细胞。2008;20(8):2238 - 51。
- 22.
在内质网中,NF-Y转录因子被内质网胁迫激活并组装成转录复合物,调控内质网中应激反应基因的表达拟南芥.植物细胞,2010,22(3):782 - 96。
- 23。
Yan DH,XIA X,YIN W.NF-YB家族基因在杨树基因组的分析中鉴定并表达胡杨对干旱的压力敏感。植物mol biol报告。2013; 31(2):363-70。
- 24。
Palmeros-SuárezPa,Massange-SánchezJA,Martínez-Gallardo Na,Montero-Vargas JM,Gómez-Leyva JF,Délano-Frier JP。过度表达的苋属hypochondriacusNF-YC基因修饰生长,赋予水分亏缺胁迫抗性拟南芥.植物科学国际实验植物生物学杂志。2015; 240:25。
- 25。
轩元刚,陆超,张锐,蒋杰stnf-yb3.1.减少光合容量和块茎生产,促进马铃薯的ABA介导的气孔闭合(Solanum Tuberosum L.).植物SCI。2017; 261:50-9。
- 26。
Ben-Naim O,Eshed R,Parni A,Teper-Bamnolker P,Shalit A,偶联G,A,Lifschitz E.可以介导铜蛋白和DNA之间的相互作用。工厂J 2006,46(3):462-476。
- 27。
关键词:ccaat,转录因子,花期,调控因子拟南芥.植物杂志。2007;145(1):98 - 105。
- 28.
陈妮兹,张XQ,魏格,陈QJ,仁F,陈继,王XC。AtHAP3b在开花时间的规定中起着至关重要的作用拟南芥在渗透压力期间。J Biochem mol Biol。2007; 40(6):1083-9。
- 29.
Cao S, Kumimoto RW, Gnesutta N,等。远端CCAAT/NUCLEAR FACTOR Y复合物促进开花位点T启动子的染色质环化,调节开花时间拟南芥.植物细胞。2014; 26(3):1009。
- 30.
【关键词】核易位,核易位,分化机制,亚基abstract拟南芥转录因子NF-Y。摩尔。2012;5(4):876 - 88。
- 31.
梁M,孔D,Wu J,Blake T,Wu Y.表达与功能分析核FACTOR-Y,大麦亚基B基因。足底。2012;235(4):779 - 91。
- 32.
关键词:油菜,NF-Y转录因子,转录因子家族,鉴定芸苔栗鸟L.)。Planta。2014; 239(1):107-26。
- 33.
Kumimoto RW,张Y,Siefers N,Holt BF。NF-YC3,NF-YC4和NF-YC9是硫型介导的,光周期依赖性开花所必需的拟南芥.工厂J.2010; 63(3):379-91。
- 34.
Siriwardana CL, Gnesutta N, Kumimoto RW, Jones DS, Myers ZA, Mantovani R, Rd HBNUCLEARFACTORY, Subunit a (NF-YA)蛋白正向调控开花并通过其发挥作用开花轨迹T..Plos Genet。2016; 12(12):E1006496。
- 35。
魏旭,徐军,郭浩,蒋磊,陈胜,于聪,周志明,胡鹏,翟浩,万军。DTH8抑制水稻开花,同时影响株高和产量潜力。植物杂志。2010;153(4):1747 - 58。
- 36。
闫WH,王P,陈HX,周HJ,李QP,王克,丁Zh,张ys,yu sb,xing yz等。一个主要的QTL,Ghd8,在水稻中调节谷物生产力,植物高度和标题日期,发挥含有热门刺激作用。莫尔植物。2011; 4(2):319-30。
- 37。
戴旭,丁勇,谭磊,付勇,刘峰,朱震,孙旭,孙旭,顾萍,蔡辉,等。LHD1的等位基因DTH8 / GHD8.,控制普通野生稻中的晚期标题日期(选用高产稻).J Intent Plant Biol。2012; 54(10):790-9。
- 38。
Kumimoto RW,Adam L,Hymus GJ,Repetti PP,Reuber TL,Marion CM,Hempel FD,Ratcliffe OJ。核因子y亚基NF-YB2和NF-YB3在促进开花的诱导漫期光周期中的促进作用拟南芥.足底。2008;228(5):709 - 23所示。
- 39。
Maity SN, De CB。异聚ccaat结合因子B亚基的生化分析。dna结合域和亚基相互作用域由两个单独的片段指定。中国生物医学工程杂志。1992;267(12):8286-92。
- 40.
Sinha S, Kim IS, Sohn KY, de Crombrugghe B, Maity SN。ccaat结合因子CBF亚基的三种突变描述了参与CBF- dna复合体三步组装的功能域。中国生物医学工程学报,1996;
- 41.
NF-YB/NF-YC的结构揭示了CCAAT因子NF-Y的DNA结合和转录调控。中国生物医学工程学报,2003;
- 42.
ccaat结合因子NF-Y的分子生物学。基因。1999;239(1):15 -。
- 43.
关键词:康斯坦斯基因(CONSTANS)拟南芥促进开花并编码蛋白质,显示出与锌指转录因子的相似之处。细胞。1995年; 80(6):847-57。
- 44.
Kardailsky I,Shukla VK,Ahn Jh,Dagenais N,Christensen SK,Nguyen JT,Chory J,Harrison MJ,Weigel D. Flock诱导者FT的激活标记。科学。1999年; 286(5446):1962-5。
- 45.
关键词:植物开花信号,拮抗基因,转录因子,调控科学。1999;286(5446):1960 - 2。
- 46.
关键词:sock1, MADS-box,春化,赤霉素,开花拟南芥.工厂J. 2003; 35(5):613-23。
- 47。
Bohlenius H, Huang T, charbonnel - campa L, Brunner AM, Jansson S, Strauss SH, Nilsson O。CO / FT.调节模块控制开花时间和季节性生长停止在树木。科学。2006;312(5776):1040 - 3。
- 48。
rinne plh,schoot cvd。寒冷的休眠芽夸张开花轨迹T.并招募ga诱导的1,3-β-葡聚糖酶重新打开信号通道,释放休眠杨树.植物细胞。2011; 23(1):130-46。
- 49。
沈磊,陈勇,苏旭,张胜,潘华,黄敏杨树simoniiCarrière诱导早花拟南芥和杨树。植物细胞组织与器官培养。2012;
- 50。
Zicola J, Liu L, Tanzler P, Turck F. a .靶向DNA甲基化抑制两个增强子开花轨迹T.在拟南芥.自然植物。5(3): 300 - 2019; 7。
- 51.
张H,朱S,刘T,王C,程Z,张X,陈L,胜P,Cai M,Li C等。延迟标题Date1与OSHAP5C / D相互作用,延迟开花时间并增强水稻产量。植物Biotechnol J. 2019; 17(2):531-9。
- 52.
我是迈尔斯·扎,霍尔特男友。核因子- y:这么多年后仍然很复杂?植物生物学当前观点,第45卷(Pt A;2018.p . 96 - 102。
- 53.
关键词:NF-YC,花过渡,卷曲叶,时间特异性植物杂志。2018;177(1):105 - 14所示。
- 54.
关键词:转基因,耐盐番茄,叶片,果实,盐分积累生物科技Nat》。2001;19(8):765 - 8。
- 55.
花浸:一种简化的方法农杆菌介断的转换拟南芥.工厂J. 1998; 16(6):735-43。
- 56.
作者:Walter M ., Chaban C ., Schutze K ., batitic O ., Weckermann K ., Nake C ., Blazevic D ., Grefen C ., Schumacher K ., Oecking C ., Harter K ., Kudla植物j . 2004; 40(3): 428 - 38。
- 57.
Livak KJ, Schmittgen TD。采用实时荧光定量PCR对相关基因表达数据进行分析-ΔΔct方法。方法。2001;25(4):402 - 8。
致谢
我们要感谢编辑和审稿人对手稿提供建设性的意见。
资金
这项工作得到了中国国家自然科学基金(第31600550号),中国陕西省自然科学基础研究计划(2017年73027),中央大学的基本研究资金(项目号2452015042),the China Postdoctoral Science Foundation (Project No. 2015 M572605), the Young Talent fund of University Association for Science and Technology in Shaanxi, China (Project No. 20160107), and the Research Fund for the Doctoral Program of Higher Education of Northwest A&F University (Project No. 2013BSJJ045). The funding agencies were not involved in study design, data collection and analysis, or preparation of the manuscript.
作者信息
从属关系
贡献
RW和LZ进行了实验,分析了数据,准备了图表,审阅了论文草稿。YZ和JF审阅了论文草稿。LL构思和设计实验,提供试剂/材料/分析工具,撰写论文,审阅论文草稿。所有作者阅读并批准最终稿件。
相应的作者
伦理宣言
伦理批准并同意参与
不适用。
同意出版
不适用。
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
额外的信息
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
附加文件
额外的文件1:
杨树中NF-YB家族的系统发育树和保守基序分析。一种。Ptnf-ybs系统发育树。湾PTNF-YBS保守的主题分析。(TIF 2879 KB)
额外的文件2:
开花的时间拟南芥转基因系异位表达PtNF-YB1.(DOC 29 kb)
额外的文件3:
杨树和杨树的氨基酸序列分析拟南芥co。一个。Poplar Ptco1,Ptco2和Atco的同源树。湾交往域PTCO1,PTCO2和ATCO的多个序列对齐。使用DNAMAN软件分析氨基酸序列。(TIF 786 KB)
额外的文件4:
图S3。过度表达PtNF-YB1在转基因杨树系中。a.将野生型(WT)和转基因番茄株系(PT1、PT3和PT4)转入生长室内45天后。标尺= 10厘米。b.将野生型(WT1和WT2)和转基因株系(PT1和PT3)移入生长室80天后。标尺= 22厘米。(TIF 1503 kb)
额外的文件5:
底漆PtNF-YB1基因克隆与过度表达的矢量建筑。(Doc 28 KB)
附加文件6:
酵母双杂交(Y2H)测定的引物。(Doc 28 KB)
附加文件7:
用于双分子荧光互补(BIFC)测定的引物。(Doc 28 KB)
附加文件8:
用于使用半定量RT-PCR的表达分析引物。(Doc 32 KB)
附加文件9:
qRT-PCR表达分析引物。(医生33 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
王,R.,朱,L.,张,Y.等等。杨树NF-YB基因家族的基因组分析并鉴定PtNF-YB1在调控转基因植物开花时间方面具有重要意义。BMC植物杂志19,251(2019)。https://doi.org/10.1186/S12870-019-1863.2.
收到了:
接受:
发表:
关键词
- 白杨
- 全基因组分析
- PtNF-YB1
- 开花时间
- 转基因植物