- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发布:GydF4y2Ba
与生育恢复与生育候选基因相关的代谢途径分析GydF4y2BaAegilops Kotschyi.GydF4y2Ba小麦的细胞质(GydF4y2BaTriticum aestivum.GydF4y2BaL.)GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba19GydF4y2Ba, 文章编号:GydF4y2Ba252GydF4y2Ba(GydF4y2Ba2019年GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
基于MATLE的热敏致密性雄性不育GydF4y2BaAegilops Kotschyi.GydF4y2Ba细胞质(K-TCMS)在杂交小麦育种中起重要作用。这在双线杂交小麦育种中具有重要应用,但与生育恢复有关的遗传基础和分子调节机制尚不清楚。在该研究中,基于RNA测序的比较转录组分布对于包含KTM3315R及其无菌对应于KTM3315A的两条近似同学系,共有六种样品(每组3重复),以鉴定生育恢复基因及其代谢途径。GydF4y2Ba
结果GydF4y2Ba
总共2642个显着的差异表达基因(DEGS),其中1238次受调节,1404次在肥沃的花药中调节。功能性注释富集分析确定了与生育恢复有关的重要途径,例如碳水化合物代谢,苯丙醇丙醇代谢和生物合成,以及编码果胶甲基酯酶和黄氰酮3-羟化酶的候选基因。此外,转录因子分析表明,大量的DEG主要涉及WRKY,BHLH和MYB转录因子家族。总可溶性糖和黄酮内容物的测定表明,重要的代谢途径和候选基因与生育恢复有关。通过定量逆转录的PCR选择并检测12个Degs,结果表明转录组测序结果是可靠的。GydF4y2Ba
结论GydF4y2Ba
我们的结果表明,所识别的可与生育恢复有关,并且他们证明是至关重要的GydF4y2BaAegilops Kotschyi.GydF4y2Ba细胞质。这些发现还提供了探索与小麦生育恢复相关的分子调控机制的基础以及筛选和克隆相关基因。GydF4y2Ba
背景GydF4y2Ba
杂种优势是提高作物产量的最成功的策略之一,并已在植物育种系统[广泛利用GydF4y2Ba1GydF4y2Ba]。在这种情况下,细胞质雄性不育(CMS)可以在不影响农艺性能的情况下产生无菌雄性配子细胞,并且这种成本效益的系统有助于杂种种子生产[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba]。在植物中,CMS是由于母体继承无法建立细胞器(线粒体)和核基因组之间的基因组协调,从而导致非功能性的花粉生产[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba]。由于CMS性状,手动去除花药的要求可被消除,从而降低了需要劳动力方面和物力,以及允许的杂交技术,以产生优良˚FGydF4y2Ba1GydF4y2Ba几代人在其产量,应力阻力和适应性方面明显优于父母和可用流行的品种[GydF4y2Ba8.GydF4y2Ba]。CMS已应用于诸如稻米之类的作物中[GydF4y2Ba9.GydF4y2Ba],玉米[GydF4y2Ba10GydF4y2Ba],高粱[GydF4y2Ba11GydF4y2Ba],大豆[GydF4y2Ba12GydF4y2Ba]和棉[GydF4y2Ba13GydF4y2Ba]结果显着。然而,由于其巨大的基因组和长期育种周期,在小麦生产中使用CMS仍然是一项挑战。GydF4y2Ba
在小麦中使用CMS对简化育种程序、提高作物产量和质量具有重要意义。目前,小麦的温敏不育系与GydF4y2BaAegilops Kotschyi.GydF4y2Ba基于双线方法的细胞质(K-TCMS)具有简单的恢复系和维护线,没有负性细胞质效应[GydF4y2Ba14GydF4y2Ba]。这些品系在杂交小麦育种中表现良好,可以产生大量杂交种子,为杂交小麦的生产提供了宝贵的利益[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba]。GydF4y2Ba
近年来,高通量测序已经提供了转录组测序的新方法,它是进行从有限的基因组信息的非模式生物获得的RNA测序数据的比较分析特别有用。比较转录组分析已经成功地用来研究雄性不育的分子机制在不同物种的不同发育阶段。例如,候选基因和重要的代谢途径进行了研究,棉花[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba18GydF4y2Ba],GydF4y2Ba芸苔栗鸟GydF4y2Ba[GydF4y2Ba19GydF4y2Ba那GydF4y2Ba20.GydF4y2Ba], 白饭 [GydF4y2Ba21GydF4y2Ba], 卷心菜 [GydF4y2Ba22GydF4y2Ba],芝麻[GydF4y2Ba23GydF4y2Ba]和其他物种。然而,已经进行了少量对小麦的生育恢复的比较转录组研究。GydF4y2Ba
为了提高小麦杂种优势的利用,促进农业发展,重要的是阐明负责CMS系中生育恢复的分子机制。在本研究中,来自K-TCMS小麦线KTM3315A的Binucleate阶段的花药及其接近的上同学恢复线KTM3315R作为RNA测序的实验材料,以鉴定重要候选基因和与生育恢复相关的生物途径。特别是,我们的目标是:对小麦生育恢复相关的分子调节机制获得新的见解;并为在随后的研究中筛选与生育恢复有关的筛选和进一步克隆基因的基础。GydF4y2Ba
结果GydF4y2Ba
表型性状和显微镜观察GydF4y2Ba
为了确定可育系和不育系在视觉上的差异,我们观察了三核期可育系KTM3315R和不育系KTM3315A的花药、花药外表皮和小孢子的形态。GydF4y2Ba1GydF4y2Ba).扫描电子显微镜表明,与KTM3315A花药相比,KTM3315R花脂剂是丰满的,对称的和常规,并且裂解花纹的上端并释放成熟花粉晶粒(图。GydF4y2Ba1GydF4y2Ba广告)。解剖显微镜也清楚地证明了这些特征(图。GydF4y2Ba1GydF4y2Bao,p)。观察口的外表皮(图。GydF4y2Ba1GydF4y2BaE-H)表明,KTM3315R花叶物形成的折叠常规且扁平(图。GydF4y2Ba1GydF4y2Bag),而它们在KTM3315A中不规则(图。GydF4y2Ba1GydF4y2BaH)。此外,KTM3315A的成熟花粉晶粒缩小并变形,而KTM3315R的含量饱和(图。GydF4y2Ba1GydF4y2BaI-L)。通过i获得成熟花粉晶粒的细胞学观察GydF4y2Ba2GydF4y2Ba-Ki染色,显示成熟花粉晶粒在KTM3315R中染色完全黑色,而在KTM3315A中未染色的成熟花粉颗粒,染色是不均匀的,这是用于流动花粉的典型染色模式(图。GydF4y2Ba1GydF4y2Bam, n)。由此可见,KTM3315A和KTM3315R由于诱导了育性恢复基因,育性表型存在明显差异。GydF4y2Ba
KMF的扫描电镜图像(GydF4y2Ba一种GydF4y2Ba那GydF4y2BaCGydF4y2Ba那GydF4y2BaE.GydF4y2Ba那GydF4y2BaGGydF4y2Ba那GydF4y2Ba一世GydF4y2Ba那GydF4y2BaK.GydF4y2Ba)和Kma(GydF4y2BaB.GydF4y2Ba那GydF4y2BaD.GydF4y2Ba那GydF4y2BaFGydF4y2Ba那GydF4y2BaHGydF4y2Ba那GydF4y2BajGydF4y2Ba那GydF4y2BaL.GydF4y2Ba).一世GydF4y2Ba2GydF4y2Ba-ki染色Kmf(GydF4y2BamGydF4y2Ba)和Kma(GydF4y2BaNGydF4y2Ba).KMF的解剖显微镜观察(GydF4y2BaO.GydF4y2Ba)和Kma(GydF4y2BaP.GydF4y2Ba).花药(GydF4y2Ba一种GydF4y2Ba-GydF4y2BaD.GydF4y2Ba那GydF4y2BaO.GydF4y2Ba那GydF4y2BaP.GydF4y2Ba).花药外表皮(GydF4y2BaE.GydF4y2Ba-GydF4y2BaHGydF4y2Ba).三核期小孢子(GydF4y2Ba一世GydF4y2Ba-GydF4y2BaNGydF4y2Ba).秤条=500μm(GydF4y2Ba一种GydF4y2Ba那GydF4y2BaB.GydF4y2Ba);100μm(GydF4y2BaCGydF4y2Ba那GydF4y2BaD.GydF4y2Ba);50μm(GydF4y2BaE.GydF4y2Ba那GydF4y2BaFGydF4y2Ba那GydF4y2Ba一世GydF4y2Ba那GydF4y2BajGydF4y2Ba那GydF4y2BamGydF4y2Ba-GydF4y2BaP.GydF4y2Ba);10μm(GydF4y2BaK.GydF4y2Ba那GydF4y2BaL.GydF4y2Ba);5μm (GydF4y2BaGGydF4y2Ba那GydF4y2BaHGydF4y2Ba)GydF4y2Ba
转录组测序和基因组测绘GydF4y2Ba
基于对花药和成熟花粉颗粒观察到的表型特征,我们假设基因表达模式发生了变化。为了验证我们的假设并进一步阐明调节生育能力的分子机制,我们使用了来自KTM3315R(指定为KMF)和KTM3315A(指定为KMA)的肥沃和无菌花药的高通量测序的Illumina Hiseq PE150序列序列,总共六个样本(每组3重复,包括KMA1,KMA2,KMA3; KMF1,KMF2,KMF3。分别在Binucleate阶段。GydF4y2Ba
总共产生了44 GB的干净数据。对每个样本的数据进行过滤,当Q20(测序错误率,1%)基础百分比超过95.69%时,平均获得7.3 GB高质量的干净数据。所有碱基均得到鉴定,CG含量范围为59.15 ~ 61.62%。每个序列的平均读长为150 bp。对于每个样本,使用rRNA数据库过滤高质量的clean reads,并与参考基因组进行比对,比对效率在63.11 ~ 68.59%之间(附加文件GydF4y2Ba1GydF4y2Ba:表S1)。在直接比较不同样品基因的表达水平的丰度和离散分布之后,我们发现测序质量和基因表达水平基本相同(图。GydF4y2Ba2GydF4y2Baa,b)。因此,该结果表明,通过测序所得到的数据的质量可靠,适用于随后的分析。GydF4y2Ba
识别煤层GydF4y2Ba
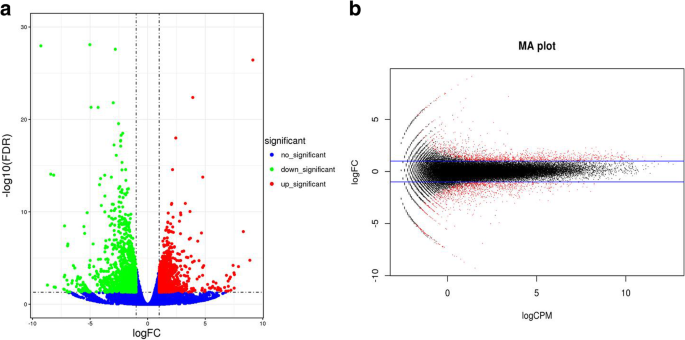
为了识别跨组的差异表达基因,使用了edger包[GydF4y2Ba24GydF4y2Ba]。我们确定的基因与日志GydF4y2Ba2GydF4y2Ba(FO.L.D.CH一种NGE.(FC) ≥ 1 and the false discovery rate (FDR) < 0.05 in a comparison as significant DEGs. In total, 2642 DEGs were identified in the KMF and KMA groups (Additional file2GydF4y2Ba:表S2),其中1238在下调,与KMA相比,KMF上调1404。我们使用了火山图和涂片图来可视化DEG的显着差异(图。GydF4y2Ba3.GydF4y2Baa, b).后续的生物信息学分析就是基于这些DEGs进行的。GydF4y2Ba
Degs的功能分类GydF4y2Ba
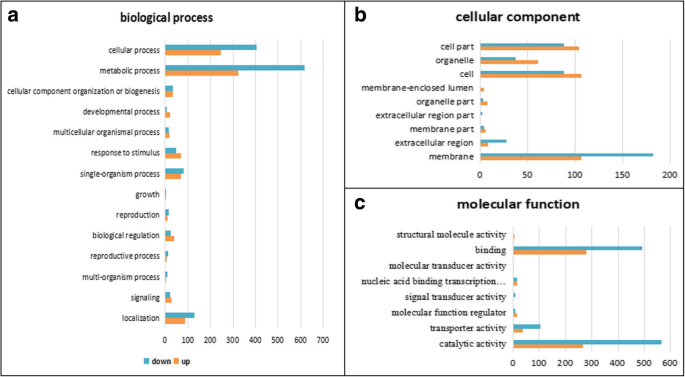
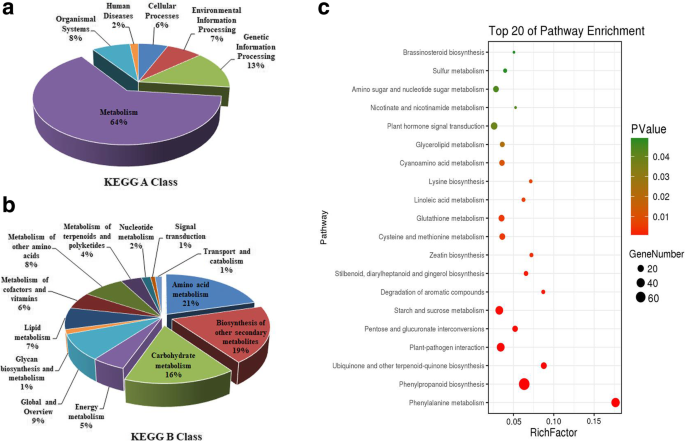
为了确定差异表达基因的主要生物学功能,将2642个DEGs序列排列到基因本体论(GO)、真核同源群(KOG)和京都基因和基因组百科全书(KEGG)数据库中。采用超几何检验,得到的q值≤0.05GydF4y2BaP.GydF4y2Ba-value作为阈值,得到在deg中显著富集的GO项和路径。由于氧化石墨烯类的数量多且分支结构复杂,仅以“生物过程”、“细胞组分”和“分子功能”这三个最为丰富的官能团为例(图1)。GydF4y2Ba4.GydF4y2BaA-C,附加文件GydF4y2Ba3.GydF4y2Ba:表S3-1)。在“生物过程”的子范畴中,“代谢过程(GO: 0008152)”和“细胞过程(GO: 0009987)”是数量最多的级联结构,分别有942和649个DEGs。在这两个子类中,“分解代谢过程(GO: 0009056)”、“次级代谢过程(GO: 0019748)”和“细胞死亡(GO: 0008219)”显著富集(附加文件)GydF4y2Ba3.GydF4y2Ba:表S3-2)。在“蜂窝分量”的下一个主要子类别中,“膜(GO:0016020)”和“小区(GO:0005623)”是最丰富的级联,分别具有288和194°的相应。在“细胞”类别中,可显着富集“细胞壁(GO:0005618)”(附加文件)GydF4y2Ba3.GydF4y2Ba:表S3-2)。在最后的子类别“分子功能”中,“催化活动(GO:0003824)”和“结合(GO:0005488)”是最丰富的瀑布,分别具有833和771次,其中下调的数量Degs几乎是上调的次数的两倍。在这两个子类别中,“激酶活性(GO:0016301)”,“水解酶活性(GO:0016787)”和“碳水化合物结合(GO:0030246)”是显着的丰富(附加文件GydF4y2Ba3.GydF4y2Ba:表S3-2)。根据这些显着丰富的术语,我们预测它们与小麦的生育恢复密切相关。GydF4y2Ba
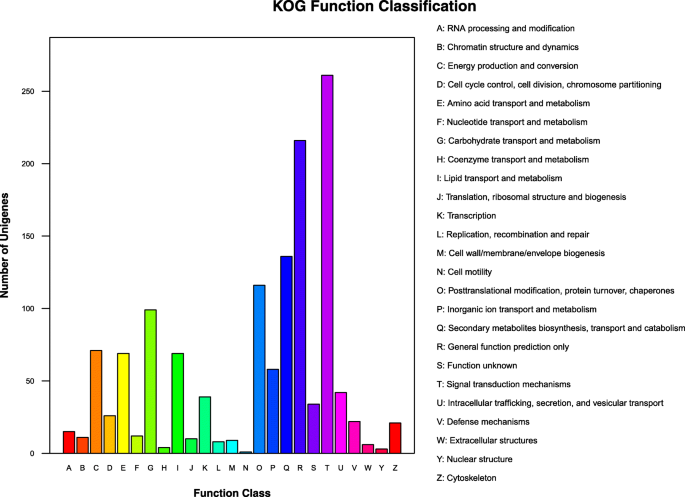
根据Kog注释的结果,1198只DEG被注释为25个KOG类别(图。GydF4y2Ba5.GydF4y2Ba,附加文件GydF4y2Ba4.GydF4y2Ba:表S4)。“信号转导机制”是最大的基团(具有261次的组T),其次是“仅限一般函数预测”(r次,216次)和“次级代谢物生物合成,运输和分解代谢”(组q,136次)。“翻译后修饰,蛋白质周转,伴侣蛋白质”(o含116次),“碳水化合物运输和新陈代谢”(G组,99次),“能量产生和转化”(C组,71次),“氨基酸”运输和新陈代谢“(e与69只次数)和”脂质运输和新陈代谢“(第69页,第69次)是其他主要类别。因此,上面突出的八种类别对于了解生育能力可能是重要的。GydF4y2Ba
在KEGG分析中,共注释了438个DEGs,分为102条通路。A类中代谢(64%,296 deg)占大多数,其次是B类,主要富集氨基酸代谢(21%,93 deg)、其他次级代谢产物生物合成(19%,87 deg)和碳水化合物代谢(16%,71 deg)(图)。GydF4y2Ba6.GydF4y2Baa,b)。在氨基酸代谢类别中,苯丙氨酸代谢(KO00360)和半胱氨酸和甲硫氨酸代谢(KO00270)分别富含42和16次。在其他次级代谢物类别的生物合成中,苯丙烷化生物合成(KO00940)最富含77℃。在碳水化合物代谢类别中,测定淀粉和蔗糖代谢(KO00500)和戊糖和葡萄糖酸酯互联(KO00040)分别测定显着的富集,分别具有34和14℃。为前20个路径准备了一个高级气泡图GydF4y2BaP.GydF4y2Ba ≤ 0.05 in order to visualize the significant pathways (Fig.6.GydF4y2BaC,附加文件GydF4y2Ba5.GydF4y2Ba:表S5)。根据KOG注释和前面的分析,我们确定了4个主要途径:苯丙氨酸代谢(ko00360),苯丙氨酸生物合成(ko00940),淀粉和蔗糖代谢(ko00500),戊糖和葡萄糖醛酸的相互转化(ko00040)。与这些代谢途径相关的代谢途径有助于进一步分析与K-TCMS育性恢复相关的基因和分子机制。GydF4y2Ba
鉴定生育恢复有关的转录因子GydF4y2Ba
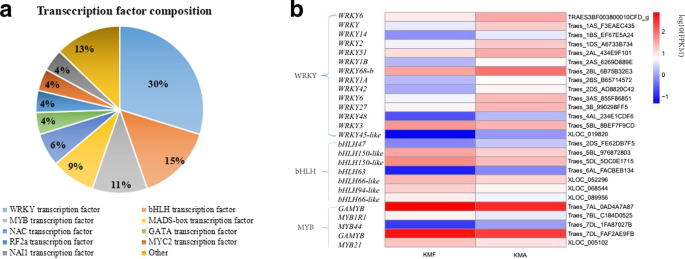
植物基因表达调控是一个复杂的网络系统。转录因子可以调控与特定性状相关的结构基因,因此其对植物生长发育的影响可能大于结构基因。基于之前对转录因子的研究[GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba那GydF4y2Ba27GydF4y2Ba]从NR数据库获得的注释信息(GydF4y2Baftp://ftp.ncbi.nlm.nih.gov/blast//db/FASTA/GydF4y2Ba),预计47只可编码转录因子,分为九个家庭,该因子分为包含腕骨,BHLH,MYB,MADS盒,NAC,GATA,RF2A,MYC2和NAI1转录因子的九个家庭。Wrky转录因子最常见,它们被14次编码,其占总量的30%,其次是BHLH转录因子(七次参数,15%)和MYB转录因子(5次,11%)(图。GydF4y2Ba7.GydF4y2Baa).这三个主要转录因子家族在KMF和KMA中的表达水平分析发现了相似的趋势(图2)。GydF4y2Ba7.GydF4y2Bab,附加文件GydF4y2Ba6.GydF4y2Ba:表S6)。热图显示出不包括上调的GydF4y2BaWRKY3.GydF4y2Ba在KMF与KMA相比,另外13次下调。GydF4y2BaBHLH47GydF4y2Ba那GydF4y2Babhlh63.GydF4y2Ba, 和GydF4y2Bamyb44GydF4y2Ba在KMF下调,但剩余的转录因子是上调的,即,BHLH和MYB。这些研究结果表明Wrky,BHLH和MyB系列转录因子可能会影响K-TCMS线中的生育恢复。GydF4y2Ba
碳水化合物代谢和苯丙烷化生物合成途径,参与了花粉发育的调节GydF4y2BaAegilops Kotschyi.GydF4y2Ba细胞质GydF4y2Ba
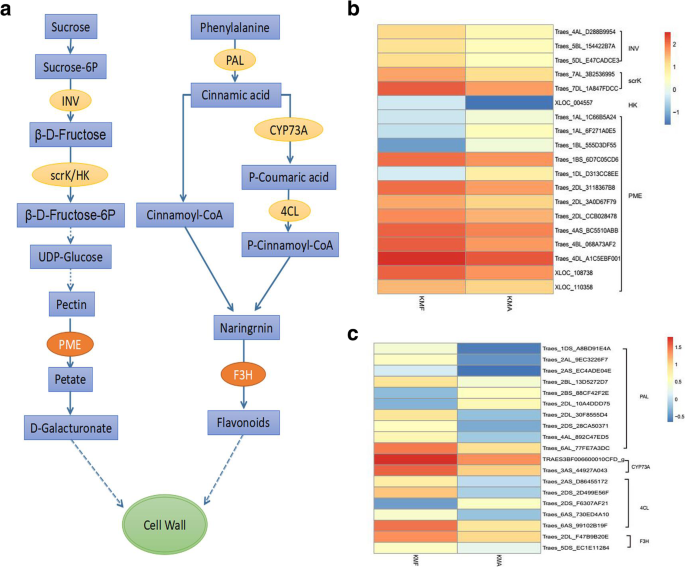
根据KOG和KEGG分析,大量的DEGs主要富集于碳水化合物代谢和苯丙类生物合成代谢途径。为了弄清这些deg是否通过这些途径调控花粉发育,我们绘制了之前确定的四个关键途径中的一些关键deg调控的代谢途径(图)。GydF4y2Ba8.GydF4y2Ba一种)。在花粉成熟过程中,糖为花粉生长和发育提供了基础。在糖代谢过程中,用作制备蔗糖6-磷酸蔗糖的蔗糖,通过水解酶β-果冻呋喃糖苷酶(INV,EC:3.2.1.26)在催化下生产β-D-果糖。然后使用β-D-果糖在催化作用的催化作用下产生β-D-果糖-6P(SCRK,EC:2.7.1.4)和六酮酶(HK,EC:2.7.1.1),其被一系列催化最后产生尿苷二磷酸葡萄糖(UDP-葡萄糖)的酶。UDP-葡萄糖是单糖互联的重要中间体或尿酸的形成,并且在碳水化合物代谢中起着重要作用。UDP-葡萄糖被一系列酶催化以产生果胶。果胶通过果胶甲基酯酶(PME,EC:3.1.1.11)水解,形成D-半乳酸酯并保持细胞壁发育。在肥沃和无菌的花药中的这些关键酶的表达水平显示在图2中的热图中。GydF4y2Ba8.GydF4y2Bab(额外的文件GydF4y2Ba7.GydF4y2Ba:表S7)。TRAES_1AL_1C66B5A24,TRAES_1AL_6F271A0E5,TRAE_1BL_555D3DF55和TRAES_1DL_D313 CC8EE在肥沃的花青中下调,但在肥沃的花药中令人畏缩,在肥沃的花药中进行了上调并在不孕症中进行下降。因此,我们假设这些酶的上调表达可以维持正常的花粉生长和发育。应该注意的是,在糖代谢期间,许多DEGS在具有作用中的作用编码了PME。在苯基丙醇丙醇代谢和生物合成途径中,苯丙氨酸用作苯丙氨酸氨基酶(PAL,EC:4.3.1.24)的作用下形成肉桂酸的基材。肉桂酸最终在氧化酶反肉桂醛4-单氧化酶(CYP73a,EC:1.14.13.11)和4-香豆素-CoA连接酶的作用下产生p-cgnamoyl-coa(4clec:6.2.1.12)。P-Cgnamoyl-CoA和肉桂 - COA产生柚皮素,最终通过氧化还原酶黄酮3-羟化酶(F3H,EC:1.14.11.9)催化在催化下,其维持花粉管和花粉墙的发育。图2中示出了显示这些关键酶的表达水平的热图。GydF4y2Ba8.GydF4y2BaC(附加文件GydF4y2Ba7.GydF4y2Ba:表S7)。Traes_2BS_88CF42F2E、Traes_2DL_10A4DDD75和Traes_2DS_F6307AF21在可育花药中表达下调,而这些基因编码的其他关键酶在可育花药中表达上调。这些结果表明,可育性(KMF)花药中碳水化合物代谢和苯丙素生物合成以及代谢相关基因的上调可能保证花粉的正常发育和育性。GydF4y2Ba
总可溶性糖和黄酮类内容物GydF4y2Ba
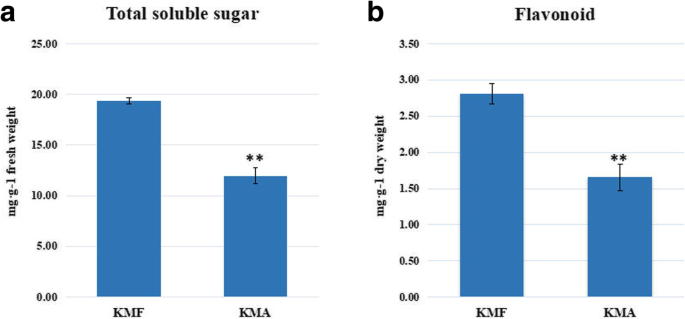
通过测定可育花药(KMF)和不育花药(KMA)中可溶性糖和类黄酮含量,研究其糖代谢和苯丙素生物合成代谢的变化。在碳水化合物代谢途径中,大部分DEGs在KMF中上调。因此,我们推测,可育性相关基因的表达可能导致可育性植株(KMF)和不育性植株(KMA)花药中总可溶性糖含量的差异,其中可育植株花药中总糖含量可能较高。结果表明,可育(KMF)花药的可溶性糖含量显著高于不育(KMA)花药的可溶性糖含量。GydF4y2Ba9.GydF4y2Ba一个,附加文件GydF4y2Ba8.GydF4y2Ba:表S8)。此外,先前的研究表明,苯丙醇丙二醇代谢具有与黄酮类化合物的重要环节,它会影响花药发展[GydF4y2Ba28GydF4y2Ba]。我们发现F3H在肥沃(KMF)花药中高度表达,但根据RNA测序结果,在无菌(KMA)花药中几乎表达,因此我们测量了KMF和KMA植物的黄色类内容物。结果表明,肥沃(KMF)花药的类黄酮含量明显高于无菌(KMA)花药(图。GydF4y2Ba9.GydF4y2Bab,附加文件GydF4y2Ba9.GydF4y2Ba:表S9)。这些结果符合我们的假设,并验证了测序结果的可靠性。GydF4y2Ba
通过QRT-PCR验证DEGSGydF4y2Ba
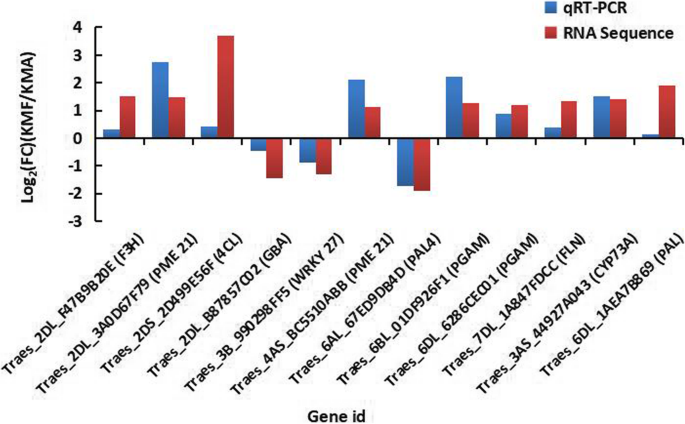
为了通过RNA测序验证检测到DEG的差异表达模式,从显着的代谢途径选择12次,其编码F3H(TRAES_2DL_F47B9B9B20E),果白酶/果白酶抑制剂21(PME 21,TRAES_2DL_ 3A0D67F79,TRAES_4AS_BC5510ABB(TRAES_4AS_BC5510ABB)进行QRT-PCR检测。),4-香豆素:辅酶酶(4CL,TRAES_2DS_2D499E56F),溶酶体β葡萄糖苷酶(GBA,TRAES_2DL_B87857C02),WRKY27转录因子(WRKY 27,TRAES_3B_990298FF5),苯丙氨酸氨酶4(PAL 4,Traes_6Al_ 67ED9DB4D),2,3.-bisphosphoglycerate-dependent phosphoglycerate mutase (PGAM, Traes_6BL_ 01DF926F1, Traes_6DL_6286CEC01), fructokinase-2-like (FLN, Traes_7DL_1A847FDCC), trans-cinnamate 4-monooxygenase (CYP73A, Traes_3AS_44927A043), phenylalanine ammonia-lyase (PAL, Traes_6DL_1AEA7B869). The expression patterns of these genes are shown in Fig.10GydF4y2Ba(附加文件GydF4y2Ba10GydF4y2Ba:表S10),表明通过QRT-PCR和RNA测序数据获得的基因表达模式表现出类似的趋势,从而确认在本研究中获得的RNA测序结果的准确性。GydF4y2Ba
讨论GydF4y2Ba
碳水化合物新陈代谢影响细胞壁发育,花药生长和生育能力GydF4y2Ba
从雌蕊和雄蕊的分化,直到形成成熟花粉颗粒,植物经常合成和降解材料,以便提供能量以支持花粉萌发,花粉管生长和施肥。碳水化合物提供能量,以维持花药和花粉的发展,但它们也充当影响其发展的信号[GydF4y2Ba29GydF4y2Ba]。大量相关基因或蛋白质参与了联合调控过程。许多研究表明,花药中基因或蛋白质的异常表达干扰了花粉的发育,从而影响花粉的育性。PME (E3.1.1.11)属于一个碳水化合物酯酶大家族,该酶调控果胶甲基化程度,是植物细胞壁的主要成分。以往对PME功能的研究表明,PME参与细胞壁松动,并参与植物的各种生长过程,如花粉形成、花粉管伸长等[GydF4y2Ba30.GydF4y2Ba]。PME能内源调控植物细胞壁与细胞间的果胶含量。果胶酸经PME去甲基化后与Ca结合GydF4y2Ba2+GydF4y2Ba形成不溶性的物质,其抑制细胞分离和器官脱落[GydF4y2Ba31.GydF4y2Ba]。Vanguard1的功能丧失可以降低花粉管和细胞外基质之间的效率,在风格和传递道中,从而导致花粉管堵塞在风格和传播漏头中,大大减少男性生育率[GydF4y2Ba32.GydF4y2Ba]。GydF4y2BaBCMF23AGydF4y2Ba和GydF4y2BaBCMF23B.GydF4y2Ba在核花粉和成熟花粉阶段在肥沃的花粉中以幼苗表达,它们在肥沃的花蕾中表达,但在基因雄性不育线中沉默[GydF4y2Ba33.GydF4y2Ba]。在淀粉和蔗糖新陈代谢途径中,PME催化果胶的水解以产生果胶和甲醇。在本研究中,作为PMES和九次在肥沃的花药中显着上调,但在不孕症中,13℃被注释为13℃,但在不育的花药中(图。GydF4y2Ba8.GydF4y2Bab,附加文件GydF4y2Ba7.GydF4y2Ba:表S7),另外四个在肥沃和无菌花药中具有非常低的表达水平。这些可在淀粉和蔗糖代谢中注释,并戊糖和葡糖醛酸酯互连途径。值得注意的是,在pentose和葡糖醛酸酯互联通路中检测到的14个末端,13个编码的PME。因此,我们建议PME酶对细胞壁发育,花药生长和生育的关键影响,因此PME在小麦生育的作用进一步研究。GydF4y2Ba
黄酮类化合物对可育花药的发育至关重要GydF4y2Ba
许多研究表明,苯丙氨酸代谢和生物合成途径在植物育性中具有重要作用。在花粉成熟过程中,苯丙氨酸被用作一系列生化酶的底物,包括PAL、C4H(肉桂酸4羟化酶)、CHS(查尔酮合酶;)、CHI(查尔酮异构酶)和FLS(黄酮合酶),然后形成酚醛树脂和长链脂肪酸。最终合成了孢粉素,作为花粉壁的主要成分[GydF4y2Ba34.GydF4y2Ba]。花粉墙体结构中的缺陷可导致花粉发生异常,这影响了植物的生育率[GydF4y2Ba35.GydF4y2Ba]。在本研究中,富含苯丙烷代谢和生物合成途径的许多含量。这些DEG编码的酶在肥沃的花药中上调,我们建议他们可能与生育率有重要的关系。通过苯基丙烷途径合成黄酮化合物[GydF4y2Ba36.GydF4y2Ba]他们在花粉发育中具有关键作用,因为它们对花卉植物的花粉成熟和花粉管生长至关重要[GydF4y2Ba37.GydF4y2Ba]。此外,F3H是形成类黄酮的关键酶,属于依赖于2-酮戊二酸酯的双加氧酶家族[GydF4y2Ba38.GydF4y2Ba]。F3h可以单独调节代谢物,但它通常共催化用硫酮异构酶和硫酮合成酶合成黄酮类化合物[GydF4y2Ba39.GydF4y2Ba]。在本研究中,F3H在可育花粉中表达上调,而在不育花药中表达量较低。黄酮类化合物是合成粉色色素的主要原料,对正常花药的发育也有重要作用。我们还在可育花药中检测到高水平的黄酮类化合物,从而支持黄酮类化合物在可育性中的关键作用。GydF4y2Ba
转录因子参与花粉发育和雄性育性的调控GydF4y2Ba
在开花植物中,雄性配子体(或花粉粒)在植物的育性中起着至关重要的作用,花粉粒的发育受到严格的控制,其中涉及到许多转录因子的复杂而精确的调控[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41.GydF4y2Ba]。一些转录因子的表达水平的变化可能导致植物生长和发育过程中的花粉发育和雄性不育。例如,过表达GydF4y2BaWRKY27GydF4y2Ba在GydF4y2Ba拟南芥GydF4y2Ba植物导致花粉裂缝缺陷,生长畸变和雄性不育[GydF4y2Ba42.GydF4y2Ba]。GydF4y2BaWRKY2.GydF4y2Ba和它接近的同源物GydF4y2BaWRKY34GydF4y2Ba雄性配子需要,它们在花粉发育和功能中起重要作用。因此,过度表达GydF4y2BaWRKY 34GydF4y2Ba从转基因的成熟花粉中GydF4y2Ba拟南芥GydF4y2Ba植物与生育率大大降低相关[GydF4y2Ba40GydF4y2Ba那GydF4y2Ba43.GydF4y2Ba]。以前的研究还表明,许多痕迹转录因子与对非生物和生物应激的抗性有关。然而,Wriky对花粉和花卉生长和发展控制的影响尚未得到广泛调查,之前的研究主要集中在GydF4y2Ba拟南芥GydF4y2Ba.在本研究中,我们检测到14个基因编码在小麦花药中特异性表达的腕词转录因子,其具有生育的差异,即,GydF4y2BaWRKY6.GydF4y2Ba那GydF4y2Ba怀疑GydF4y2Ba那GydF4y2BaWRKY14GydF4y2Ba那GydF4y2BaWRKY2.GydF4y2Ba那GydF4y2BaWRKY51GydF4y2Ba那GydF4y2BaWRKY1B.GydF4y2Ba那GydF4y2BaWRKY68-bGydF4y2Ba那GydF4y2BaWrky1a.GydF4y2Ba那GydF4y2BaWRKY42GydF4y2Ba那GydF4y2BaWRKY27GydF4y2Ba那GydF4y2BaWRKY48GydF4y2Ba那GydF4y2BaWRKY3.GydF4y2Ba, 和GydF4y2BaWRKY45样式GydF4y2Ba.这些痕迹转录因子中的13个表达水平在雄性无菌小麦阴茎中上调(图。GydF4y2Ba8.GydF4y2BaB),从而表明它们在无菌小麦中的上调对生育能力具有重要影响。进一步研究小麦花粉颗粒中这些腕骨转录因子的调控可以增强我们对与花粉发育和生育的分子机制的理解。GydF4y2Ba
MYB转录因子家族是一类大类转录因子,它们也参与了植物生长期间基因表达的调节,其中它们主要参与初级和次生代谢,包括苯丙烷丙醇代谢[GydF4y2Ba44.GydF4y2Ba]和黄烷醇生物合成[GydF4y2Ba45.GydF4y2Ba]。此外,一些MYB转录因子与花的发育有关。R2R3-MYB转录因子MYB21在雄蕊花丝伸长中起主导作用。在GydF4y2Ba拟南芥GydF4y2Ba,过表达GydF4y2BaMYB21GydF4y2Ba部分恢复雄蕊长丝生长和生育能力GydF4y2Baopr3.GydF4y2Ba突变体[GydF4y2Ba46.GydF4y2Ba那GydF4y2Ba47.GydF4y2Ba]。Gibberellin Myb参与甘草酸信号转导,强烈影响心血管植物的花发育,但主要是花药和花粉生长[GydF4y2Ba48.GydF4y2Ba]。此外,一些bHLH转录因子与MYB转录因子相互作用以调节不同的植物反应,包括二次代谢过程,类黄酮途径的,和雄蕊发展[GydF4y2Ba49.GydF4y2Ba]。例如,bHLH转录因子(MYC2,MYC3,MYC4和MYC5)相互作用与MYB转录因子(MYB21以及MYB24),以形成的bHLH-MYB复杂,和茉莉酸抑制bHLH结构-MYB复合物来调节茉莉酸介导的雄蕊发育和生育率[GydF4y2Ba50.GydF4y2Ba]。一些与R2R3-MYBs或bHLHs相互作用的类黄酮生物合成调节剂可以促进或损害类黄酮的生产[GydF4y2Ba51.GydF4y2Ba]。在我们的研究中,大多数BHLH和MYB转录因子在肥沃的小麦中上调,在无菌小麦下调(图。GydF4y2Ba8.GydF4y2Bab)。这些MYB和BHLH转录因子的可变表达水平表明,它们与小麦生育能力有关系,并且在这一过程中可能具有重要作用。这些结果提供了对黄酮类化合物生物合成和生育的新颖洞察力,从而增加了我们对负责调节生育能力的各种机制的理解。GydF4y2Ba
影响花粉生育恢复的线粒体相关基因GydF4y2Ba
植物花粉的正常发展与细胞核和细胞质之间的协调相互作用不可分割,并且与基因的选择性表达密不可分。GydF4y2Ba
研究线粒体相关基因表达对了解基因的时空表达和阐明细胞质雄性不育的分子机制具有重要意义。线粒体是一种半自主的细胞器,可以编码自身的rRNA、tRNA和少量蛋白质,与核基因组的引导和调控密不可分[GydF4y2Ba52.GydF4y2Ba]。研究表明,花粉生育恢复是核细胞质相互作用的过程。当引入一个或多个生育恢复基因时,相应地调节CMS相关基因的结构或表达,因此线粒体的功能恢复正常,从而使花粉生育率进行恢复[GydF4y2Ba53.GydF4y2Ba]。一些研究发现,线粒体相关基因的正常表达在花粉发育和生育中发挥着重要作用。米格GydF4y2Ba2+GydF4y2Ba运输车GydF4y2BaMRS2 / MGT.GydF4y2Ba基因家族主要介导细胞质和线粒体之间的镁运输[GydF4y2Ba54.GydF4y2Ba]。有研究发现,GydF4y2BaATMGT 5.GydF4y2Ba基因在早期花发育花药和雄配子特异表达GydF4y2BaATMGT 5.GydF4y2Ba突变体产生有缺陷的花粉[GydF4y2Ba55.GydF4y2Ba]。此外,扰乱GydF4y2BaATMGT 9.GydF4y2Ba基因表达导致成熟花粉颗粒的流产[GydF4y2Ba56.GydF4y2Ba],表明GydF4y2BaATMGT 9.GydF4y2Ba和GydF4y2BaATMGT 5.GydF4y2Ba基因对花粉发育和男性生育是至关重要的。在这项研究中(附加文件GydF4y2Ba11GydF4y2Ba:表S11),随着线粒体内膜镁转运蛋白MRS2的两种基因在肥沃的花青中上调,其表达了两倍的无菌花药,表明MRS2基因的正常表达与肥沃的花药的生育恢复有关。NADH脱氢酶是一种酶,其在线粒体内膜中催化电子从NADH转移到辅酶Q,并且其存在使植物在生物能量功能过程中更加柔韧的呼吸链[GydF4y2Ba57.GydF4y2Ba]。甲酸脱氢酶(FDH)是一种NAD +依赖性酶广泛分布在生物中,FDH催化甲酸对二氧化碳的氧化,同时在该过程中减少NAD +至NADH [GydF4y2Ba58.GydF4y2Ba]。ATP是细胞的主要能量货币,其通过ATPase催化分解成ADP和无机磷酸盐,以促进细胞质中的大多数生物反应。穆罕默德萨巴尔等人。发现,无菌线中F1-F0-ATP合酶的ATPase活性通过比较肥沃和无菌线之间的几种线粒体呼吸络合物的胶酶活性而显着低于育种线的植物活性,并认为这可能是的效果GydF4y2BaORF 522.GydF4y2Ba表达,使得无菌线无法满足维持花药开发所需的能量要求,导致花粉堕胎[GydF4y2Ba59.GydF4y2Ba]。在我们的研究中,编码NADH脱氢酶的两种基因,一种编码甲酸盐脱氢酶和五种编码AAA-ATP酶的无菌小麦花药。我们预测,这一系列相关酶的下调表达会影响与细胞质和核相互作用相关的线粒体中的能量转移,这反过来影响花粉的生育恢复。这些调查结果为细胞质雄性无菌小麦的线粒体相关基因和生育恢复的潜在分子调控机制提供了新的洞察力。GydF4y2Ba
结论GydF4y2Ba
在存在的情况下诱导恢复生育能力的基因GydF4y2BaAegilops Kotschyi.GydF4y2Ba细胞质导致KTM3315R中正常的花粉发育和生育能力,主要是通过对碳水化合物代谢,苯丙醇丙烯酸代谢和生物合成的影响,以及上调编码PME和F3H的候选基因的表达,这与花粉发育密切相关。此外,花粉发育和男性生育率的调节受WRKY,BHLH和MYB转录因子家族的影响,其中男性生育率与WRKY的下调和BHLH和MYB的上调相关。因此,这些转录因子可以增强花粉生长和发育,并在小麦中恢复男性生育能力GydF4y2BaAegilops Kotschyi.GydF4y2Ba细胞质。我们的结果表明,负责调节生育恢复的基因在存在的情况下起着重要作用GydF4y2BaAegilops Kotschyi.GydF4y2Ba细胞质,从而为探索调节小麦生育能力变化的分子机制提供依据。GydF4y2Ba
方法GydF4y2Ba
植物材料GydF4y2Ba
该研究材料包括近似同学线KTM3315A(指定为KMA,K-TCMS线GydF4y2BaAegilops Kotschyi.GydF4y2Ba细胞质)和KTM3315R(指定为KMF,一种细胞质雄性肥沃线GydF4y2BaAegilops Kotschyi.GydF4y2Ba这是由西北农林科技大学多年来发展起来的。以不育系KTM3315A为母本,与提供花药的同源保持系TM3315B杂交,获得不育系KTM3315A(不育系繁殖法)。KTM3315R的选育程序如下:中国春季对K-CMS具有较高且稳定的恢复程度(结实率~ 75.00%)[GydF4y2Ba34.GydF4y2Ba],所以我们选择了用KTM3315A杂交的花粉供体杂交的恢复器中国春天GydF4y2Ba1GydF4y2Ba一代KTM3315A和中国春。K-CMS系属属化学性雄性无菌类型[GydF4y2Ba60.GydF4y2Ba]并且雄性配子几乎不能通过雄性配音(〜0.54%)传播,因此我们选择其同源维护者TM3315B作为花粉供体,并将其与F交叉GydF4y2Ba1GydF4y2Ba一代KTM3315A和中国春。作为轮回亲本,TM3315B与FGydF4y2Ba1GydF4y2Ba生成和肥沃的植物被选择生产BCGydF4y2Ba8.GydF4y2BaFGydF4y2Ba1GydF4y2Ba人口。卑诗GydF4y2Ba8.GydF4y2BaFGydF4y2Ba1GydF4y2Ba群体自交5代,形成稳定遗传的近等基因系KTM3315R。育种程序在附加文件中说明GydF4y2Ba12GydF4y2Ba:图S1。GydF4y2Ba
在2016年10月期间,KMF和KMA在西北A&F大学实验站的自然条件下培养,杨凌(34°15'N,108°08'e),中国。在2017年5月期间,在每株植物上随机选择三个尖峰,用于在前级级,直至随后的生育率分析。使用1%acetocarmine鉴定其他尖峰的阶段和肥力,1%iGydF4y2Ba2GydF4y2Ba-ki。从Binucleat阶段的花药被收集为三种生物学重复,20种肥沃的植物和20个无菌植物,来自KMF和KMA的相等量进行测序。肥沃和无菌的花药立即在液氮中冷冻并在-80℃下储存直至使用。GydF4y2Ba
表型性状和显微镜观察GydF4y2Ba
使用尼康E995数码相机(尼康,东京,日本)获得无菌和肥沃的小麦花肿表型的照片,安装在Motic K400解剖显微镜(Preiser Scientific,Louisville,Ky,USA)上。通过用1%acetocarmine染色来鉴定不同的制剂发育阶段[GydF4y2Ba61.GydF4y2Ba]。为了评估成熟花粉颗粒的可行性,在裂开之前在裂开之前的花药被粉碎于1%iGydF4y2Ba2GydF4y2Ba-ki,用i孵育15至20分钟GydF4y2Ba2GydF4y2Ba-Ki,用缓冲液洗涤,然后通过显微镜观察花粉晶粒[GydF4y2Ba62.GydF4y2Ba]。通过扫描电子显微镜(如[)进行扫描电子显微镜,分析阴茎,花药外表皮和三核阶段幼儿孢子。GydF4y2Ba63.GydF4y2Ba]用JSM-6360LV扫描电子显微镜(JEOL,东京,日本)。GydF4y2Ba
RNA提取,cDNA文库构建,Illumina深度测序GydF4y2Ba
总RNA从KMF和KMA植物花药的六个样品,每个具有三个生物学重复提取,根据用于多糖富含植物组织试剂盒(Takara生物工程(大连)有限公司,中国设有RNAiso说明书).RNA浓度和纯度使用NanoDrop 2000分光光度计(Thermo Fisher Scientific公司,威尔明顿,DE,USA)测定。RNA完整性使用RNA纳米6000检测试剂盒为安捷伦生物2100系统(Agilent Technologies公司,圣克拉拉,CA,USA)进行评估。RNA样品通过这三个步骤过后,真核mRNA的用寡(dT)珠富集。然后将富集的mRNA分裂成使用片段化缓冲液和逆转录为第一链cDNA用随机引物的短的片段。第二链cDNA用DNA聚合酶I,RNA酶H,合成的dNTP,和缓冲。将cDNA样品用QIAquick凝胶提取试剂盒(北京蓝博康思农技术有限公司,中国)纯化,最终维修之前,加入聚(A)尾巴,并连接到Illumina测序适配器。连接产物按大小通过琼脂糖凝胶电泳选择之前的PCR扩增和测序使用Illumina HiSeq™2500系统通过Sagene生物科技有限公司(中国广州)。GydF4y2Ba
RNA测序数据分析GydF4y2Ba
通过测序获得的读取包括含有适配器或低质量基础的原始读数,这将影响随后的组装和分析步骤。因此,通过去除含有适配器的低质量读数,未知的核苷酸(以下)来筛选原料读取以获得高质量读取GydF4y2BaNGydF4y2Ba> 10%),低质量碱基50%以上(q值≤20)。短读对齐工具Bowtie2 [GydF4y2Ba64.GydF4y2Ba使用用于将读取映射到核糖体RNA(RRNA)数据库(GydF4y2Baftp://ftp.ncbi.nlm.nih.gov/genbank/GydF4y2Ba).删除映射到RRNA数据库的读取。每个样本的剩余读数被映射到Ensembl版本31 IWGSC1.0 + NC_002762.1参考基因组(版本2.0.3.12)[GydF4y2Ba65.GydF4y2Ba]。使用Cufflinks(版本2.2.1)重建转录本[GydF4y2Ba66.GydF4y2Ba]。用RSEM量化基因丰富(1.2.31)[GydF4y2Ba67.GydF4y2Ba]。使用每百万映射的读数(FPKM)方法的转录物的每千碱基片段标准化基因表达水平。GydF4y2Ba
DEGs的生物信息学分析GydF4y2Ba
使用非冗余蛋白质数据库(NR; NCBI:GydF4y2Baftp://ftp.ncbi.nlm.nih.gov/blast//db/FASTA/GydF4y2Ba).然后将待进一步与彻底组的簇相处(GydF4y2Bahttps://www.ncbi.nlm.nih.gov/cog/GydF4y2Ba)数据库以预测和分类它们的功能[GydF4y2Ba68.GydF4y2Ba],在富集分析根据其基因本体学(GO;GydF4y2Bahttp://www.geneontology.org/GydF4y2Ba)基因和基因组的功能和京都百科全书)(Kegg;GydF4y2Bahttp://www.genome.jp/kegg/genes.htmlGydF4y2Ba途径。此外,分析了GO注释,以确定BLAST2GO计划的参数的主要生物功能[GydF4y2Ba69.GydF4y2Ba](GydF4y2Bahttps://www.blast2go.com/GydF4y2Ba)被用来获得所有参数的Go注释。结果已提交给wego(GydF4y2Bahttp://wego.genomics.org.cn.GydF4y2Ba)为所有DEG生成GO分类图。kegg是与途径相关的主要公共数据库[GydF4y2Ba70GydF4y2Ba]它可以鉴定用于段的主要生化代谢途径和信号转导途径。根据GO和途径浓缩分析结果,选择Q值≤0.05作为在DEG套件中测定富集的重要性阈值[GydF4y2Ba71.GydF4y2Ba]。OmicShare小工具2 (GydF4y2Bahttp://www.omicshare.com/tools/GydF4y2Ba)用于获得没有行和柱簇的热图。GydF4y2Ba
的可溶性糖和类黄酮含量的测定GydF4y2Ba
在加入1ml蒸馏水之前称,在加入1ml蒸馏水之前称称其三种生物重复(Kmb1,Kmf 2和Kmf 3)分别为三种生物重复,分别为以下三种生物重复)或无菌(KMA 1,Kma2和Kma3)。然后将其研磨成匀浆,然后将其倒入2ml离心管中,盖子封闭。将样品在95℃下在水浴中加热10分钟,冷却,然后在8000×g和25℃下进行离心10分钟,然后将上清液倒入10ml试管中。用蒸馏水将体积调节至10毫升,然后用手轻轻摇动约30秒。根据具有植物可溶性糖含量测定套件(苏州Keming Biothnology Co. Ltd.)的指示进行的程序和计算。GydF4y2Ba
通过在通过40目筛后,通过干燥样品(与高于,KMF 1,2,3和Kma1,2,3)的样品(KMF 1,2,3和Kma1,2,3)干燥样品来确定类黄酮含量。Approximately 0.1 g of the crushed sample was weighed and added to 2.5 mL of distilled water, before ultrasonic extraction (ultrasonic power = 300 W, crushing = 5 s, intermittent = 8 s, temperature = 60 °C, extraction = 30 min). The sample was then subjected to centrifugation at 12000 rpm and 25 °C for 10 min, before analyzing the supernatant from the extract. A spectrophotometer was turn on for more than 30 min and the wavelength was adjusted to 502 nm, before zeroing with distilled water and measuring the absorbance of each sample. The operations and calculations were performed according to the instructions provided with a Plant Flavonoid Content Determination kit (Sino Best Biological Technology Co., Ltd., China).
通过定量逆转录PCR确认候选DEGS(QRT-PCR)GydF4y2Ba
为了验证RNA测序检测的DEG,选自12次的代谢途径。用于QRT-PCR的引物用底漆喷射设计(GydF4y2Bahttps://www.ncbi.nlm.nih.gov/tools/primer-blast/GydF4y2Ba)由西安庆科Zexi生物科技有限公司合成。actin基因(Genbank:GQ339766.1)用作标准化将其设定为1的基因表达水平的参考[GydF4y2Ba72.GydF4y2Ba]。如YE所述进行QRT-PCR分析[GydF4y2Ba35.GydF4y2Ba]。用于qRT-PCR的序列特异性引物对列于附加文件GydF4y2Ba13GydF4y2Ba:表S12,具有用于肌动蛋白基因的那些和12个选定的次数。使用每个样品的三种技术复制进行分析。我们计算了使用2的肌动蛋白基因的表达水平 − ΔΔCt方法并相对于肌动蛋白基因的表达水平归一化相对表达水平[GydF4y2Ba73.GydF4y2Ba]。GydF4y2Ba
缩写GydF4y2Ba
- 4CL:GydF4y2Ba
-
4-香豆素 - COA连接酶GydF4y2Ba
- CMS:GydF4y2Ba
-
细胞质雄性不育GydF4y2Ba
- CYP73A:GydF4y2Ba
-
Trans-umnamate 4-单氧基酶GydF4y2Ba
- 度的视角:GydF4y2Ba
-
差异表达基因GydF4y2Ba
- F3h:GydF4y2Ba
-
黄烷酮3-羟化酶GydF4y2Ba
- FC:GydF4y2Ba
-
折叠变化GydF4y2Ba
- FDR:GydF4y2Ba
-
假发现率GydF4y2Ba
- FPKM:GydF4y2Ba
-
每百万百万映射的成绩单每千碱基映射的碎片GydF4y2Ba
- GBA:GydF4y2Ba
-
溶酶体β葡糖苷酶GydF4y2Ba
- 香港:GydF4y2Ba
-
六酮酶GydF4y2Ba
- inv:GydF4y2Ba
-
水解酶beta-fructofuranosidaseGydF4y2Ba
- KEGG:GydF4y2Ba
-
京都基因和基因组百科全书GydF4y2Ba
- KMA:GydF4y2Ba
-
KTM3315AGydF4y2Ba
- KMF:GydF4y2Ba
-
KTM3315RGydF4y2Ba
- Kog:GydF4y2Ba
-
真核外科群体GydF4y2Ba
- K-TCMS:GydF4y2Ba
-
温雄性不育GydF4y2Ba
- 朋友:GydF4y2Ba
-
苯丙氨酸氨 - 裂解酶GydF4y2Ba
- PGAM:GydF4y2Ba
-
2,3- bisphosphoglycerate依赖性磷酸变位酶GydF4y2Ba
- PME:GydF4y2Ba
-
果胶甲基酯酶/甲基酯酶GydF4y2Ba
- scrK:GydF4y2Ba
-
Fructokinase.GydF4y2Ba
- UDP-葡萄糖:GydF4y2Ba
-
尿苷二磷酸 - 葡萄糖GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
刘yj,高平方,唐ym,贡j,张x,王yb,张立会,太阳rw,张q,陈zb等。小麦幼苗和掺入杂交类未染成基因的小麦幼苗和穗组织的转录体分析。Planta。2018; 247(6):1307-21。GydF4y2Ba
- 2.GydF4y2Ba
林C,张C,赵立,兴S,王Y,刘X,元C,Zhao L,Dong Y.细胞质雄性无菌和雄性育叶片叶绿素基因组的测序及多晶型雄性育种。植物SCI。2014; 229:208-14。GydF4y2Ba
- 3.GydF4y2Ba
Bohra A,JHA UC,Adhimoolam P,Bisht D,Singh NP。细胞质雄性不育(CMS)在野外作物中的杂种繁殖。植物细胞代表2016; 35(5):967-93。GydF4y2Ba
- 4。GydF4y2Ba
Ivanov Mk,Dymshits Gm。细胞质雄性不育和高等植物花粉生育的恢复。Genetika。2007; 43(4):451-68。GydF4y2Ba
- 5。GydF4y2Ba
Touzet P,Budar F.揭示两种冲突的基因组在细胞质雄性不育中的分子臂竞争?趋势植物SCI。2004; 9(12):568-70。GydF4y2Ba
- 6。GydF4y2Ba
Fujii S,Toriyama K.细胞核和线粒体之间的基因组屏障被细胞质雄性不育所例子。植物细胞生理。2008; 49(10):1484-94。GydF4y2Ba
- 7。GydF4y2Ba
touzet p,meyer eh。植物中细胞质雄性不育和线粒体代谢。线粒体。2014; 19(PT B):166-71。GydF4y2Ba
- 8。GydF4y2Ba
Saxena KB,Kumar RV,Tikle An,Saxena Mk,Gautam VS,Rao Sk,Khare Dk,Chauhan Ys,Saxena RK,Reddy BVS等。ICPH 2671 - 世界上第一个商业食品豆类杂交。植物品种。2013; 132:479-85。GydF4y2Ba
- 9。GydF4y2Ba
黄杰兹,ZG,张HL,舒QY。用于杂种稻的可行的男性不育系统:遗传学,生物化学,分子生物学和利用。米(n y)。2014; 7(1):13。GydF4y2Ba
- 10.GydF4y2Ba
李永明,卓帆,李艳丽,李川,王静,博晓,吕兵,陶青,文兵,C.玉米CMS-C恢复基因Rf*-A619的初步鉴定(英文)GydF4y2BaZea Mays.GydF4y2Bal .)。peerj。2016; 4:e2719。GydF4y2Ba
- 11.GydF4y2Ba
伊尔库林·洛杉矶,Tsvetova Mi。植物水可用性条件对高粱“9e”CMS诱导细胞质造成雄性肥力恢复的遗传效应。前植物SCI。2012; 3:91。GydF4y2Ba
- 12.GydF4y2Ba
董某,李泽,元FJ,朱股,陈鹏,玉w,杨Qh,傅xj,yu xm,李bq等。大豆细胞质雄性不育的恢复生育率(RF)基因的遗传和精细映射。植物SCI。2012; 188-189:36-40。GydF4y2Ba
- 13.GydF4y2Ba
闫岚,梁开,萌Z,马利克W,Zhu T,Zong X,Guo S,Zhang R:基因组测序的进展将加速棉花分子育种(GydF4y2BaGossypium spp。GydF4y2Ba).3 Biotech 2016,6(2):217。GydF4y2Ba
- 14。GydF4y2Ba
歌曲x,方p,ma l,xi y,胡y,liu s,他b。小麦cms线的比较GydF4y2BaAE。Kotschyi.GydF4y2Ba无1b / 1r型和1b / 1r型的细胞质。Agri北京北京北京科技大学学报(NAT SCI ED)。2002年。GydF4y2Bahttps://doi.org/10.13207/j.cnki.jnwafu2002.01.001GydF4y2Ba.GydF4y2Ba
- 15.GydF4y2Ba
歌曲X,张L,曾j,qian h,李h,李h,他是在较低温度下完全雄性不育的热敏细胞质雄性无菌(Tcms)线的发展,并在较高温度下部分恢复生育能力。Euphytica。2013; 192:393-9。GydF4y2Ba
- 16。GydF4y2Ba
刘志强,张磊,胡国平,宋欣。小麦k型细胞质温敏雄性不育系的细胞学特性GydF4y2BaAegilops Kotschyi.GydF4y2Ba.品种sci。2016; 66:752-61。GydF4y2Ba
- 17。GydF4y2Ba
Suzuki H,Rodriguez-Uribe L,Xu J,张J. CMS-D8棉中细胞质雄性不育和恢复的转录组分析。植物细胞代表2013; 32(10):1531-42。GydF4y2Ba
- 18。GydF4y2Ba
杨P,汉族,黄杰。转录组测序和JA-CMS棉中细胞质雄性不育和维修的转录组序列测序。Plos一个。2014; 9(11):E112320。GydF4y2Ba
- 19。GydF4y2Ba
李Z,程y,崔j,张p,zhao,hu s。比较转录组分析显示碳水化合物和脂质代谢块GydF4y2Ba芸苔栗鸟GydF4y2BaL.化学杂交试剂甲磺脲酯钠诱导的雄性不育。BMC基因组学。2015; 16(1):206。GydF4y2Ba
- 20。GydF4y2Ba
M-X S,Qu C,Fu F,Liu M,Zhao H,Liu C,Li J,Tang Z,Xu X,Qiu X等。无菌和肥沃隐性雄性不育(RGMS)的比较转录组分析GydF4y2Ba芸苔栗鸟GydF4y2Ba线条。Plos一个。2015; 10(12):E0144118。GydF4y2Ba
- 21。GydF4y2Ba
Ishiguro S, Ogasawara K, Fujino K, Sato Y, Kishima Y.花药转录组重复序列的低温响应变化表明水稻株系的胁迫敏感性和花粉不育性。植物杂志。2014;164(2):671 - 82。GydF4y2Ba
- 22。GydF4y2Ba
王S,王C,张XX,陈X,刘JJ,佳XF,贾SQ。转录组De Novo组装和浅层表达基因的卷心子晶型母性无菌性差异。植物理性生物化学。2016; 105:224-32。GydF4y2Ba
- 23.GydF4y2Ba
刘虎,谭m,yu h,li l,周f,杨m,周t,赵玉。芝麻菌肥育和无菌花蕾的比较转录组谱析(GydF4y2Ba胡麻属indicumGydF4y2Bal .)。植物学报。2016;16(1):250。GydF4y2Ba
- 24.GydF4y2Ba
罗宾逊MD,麦卡锡DJ,SMYTH GK。编辑:用于数字基因表达数据的差异表达分析的生物导体包。生物信息学。2010; 26(1):139-40。GydF4y2Ba
- 25.GydF4y2Ba
董X,冯H,徐M,李继,金YK,林捷,邱Z,帕克yd,Ma H,Hur Y.使用新开发的BR300K低聚芯片甘蓝型RAPA中基因雄性不育相关基因的综合分析。Plos一个。2013; 8(9):E72178。GydF4y2Ba
- 26.GydF4y2Ba
周X,刘泽,吉河,冯H.大白菜中多等位基因遗传性雄性不育的肥沃和无菌花蕾的比较成绩单剖析(GydF4y2Ba芸苔CameStris.GydF4y2BaL. SSP。GydF4y2Bapekinensis.GydF4y2Ba).Mol Gen Genomics。2017; 292(5):967-90。GydF4y2Ba
- 27。GydF4y2Ba
谢F,袁杰,李耀,王CJ,唐海,夏耶,杨Qy,万ZJ。转录组分析揭示了大白菜中细胞质雄性不育系的叶状物相关的候选基因(GydF4y2BaBrassica Rapa.GydF4y2BaL. SSP。GydF4y2Ba大白菜GydF4y2Ba).中华医学杂志。2018;19(4):922。GydF4y2Ba
- 28。GydF4y2Ba
张克,叶茹,贾y,张l,宋X. ITRAQ的蛋白质组学分析来自热敏性细胞质男性无菌小麦的Ssterile / uffertileanthersGydF4y2BaAegilops Kotschyi.GydF4y2Ba细胞质。int j mol sci。2018; 19:1344。GydF4y2Ba
- 29。GydF4y2Ba
ClémentC,Burrus M,Audran JC。百年花植物花粉发育过程中的花式器官生长和碳水化合物含量。我是J机器人。1996年; 83(4):459-69。GydF4y2Ba
- 30.GydF4y2Ba
田GW,陈MH,Zaltsman A,Citovsky V. Pollen特异性果胶甲基酯酶参与花粉管生长。Dev Biol。2006; 294(1):83-91。GydF4y2Ba
- 31。GydF4y2Ba
果胶甲基酯酶:在植物生理中具有重要作用的细胞壁酶。植物科学进展。2001;6(9):414-9。GydF4y2Ba
- 32。GydF4y2Ba
姜L,杨股,谢LF,Puah CS,张XQ,杨WC,Sundaresan v,Ye D. Vanguard1编码了果胶甲基酯酶,可增强拟南芥风格和传播道的花粉管生长。植物细胞。2005; 17(2):584-96。GydF4y2Ba
- 33。GydF4y2Ba
林S,Huang L,Yu X,Xiong X,Yue X,Liu T,Liang Y,LV M,Ca J.表征GydF4y2BaBCMF23AGydF4y2Ba和GydF4y2BaBCMF23B.GydF4y2Ba,两个推测与花粉发育有关的果胶甲基酯酶基因GydF4y2Ba芸苔Camestris SSP。中国人GydF4y2Ba.中国人民大学学报(自然科学版);GydF4y2Ba
- 34.GydF4y2Ba
Herdt E,Sutfeld R,Wiermann R.在花药绒毡层分数参与苯丙代谢的酶的产生。Cytobiologie。1978; 17(2):433-41。GydF4y2Ba
- 35.GydF4y2Ba
叶建军,段勇,胡刚,耿新平,张鹏,刘志强,张磊,宋晓霞。小麦KTM3315A转录组分析与育性转化相关候选基因及生物合成途径的鉴定。植物学报,2017;GydF4y2Ba
- 36.GydF4y2Ba
Kang K,Park S,Natsagdorj U,Kim Ys,返回K.甲醇是在脱离稻壳的衰老时合成色氨酸和色氨酸衍生的次生代谢物的内源性引导剂分子。工厂J 2011; 66(2):247-57。GydF4y2Ba
- 37.GydF4y2Ba
Wani Ta,Pandith SA,Gupta AP,Chandra S,Sharma N,Lattoo Sk。两种Chalcone合酶两种同种型的分子与功能性及其表达分析与黄酮类化合物组分GydF4y2Baasiatica asiaticaGydF4y2BaL. Plos一个。2017; 12(6):E0179155。GydF4y2Ba
- 38。GydF4y2Ba
Pelletier MK,Shirley BW。拟南芥幼苗黄芪3-羟化酶的分析。Chalcone合成酶和Chalcone异构酶的坐标调节。植物理性。1996; 111(1):339-45。GydF4y2Ba
- 39。GydF4y2Ba
欧文斯DK,Crosby Kc,Runac J,Howard Ba,Winkel BSJ。拟南芥黄烷酮3B-羟化酶的生化和遗传表征;2008年。GydF4y2Ba
- 40。GydF4y2Ba
关义,孟X,khanna r,lamontagne e,liu y,张某,据称parken开发和拟南芥的功能需要摇头的粘性转录因子。Plos Genet。2014; 10:E1004384。GydF4y2Ba
- 41。GydF4y2Ba
雷R,李X,MA Z,LV Y,Hu Y,Yu D.拟南芥Wrky2和Wrky34转录因子与VQ20蛋白相互作用,调节花粉发育和功能。工厂J. 2017; 91(6):962-76。GydF4y2Ba
- 42。GydF4y2Ba
Mukhtar Ms,Liu X,Somssish Ie。阐明Wrky27在拟南芥中雄性不育中的作用。植物信号表现。2017; 12(9):E1363945。GydF4y2Ba
- 43。GydF4y2Ba
Zou C,江W,Yu D.男性配子体特异性Wrky34转录因子在拟南芥中介导成熟花粉的冷敏感性。J Exp Bot。2010; 61(14):3901-14。GydF4y2Ba
- 44。GydF4y2Ba
刘家,奥巴顿A,MA P. MYB转录因子作为植物苯丙醇代谢调节因子。莫尔植物。2015; 8(5):689-708。GydF4y2Ba
- 45。GydF4y2Ba
Stracke R, Ishihara H, Huep G, Barsch A, Mehrtens F, Niehaus K, Weisshaar B.密切相关的R2R3-MYB转录因子的差异调控控制黄酮醇在不同部位的积累GydF4y2Ba拟南芥蒂利亚纳GydF4y2Ba幼苗。工厂J. 2007; 50(4):660-77。GydF4y2Ba
- 46。GydF4y2Ba
程H,Song S,Xiao L,Soo HM,Cheng Z,谢D,Peng J.Gibberellin作用于茉莉酸盐以控制MyB21,MyB2和MyB57的表达,促进拟南芥的雄蕊长丝生长。Plos Genet。2009; 5(3):E1000440。GydF4y2Ba
- 47.GydF4y2Ba
宋S,齐T,黄H,仁Q,吴d,昌C,鹏W,刘毅,彭Ĵ,谢D.茉莉酸类,ZIM域蛋白与R2R3-MYB转录因子MYB21和MYB24相互作用,对茉莉调控的雄蕊发育拟南芥。植物细胞。2011; 23(3):1000至1013年。GydF4y2Ba
- 48.GydF4y2Ba
蒲根CT,Kim Sh,Kim D,Paek NC。水稻花卉抑制器早期开花1通过调节嗜酸纤毛素信号传导来影响小穗生育率。米(n y)。2015; 8(1):58。GydF4y2Ba
- 49.GydF4y2Ba
Chezem WR,克莱NK。植物次生代谢的调控以及相关的专门细胞的发育受MYBS和bHLHs。植物化学。2016; 131:26-43。GydF4y2Ba
- 50。GydF4y2Ba
陈X,黄鹤,齐T,刘B,宋S.拟南芥中茉莉植物植物生育中Bhlh-Myb综合体的新观点。植物信号表现。2016; 11(2):E1135280。GydF4y2Ba
- 51.GydF4y2Ba
黄酮类生物合成的转录控制:MYB-BHLH-WD40(MBW)复合物的微调。植物信号表现。2014; 9(1):E27522。GydF4y2Ba
- 52.GydF4y2Ba
van dingenen J,Blomme J,Gonzalez N,Inze D.植物从他们的细胞器朋友那里增长了一点帮助。J Exp Bot。2016; 67(22):6267-81。GydF4y2Ba
- 53.GydF4y2Ba
线粒体和核基因的相互作用对雄性配子体发育的影响。植物学报。2004;16增刊:S154-69。GydF4y2Ba
- 54.GydF4y2Ba
张L,Wen A,Wu X,Pan X,Wu n,Chen X,Chen Y,Mao D,Chen L,Luan S.分子鉴定镁运输基因家族GydF4y2Ba芸苔栗鸟GydF4y2Ba.植物理性生物化学。2019; 136:204-14。GydF4y2Ba
- 55。GydF4y2Ba
Li Lg,Sokolov Ln,杨Yh,Li DP,Ting J,Pandy GK,Luan S.拟南芥花粉发育中的线粒体镁转运蛋白功能。莫尔植物。2008; 1(4):675-85。GydF4y2Ba
- 56。GydF4y2Ba
陈继,李丽,刘zh,元yj,郭立,毛dd,田lf,陈某,栾s,李dp。镁转运仪ATMGT9对于拟南芥的花粉发育至关重要。细胞res。2009; 19(7):887-98。GydF4y2Ba
- 57。GydF4y2Ba
Brugiere S, Kowalski S, Ferro M, Seigneurin-Berny D, Miras S, Salvi D, Ravanel S, D’herin P, Garin J, Bourguignon J,等。拟南芥线粒体膜的疏水蛋白组。植物化学,2004;65(12):1693 - 707。GydF4y2Ba
- 58.GydF4y2Ba
Choi DS,Kim NH,Hwang BK。辣椒线粒体甲酸脱氢酶1调节对细菌病原体的细胞死亡和防御反应。植物理性。2014; 166(3):1298-311。GydF4y2Ba
- 59.GydF4y2Ba
Sabar M, Gagliardi D, Balk J, Leaver CJ。ORFB是F1F(O)-ATP合酶的一个亚基:向日葵细胞质雄性不育的基础。EMBO众议员2003;4(4):381 - 6。GydF4y2Ba
- 60。GydF4y2Ba
齐志,石旭,孟L,胡刚,宋旭。k质雄性不育小麦育性恢复基因的遗传特性及稳定性。中国农业大学学报2015;04:02。GydF4y2Ba
- 61。GydF4y2Ba
姚明,叶军,杨志,段勇,孟L,闫平,刘智,张玲,宋欣。小麦5种细胞质雄性不育系的败育特征及育性恢复。麦类作物学报。2015;35(12):1676-84。GydF4y2Ba
- 62。GydF4y2Ba
聚氨酯残雪,韩寒YF,朱年代,歌曲财政年度,赵Y,王CY,张YC,杨问,王J, Bu SL, et al。水稻类受体激酶矮化和Runtish SPIKELET1和2在生殖发育过程中抑制细胞死亡和影响糖的利用。植物细胞。2017;29(1):70 - 89。GydF4y2Ba
- 63。GydF4y2Ba
辛格A,安萨里MW,拉尼V,辛格CP,舒克拉A,潘特RC,Tuteja N,减轻在芒果花腐胺畸形参与班G.第一证据:扫描电子显微镜研究。原生质。2014; 251(5):1255至1261年。GydF4y2Ba
- 64。GydF4y2Ba
Langmead B,Salzberg SL。与Bowtie 2. NAT方法的快速喷射读取对齐。2012; 9(4):357-9。GydF4y2Ba
- 65。GydF4y2Ba
Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg SL. TopHat2:在插入、缺失和基因融合中转录组的精确比对。基因组医学杂志。2013;14 (4):R36。GydF4y2Ba
- 66。GydF4y2Ba
Trapnell C,Roberts A,Goff L,Pertea G,Kim D,Kelley Dr,Pimentel H,Salzberg SL,RINN JL,Pachter L.差分基因和RNA-SEQ实验与Tophat和袖扣的实验分析。NAT PROTOC。2012; 7(3):562-78。GydF4y2Ba
- 67。GydF4y2Ba
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12:323。GydF4y2Ba
- 68。GydF4y2Ba
Tatusov RL,Galperin My,Natale da,Koonin EV。COG数据库:蛋白质功能和演化的基因组规范分析工具。核酸RES。2000; 28(1):33-6。GydF4y2Ba
- 69。GydF4y2Ba
Conesa A,Gotz S.Bast2Go:植物基因组学中功能分析的综合套件。int j植物基因组学。2008; 2008:619832。GydF4y2Ba
- 70。GydF4y2Ba
Kanehisa男,荒木男,后藤S,服部男,平川男,伊藤男,片山T,川岛S,奥田S,Tokimatsu T,等人。KEGG用于连接基因组生命和环境。核酸RES。2008; 36(数据库号):D480-4。GydF4y2Ba
- 71。GydF4y2Ba
GAO Y,Xu H,Shen Y,王J.转录米[转录组分析(GydF4y2Ba奥雅萨苜蓿GydF4y2Ba)使用RNA-SEQ技术的胚乳。植物mol biol。2013; 81(4-5):363-78。GydF4y2Ba
- 72。GydF4y2Ba
庚克,叶茹,杨X,李S,张L,歌曲X.鉴定碳水化合物代谢和能量代谢途径的蛋白质及其对小麦细胞质雄性不育的调控。int j mol sci。2018; 19:324。GydF4y2Ba
- 73。GydF4y2Ba
Livak KJ,Schmittgen TD。使用实时定量PCR和2分析相对基因表达数据 − ΔΔCt方法。方法(San Diego,Calif)。2001; 25(4):402-8。GydF4y2Ba
致谢GydF4y2Ba
我们感谢广州SAGENE BIOTECH公司的帮助,有高吞吐量排序。GydF4y2Ba
资金GydF4y2Ba
中国自然科学基金的补助金提供高吞吐量排序(31771874)。该编辑和出版费得到了农业高新技术产业杨凌国家示范区(2018亿-19)的科学技术方案。GydF4y2Ba
可用性数据和材料GydF4y2Ba
在当前研究期间生成和分析的数据集可从相应的作者获得合理的请求。GydF4y2Ba
作者信息GydF4y2Ba
隶属关系GydF4y2Ba
贡献GydF4y2Ba
XS和LZ构思和设计了这项研究。SL,YJ和JY进行了实验。SL和ZL分析了数据。XY提供了建议和帮助。SL写了所有作者的贡献。XS批判性地修改了手稿。所有作者都阅读并批准了稿件。GydF4y2Ba
通讯作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
不适用。GydF4y2Ba
同意出版物GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
提交人声明他们没有竞争利益。GydF4y2Ba
出版商的注意事项GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:GydF4y2Ba
表S1。GydF4y2Ba测序结果摘要。(XLSX 10 KB)GydF4y2Ba
额外的文件2:GydF4y2Ba
表S2。GydF4y2Ba差异表达的基因。(XLSX 387 kb)GydF4y2Ba
附加文件3:GydF4y2Ba
表S3。GydF4y2Ba基因本体论注释。(XLSX 66 kb)GydF4y2Ba
额外的文件4:GydF4y2Ba
表S4。GydF4y2BaKog类注释。(XLSX 30 KB)GydF4y2Ba
额外的文件5:GydF4y2Ba
表S5。GydF4y2Ba显着丰富的Kegg途径。(XLSX 14 KB)GydF4y2Ba
附加文件6:GydF4y2Ba
表S6。GydF4y2BaWRKY、bHLH和MYB转录因子。(XLSX 12 kb)GydF4y2Ba
附加文件7:GydF4y2Ba
表S7。GydF4y2Ba参与途径的舞台。(XLSX 17 KB)GydF4y2Ba
附加文件8:GydF4y2Ba
表S8。GydF4y2Ba可溶性糖含量。(XLSX 11 KB)GydF4y2Ba
附加文件9:GydF4y2Ba
表S9。GydF4y2Ba类黄酮含量。(XLSX 11 KB)GydF4y2Ba
额外的文件10:GydF4y2Ba
表S10。GydF4y2BaQRT-PCR和RNA测序的基因表达。(XLSX 15 KB)GydF4y2Ba
额外的文件11:GydF4y2Ba
表S11。GydF4y2Ba线粒体功能相关基因。(XLSX 14 KB)GydF4y2Ba
附加文件12:GydF4y2Ba
图S1。GydF4y2Ba近代源性线的育种程序。(DocX 1939 KB)GydF4y2Ba
附加文件13:GydF4y2Ba
表S12。GydF4y2Ba用于QRT-PCR的序列特异性引物。(XLSX 11 KB)GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
李,苏,Z.,贾,Y。GydF4y2Ba等等。GydF4y2Ba与生育恢复与生育候选基因相关的代谢途径分析GydF4y2BaAegilops Kotschyi.GydF4y2Ba小麦的细胞质(GydF4y2BaTriticum aestivum.GydF4y2Bal .)。GydF4y2BaBMC植物BIOL.GydF4y2Ba19,GydF4y2Ba252(2019)。https://doi.org/10.1186/s12870-019-1824-9.GydF4y2Ba
已收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-019-1824-9.GydF4y2Ba
关键词GydF4y2Ba
- 比较转录组GydF4y2Ba
- 细胞质雄性不育GydF4y2Ba
- 黄烷酮3-羟化酶GydF4y2Ba
- 果胶甲基酯酶GydF4y2Ba
- 小麦 (GydF4y2BaTriticum aestivum.GydF4y2BaL.)GydF4y2Ba
- WRKY转录因子GydF4y2Ba