摘要
背景
大高寒草场而且大肠sibiricus是本属的两种重要牧草吗大.但由于种子破碎严重,它们很难用于商业种子生产。我们对脱落区进行了转录组比较分析,以寻找可能与种子碎粒相关的转录变化,探索与种子碎粒相关的候选基因,并识别基于基因的候选EST-SSR标记用于种质评价。
结果
黄豆脱落带(AZ)和非脱落带(NAZ)组织的cDNA文库大肠高寒草场构建并测序。共注释了111667个unigenes,预测了7644个差异表达转录本(DETs),对应于AZ中上调的6936个,NAZ中下调的708个。我们鉴定了489个与转录因子、细胞壁水解或修饰、水解酶活性、植物激素信号和响应、木质素生物合成、信号转导或蛋白质周转相关的候选基因。11个类似的候选基因涉及聚半乳糖醛酸酶活性、水解酶活性和丝裂原激活蛋白激酶在两者的脱落区上调大物种,提示这些基因可能在脱落带发育和种子破碎中具有特定的作用。根据候选基因序列,共开发了67个多态EST-SSR标记。利用14条多态EST-SSR引物对48株植物的遗传多样性进行了研究大肠高寒草场具有不同碎粒习性的基因型。基于分子数据的树状图显示,多数破碎程度相近的材料倾向于聚在一起。
结论
本研究获得的表达数据为未来分子生物学研究提供了重要的资源。许多DETs与脱落带的发育有关,与候选基因相关的EST-SSR位点可能在鉴定植物性状相关标记方面具有潜在的应用价值大肠高寒草场在未来。
背景
种子破碎是野生植物种子传播的重要适应性性状,也是许多谷物作物和牧草在收获期间减产的主要原因[1].在水稻、小麦和大麦等主要作物的早期驯化过程中,低碎粒率被选为最重要的农艺性状之一[2].相比之下,牧草的育种目标主要集中在生物量产量、饲料品质和耐逆性上。因此,许多牧草的种子粉碎改良严重落后于作物种植,尽管种子粉碎是许多牧草品种和野草种的常见特征[2,3.,4].以往研究表明,通过种子收获时的高鲜重选择,可以提高种子产量和牧草产量[5].此外,提高种子保有量并不影响牧草品质,提示种子保有量的选择将是高种子破碎度牧草的重要育种目标之一[6].
大高寒草场而且e . sibiricus哪一个属于这个属大(禾科:小麦科),是两种重要的多年生草本植物,主要分布在中国西部和北部的高海拔地区[7].当两个大该品种具有良好的牧草产量和品质,以及优异的耐寒性和耐旱性,在人工牧场和天然草地上被广泛用作饲料作物。尽管他们的经济重要性,这两个大由于严重的种子破碎,这些品种很难用于商业种子生产。在以往的研究中,我们发现这两种植物的野生品种和栽培品种的种子破碎程度较高大物种(1,8].事实上,如果由于某些不利条件而延迟收割,种子粉碎可能导致高达80%的种子产量损失[3.].因此,选择两种植物的种子保存和提高种子破碎率是育种的重要目标。
种子破碎是一个复杂的过程,受植物细胞结构、代谢和推定基因表达高度协调的变化所控制。先前的研究表明,种子破碎与位于花梗连接处的脱落层的形成、发展和降解高度相关[9,10].在许多谷物中,种子的保留是由于脱落层的丧失[9].许多牧草在抽穗期具有明显的脱落层[6,11].野生植物和栽培植物的种子破碎率差异是由于脱落层降解程度不同造成的。之前的一项研究大肠sibiricus高碎粒基因型的脱落层降解程度较高[10].同时,落粒习性是一种复杂的性状,受多种基因的控制和调控。12].迄今为止,许多粉碎基因已在几种作物中被报道。在水稻中鉴定和克隆了主要的碎粒基因,包括SH4[13),qSH1[14),OsCPL1[15),SHAT1[16),而SH5[17].SH4,是一个主要的种子破碎QTL,它编码一个具有Myb3 DNA结合域的转录因子,负责减少种子破碎[13].qSH1是另一个重要的种子破碎QTL,它编码bel1型同源盒基因并调节脱落带的形成[14].在拟南芥中,小麦bel1样基因的过表达可调控花器官的脱落TaqSH1[18].小麦驯化的主要基因问调控植物结构和种子传播[19].粉碎1(Sh1),它编码YABBY转录因子,调节高粱种子的破碎[20.].在玉米、Sh1染色体1和5上的同源基因已被鉴定为与种子破碎相关的主要qtl [19].
相比之下,关于牧草种子破碎的研究非常有限。在杂交种LG6a上鉴定出一个主要效应的种子保留QTLLeymus(Triticeae) wildryes [21].一个mikc型MADS-box基因EnWM8被克隆大肠高寒草场[18].我们之前对脱落带的转录组研究大肠sibiricus鉴定出超过7000个差异表达的基因,并表明许多推测参与水解酶活性、植物激素信号和木质素生物合成的基因在高碎籽基因型的脱落带组织中上调[10].但目前尚不清楚这些是否大肠sibiricus候选基因可以在其他大物种如e .高寒草场建议鉴别不同品种间调节种子破碎的基因大物种是至关重要的。
为了更好地了解种子破碎的机理大种,探索与种子落粒相关的候选基因,并筛选出基于基因的候选EST-SSR标记用于种质评价,对两者的脱落带进行了转录组比较分析大物种。本研究的结果将有助于更好地认识这两种植物的碎粒现象,并为它们的遗传改良和标记辅助选择提供参考大物种。
方法
RNA提取
在RNA提取前,利用组织学分析,包括纵向和横切面,以及扫描电子显微镜检查花梗连接。在开颅后14天对花梗结构进行组织学分析大肠高寒草场.为了检测不同时期脱落层的发育情况,选取21和28 DAH时的花梗组织大肠sibiricus.用扫描电镜观察种子剥离后的花梗连接处。根据Zhao等人描述的方法进行组织学分析。[11].脱落带(AZ)和非脱落带(NAZ)组织大肠高寒草场采于开颅后14 d。脱落途径包括脱落区形成与发育、脱落信号响应、脱落激活、脱落层分化四个主要步骤[10].种子在21dah时通常会出现碎粒现象,在此时间点之前,许多与种子碎粒有关的基因应该被激活,因此收集14dah时的组织。脱落区(AZ)由约1毫米的花梗区域和1.5毫米的花组成[13,15].每个花梗的其余区域称为非脱落区(NAZ)。每次重复采集约30毫克组织。根据植物总RNA试剂盒(TIANGEN, Beijing, China)的制造商说明从每个组织中提取总RNA。使用安捷伦2100生物分析仪(Agilent Technologies, Inc.)测量RNA浓度和质量。Waldbronn,德国)。试验共进行3个生物重复。
cDNA文库和RNA-Seq的构建
来自AZ和NAZ组织的高质量RNA样本被送往中国杨凌育种生物技术公司进行cDNA文库构建和转录组测序。用富磁Oligo (dT)磁珠富集poly (A) mRNA,然后破碎成短片段。以这些被裂解的mRNA片段为模板,利用随机六聚物引物合成了第一条cDNA链。加入DNA聚合酶I (New England BioLabs)和RNase H (Invitrogen)、缓冲液和dNTPs合成第二条链。然后使用T4 DNA聚合酶和Klenow DNA聚合酶进行末端修复和磷酸化。然后,在修复的cDNA片段的3 '端插入一个' a '碱基作为悬垂物。将cDNA片段连接到测序适配器上,用琼脂糖凝胶电泳纯化所需长度的DNA片段,并进行PCR扩增收集。最后将纯化的cDNA文库用Illumina HiSeq™4000 (Illumina Inc.)进行测序。美国),使用Chrysalis 36 cycles v 3.0测序试剂盒,从片段两端(“成对两端”)读取2 × 101 bp,插入距离为180 bp进行组装。
序列过滤、从头组装和注释
通过过滤适配器序列、重复序列和q值≤20且' N '碱基不明确的低质量reads,从原始数据中获得高质量的clean read。然后,对高质量reads进行De novo转录组组装,使用trinity程序获得unigenes [22].用BLASTX (e值≤1e-5)在NCBI非冗余蛋白序列(Nr)、基因本论(GO)、同源组簇(COG)、真核同源组(KOG)、蛋白族(Pfam)、注释蛋白序列数据库(Swiss-Prot)和京都基因与基因组百科(KEGG)等数据库中进行单基因序列的注释。生物过程、细胞成分和分子功能的GO注释使用Blast2GO软件[23],使用WEGO软件对unigenes进行GO功能分类[24].
差异表达基因(DETs)分析
将转录本映射到assembly上,使用SOAPaligner计算每个转录本的计数,使用Mortazavi等人描述的Fragments Per Kilobase Per Million Fragments mapped (FPKM)方法确定单基因表达水平。[25].日志的公式2(FC)用于计算转录本折叠变化,多个测试的校正使用错误发现率(FDR)控制方法[26].以FDR≤0.01,log2 (FC)的绝对值≥1为阈值,识别显著DETs。使用STEM软件对det进行聚类p≤0.05 (27].氧化石墨烯富集分析使用agriGO [28].使用KOBAS 2.0对DETs进行KEGG途径富集分析[29].
实时定量PCR (qRT-PCR)对RNA-seq数据的验证
为了定量确定转录组数据的可靠性,采用qRT-PCR方法对随机选择的16个DETs的表达进行分析。用于RNA- seq分析的总RNA的一部分用于qRT-PCR的cDNA。qRT-PCR是根据SYBR预配Ex Taq™II定量PCR系统(Takara,大连)按照制造商的说明进行的,反应发生在Bio-Rad iQ5实时PCR仪(Bio-Rad, Hercules, CA, USA)上。基因特异性引物使用Primer Express软件(Applied Biosystems)设计,并在附加文件中显示1S1:表。相对于内参基因计算这些DETs的表达水平GAPDH使用2-ΔΔCt方法(30.].每次qRT-PCR分析均在3个重复中进行,实验在3个生物重复中进行。
基于基因的EST-SSR标记开发
使用简单序列重复识别工具程序在差异表达的基因序列中检测SSRs。EST-SSR引物采用Primer3 (http://bioinfo.ut.ee/primer3-0.4.0/),设计的EST-SSR引物由上海桑工生物工程技术有限公司合成。
植物遗传多样性分析材料
一共12个大肠高寒草场采用基于候选基因的EST-SSR标记验证和遗传多样性分析(表4),包括两个对照板(高碎粒和低碎粒)1).在甘肃榆中兰州大学试验站(北纬35°34′,东经103°34′,海拔1720 m)的田间小区共种植48株单株。通过测量从花梗上分离种子所需的断裂抗拉强度(BTS)来确定每个附加的种子破碎水平[7].它有一个穗状花序包含15-28个小穗。在种子成熟阶段,随机选取各植株的20个小穗进行测定,计算其平均BTS值。
DNA提取和聚合酶链反应(PCR)扩增
收集每个个体的新鲜叶片组织,冻干,并使用SDS(十二烷基硫酸钠)方法提取DNA [31].DNA的数量和质量使用NanoDrop ND1000分光光度计(Thermo Scientific, USA)和琼脂糖凝胶电泳测定。然后将DNA样品稀释到25 ng/μL,保存在−20℃下,按照Zhang等人描述的方法进行PCR扩增、SSR基因分型和电泳过程。[7].
数据分析
14条引物扩增出的清晰可重复条带分别为存在(1)和缺失(0),利用二元矩阵数据进行进一步的遗传多样性分析。各引物的多态性信息含量(PIC)值的计算采用前人报道的方法:PIC = 1 -p2- - - - - -问2,在那里p当前频带的频率和问是无频带的频率[7].利用POPGENE 1.31程序分析这些个体之间的两两遗传分化和遗传距离[32].基于Jaccard遗传相似系数,采用非加权算术平均对组方法(UPGMA)构建树状图[33].48人的遗传结构大肠高寒草场使用STRUCTURE v 2.3.4软件对个体进行分析,方法由Zhang等人描述。7].
结果
转录组测序和组装
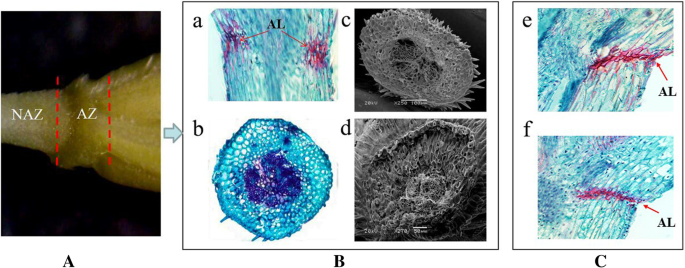
游离层(AL)可见于大肠高寒草场而且大肠sibiricus对脱落区进行组织学分析。纵断面解剖研究表明,AL位于每朵小花下方的小穗状花序中,同时发生在两朵小花的维管束两侧大物种。观察到脱落层的降解大肠sibiricus21dah时(图。1).目的:筛选在黄芪非脱落带(NAZ)和脱落带(AZ)中差异表达的候选基因大肠高寒草场,从NAZ和AZ组织RNA样本中构建6个cDNA文库,并进行3个生物重复,然后使用Illumina HiSeq™4000平台进行测序。经过清理和检查,我们总共获得了36.64 Gb的清洁数据,分别对应于NAZ和AZ中的60.93和6021万个清洁读取(Table2).通过对GenBank COG、GO、KEGG、KOG、Pfam、Swiss-Prot和Nr数据库的Blast检索,共鉴定出137,888个N50长度为1191 bp的unigenes,其中111,667个unigenes被注释在至少一个数据库中(表1)3.,4).总共获得了21.05 Gb的干净数据大肠sibiricus脱落区转录组数据(https://www.ncbi.nlm.nih.gov/biosample/6545378),分别对应AZ-21(航向后21天)和AZ-28(航向后28天)的4238和4234万个clean reads。
qRT-PCR验证RNA-seq表达
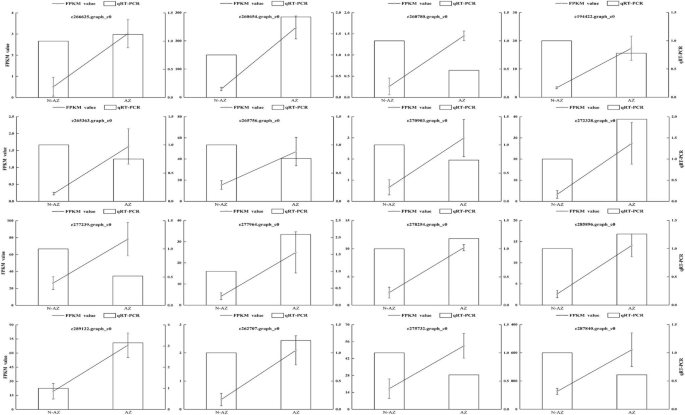
为了证实我们的转录组数据的可靠性,我们使用实时定量PCR (qRT-PCR)检测了随机选取的16个转录本的表达倍数变化,并进一步与RNA-Seq数据进行比较。在本研究中,我们使用非脱落区(NAZ)作为相对表达分析的基准。根据我们的结果,在脱落区有8个基因上调(图。2).正相关系数(r= 0.72,p线性回归分析得到< 0.05),说明qRT-PCR测定的16个转录本的表达谱与RNA-seq数据基本一致。
差异表达转录本(DETs)和注释
研究两种植物种子破碎的基因表达变化,并探讨可能参与种子破碎的基因大物种。分别鉴定了差异表达的转录本大肠高寒草场非脱落区(NAZ)和脱落区(AZ),以及不同发育阶段(脱粒后21天和28天)大肠sibiricus,分别。在大肠高寒草场我们鉴定了7644个差异表达转录本(DETs),其中NAZ下调708个,AZ上调6936个大肠sibiricus,我们在脱落带中鉴定了2681个差异表达基因(DETs),其中1458个unigenes在抽穗后21天上调,1223个unigenes在抽穗后28天下调。在7个公共数据库中检索到7303和2214个DETs注释大肠高寒草场而且大肠sibiricus分别为(表5).
为了揭示DETs中显著富集的氧化石墨烯术语,通过agriGO网站对氧化石墨烯的功能意义进行了富集分析。在三个主要的氧化石墨烯类别中,分别列出了10个最显著丰富的氧化石墨烯术语1:表S1)。“氧化还原过程”、“水解酶活性、水解o -糖基化合物”和“过氧化氢酶活性”在两者中较为常见大物种。
为了表征转录组的复杂生物学行为并进一步探索差异表达转录本的生物学功能,所有DETs都进行了KEGG途径富集分析(附加文件2:图S1)。总共有1586个det被注释并分配到KEGG通路大肠高寒草场.最具代表性的途径是“内质网蛋白加工”(64,4.0%)、“RNA转运”(51,3.2%)、“嘌呤代谢”(48,3.0%)、“过氧化物酶体”(47,2.9%)和“氧化磷酸化”(46,2.9%)。在大肠sibiricus929个DETs被注释并分配到KEGG通路。最具代表性的途径是“碳代谢”(63,6.8%)、“氨基酸生物合成”(46,4.9%)、“内质网蛋白加工(31,3.3%)”、“糖酵解/糖异生”(30,3.2%)和“氧化磷酸化”(29,3.1%)。一些DETs在“植物激素信号转导”和“苯丙类生物合成”等其他途径中被注释和分配。例如,13个来自脱落区组织的unigenes大肠sibiricus在“植物激素信号转导”途径中有注释。在“苯丙类生物合成”途径中,分离带组织中23个unigenes大肠高寒草场对6种可能与木质素生物合成有关的酶进行了注释和编码。
比较转录组分析发现了两个种子破碎的候选转录本大物种
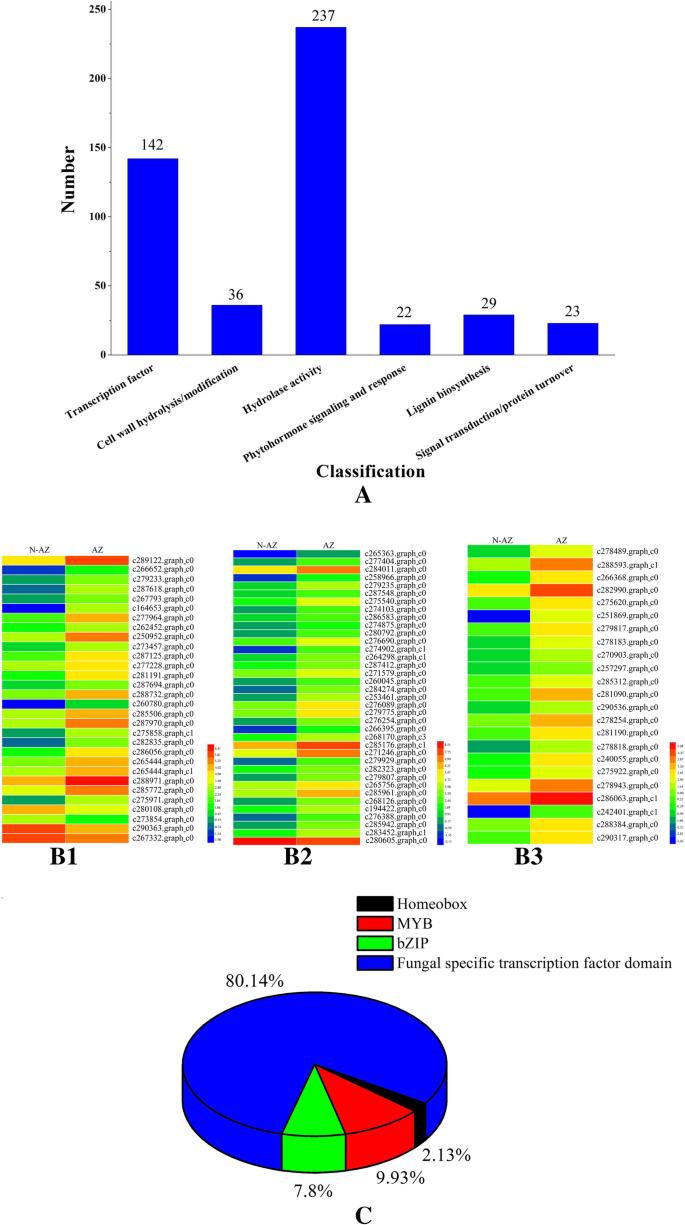
确定与种子破碎有关的候选基因大肠高寒草场我们进一步比较和分析了非脱落区(NAZ)和脱落区(AZ)之间的489个det(附加文件)3.:表S2)。根据注释,这些DETs被分为6个主要的功能群:转录因子(142)、细胞壁水解或修饰(36)、水解酶活性(237)、植物激素信号转导和响应(22)、木质素生物合成(29)、信号转导或蛋白质周转(23)(图)。3.).142个转录因子基因包括3个同源盒基因、14个MYB基因、11个bZIP基因和114个真菌特异性转录因子,其中139个基因在脱落区上调(图4)。3.c).总共有26种参与木质素生物合成的DETs在脱落区上调(图5)。3.B1)。参与细胞壁水解或修饰的DETs共有36个,其中涉及纤维素酶活性、聚半乳糖醛酸酶活性和果胶裂解酶活性的基因分别有19个、9个和7个在脱落区上调(图。3.B2)。特别是,与NAZ相比,AZ中所有参与植物激素信号和反应的DETs均上调,其中生长素、脱落酸、乙烯、赤霉素和细胞分裂素分别表达2、4、6、4和7个DETs(图1)。3.B3)。为了确定与脱落层发育相关的候选基因,我们进一步分析了21 ~ 28个DAH之间的116个DETs大肠sibiricus(附加文件4:表S3).根据注释将这些DETs分为转录因子(47个)、细胞壁水解或修饰(23个)、植物激素信号与响应(30个)、木质素生物合成(1个)、信号转导(6个)和过氧化物酶(9个)5个主要功能类群。47个转录因子基因中包括13个同源盒基因、12个MYB基因、16个bZIP基因、3个mmas -box基因和3个bHLH基因,未发现真菌特异性转录因子大肠sibiricus转录组数据。抽穗后28天,47个转录因子基因中有18个在脱落区表达上调。
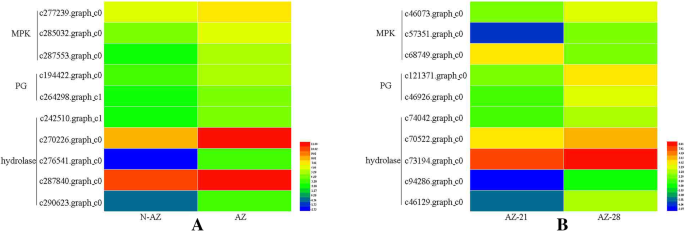
我们进一步比较和分析了在大肠高寒草场候选基因大肠sibiricus转录组数据。共发现11种DETs与AZ-21和AZ-28预测的DETs相似大肠sibiricus经序列比对,包括3个基因(c279235。graph_c0 c264298。Graph_c1, c194422.graph_c0)参与多聚半乳糖醛酸酶活性的5个基因(c287840。graph_c0 c242510。graph_c1 c270226。graph_c0 c290623。Graph_c0, c276541.graph_c0)参与水解酶活性,3个基因(c285032. Graph_c0)参与水解酶活性。graph_c0 c277239。Graph_c0, c287553.graph_c0)参与丝裂原激活蛋白激酶。11种det在脱落区上调大肠高寒草场并在不同发育阶段的脱落带中有差异表达e . sibiricus这表明这些基因可能与脱落带的发育和种子粉碎有关(图。4).
基于基因的EST-SSR候选标记开发及其在遗传多样性分析中的应用
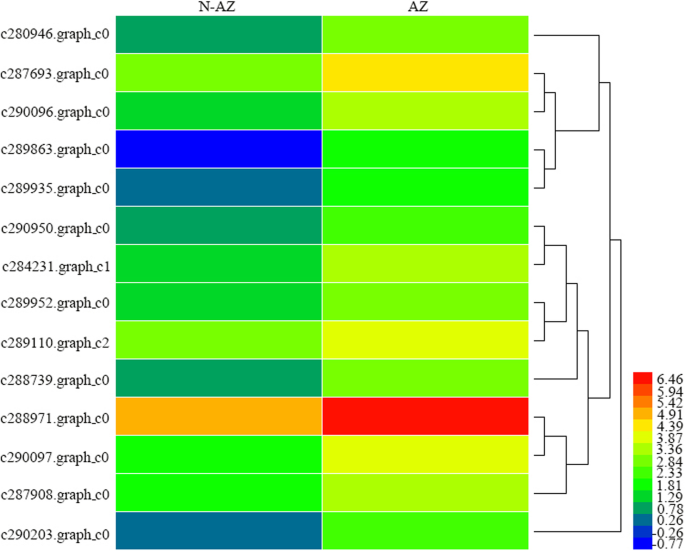
共设计了300对EST-SSR引物,针对种子破碎相关的候选基因5:表S4)。为了验证,这些引物被随机选择5个进行扩增大肠高寒草场基因型,67条引物具有多态性。最后,利用14个多态EST-SSR引物对48份材料进行了遗传多样性研究大肠高寒草场基因型。用于EST-SSR标记开发的14个候选基因在脱落区上调(图1)。5).这些基因的功能注释表明,它们参与水解酶活性、转录因子和木质素生物合成。在本研究中,共检测到175个波段。每个引物的扩增条带范围从7 (c287908。graph_c0 c284231。Graph_c1,和c280946.graph_c0)到18 (c290097。Graph_c0和c290950.graph_c0),平均值为12.5。多态信息含量(PIC)变化范围为0.220 (c287908.graph_c0) ~ 0.370 (c289935.graph_c0),平均为0.3186).
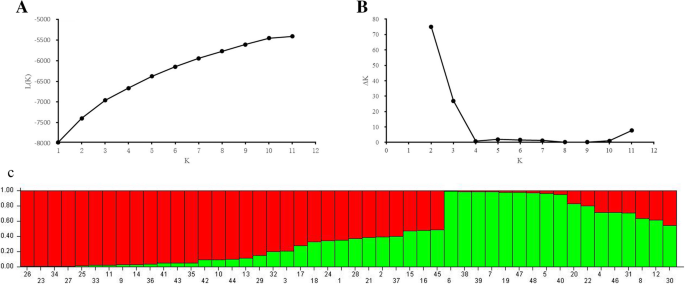
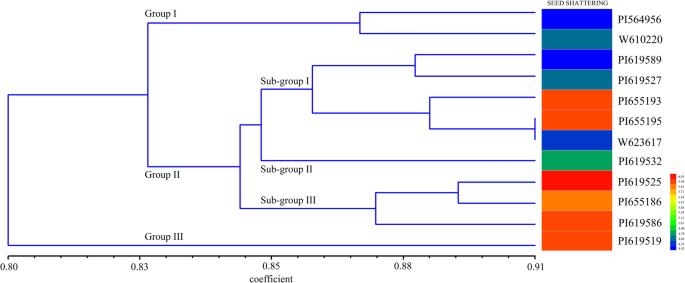
利用STRUCTURE软件对48个基因型的遗传结构进行分析。根据最大似然和K (△K)值时,这些基因型的最佳组数为2。6).1组由31个基因型组成,2组由17个基因型组成。UPGMA聚类分析表明,当遗传相似性值为0.83时,大部分材料可被划分为两个主要类群(图1)。7).第1组含有2个低碎粒系(PI564956和W610220)。第2组分为2个亚组,将PI619525、pi655186和PI619586 3个高碎粒材料归为一组,其余6个材料归为同一亚组。有趣的是,第3组的种子破碎率最高的是pi619519。一般来说,具有相似种子破碎习性的品系倾向于组合在一起。利用EST-SSR标记对不同碎粒习性的基因型进行了区分。
讨论
脱落区细胞壁降解基因上调
以往对主要作物的研究[16和多年生黑麦草等牧草[6的研究表明,种子的脱落通常是由位于每个小花下方的穗状花序中脱落层的发育引起的。脱落与细胞壁成分的裂解和降解有关。研究发现,种子破碎程度与脱落层降解程度之间存在相关性,表明脱落区水解酶活性的提高有助于种子破碎程度的提高[10,11].我们的转录组分析显示,细胞壁水解或修饰的36个DETs在脱落区上调。这些基因包括纤维素酶(CE)、聚半乳糖醛酸酶(PG)和果胶裂解酶。CE和PG对脱落层的降解有至关重要的作用,从而导致种子和其他器官的破碎[34,35].伴随器官分离的是包括CE和PG在内的几种细胞壁水解酶活性的增加。种子破碎率高的材料在种子成熟阶段的脱落区有较高的CE和PG活性[10,11].纤维素酶是最早被报道的水解酶,在植物器官脱落过程中,纤维素酶在植物细胞壁松动过程中起着关键作用[36].在大米、OsCel9D基因,编码一个endo1,4,-β-葡聚糖酶基因,在脱落过程中对细胞壁结构和成分的改变起着重要的作用,该基因的突变通过降低细胞伸长和纤维素含量,增加果胶含量,从而阻碍种子碎粒中的脱落过程[37].聚半乳糖醛酸酶是另一种水解细胞壁果胶的重要酶。PG已被证实可促进各种植物器官如叶、花、果实和种子的细胞分离和脱落[38,39].PG基因在番茄花梗发生脱落时强烈上调[40和柑橘叶[41].此外,脱落区PG基因的高表达与种子的高碎粒率有关大肠sibiricus[11].先前的一些报道也表明果胶酸裂解酶在分离过程中的潜在作用,因为果胶酸裂解酶可以通过催化a-1,4-连接的半乳糖醛酸的消除裂解来解聚果胶。对于花器官,花瓣脱落需要大量溶解富含果胶的中片,果胶裂解酶的激活被认为是中片溶解的重要步骤[42].许多拟南芥果胶酸裂解酶样基因在生长发育的许多方面都是必需的[43].
脱落过程中植物激素途径的复杂调控
脱落酸、乙烯和细胞分裂素等植物激素在调节植物广泛的生长发育过程中发挥着重要作用[10].乙烯是植物器官如开花、叶子和种子脱落的重要调节因子[44].植物器官中乙烯含量高通常与组织衰老和细胞应激有关[45].乙烯不敏感的突变体拟南芥etr1表现出花部分脱落的延迟[46].在本研究中,我们发现5个乙烯受体基因(ETR1)在脱落区较非脱落区表达上调,提示这些乙烯响应基因在调控脱落中的作用。此外,我们还发现有7个与细胞分裂素相关的基因在脱落区上调。细胞分裂素是一种植物生长调节剂,对参与代谢的一些酶的活性有影响。酯酶是一种水解酶,其活性在细胞分裂素的影响下显著提高[47].器官脱落过程中果胶酯酶数量的表达增加[48].此外,在番茄花脱落带的脱落相关转录组分析显示,在脱落过程中,多种植物激素信号基因上调[40].植物器官(包括叶、芽、花瓣、果实和种子)的脱落是一个复杂而高度协调的过程,涉及脱落区发育、植物激素水平、代谢和基因表达的多重变化[11,49].根据我们目前的数据,很难确定调控和决定脱落过程的关键激素基因。这些植物激素的平衡和相互作用可能是关键因素。
转录因子基因
转录因子在信号转导途径中扮演重要角色,并协调细胞的基因表达控制[50].在本研究中,我们发现了142个转录因子基因。许多报道的水稻碎粒基因是转录因子之类的基因qSH1而且SH4。qSH1是bel1型同源异构体基因[14),而SH4编码具有myb3 DNA结合结构域的转录因子[13].许多MYB蛋白是调控植物器官脱落的乙烯、生长素、脱落酸等多种激素介导的转录级联反应的关键成分[51].在研究中,3个同源盒基因和14个MYB基因在脱落区上调。bZIP转录因子也是转录因子家族的重要成员.几个bZIP转录因子基因喜欢OsABF2[52),OsbZIP23[53都与荷尔蒙信号有关。以前,几个tga型bZIP基因被认为是调控脱落相关基因表达的基因[54].11个bZIP基因的表达上调大肠高寒草场可作为积极的调节。大多数报道的真菌特异性转录因子影响植物的致病性。真菌特异性转录因子编码基因Vdpf被证明与营养生长和毒力有关黄萎病dahliae[55].Fungal-specific转录因子AbPf2激活的致病性链格孢属brassicicola[56].之前的研究也报道了真菌特异性转录因子并不完全局限于真菌特异性功能。这意味着在进化的某个时刻,其他转录因子的一些一般功能已经转移到真菌特异性转录因子[50].有趣的是,142个转录因子基因中有114个是真菌特异性转录因子,特异性表达于脱落区,表明这些基因可能影响脱落区的发育和降解。然而,真菌特异性转录因子在种子脱落中的潜在作用大肠高寒草场在很大程度上仍是个未知数.
基于EST-SSR的种子破碎辅助选择候选基因标记
小说的发展大破碎性改良种质的建立有赖于破碎性的准确评价。形态鉴定的准确性往往受到环境因素的影响。与形态鉴定相比,与重要农艺性状密切相关的DNA标记在通过标记辅助选择(MAS)提高性状选择精度和育种效率方面具有巨大潜力[57].迄今为止,已经开发了多种分子标记,如扩增片段长度多态性(AFLP)、限制性片段长度多态性(RFLP)、简单序列间重复(ISSR)、序列相关扩增多态性(SRAP)、起始密码子靶向(SCoT)和单核苷酸多态性(SNP)。其中,SSR (simple sequence repeat, SSR)标记丰富、共优势、重现性高、多态性强。由随机基因组序列开发的传统SSR标记与功能基因的连锁存在不确定性,而基于候选基因序列的SSR或EST-SSRs与农学重要位点连锁的可能性更大[58].因此,基于特定性状相关候选基因的SSR标记的开发,可以极大地促进标记辅助选择育种计划的目标性状。肖等人。[59]利用转录组数据开发了182个与油棕耐冷性相关的SSR基因标记,认为这些SSR标记对不同耐冷性油棕种质的基因定位和群体结构分析具有重要意义。Tranbarger等人[60].基于推测的与生长发育过程中转录后和转录调节功能相关的基因,开发了SSR标记Elaeis guineensis.这些多态标记为分子育种策略提供了工具。Molla等人[61]鉴定并分析了19个新的基于水稻SSRs的盐责任候选基因。基于分子数据的树状图显示,这些标记可以区分盐感和耐盐基因型。在本研究中,涉及bZIP转录因子、水解酶活性和木质素生物合成的14个种子破碎候选基因在脱落区上调,表明它们可能与AZ的发育或种子破碎有特异性或强相关性。既往研究表明,脱落过程中bZIP转录因子可能调节下游过程,主要与ABA相关[50].先前的转录组分析大肠sibiricus报道了许多木质素生物合成相关基因在脱落带的差异表达[9].在水稻中,bel1型同源异构体基因SH5该基因可抑制木质素的生物合成,在非碎粒品种中过表达导致小穗基部木质素含量降低,导致种子碎粒增加[16].以EST-SSR标记为基础,对14个候选基因进行了遗传多样性评价,并对6个高碎粒和6个低碎粒的遗传多样性进行了验证大肠高寒草场登记入册。树状图显示,多数种子破碎程度相近的材料倾向于聚在一起。结果表明,这些标记有可能作为植物多样性分析的新候选标记大肠高寒草场具有不同种子破碎习惯的品种。
结论
在本研究中,我们描述了脱落区和非脱落区分化的rna测序大肠高寒草场进入后21天和28天AZ发育大肠sibiricus。此外,开发了基于基因的多态EST-SSR候选标记并对其进行了表征。测序结果显示,在AZ和NAZ组织之间预测了7644个DETse .高寒草场其中候选基因489个。特别是涉及聚半乳糖醛酸酶活性、水解酶活性和丝裂原激活蛋白激酶的11个相似候选基因在两者的脱落区上调大物种。这些转录本为进一步测试和发展低粉碎提供了假设大种质。同时,利用14个基于基因的多态候选EST-SSR标记,对该植物的遗传多样性进行了研究大肠高寒草场粉碎程度不同的材料。这些结果表明,与候选基因相关的EST-SSR位点在性状相关标记的鉴定中具有潜在的应用价值大肠高寒草场。
缩写
- 阿兹:
-
离层区
- BTS:
-
断裂抗张强度
- CE:
-
纤维素酶
- 齿轮:
-
同源群的聚类
- 长音:
-
天后标题
- 依据:
-
差异表达文字记录
- 罗斯福:
-
错误发现率
- FPKM:
-
每千碱基每百万片段映射
- 走:
-
基因本体论
- KEGG:
-
京都基因和基因组百科全书
- KOG:
-
真核生物的同源组
- Nr:
-
冗余蛋白质序列
- 包含了:
-
蛋白家族
- 答:
-
聚半乳糖醛酸酶
- 存在:
-
定量实时聚合酶链反应
- QTL:
-
数量性状位点
- SNP:
-
单核苷酸多态性
- Swiss-Prot:
-
注释蛋白序列数据库
参考文献
- 1.
赵晓红,蒋旭,赵凯,赵晓红,尹杰,谢广伟。低摔粒率种质的筛选及农艺性状评价大sibiricusL.(中文附英文摘要)。植物遗传资源。2015;16:691-9来源:http://www.zwyczy.cn/ch/reader/view_abstract.aspx?file_no=20141107001.
- 2.
董燕,王永忠。种子粉碎:从模型到作物。前沿植物科学2015;6:476http://europepmc.org/backend/ptpmcrender.fcgi?accid=PMC4478375&blobtype=pdf.
- 3.
尤敏明,刘建平,白淑琴,张晓强,闫俊杰。小麦籽粒破碎、种子发育与产量性状关系的研究大sibiricusL(中文附英文摘要)。西南农业科学学报2011;24:1256-60http://www.cnki.com.cn/Article/CJFDTotal-XNYX201104005.htm.
- 4.
刘志军,陈勇,孟J,吴东波,周启勇,刘贵光。种子破碎及相关性状羊草(中文附英文摘要)。草地学报,2013;21(1):152-8http://en.cnki.com.cn/Article_en/CJFDTOTAL- CDXU201301027.
- 5.
Wijk AJPV。改良牧草和种子产量的育种Selaria sphacelata(舒马克)葡萄球菌和前莫斯哈伯德。农业研究报告,1980;74(74):781-4。http://edepot.wur.nl/211515.
- 6.
李志强,李志强,李志强。多年生黑麦草的脱落和种子破碎(多年生黑麦草l .)。Euphytica. 1988; 39:51-7可从:https://link.springer.com/article/10.1007%2FBF00043367.
- 7.
张振英,谢文伟,张景春,赵晓红,赵永强,王逸尔。基于表型和ssr的两种重要基因间和内部遗传变异的估计大s中国西部和北部的种。基因学报。2018;9(3):147https://www.ncbi.nlm.nih.gov/pubmed/ 29518961.
- 8.
赵永强,张建军,赵晓华,张志智,张建强,王逸君,谢文伟。种子破碎性评价及农艺性状分析大高寒草场(中文附英文摘要)。草业科学。2017;34:1711-20http://www.cnki.com.cn/Article/CJFDTotal-CDXU201301027.htm.
- 9.
时机决定一切:在美国杂草水稻中,脱落层的早期降解与种子破碎的增加有关。BMC Plant Biol. 2011; 11:1-10http://www.cnki.com.cn/Article/CJFDTOTAL-CYKX201708019.htm.
- 10.
谢文伟,张春江,赵晓红,张志英,王若燕大sibiricus该研究揭示了可能与种子破碎有关的候选基因的新见解。BMC Plant Biol. 2017;17:78可从:https://www.ncbi.nlm.nih.gov/pubmed/28431567.
- 11.
赵晓红,谢文伟,张春春,张志英,王若燕。黄花苜蓿种子破碎的组织学特征、细胞壁水解酶活性及候选基因表达大sibiricus登记入册。植物科学进展2017;8:606。可以从:http://pdfs.semanticscholar.org/9ab2/b50da7a800726debe252c73cb8cc95f9bca8.pdf.
- 12.
Onishi KO, Takagi KT, Kontani MK, Tanaka T, Sano Y.两个主要qtl在水稻驯化过程中导致种子破碎减少的不同系谱关系模式基因组。2007;50:757-66http://www.nrcresearchpress.com/doi/abs/10.1139/G07-051.
- 13.
李超,周安,桑涛。减少落粒的水稻驯化。科学。2006;311:1936-9https://www.ncbi.nlm.nih.gov/pubmed/16527928.
- 14.
小西S,井泽T,林SY, Ebana K, fuuta Y, Sasaki T,矢野M.一个SNP在水稻驯化过程中导致种子破碎损失。科学。2006;312:1392 - 1396。可以从:http://science.sciencemag.org/content/312/5778/1392.
- 15.
池浩,金老,金英华,金浩,银美,金立德,等。CTD磷酸酶样基因失活OsCPL1促进水稻脱落层发育和种子破碎。植物j . 2010; 61:96 - 106。可从:https: //获取www.ncbi.nlm.nih.gov pubmed / 19807881.
- 16.
周勇,吕东,李超,罗杰,朱宝峰,朱军,等。水稻种子落粒的遗传防治APETALA2转录因子粉碎流产1。植物细胞。2012; 24:1034-48可以从:https://www.ncbi.nlm.nih.gov/pubmed/22408071.
- 17.
Yoon J, Cho LH, Kim SL, Choi HB, Koh HJ, An G. bel1型同源异构体基因SH5通过促进脱落区发育和抑制木质素生物合成诱导种子碎粒。植物学报。2014;39 (5):717-28https://www.ncbi.nlm.nih.gov/pubmed/24923192.
- 18.
张明明,张建勇,刘志平,王怡林,张磊。MADS-box基因的克隆与分析WM8的大高寒草场(中文附英文摘要)。草业学报,2015;21:41 - 50来源:http://en.cnki.com.cn/Article_en/CJFDTOTAL-CYXB201204018.htm.
- 19.
Simons KJ, Fellers JP, Trick HN, Zhang ZC, Tai YS, Gill BS, Faris JD。小麦主要驯化基因的分子特征问.《遗传学》,2006;172:547-55https://www.ncbi.nlm.nih.gov/pubmed/16172507.
- 20.
林志伟,李晓荣,香农林敏,叶春涛,王明民,白光华,等。平行驯化Shattering1基因在谷物。Nature Genet. 2012; 44:720-4可从:https://www.ncbi.nlm.nih.gov/pubmed/22581231.
- 21.
杂交羊草(小麦科)野生植物制种性状的遗传解剖和一个主要效应种子保留QTL的鉴定。作物科学2009;49:29-40可从:https://dl.sciencesocieties.org/publications/cs/abstracts/49/1/29.
- 22.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-seq数据的全长转录组组装。Nat biotechnology . 2011; 29:644-52https://www.ncbi.nlm.nih.gov/pubmed/21572440.
- 23.
Conesa A, Götz S, García-Gómez JM, Terol J, Talón M, Robles M. Blast2GO:功能基因组学研究中注释、可视化和分析的通用工具。生物信息学,2005;21:3674-6https://www.ncbi.nlm.nih.gov/pubmed/16081474.
- 24.
叶军,方磊,郑浩,张勇,陈杰,张铮,等。WEGO:绘制GO注释的web工具。核酸Res. 2006; 34:293-7可从:https://www.ncbi.nlm.nih.gov/pubmed/16845012.
- 25.
Mortazavi A, Williams BA, McCue K, Schaeffer L, Wold B.利用RNA-seq绘制和量化哺乳动物转录组。Nat方法。2008; 5:621-8可以从:https://www.ncbi.nlm.nih.gov/pubmed/18516045.
- 26.
层JD。错误发现率的直接方法。J R Stat Soc B. 2002; 64:479-98可从:https://www.jstor.org/stable/3088784.
- 27.
Ernst J . Barjoseph Z. STEM:短时间序列基因表达数据的分析工具。BMC生物信息学。2006; 7:191可以从:https://www.ncbi.nlm.nih.gov/pubmed/16597342.
- 28.
杜志,周旭,凌云,张志华,苏铮。Agrigo:面向农业社区的GO分析工具。核酸Res. 2010;38:6470可从:https://www.ncbi.nlm.nih.gov/pubmed/20435677.
- 29.
谢超,毛旭,黄娟,丁勇,吴俊,董松,等。KOBAS 2.0:用于注释和识别富集途径和疾病的web服务器。核酸Res. 2011; 39:316-22可从:https://www.ncbi.nlm.nih.gov/pubmed/21715386.
- 30.
Livak KJ, Schmittgen TD。相关基因表达数据的实时定量PCR分析和2-ΔΔCt方法。2001; 25:402-8可从:https://www.ncbi.nlm.nih.gov/pubmed/11846609.
- 31.
单铮,吴海林,李春林,陈辉,吴强。改良的SDS法提取植物一般基因组DNA。广东农业科学,2001;38:113-5http://www.cnki.com.cn/Article/CJFDTotal-GDNY201108048.htm.
- 32.
Yeh FC, Boyle TJB。共显性和显性标记及数量性状的群体遗传分析。中华医学杂志1997;129:157。
- 33.
Rohlf FJ。NTSYS:数值分类和多变量分析系统2.1版本。埃克塞特出版、Setauket;2000.Availablefrom:http://www.exetersoftware.com/cat/ntsyspc/ntsyspc.html.
- 34.
塞克斯顿R,德宾ML,刘易斯LN,汤姆森WW。用纤维素酶抗体研究叶片脱落。《自然》1980;283:873-4https://www.researchgate.net/publication/232787760.
- 35.
Agrawal AP, Basarkar PW, Salimath PM, Patil SA。细胞壁降解酶在大豆破荚过程中的作用美林。Curr Sci. 2002; 82:58-61http://www.iisc.ernet.in/currsci/jan102002/58.pdf.
- 36.
Robert JA, Elliott KA, Gonzalez-Carranza ZH。脱落、开裂等细胞分离过程。一年生植物生物学。2002; 53:131 - 158。可以从:https://www.ncbi.nlm.nih.gov/pubmed/12221970.
- 37.
周海林,何世杰,曹昱,陈涛,杜伯祥,褚春林,等。OsGLU1被认为是来自水稻的膜结合的endoin - 1,4 -ß-d -葡聚糖酶,影响植物节间伸长。Plant Mol Biol. 2006; 60:137-51https://www.ncbi.nlm.nih.gov/pubmed/16463105.
- 38.
三种不同的多聚半乳糖醛酸酶在番茄叶片和花脱落中表达,每一种都有不同的时间表达模式。植物物理。1997;113(4):1303-8https://www.ncbi.nlm.nih.gov/pubmed/9112778.
- 39.
姜长忠,吕芳,Imsabai W, Meir S, Reid MS.沉默多聚半乳糖醛酸酶表达抑制番茄叶柄脱落。J Exp Bot. 2008;59(4): 973-9可用于:https://www.ncbi.nlm.nih.gov/pubmed/?term=Silencing+polygalacturonase+expression+inhibits+tomato+petiole+abscission.
- 40.
梅厄斯,哲思-哈达斯,桑达里森,塞尔瓦拉杰,伯德,欧斐,等。基因芯片分析番茄花脱落区与生长素耗竭相关的脱落转录组。植物物理。2010;154:1929-56https://www.ncbi.nlm.nih.gov/pubmed/20947671.
- 41.
陈晓燕,陈晓燕,陈晓燕,等。乙烯诱导柑桔叶片脱落过程中差异基因表达的研究。J Exp机器人。2008; 59(10): 2717 - 33可以从:https://www.ncbi.nlm.nih.gov/pubmed/18515267.
- 42.
Singh AP, Pandey SP, Pandey RS, Nath P, Sane AP.果胶裂解酶基因的转录激活,rbpel1在玫瑰花瓣脱落期间。采后生物技术,2011;60(2):143-8https://doi.org/10.1016/j.postharvbio.2010.12.014.
- 43.
孙丽,范NS。果胶酸裂解酶like (锁相环)基因家族在细胞分离中的作用拟南芥.BMC医学杂志。可以从:https://www.ncbi.nlm.nih.gov/pubmed/20649977.
- 44.
Sargent JA, Osborne DJ, Dunford SM。禾本科果实脱落过程中的细胞分离及其激素控制。J Exp Bot. 1984;35(160): 1663-74可用于:https://www.researchgate.net/publication/297182815.
- 45.
塞克斯顿R,罗伯茨JA。脱落的细胞生物学。植物生物学年鉴。2003;33(33):133-62https://www.annualreviews.org/doi/pdf/10.1146/annurev.pp.33.060182.001025.
- 46.
Schaller GE, Bleecker AB.拟南芥酵母中乙烯结合位点的生成ETR1基因。科学。1995;270(5243):1809-11https://www.ncbi.nlm.nih.gov/pubmed/8525372.
- 47.
Sohal SK, Rup PJ, Arora GK。植物生长调节剂细胞分裂素(PGR)对黄豆若虫体内代谢相关酶活性的影响Lipaphis erysimi。约翰逊·(·卡特证实印地安)。环境生物学杂志。2006;27(2):217-20http://jeb.co.in/journal_issues/200604_apr06/paper_10.pdf.
- 48.
罗伯茨JA,冈萨雷斯卡兰萨ZH。果胶酶在脱落过程中起作用。斯图尔特采后评论。2009;5:1-4可从:https://www.researchgate.net/publication/233587756.
- 49.
泰勒乙脑,怀特洛CA。信号脱落。New Phytol. 2001; 151:323-39http://onlinelibrary.wiley.com/doi/10.1046/j.0028-646x.2001.00194.x/full.
- 50.
真菌中的转录因子。Fems微生物学杂志2008;286(2):145-51https://doi.org/10.1111/j.1574-6968.2008.01293.x.
- 51.
j。橄榄成熟果实脱落控制的转录组分析。植物细胞物理学报。2013;54:244-69https://www.ncbi.nlm.nih.gov/pubmed/23292600.
- 52.
马侯赛因,赵智,韩敏,安昌,全杰,安刚,等。abre结合bZIP转录因子OsABF2是水稻非生物胁迫和aba信号的正向调控因子。植物生理学报,2010;167(17):1512-20https://www.sciencedirect.com/science/article/pii/S0176161710002348?via%3Dihub.
- 53.
向勇,唐宁,杜红,叶辉,熊磊。作为基本亮氨酸拉链转录因子家族的关键成员,OsbZIP23对水稻脱落酸敏感性和耐盐耐旱性的研究。植物物理。2008;148:1938-52https://minimanuscript.com/fr/manuscripts/characterization-of-osbzip23-as-a-key-pla.pdf.
- 54.
Tucker ML, Whitelaw CA, Lyssenko NN, Nath P.大豆分离特异性纤维素酶基因启动子中调控元件的功能分析及三个tga型碱性亮氨酸拉链转录因子的分离、表达和结合亲和力植物物理。2002;130(3):1487-96http://www.plantphysiol.org/content/plantphysiol/130/3/1487.full.pdf.
- 55.
罗曦,毛红,魏燕,蔡娟,谢超,隋安,杨旭,董娟。真菌特异性转录因子vdpf影响分生孢子的产生,黑化微菌核的形成和致病性黄萎病dahliae.Mol plant Pathol 2016;17(9): 1364-81https://www.ncbi.nlm.nih.gov/pubmed/26857810.
- 56.
yang grae C, Ohm RA, Grigoriev IV, Akhil s真菌特异性转录因子AbPf2激活的致病性链格孢属brassicicola.植物学报,2013;32 (3):498-514https://www.ncbi.nlm.nih.gov/pubmed/23617599.
- 57.
科拉德BCY,麦基尔DJ。标记辅助选择:21世纪植物精密育种的途径。Philos T R Soc B. 2008; 363:557-72可从:http://europepmc.org/backend/ptpmcrender.fcgi?accid=PMC2610170&blobtype=pdf.
- 58.
Dutta S, Kumawat G, Singh BP, Gupta DK, Singh S, Dogra V,等。用转录组深度测序技术开发豌豆的遗传ssr标记[Cajanus毛竹(l)Millspaugh]。BMC植物生物学。2011;11:17。https://doi.org/10.1186/1471-2229-11-17可以从:https://www.ncbi.nlm.nih.gov/pubmed/21251263.
- 59.
肖燕,周丽霞,夏伟,Mason AS,杨永德,马志林,等。利用转录组数据开发与油棕耐寒性相关的ssr基因标记。Elaeis guineensis).BMC Plant Biol. 2014;14:384。https://doi.org/10.1186/s12870-014-0384-2可以从:hhttps: / / www.ncbi.nlm.nih.gov pubmed / 25522814.
- 60.
植物营养和生殖发育过程中转录后和转录调节功能相关基因转录物的SSR标记Elaeis guineensis.BMC Plant Biol. 2012;12:1https://www.ncbi.nlm.nih.gov/pubmed/22214433.
- 61.
Molla KA, Debnath AB, Ganie SA, Mondal TK。水稻盐敏感候选基因cgSSRs的鉴定与分析(英文)栽培稻l.).BMC医学杂志。2015; 15(1): 122可以从:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4435636/.
确认
国家基础研究计划项目(2014CB138704)、长江学者创新团队项目(IRT13019)、国家自然科学基金项目(31302023)和111计划项目(B12002)资助。
资金
国家基础研究计划项目(2014CB138704)和国家自然科学基金项目(31302023)资助。
数据和材料的可用性
原始Illumina读数可在NCBI SRA: SRX5027500 (https://www.ncbi.nlm.nih.gov/sra/SRX5027500),支持本文结论的其他数据集包含在文章及其附加文件中。
作者信息
从属关系
贡献
YZ进行了研究,分析了数据并撰写了论文。JZ和ZZ进行了研究并分析了数据。WX构思并设计了该研究,并撰写了论文。所有作者阅读并批准了该手稿。
相应的作者
道德声明
伦理批准和同意参与
本研究所用材料的来源见表1,这些资料来自兰州大学。大高寒草场而且大肠sibiricus不是濒危或受保护物种,因此,收集这些样本和进行这项实验不需要许可或许可证。
同意出版
不适用。
相互竞争的利益
作者声明他们没有竞争利益。
出版商的注意
施普林格自然对出版的地图和机构附属的管辖权要求保持中立。
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
赵颖,张俊,张俊,张智。et al。大高寒草场种子破碎基因和候选EST-SSR标记用于种质评价。BMC植物杂志19日,102(2019)。https://doi.org/10.1186/s12870-019-1691-4
收到了:
接受:
发表:
关键字
- 大
- 种子破碎
- 比较转录组
- 候选基因
- Gene-derived EST-SSR标记