抽象的
背景
携带基本螺旋环 - 螺旋(BHLH)域的MYC的监管因素属于所有真核生物王国中存在的转录因子(TFS)的大型超级家族。在植物中,这种超家族的代表调节不同的生物过程,包括生长和发展以及对各种应力的反应。作为监管MBW复合物的成员,他们参与了类黄酮的生物合成。在小麦,只有一个成员(Tamyc1.)Myc样TFS家族已经研究过,而其他成员的结构和功能组织则保持不协调。从最近描述的两种Myc-subfamilies在Triticeae Tribe物种的基因组中,我们彻底调查了亚家族的成员,其中包括Tamyc1.基因。
结果
的启动子区域比较Myc小麦亚科I成员被分为两组(可能是同源集):TaMyc-1(Tamyc-A1/Tamyc1.,Tamyc-B1,TaMyc-D1),TaMyc-2(Tamyc-A2和TaMyc-D2).它被证明了TaMyc-D1由于帧移位突变,复制已丢失其功能。对另外四个副本的功能特征的研究表明他们中的一些人参与了花青素的生物合成。特别是,Tamyc-B1被认为是基因的共同调节器TAC1-A1(编码R2R3-MYB因子)在MBW调节络合物中激活小麦菌液中的花青素合成。mRNA水平Tamyc-A1,Tamyc-B1,Tamyc-A2和TaMyc-D2小麦幼苗在渗透胁迫下基因数量显著增加。盐胁迫诱导表达Tamyc-B1和Tamyc-A2,而Tamyc-A1被压抑了。
结论
确定了小麦中MYC样TFS的亚家族I的结构和功能组织的结构和功能组织的特征。myc样式调节器(Tamyc-B1)首次描述小麦菌液中的花青素合成。在小麦中测定可能参与促进干旱和盐度的Myc编码基因。获得的结果对于进一步的操纵是重要的Myc基因,旨在增加小麦适应性。
背景
真核细胞中的大多数生物过程都是在转录因子(TFs)的控制下进行的。每个转录因子家族都有其独特的高度保守结构域[1,2].转录因子通常包含两个功能域:一个与DNA结合有关,另一个与蛋白质二聚作用有关[3.].1989年,Murre,McCaw和巴尔的摩发现了这一点myod.基因与成员分享保守的cDNA地区myc科和果蝇女性(达),achaete-scute.和扭基因家族(4].发现该保守区域编码了蛋白质基序,这是DNA结合和二聚化所需的。将这些TFS组合成一个名为BHLH(基本螺旋环 - 螺旋)的超家族。它是第二大TFS系列,在植物和动物分歧之前出现在真核细胞中[5].bHLH蛋白具有高度保守的结构域,长度约为60个氨基酸[6,7].bHLH结构域分为两个区域:基本区域和螺旋-环-螺旋(HLH)区域。碱基区长度约为15个氨基酸,通常包括6个碱基残基,其功能是与目标基因启动子中的回文六核苷酸DNA区域E-box (CANNTG)结合,如G-box (CACGTG)。HLH区域包含两个由变长环结合的两亲α螺旋[6,7].HLH促进蛋白质相互作用,并作为homo和heterodimerization区域。据报道,bhlh是控制许多生物过程的转录网络中的关键调控成分[5,6,7].在植物中,BHLH蛋白涉及对损伤,干旱和盐度应激的反应,种子萌发调节,胎儿和胎儿发育,脱色的黄酮和它们色的衍生物花青素,叶片,叶子和水果中的衍生物花青素[6,7,8,9,10,11,12,13,14,15,16].在许多植物物种中,类黄酮生物合成途径的转录调节在包括玉米(玉米l .)、拟南芥(拟南芥L.)和葡萄(vitis Viniferal .) [10,17,18].在生物合成途径中,bHLH蛋白与其他转录因子家族成员如R2R3-MYB和WD40相互作用。它们一起可以形成MBW配合物,这种配合物只在植物中被描述过[7,10,15,16,18].MYB和BHLH蛋白质的特异性决定了待活化的基因。非特异性WD40蛋白在MBW调节综合体中起着更一致的作用。
allohexaploid面包小麦(Triticum Aestivum.L.,基因组BBAADD, 2n = 6x = 42,)是最重要的谷类作物之一。bHLH-coding基因Tamyc1./TaMyc1.1(染色体2AL)先前控制小麦颗粒的果皮中的花青素合成的合成[19].此外,在面包小麦的同源2组染色体中还发现了该基因的4个高度同源拷贝。这些基因以同源序列形成一个簇HvAnt2/HVMYC1(2HL)来自大麦(HH,2N = 14,Hordeum Vulgare.L.)还调节Pericarps中的花青素色素沉着[19,20.,21,22,23].后来,通过寻找同源序列,六种高度同源Myc在小麦基因组中鉴定和注释序列(位于染色体4染色体中的长臂上的五拷贝和位于2DL染色体上的一份)[24].此外,在大麦基因组中也发现了一个Myc- 在大麦葡萄龙酮层中的4HL控制oblocyanin生物合成中的keike基因拷贝[25].但是,函数Myc除了麦基基因组中的基因副本Tamyc1.仍然未知。在本研究中,我们研究了小麦中更多Myc-like TFs家族成员的结构和功能组织特征,探索它们与花青素合成和胁迫反应的关系。我们还测试了甲基化状态是否Tamyc1.启动子可能在该基因的不同等位基因的不同活性中发挥作用。
结果
编码序列Myc基因
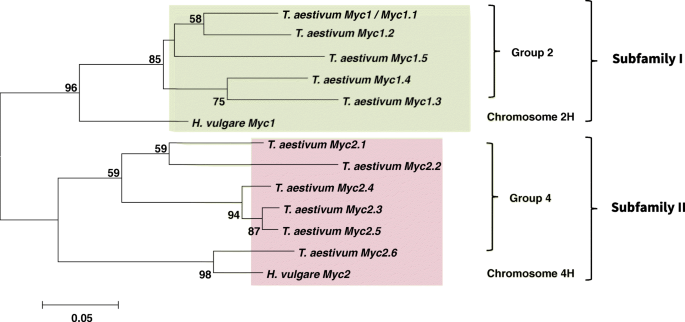
11种面包小麦和2种大麦的亲缘关系Myc使用全长BHLH结构域的邻近的系统发育分析来建立基因。分析结果表明,在妥膜部落中存在两种Myc-subilies(图。1),起源于古代的复制,涉及染色体2(染色体的携带者)Myc亚科II包括最近发现的HVMYC2.基因[25].
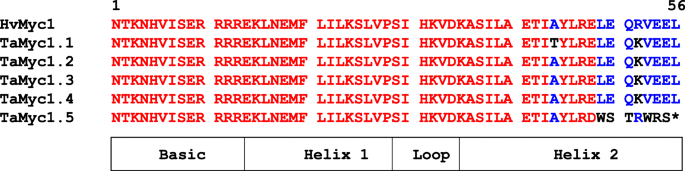
的TaMyc1.5基因携带在功能性显着的BHLH结构域中的单个核苷酸缺失(图。2).该突变应导致非功能性BHLH结构域的形成,因为它导致官能氨基酸替换,并且在BHLH结构域的螺旋2区域中的止挡密码子的过早出现。通过重新排序来确认面包小麦基因组中这种突变的存在TaMyc1.5中国春季和萨拉托夫斯卡亚品种中的基因29.此外,随后的分析Myc1.5从Aegilops Tauschii.L.(DD,2N = 14,面包小麦的D-基因组的供体)揭示了相同的突变,表明在二倍体水平(Contig 1,770,231,Urgi数据库)中发生这种缺失和形成非功能基因的突变。这种无功能TaMyc1.5在进一步比较亚家族I成员转录活性的实验中,不包括copy。
启动子序列的Myc基因(亚科)
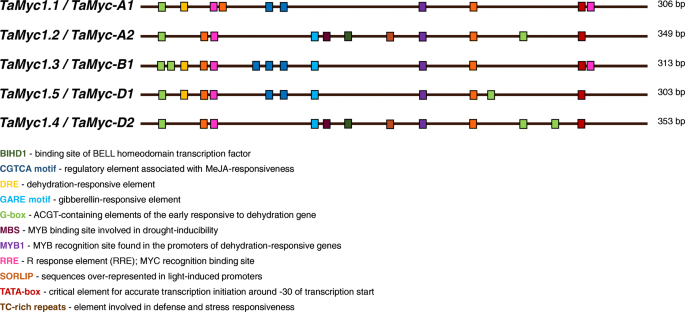
基于启动子序列Tamyc1./TaMyc1.1(GenBank: KJ747954)从NCBI数据库中提取Myc来自同种型染色体的基因(〜350bp,来自转录开始部位Tamyc1.).利用New PLACE数据库进行多序列比对和分析(用于检测单个元件及其相对位置),结果显示,基因根据启动子区域的特征和系统发育关系分为两组:TaMyc1.1,TaMyc1.3,TaMyc1.5(第一个组)和TaMyc1.2,TaMyc1.4(第二组)(图。3.,附加文件1,附加文件2).每组内的序列保留了一组常见的调节元件,例如转录因子结合位点,应激响应性元素和光诱导的转录激活的位点(图。3.,附加文件3.).我们建议常见的序列模式可以与促进剂序列的系统发育分析所证明的同优源基因的共同来源(附加档案2).根据小麦同源基因的命名规则,进行了相应的筛选Myc亚家族I成员被重新指定:TaMyc1.1(Tamyc1.)——TaMyc-A1,TaMyc1.2——TaMyc-A2,TaMyc1.3——TaMyc-B1,TaMyc1.4——TaMyc-D2,Tamyc1.5 - Tamyc-d1分别(无花果。3.).
表达式的Myc不同颜色小麦品种胚芽可塑性的基因
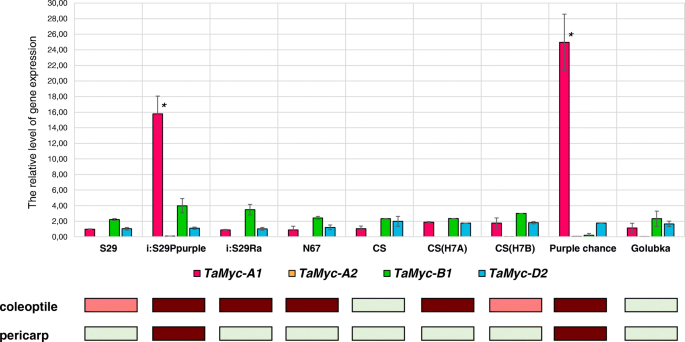
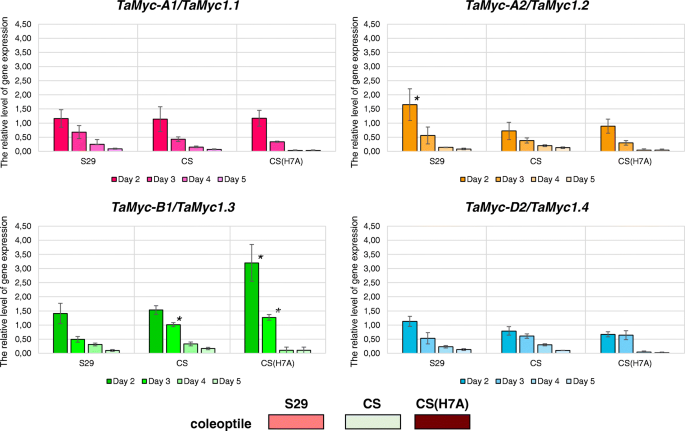
在此之前,Tamyc-A1基因显示在小麦终食中参与花青素生物合成,而其他亚家族I成员在该组织中无活性[19].为了探讨它们是否可以与小麦植物的其他部分中的花青素合成有关,我们用基因特异性引物进行QRT-PCRTamyc-A1,Tamyc-A2,Tamyc-B1和TaMyc-D2在胚芽鞘着色为绿色(未着色)、浅红色和深红色的小麦品种和品系中(表1,附加文件4).的Tamyc-A1两种基因型S29的胚芽鞘在种子萌发后第5天的表达量较高,分别为8-15倍和13-25倍Pp-A1Pp-D1Pp3P紫色机会(携带显性等位基因Tamyc-A1),与所有其他基因型比较(图。4).高度的Tamyc-A1表达可以解释i:S29中胚芽鞘呈暗红色的现象Pp-A1Pp-D1Pp3P和紫色的机会。然而,这种基因不能被认为是花青素中的花青素积累的主要调节因子,因为植物中具有深红色的线(I:S29类风湿性关节炎, CS(Hope 7A), Novosibirskaya 67)却不一样Tamyc-A1表达水平。总体而言,在萌发后第5天的qRT-PCR显示,小麦胚芽鞘中基因的相对表达量与花青素的存在无相关性。4)因此,我们使用3种基因型在发芽后第5天的动态分析,使用3种基因型:uncoloration Cs,浅红色S29和深红色Cs(H7a)(表1).
对于所有三种基因型中的每种分析的基因,我们发现在第5天在第2天在第2天到极低的mRNA水平降低的一般趋势(图。5).我们发现表达水平的统计学意义Tamyc-B1在发育早期阶段的姐妹系CS和CS(H7A)之间的基因(图。5).这些基因型因等位基因的状态而不同TAC1-A1基因,被认为是植物化学中的花青素合成的植物编码稳压因子。引入主导TAC1-A1进入CS基因组的基因导致增加Tamyc-B1基因表达2倍(图。5).我们假设Tamyc-B1可能是主要的共同监管机构TAC1-A1小麦胚芽鞘花青素生物合成的控制。此外,对于S29基因型,我们发现Tamyc-A2第2天发育的基因显着高于其Cs和Cs(H7a)中的表达(H7a)(较高2倍)。这种差异可能是S29植物精精弱花青素颜色的出现的原因(表1,附加文件4).S29是另一个的载体TAC1-A1与CS和CS都不同的等位基因(H7A)。异的特定识别TaMyc-1由不同的R2R3-复制Myb因素可以假设以供未来的核查。
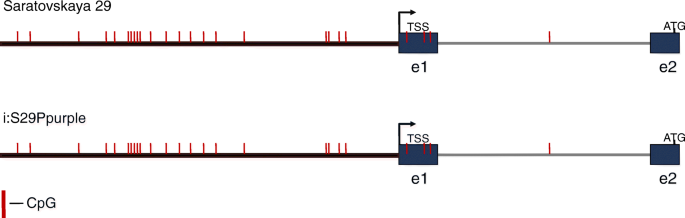
甲基化模式Tamyc-A1启动子
由于检测增加了增加的转录活动Tamyc-A1基因型中的基因型与花青素果皮色素沉着化(图。4),通过亚硫酸氢盐测序分析了该基因启动子的DNA甲基化,分析了不同等位基因状态的近等基因系(NILs)基因型Tamyc-A1:线S29和I:S29Pp-A1Pp-D1Pp3P(表1).作为分析的结果,我们表明,分析的748bp区域既不含有甲基化位点,既不在CPG和植物特定的非CpG甲基化位点中的启动子区(406bp)也不是342bp中的342bp(图。6,附加文件5).因此,我们假设表达水平的调节Tamyc-A1基因是由结构决定的CIS.-基因的调节成分。像DNA甲基化这样的表观遗传机制显然不影响所分析基因的活性。
压力响应关系Myc基因
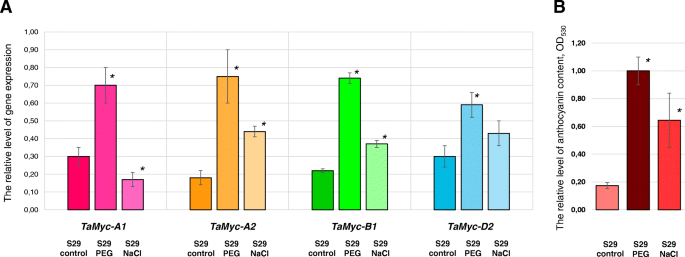
在启动子中找到依赖于压力的成分Myc亚家族I基因(图。3.,附加文件3.)是进一步分析它们在干旱和盐胁迫下表达水平的原因。相对的水平Myc测定了S29植物胚芽鞘对10% PEG和0.2 M NaCl的响应,并与在蒸馏水中萌发的植物进行比较。mRNA水平Tamyc-A1,Tamyc-B1,Tamyc-A2和TaMyc-D2在暴露于10%PEG的小麦幼苗中,基因显着增加。盐胁迫诱导表达Tamyc-B1和Tamyc-A2只要。的Tamyc-A1mRNA水平降低,而TaMyc-D2没有响应0.2M NaCl治疗。响应于压力与植物精中的花青素含量的变化相关的MRNA水平的变化及其除外Tamyc-A1(图。7a, b)。
讨论
多倍体比二倍体祖先有许多优势。多倍体生物的基因和基因组的进化一直是进化生物学领域广泛研究的课题。生物体由于基因复制而获得新的功能,例如抵抗疾病、适应压力和极端环境条件[26,27].大多数重复的基因仍然活跃于淋巴瘤生物中,有助于额外基因剂量的有益效果。例如,小麦,棉花和大豆的多倍化有助于改善这种重要的农艺性状,作为粮食质量和开花时间[26].面包小麦t . aestivum是一种六倍倍醇物种,其是由于四倍体之间的杂交而形成的小麦属植物turgidum(2n = 4x = 28, BBAA)和二倍体Aegilops Tauschii.(2n = 14, DD)约8000年前[28,29,30.].面包小麦基因组携带许多结构和调节基因的同源和同源副本,包括myc编码基因。Myc TFs是监管MBW复合体的成员[7,10,18].从17可能Myc可能参与调控类黄酮生物合成的拷贝,t . aestivum保留11(6份可能是假拷贝化的)基因组[24].11个副本的保留可能表明它们在不同组织中专门合成不同种类的类黄酮。具体的特征是预先确定的Tamyc-A1基因,和myb编码一起TaC1-D1基因对小麦颗粒的Pericarp中的花青素进行了生物合成[16,19].其他10份副本的具体特征仍不得而知。我们发现至少还有两个Myc拷贝(Tamyc-A2和Tamyc-B1)可能参与花青素的生物合成(图。5).此外,我们证明小麦发育的早期阶段(直到发芽后的第3天)可以是用于开始花青素生物合成的关键阶段(图。5).也许,因此我们没有发现任何显著的差异Myc基因型中的基因表达模式在后期的植物精灵着色(发芽后第5天的基因型中的基因型中的表达模式;图。4).
众所周知,复制后,两个相同的基因副本通常是多余的。复制拷贝的基因通常接受一个可能的进化事件:pseudogenization(重复基因变得非功能之一),neofunctionalization(重复基因之一可能获得一个新的函数)或subfunctionalization(原基因的副本可以分享功能)(31.].虽然上面提到了Tamyc-A1或Tamyc-B1基因可以代表子官能化的实例([19];无花果。5), 这TaMyc-D1由于检测到的单个核苷酸框架偏移突变,基因经历了伪原化(图。2).增加一些基因的剂量可能具有不良后果。在这种情况下,由于遗传和表观遗传学变化,发生基因剂量的标准化。例如,在三个同源副本中WLHS-1小麦基因一个基因由于功能域突变而失去功能,另一个拷贝因超甲基化而沉默,只有第三个基因保留了功能[32.].作为DNA甲基化(MC)的这种表观遗传因素对于TFS与基因的结合是显着的CIS.-调控区域(TF识别元件通常存在于启动子区域和第一个内含子)[33.,34.,35.].表观遗传变化可能是可逆的,并且比遗传变化更少。DNA甲基化是对胞嘧啶的共价修饰,其主要发生在植物和动物中的CPG二核苷酸上。然而,对于植物,不仅在CpG位点观察到DNA甲基化,而且在CPHPG和CPHPH位点观察,其中H是腺嘌呤,胞嘧啶或胸腺嘧啶[33.].在小麦中,可以在同一基因的等位基因中发现表观遗传学变化或同源性。由于推动者区域Tamyc-A1(Tamyc1.)占优势(在Pericarp中转录)和隐性(在Pericarp中未转录)等位基因是相同的[19的甲基化模式的假定差异提出的假设CIS.-调控区域Tamyc-A1等位基因。然而,这一假设并未得到证实(图。6).最后,在启动子上游261个bp-元件的拷贝数变异中发现了等位基因的差异[16,36.].这种元素的串联复制导致强烈的激活Tamyc-A1花青素颜料在小麦果皮中的表达及外观。
色素沉着只是类黄酮物质的多种作用之一。它们也因其适应特性而广为人知,这有助于植物在不利的环境条件下生存[37.].成员MRNA水平的比较评估Myc亚家族I在最佳的增长与压力(盐度和干旱)条件下表明他们可能会参与压力依赖性响应(图。7).小麦胚芽鞘中花青素的数量含量与小麦胚芽鞘中花青素的相对含量存在平行关系Myc基因的表达。唯一的例外是Tamyc-A1在0.2 M NaCl溶液处理下,mRNA水平显著降低(图2)。7).在植物中,非生物胁迫与类黄酮生物合成之间的关系已经得到了广泛的证据。干旱和盐度对细胞造成渗透和氧化应激、光合作用抑制、细胞成分损伤和代谢功能障碍等负面影响。不同的类黄酮物质参与渗透调节,保护光合器官和质膜,清除氧化应激发育过程中出现的自由基[37.].我们建议,那个Myc通过激活花青素等多种类黄酮化合物的合成,I亚家族基因可能参与了小麦对干旱和盐胁迫的耐受性改善。
结论
确定了小麦中MYC样TFS的亚家族I的结构和功能组织的结构和功能组织的特征。Myc- 克状的共调节器(Tamyc-B1)第一次描述小麦菌液中的花青素合成。在小麦中测定参与盐度和干旱应激反应的Myc编码基因。所获得的结果对于理解(i)留下多重是重要的Myc小麦基因组的复制,(ii)小麦类黄酮生物合成的调控特征,以及(iii)进一步的操纵Myc基因旨在提高小麦植株的适应性。
方法
多序列比对,鉴定保护基序和系统发育分析
小麦Myc- 从国际URGI数据库中选择基因(启动子和编码序列)(https://urgi.versailles.inra.fr(说)24使用爆炸)。大麦基因HvAnt2/HVMYC1(基因库:KX035100)HVMYC2.(GenBank: MF679157)取自NCBI数据库(https://www.ncbi.nlm.nih.gov.).使用MultAlin程序进行多序列比对(http://multalin.toulouse.inra.fr/multalin.).Promoter sequences ofMyc通过与...比较预测来自亚家族I的基因Tamyc-A1(Genbank:KJ747954)。通过预测结构域和重要的结合位点与Interpro计划分析蛋白质序列(https://www.ebi.ac.uk/interpro).使用新的地方数据库进行启动子分析,包含CIS.- 血管植物的调节性DNA元素(https://sogo.dna.affrc.go.jp/cgi-bin/sogo.cgi?lang=en&pj=640&action=page&page=newplace)(额外的文件3.).用MEGA 7.0软件(http://www.megasoftware.net.),采用Neighbor-Joining法,启动子序列为500个,bHLH基序序列为1000个。结果图像显示bootstrap帐户≥50%。
植物材料和生长条件
植物材料包括六倍磅麦片的九种品种t . aestivum从ICG收集Genagro,在植物精精和果皮中的花青素色素沉着对比。这些品种及其表型在表中呈现1.在20℃下,在12小时光周期下的湿滤纸下,在气候室“Rumarth Package”(Rumarth GmbH,Laatzen,德国)的气候室“Rumarth Package”(Ruqued GmbH,Laatzen,德国)进行萌发。将发芽的单日幼苗暴露于0(对照),200mM NaCl和15%聚乙二醇(PEG 6000)的模拟盐度和干旱胁迫。该实验一式三份对每个发育阶段进行,浓度和每个基因型进行。使用ICG温室核心设施(NovoSibirsk,俄罗斯)的资源在20-25°C下使用12小时的植物,从Pericarps的DNA提取植物。
花青素的提取及含量测定
在1%-HCl /甲醇中发芽后第4天从冷冻和均质的COLeoptiles中萃取花青素。[38.].三孔萃取和测量三次重复进行。通过分光光度法在530nm波长下评价相对花青素含量。
DNA提取和亚硫酸氢盐处理
使用来自两种品种的DNEasy植物迷你试剂盒(QIAGEN)从新鲜小麦骨质中提取总基因组DNA:S29(未溶解的Pericarp)和I:S29Pp-A1Pp-D1Pp3P(深紫色果皮)(表1).Pericarps从早期面团成熟时从谷物中脱毛。使用EPITICT试剂盒(QIAGEN)用亚硫酸氢钠处理来自每种样品的一μg的GDNA。
RNA分离和cDNA合成
用RNeasy Mini Kit (QIAGEN)提取胚芽鞘样品中的rna。所有分离的rna用不含rnase的DNase (QIAGEN)处理。使用RevertAid First Strand cDNA Synthesis Kit (Thermo Fisher Scientific Inc.),从0.5 μg总RNA的模板中,20 μ l反应将总RNA转化为单链cDNA。
引物设计和PCR扩增,测序
显影基因特异性引物:(1)用于扩增部分基因序列和全长CDS使用Oliso软件设计;(2)用于启动子地区Tamyc-A1基因使用methprimer(表2).20 μL pcr扩增。反应混合物包含50-100 ng基因组模板DNA,每个引物1 ng,每个dNTP 0.25 mM, 1x反应缓冲液(67 mM TrisHCl, pH 8.8;2毫米MgCl2;18毫米(NH4)2所以4;0.01%吐温20)和1-2.5u Taq聚合酶。DNA模板在94℃下在94℃下初始变性扩增2分钟,35个循环在94℃下,1分钟,50-63℃,1分钟(表2)和72℃的0.5-2分钟,然后在72℃下最终延伸5分钟。PCR产物在琼脂糖凝胶上分离,用溴化乙锭染色并在UV光下可视化。使用DNA清洁试剂盒(细胞因子)从琼脂糖凝胶中纯化扩增的片段。使用Sb Ras Genomics核心设施(Novosibirsk,俄罗斯)进行DNA测序。在Genbank(NCBI)中沉积获得的序列。
二硫酸氢盐基因组测序分析
使用PCR克隆试剂盒(QIAGEN)亚克隆上述每个样品的扩增的亚硫酸氢盐PCR产物。将每个PCR产物的10个插入阳性克隆的质粒DNA在与M13引物的两个方向上测序。
定量rt - pcr分析
利用表中的引物进行qRT-PCR2.一个片段泛素基因序列供参考[39.].在ABI Prism 7000序列检测系统(应用生物系统)中使用SYBR Green I试剂盒(Syntol)进行扩增。预先确定的克隆cDNA的数量用于生成标准曲线。每个样品都进行了三次技术复制。基因型的差异由曼-惠特尼公司进行了测试U- 吧,服用p ≤ 0.05 and 0.005 as significant.
缩写
- MBW:
-
M - Myb, B - bHLH (Myc), W - WD40
参考
- 1.
Cooper Gm。真核生物中转录的调节。在:细胞:一种分子方法。第2版。桑德兰:恩豪斯伙伴;2000年。
- 2.
Riechmann JL,Ratcliffe OJ。植物转录因子的基因组视角。CurrOp植物BIOL。2000; 3(5):423-34。https://doi.org/10.1016/s1369-5266(00)00107-2.
- 3。
Frietze S,Farnham PJ。转录因子效应域。在:转录因子的手册。DONDRECHT:SPRINGER;2011. p。261-77。https://doi.org/10.1007/978 - 90 - 481 - 9069 - 0 - _12。
- 4.
免疫球蛋白增强子结合,无子,MyoD和myc蛋白中的一种新的DNA结合和二聚体基序。细胞。1989;56(5):777 - 83。https://doi.org/10.1016/0092-8674(89)90682-x.
- 5。
植物中碱性螺旋-环-螺旋蛋白的起源和多样性。中国生物医学工程学报。2009;27(4):862-74。https://doi.org/10.1093/molbev/msp288.
- 6。
螺旋-环-螺旋蛋白:真核生物的转录调控因子。中国生物医学工程学报。2000;20(2):429-40。
- 7.
Feller A,Machemer K,Braun El,Grotewold E. MyB和BHLH植物转录因子的进化和比较分析。工厂J1111; 66(1):94-116。https://doi.org/10.1111/j.1365-313x.2010.04459.x.
- 8.
bHLH和MYB结构域蛋白的分析:种特异性调控差异是由靶花青素基因的不同进化引起的。植物j . 1998; 13(4): 475 - 88。https://doi.org/10.1046/j.1365-313x.1998.00046.x.
- 9.
OH E,Kim J,Park E,Kim Ji,Kang C,Choi G. Pil5,一种植物与植物相互作用的基本螺旋环 - 螺旋蛋白,是种子萌发的关键负调节因子拟南芥.植物细胞。2004; 16(11):3045-58。https://doi.org/10.1105/tpc.104.025163。
- 10.
Gonzalez A, Zhao M, Leavitt JM, Lloyd AM。TTG1/bHLH/Myb转录复合物对拟南芥幼苗花青素合成途径的调控植物j . 2008; 53(5): 814 - 27所示。https://doi.org/10.1111/j.1365-313x.2007.03373.x..
- 11.
Long TA, Tsukagoshi H, Busch W, Lahner B, Salt DE, Benfey PN。bHLH转录因子POPEYE调节拟南芥根对缺铁的反应。植物细胞。2010;tpc - 110。https://doi.org/10.1105/TPC.110.074096.
- 12.
Zhao H,Li X,MA L.拟南芥的基本螺旋环 - 螺旋转录因子和表皮细胞命运测定。植物信号表现。2012; 7(12):1556-60。https://doi.org/10.4161/psb.22404.
- 13.
Kavas M,BaloğluMC,Atabay Es,Ziplar UT,DaşganHy,ÜnverT.鉴别豆类BHLH转录因子的基因组型鉴定和表达分析响应过量盐浓度。MGG。2016; 291(1):129-43。https://doi.org/10.1007/s00438-015-1095-6.
- 14。
毛凯,董强,李超,刘超,马峰。苹果bHLH转录因子的全基因组鉴定、鉴定及对干旱和盐胁迫的响应。植物学报,2017;https://doi.org/10.3389/fpls.2017.00480.
- 15.
Lloyd A, Brockman A, Aguirre L, Campbell A, Bean A, Cantero A等。MYB - bhlh - wd重复(MBW)色素调控模型的研究进展:添加WRKY因子和利用花青素MYB调控甜菜碱。植物生理学报。2017;58(9):1431-41。https://doi.org/10.1093/pcp/pcx075.
- 16。
姜伟,刘涛,南伟,Jeewani DC,牛勇,李超,等。两种转录因子TaPpm1和TaPpb1共同调控小麦紫色果皮花青素的生物合成。J Exp Bot. 2018;69(10): 2555-67。https://doi.org/10.1093/jxb/ery101.
- 17。
Holton Ta,康沃欧欧盟。花青素生物合成的遗传学和生物化学。植物细胞。1995年; 7(7):1071。https://doi.org/10.1105/tpc.7.7.1071。
- 18.
徐伟,王志强,王志强,等。MYB-bHLH-WDR配合物对黄酮类化合物合成的调控作用。植物科学进展。2015;20(3):176-85。https://doi.org/10.1016/j.tplants.2014.12.001.
- 19.
Shoeva Oy,Gordeeva ei,khlestkina ek。小麦果皮中花青素合成的调节。分子。2014; 19(12):20266-79。https://doi.org/10.3390/molecules191220266.
- 20.
大麦类黄酮合成的遗传控制。Hereditas。1993;3(5):187 - 204。https://doi.org/10.1111/j.1601-5223.1993.00187.x。
- 21.
作者简介:黄志刚,男,四川人,博士,主要研究方向为生物医学工程。未测序大麦基因组候选多态性的全基因组关联图谱分析。中国科学(d辑:地球科学)2010;https://doi.org/10.1073/pnas.1010179107.
- 22.
Shoeva Oy,Mock H-P,Kukoeva TV,BörnerA,khlestkina ek。紫色耐血清紫色和黑晶粒中黄酮类生物合成途径基因的调节。Plos一个。2016; 11(10):E0163782。https://doi.org/10.1371/journal.pone.0163782.
- 23.
Adzhieva vf,巴巴克og,shoeva oy,Kilchevsky Av,Khlestkina Ek。植物果实和种子着色发展的分子遗传机制。Russ J Genet Appr Res。2016; 6(5):537-52。https://doi.org/10.1134/S2079059716050026.
- 24.
Strygina kv,khleskina ek。谷物中的Myc基因家族:转型在六倍面包小麦及其亲属的演变过程中。mol Biol。2017; 51(5):572-9。https://doi.org/10.7868/S0026898417050032.
- 25.
Strygina KV, Börner A, Khlestkina EK。大麦糊粉中花色素苷合成调控网络成分的鉴定与表征。植物学报。2017;17(1):184。https://doi.org/10.1186/s12870-017-1122-3。
- 26。
Panchy n,Lehti-shiu md,shiu sh。基因重复:从起源到植物演化的影响。植物理性。2016年:00523。https://doi.org/10.1104/pp.16.00523.
- 27。
娇Y,帕特森啊。陆生植物进化中的多倍性相关基因组修饰。中国科学技术大学学报(自然科学版)2014;https://doi.org/10.1098/rstb.2013.0355.
- 28。
Gill BS,金伯G.Giemsa C-束带和小麦的演变。Proc Natl Acad SCI U S A. 1974; 71(10):4086-90。https://doi.org/10.1073/pnas.71.10.4086.
- 29。
关键词:小麦,重复核苷酸序列,限制性片段长度,多态性,表观来源基因组。1988;30(5):680 - 9。https://doi.org/10.1139/g88-115.
- 30.
Marcussen T, Sandve SR, Heier L, Spannagl M, Pfeifer M, Jakobsen KS,等。国际小麦基因组测序联盟。面包小麦祖先基因组中的古老杂交。科学。2014;345(6194):1250092。https://doi.org/10.1126/science.1250092。
- 31.
Lynch M, Conery JS。复制基因的进化命运和后果。科学。2000;290(5494):1151 - 5。https://doi.org/10.1126/science.290.5494.1151。
- 32.
Shitsukawa n,Tahira C,Kassai Ki,Hirabayashi C,Shimizu T,Takumi S等人。六倍体小麦级疯箱基因三种同源基因的遗传和表观遗传改变。植物细胞。2007; 19(6):1723-37。https://doi.org/10.1105/tpc.107.051813.
- 33.
Finnegan EJ,Genger RK,孔雀WJ,Dennis Es。植物中的DNA甲基化。Annu Rev植物Biol。1998年; 49(1):223-47。https://doi.org/10.1146/annurev.arplant.49.1.223.
- 34.
Schübeler D. DNA甲基化的功能和信息含量。大自然。2015;517(7534):321。https://doi.org/10.1038/nature14192.
- 35.
鸟A. DNA甲基化图案和表观遗传记忆。基因开发。2002; 16(1):6-21。https://doi.org/10.1101/gad.947102.
- 36.
陈伟,张斌,刘东,等。小麦TaMYC1基因调控果皮花青素合成的等位变异和转录亚型。植物学报2017;8:1645。https://doi.org/10.3389/fpls.2017.01645.
- 37.
khlestkina ek。黄酮类化合物的适应作用:重点是谷物。咖喱店。2013; 41:185-98。https://doi.org/10.1556/CRC.2013.0004。
- 38。
等。小麦和小麦异种遗传资源中红色胚芽鞘等位基因的变异。谷物研究。2011;39(4):465-74。https://doi.org/10.1556/crc.39.2011.4.1..
- 39。
小麦红粒颜色基因(R)是一种myb型转录因子。Euphytica。2005;143(3):239 - 42。https://doi.org/10.1139/g05 - 026。
- 40。
arbuzova vs,maystrenko oi,popova om。常见小麦品种近代甲萨拉夫斯卡省近代线的发展。1998年:39-46。https://doi.org/10.2307/23785246。
- 41。
Gordeeva Ei,Shoeva Oy,Khlestkina EK。标记辅助开发面包小麦近代含有PP(紫果皮)等位基因各种组合的近代型线。Euphytica。2015; 203:469-76。https://doi.org/10.1007/s10681-014-1317-8.
- 42.
khlestkina ek,gordeeva ei,arbuzova vs.小麦近代的分子和功能性表征I:S29RA'具有植物精光,秆,叶片和抗柱的密集花青素色素沉着。植物品种。2014; 133:454-8。https://doi.org/10.1111/pbr.12180.
- 43.
大风MD,Flavell RB。小麦同源染色体的花青素生物合成的遗传控制。Genet Res。1971; 18(2):237-44。
- 44.
Tereshchenko Oy,Pshenichnikova Ta,Salina Ea,Khlestkina Ek。具有紫色粒子颜色的新小麦基因型的发展与分子特征。咖喱店。2012; 40:210-4。https://doi.org/10.1556/crc.40.2012.2.5.
致谢
不适用。
资金
出版成本由俄罗斯基础研究基金会资助(№16-04-00912)资助。在ICG项目0324-2018-0018支持的ICG植物生长核心设施中进行了生长。
可用性数据和材料
本研究获得的序列可在NCBI获得:MH727568-MH727571。
关于这个补充剂
本文已作为BMC Plant Biology Volume 19 Supplement 1, 2018: Selected articles from BGRS\SB-2018: Plant Biology。补充的完整内容可在线提供//www.cinefiend.com/articles/supplements/volume-19-supplement-1.
作者信息
从属关系
贡献
KVS在硅分析中进行的所有分子遗传实验,并参与起草稿件。EKK促成了研究的概念和设计,以解释数据并批判性修改手稿。这位作者都读到并批准了最终手稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
附加文件2:
启动子序列的遗传相似性Myc- 偶然基因亚家族I.用邻近接合方法在Mega 7.0中构建了系统发生树,具有500个引导复制。蓝色 - 第一个组。绿色 - 第二组。(PPTX 37 KB)
额外的文件3:
识别的CIS作用调节元件Myc启动子。启动子分析使用New PLACE数据库进行。" + " -编码链," - " -模板链.(DOCX 27 KB)
附加文件4:
萌发后第五天的选定小麦样品的植物精光颜色。(PPTX 459 KB)
附加文件5:
亚硫酸氢盐在近等基因系的基因型测序结果,在等位基因状态不同Tamyc-A1:线S29和I:S29Pp-A1Pp-D1Pp3P.第一和第二个外显子分别以黄色和绿色销售。蓝色 - 未甲基化的CPG网站,红色 - 开始 - 密码子(ATG站点)。(docx 13 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
小麦中myc样转录因子:亚家族I成员的结构和功能组织BMC植物BIOL.19,50(2019)。https://doi.org/10.1186/s12870-019-1639-8
关键词
- 花青素生物合成
- bHLH
- 类黄酮生物合成
- 基因复制
- Myc
- 渗透压力
- 盐度的压力
- 应激反应
- 转录因子
- 小麦属植物
- 小麦