抽象的
背景
花青素是植物的次生代谢产物,在植物适应恶劣环境中起重要作用,并可能对人类健康有益。大麦籽粒的紫色是由果皮中合成的色素引起的。一个或两个基因决定性状。其中之一是Ant2.映射在染色体2HL上,已知用BHLH结构域编码转录因子(TF)。在植物中,BHLH调节花青素生物合成,与TF含有R2R3-MYB结构域。在小麦中,负责紫色果皮的紫色颜色的R2R3-MyBS由均方的系列编码Pp-17号染色体短臂上的基因。在大麦中与小麦的同源位置Pp-1,ANT1.确定叶鞘红色的基因已经绘制。在目前的研究中,我们测试了是否ANT1.不仅对叶鞘颜色有多效作用,而且对果皮色素沉着也有多效作用。
结果
А近近等离子线(零)携带不同的等位基因组合ANT1.和Ant2.利用标记辅助回交方法创建基因座。两者的显性等位基因ANT1.和Ant2.Pericarp中的花青素积累需要基因。QRT-PCR分析蚂蚁含有的引物和果皮中的基因揭示了在基因之间发生一些往复相互作用。两种基因中的每一个的表达在紫色晶粒中上调,在两个基因座中具有显性等位基因。携带主导等位基因的线条ANT1.或在Ant2.基因座的特征在于显性基因的表达水平降低,并且隐性一个的致粘剂活性。的ANT1.和Ant2.在岩土内勉强检测到在两个基因座的隐性等位基因中检测到表达。花青素生物合成结构基因不同调节:Chs,气,F3h.,Dfr在所有系谱中都是独立于等位基因的ANT1.和Ant2.基因,而F3'h和答在两个调节基因的显性等位基因上被激活。
结论
r2r3 - myb编码版本(ANT1.)的规管Ant2.基因首次被确定。大麦外稃和果皮中花青素合成的激活需要这两个显性等位基因。R2R3-MYB + bHLH复合物通过影响表达激活合成F3'h和答结构基因。此外,环间正调节ANT1.和Ant2.被检测到。此前花青素生物合成调控基因之间的相互作用仅在双子叶植物物种中被揭示。我们的数据表明,这种调节机制在植物界比目前报道的更为普遍。
背景
花青素是类黄酮色素,在植物细胞和组织的液泡中积累。它们负责植物营养和生殖部分的橙色、棕色、红色、蓝色和紫色。由于色素及其未着色前体在植物生理学中的重要作用,它们引起了科学界的兴趣[1,2,3.]人类健康促进效果[4].目前,在包括谷物的农业植物中增加花青素含量有很强的趋势[5].
花青素生物合成是通过属于三个家庭的转录因子(TFS)调节的普遍代谢途径:我的值得信赖bTFS的脆弱家族含有两个不完美的氨基酸序列rEPEATS(R2R3-MYB),TFS具有基本螺旋环 - 螺旋(BHLH)域,其在禽类病毒癌症中首次描述了我的值得信赖c细胞瘤病(MYC)和携带色氨酸-天冬氨酸二肽结构基序的转录因子重复约40次(WD40)。R2R3-MYB、bHLH (MYC)和WD40在调节结构基因表达的MBW复合物中结合[6].WD40除外,它是许多细胞过程的通用TF,包括类黄酮生物合成[7],其他因素在时间上和空间上调节和在组织特异性方式中激活花青素或花青蛋白的生物合成[8].例如,不同的bHLH和R2R3-MYB因子(结合WD40)共同激活玉米营养组织(B1/SN1和PL1结合PAC1)和种子(R1和C1结合PAC1)的花青素合成。在拟南芥bHLH TT8/GL3/EGL3、R2R3-MYB PAP1/PAP2/MYB113/MYB114和WD40 TTG1组成的复合物调控花青素生物合成,而种子原花青素合成由bHLH TT8、R2R3-MYB TT2和相同的WD40 TTG1调控。8])。
进化研究表明,调控基因比编码生物合成酶的结构基因进化得更快[9].色素模式的变异更多的是基于调控基因的等位变异,而不是结构基因的等位变异。因此,识别花色苷生物合成基因网络的调控成分并揭示其自身调控特征是调控任何植物花色苷合成的重要任务。
大麦(Hordeum Vulgare.L.)谷物可能具有黄色,蓝色,紫色,由黄酮类化合物积聚在不同层中的黄酮类化合物引起。在种子涂层中合成的原花青素给了黄色晶粒,不能与非彩色的白色。用香草蛋白-HCl染色后颜料出现砖红色[10].种子涂层中原花青素的积累与种子休眠相关[11].原花青素的生物合成是由一个特定的R2R3-MYB结构域蛋白控制的ant28基因映射到染色体的长臂3h [12].
大麦谷物的蓝色是由含有阿列酮层中积累的花青素引起的[13].最近,控制糊粉层花青素生物合成的MBW复合物成分的候选基因已经被确定[14].的HvMyc2和HvMpc2分别编码的基因,BHLH和R2R3-MYB TFS映射在染色体4HL的长臂上。HvMyc2仅在糊粉中有转录活性吗HvMpc2在不同的组织中表达,但在非彩色的阿仑酮中未检测到其转录。基于通过大麦基因组的同源性搜索HvWD40基因被鉴定为花青素/原花青素调节因子的候选基因。该基因位于6HL染色体上,并在不同的组织中独立地持续表达[14].
籽粒果皮呈紫色是由果皮细胞中积累的花青素引起的[15.].最近,控制紫色大麦颗粒中单个花青素的两种定量性状基因座(QTLS)位于染色体2HL和7HS上类似于Ant2.和ANT1.基因,分别16.],测定茎,耳廓,AWN和雷姆玛的红色色素沉着[17.].增加的转录水平Ant2.大麦谷物紫果皮中的基因[18.],以及其他谷物的类似物的数据[19.,20.允许表明这一点Ant2.控制果皮中花青素的生物合成。的功能作用ANT1.基因在大麦果皮色素尚未评估。
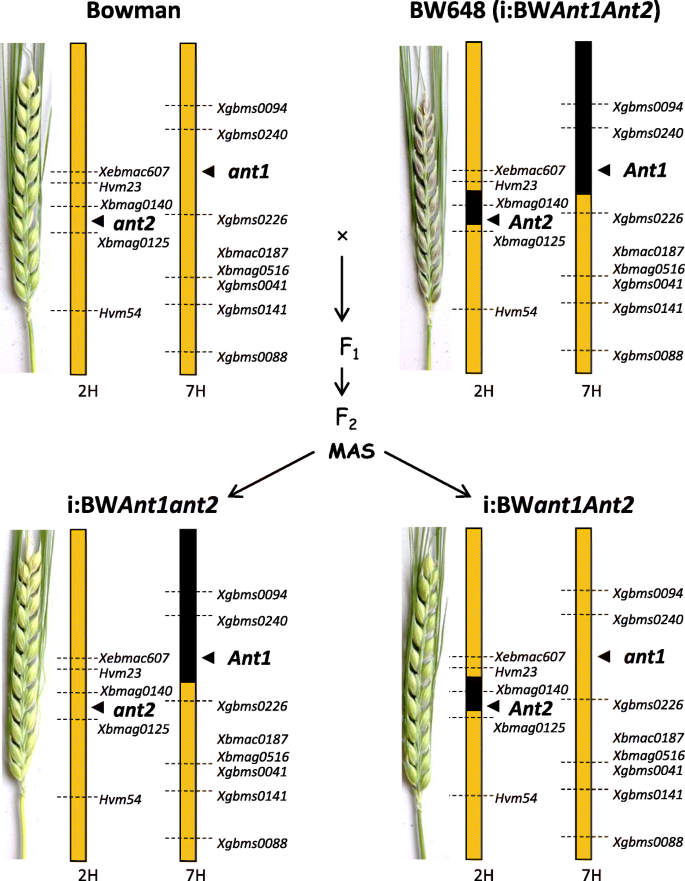
来确定每个的角色蚂蚁我们已经“分裂”了位于2H染色体上携带供体片段的紫色颗粒线(与显性等位基因Ant2.基因)和7H(具有显性等位基因ANT1.基因赋予紫色叶鞘颜色)分为两条线:一个与供体片段的片段在2h,另一个与捐赠者的片段为7小时。形态学(红色茎,卢比同义的,ANT1.)和分子(ANT1.- - -Ant2.和7H-和2H-specific微卫星)标记用于选择具有理想基因型的植物。
结果
标记辅助NILs的开发
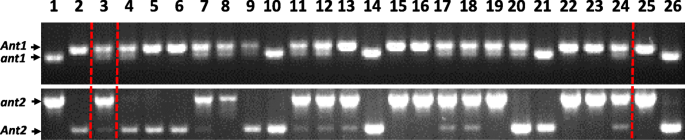
鲍曼(BW)植物有隐性ANT1.,Ant2.与BW648杂交,具有显性ANT1.和Ant2.(无花果。1);果皮1杂交植株呈深紫色1).F2具红色叶鞘的后代(基因型ant1ant1或ant1ant1)使用微卫星侧翼的微卫星进行基因分型ANT1.和Ant2.基因除了引物扩增部分外蚂蚁基因;纯合植物Ant1Ant1ant2ant2被选中。F2具有绿色叶鞘的后代(基因型ant1ant1)用于选择纯合基因型的植物Ant1ant1ant2ant2.(无花果。2).选择F2BW648染色体7H和BW染色体2H微卫星等位基因同时纯合的基因型命名为i:BWant1ant2..BW染色体7H和BW648染色体2H微卫星等位基因纯合子设计为i:BWant1ant2..亲本BW648重命名为i:BWant1ant2..行我:BWant1ant2.我:BWant1ant2.果皮中没有积累花青素(图。1).线I:BWant1ant2.与i:BW相比,叶鞘表现出色素ant1ant2.,这并未在这部分植物中积累了花青素。
大麦籽粒总花青素浓度
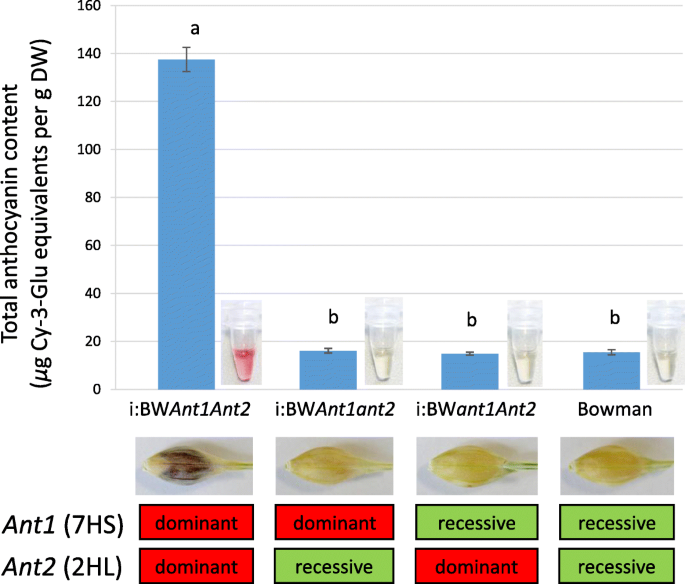
亲本(BW, i:BW)籽粒总花青素含量ant1ant2.)新创造(我:BWant1ant2.,我:BWant1ant2.)线测量(图。3.).我:BWant1ant2.携带显性等位基因的系蚂蚁基因在籽粒中积累的花青素是其姊妹株系的9倍蚂蚁基因。可以通过530nm的其他未加入化合物的吸光度来解释非溶解线中的花青素。
NILs外稃和果皮中花青素生物合成基因的转录
基于qrt - pcr的转录本丰度评估ANT1.和Ant2.)和结构(Chs,气,F3 h,F3 h,Dfr, 和答)基因在NILs的外稃和果皮中进行了综述。4.
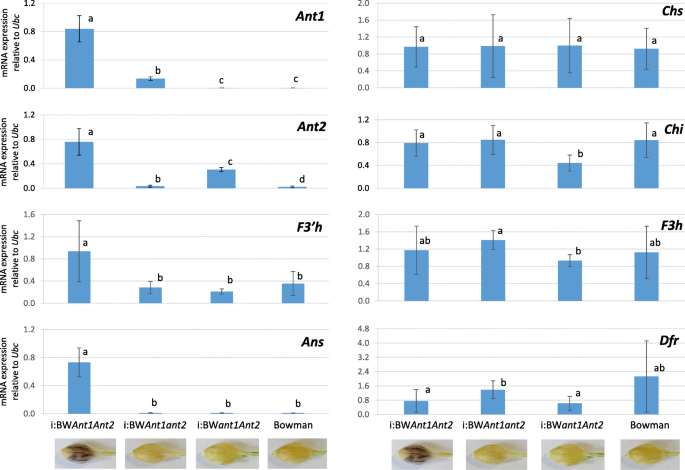
对蚂蚁在具有隐性等位基因的品系的外稃和果皮中几乎检测不到基因。ANT1.Bowman蛋白表达减少(ant1ant1ant2ant2),我:BWant1ant2.,以及Ant2.- 在Bowman和I:BWant1ant2..相对于鲍曼,表达的ANT1.和Ant2.在品系i:BW中基因分别增加了71倍和14倍ant1ant2.我:BWant1ant2.具有相应基因的显性等位基因和相应基因的隐性等位基因。显著增强ANT1.和Ant2.基因表达量是i:BW的6倍和2.5倍ant1ant2.我:BWant1ant2.分别在I:BW中检测到检测到ant1ant2.在这种情况下,两种基因都是显性的。这些数据表明,两者之间存在一个相互的正调节回路ANT1.和Ant2.基因。
结构基因表达的分析显示出两种不同调节的单位。第一个调节单元结合了基因Chs,气,F3h., 和Dfr以任何组合转录蚂蚁基因(图。4).结构基因的表达量在各品系间无差异,但表达量有所下降气和F3 h在我:BWant1ant2.相对于一些其他的线和增加的表达Dfr我的基因:BWant1ant2.相对于我:BWAnt1ant2.我:BWant1ant2.(无花果。4).
第二个监管单位代表F3'h和答基因,即在线I:BW上调ant1ant2.只有,而其他的组合蚂蚁基因并不影响这些基因的表达。
讨论
ANT1.和Ant2.大麦果皮中花青素生物合成调控网络的组成部分
通过分离分析,对紫色色素性状进行了单基因和基因控制[21.,22.].应用标记辅助选择优势等位基因ANT1.和Ant2.基因分为不同的线条,线的形态学和化学分析表明,在大麦籽粒中的花青素合成需要两种因素(图。1和3.).
参加Ant2.在甲克粥中,在合并中展示了在甲虫生物合成中,并通过共同作者证明了AWNS [23.].此外,该基因在Bowman NIL BW648/i:BW紫色果皮中表达上调ant1ant2.([18.], 无花果。4).共同作者贾贾映射了PreS2控制标记附近的基因控制紫色果皮鞋HVOS04G47170.[24.与。紧密相连Ant2.基因(23.].虽然bhlh编码基因的其他拷贝在附近未被检测到Ant2.[23.[作者认为这是PreS2和Ant2.基因不是同义的,因为紫粒和白粒的品种余姚红大麦和ACCA用于作图PreS2没有多态Ant2.诊断标记。基于所有白颗粒基因型中鉴定的16核苷酸缺失,开发了标记物[23.].在' white ' Bowman, ' purple ' BW648/i:BW之间也未检测到多态性ant1ant2.[18.]在39个白粒大麦品种和ICG系列Genagro(Novosibirsk,Russia,http://ckp.icgen.ru/plants/)(数据不存在)。数据还证明,这种缺失出现并在欧洲局部分布[23.].另一个与“白色”有关的突变Ant2.Shoeva与共同作者鉴定了等位基因[18.].它是隐性的179 nt的插入Ant2.等位基因。在本研究中,所发现的多态性被成功地用于开发NILs(表)1,无花果。2).总的来说,数据确认了Ant2.控制籽粒果皮组织中花青素的生物合成。
紫色晶粒性状所需的第二个互补基因几乎更难以捉摸。在小麦,基于基因的分离分析群rc.,个人电脑,请,拉钮,锅,Pp-1同源7组染色体分别控制胚芽鞘、茎、叶鞘、叶片、花药和果皮的花青素色素沉着[19.].应用位置克隆方法TaC1同样的基因叫做tappm1.被分离为rc.和Pp-D1分别为(20.,25.].该基因编码R2R3-MYB TF,是唯一位于该位置的R2R3-MYB编码基因,该基因簇被定位[20.,25.,26.,27.].随着小麦TAC1 / TAPPM1基因是负责胚芽鞘和果皮色素沉着,我们认为大麦的同源性ANT1.负责叶鞘的色素沉着[25.,26.,28.[还需要在果皮中合成花青素。我们展示了ANT1.基因在紫色果皮中上调(图。4).从其他谷物中获得的同源基因的结果和数据[19.,20.,25.]确认ANT1.控制果皮中的花青素生物合成。
正面监管环之间ANT1.和Ant2.
qRT-PCR分析ANT1.和Ant2.NILs中的基因揭示了基因之间相互的正调节回路。的ANT1.和Ant2.当它们的对象物是显性的时候,基因高度上调(图。4).这表明由ANT1 (R2R3-MYB)、ANT2 (bHLH)和WD40组成的复合物显著增强了R2R3-MYB的转录ANT1.和Ant2.基因。
在小麦中检测到调节基因之间的另一种调节相互作用。使用具有不同组合的类似线页紫果皮性状基因[29.],结果表明,基因产物Pp-D1 / TaMyb-7D(R2R3-MYB)轻度抑制Tamyc1 / pp3.(bHLH)。在这里,我们还测试了表达式Tamyb-7d.(同义词TaC1,tappm1.)(额外的文件2).与大麦相比,没有任何影响TaMyc1在这一点Tamyb-7d.基因的表达。
在双子叶植物中,花青素调控基因的表达被描述为一个复杂的负和正反馈机制的调控网络。在拟南芥,TT8MBW复合物包括WD40 TTG1, MYBs TT2/PAP1和bHLHs TT8本身或GL3/EGL3 [8].同样,VVMYC1涉及其自身表达的正反馈调节vitis Vinifera[30.].在佩妮混合,异位表达AN2(R2R3-MYB)的异位表达AN1(bHLH)。同样的,转录水平AN1在缺乏功能性的矮牵牛体中严重减少AN4等位基因(R2R3-MYB),提示AN1表达可以由构成MBW复合体的R2R3-MYB因子调节[31.].
在小麦和大麦中发现的花青素生物合成调控中复杂的调控回路表明,这种现象比之前所认为的更为普遍,尽管存在一些物种特有的调控特征。
花青素生物合成结构基因的调控
结构基因表达的分析显示,在大麦的筛选中的花青素生物合成期间,在花青素生物合成期间不同调节花青素生物合成的基因。表达式Chs,气,F3h.,Dfr不受ANT1.或Ant2.或它们的组合,而转录F3'h和答显著上调,当两者蚂蚁基因占主导地位。这一观察结果与之前发表的数据截然不同,此前发表的数据显示紫粒大麦中整个基因组的共同调控[18.,32.].一种可能的解释是,结构基因参与了其他类黄酮的生物合成,如在大麦种皮中积累的原花青素[10并要求所有的酶都具有活性。外稃和果皮组织的剥皮过程无法避免种皮材料的存在,通过qRT-PCR可以检测到在种皮材料中有活性的基因。另一种可能的解释是,上述研究中的RNA是在另一个阶段提取的,当时基因的表达模式与当前研究中观察到的不同。
结论
在目前的研究中,应用标记辅助的回复方法我们开发了一组近的等源性线(NIL),其代表了解剖紫色色谱颗粒的紫色色素沉着特征的适当遗传模型。由于这些含量,我们揭示了大麦果皮中的花青素生物合成调节的特定特征。我们表明这两个基因ANT1.和Ant2.是花青素生物合成的调节网络的组成部分。在转录层面之间的正调节互动蚂蚁基因预先决定每个调控基因的转录活性以及花青素生物合成后期基因(F3'h,答).该数据代表了在大麦籽粒中的定量花青素含量进行靶向操纵的强基础。
材料和方法
植物材料和表型
品种Bowman (BW) (NGB22812, NordGen,https://www.nordgen.org/en/)外稃、果皮和叶鞘及其近等基因系BW648 (NGB22213)无花青素着色[33.紫果皮和红色叶子护套用作父母线,用于制造具有不同组合的衍生线蚂蚁基因。前面使用微卫星标记进行基因分型进行亲本系[18.,28.].
使用的标记辅助回交方法的方案如图2所示。1.
在f的植物中2以BW × BW648杂交后代为材料,对其叶鞘花色苷含量进行了评价ANT1..果皮色素的每个F2籽粒全年成熟的后代被评分。
标记辅助选择
在Plaschke与共同作者之后从植物的新鲜叶子中提取DNA [34.].2H染色体微卫星标记(Hvm23,Hvm54,Xbmag0125,Xbmag0140,XEBMAC0607.7h(Xbmac0187,XBMAG0516,Xgbms0041,XGBMS0088.,XGBMS0094.,Xgbms0141,Xgbms0226,Xgbms0240)[35.,36.]用于根据[的PCR)进行37.].Marion博士Röder (IPK-Gatersleben, Germany)好心提供了微卫星位点的引物。扩增子通过5% ACTGene琼脂糖凝胶(ACTGene, Inc., Piscataway, NJ, USA)分离。
Ant1 -和ant2-特定的引物(表1)的显性和隐性等位基因的区分,以验证基因的等位基因ANT1.和Ant2.在新创建的nil中。引物对采用OLIGO软件设计[38.].
花青素提取和测量
将成熟的种子在实验室谷物磨料LZM-1(Zernotechnika,莫斯科,俄罗斯)中研磨,将1g样品材料在10ml 1%HCl / MeOH中均化。将混合物在4℃下温育12小时,并在4℃下以12,000rpm离心25分钟。在530和700nm的Smartpepmplus分光光度计(Bio-Rad Laboratories,Inc.,Hercules,CA,USA)上测量吸光度(纠正阴霾[39.])。修正的吸光度值计算为(A530 - A700)。总花青素含量根据[40,表示为每克样品材料干重(DW)中cy3 -glu当量的微克数。
RNA提取、逆转录和qRT-PCR
使用RNeasy Plant Mini Kit (QIAGEN, Hilden, Germany)同时从籽粒成熟期早期的果皮组织中提取RNA,然后用RNase-Free dna酶组(QIAGEN, Hilden, Germany)处理。每个基因型有三个生物学重复。利用1 μg RNA,基于RevertAidTM试剂盒(Thermo Fisher Scientific Inc., Waltham, MA, USA)和(dT)逆转录制备单链cDNA。15.底漆。通过使用Syntol Sybr Green I套件(Syntol,Moscow,俄罗斯)进行随后的QRT-PCR。用于评估花青素生物合成结构的转录性的引物(Chs,气,F3h.,F3'h,Dfr,答)及规管(ANT1.和Ant2.)基因总结于附加文件3..一段UBC.(泛素)基因序列供参考[41.].运行每种反应的三种技术复制。预定量的克隆cDNA用于产生标准曲线。使用Mann-Whitney测试条目之间的转录物丰富的差异U-test(阈值为p≤0.05)。
缩写
- bHLH:
-
基本helix-loop-helix
- BW:
-
鲍曼
- DW:
-
干重
- MBW:
-
MYB-BHLHL-WD40
- MYB:
-
成髓细胞瘤
- 我的C:
-
髓鞘症
- 零:
-
近等基因系
- QTL:
-
定量特质基因座
- TF:
-
转录因子
参考文献
- 1.
李志刚,李志刚,李志刚。花青素在植物逆境响应中的环境意义。Photochem Photobiol。1999;70:1-9。https://doi.org/10.1111/j.1751-1097.1999.tb01944.x。
- 2。
Peer WA, Murphy AS。类黄酮作为信号分子。在:Groteworld E,编辑器。黄酮类化合物的科学柏林:春;2006.p . 239 - 68。
- 3.
Landi M, Tattini M, Gould KS。花青素在植物-环境相互作用中的多种功能作用。Environ Exp Bot. 2015; 119:4-17。https://doi.org/10.1016/j.envexpbot.2015.05.012.
- 4.
Smeriglio A,Barreca D,Bellocco E,Trombetta D.化学,药理学和花青素的健康益处。植物素描妇。2016; 30:1265-86。https://doi.org/10.1002/PTR.5642.
- 5。
谷物中的花青素:组成和健康效果。食物res int。2018; 109:232-49。https://doi.org/10.1016/j.foodres.2018.04.015.
- 6.
黄酮类化合物生物合成途径的转录调控研究进展acta photonica sinica . 2011;62(8): 2465-83。https://doi.org/10.1093/jxb/erq442.
- 7.
张志强,张志强,张志强,等。黄酮类化合物的生物合成及其调控。植物。2017;6(4):65。https://doi.org/10.3390/plants6040065.
- 8。
王志强,王志强,王志强,等。植物生殖器官中花青素合成调控的研究进展。植物科学。2011;181:219-29。https://doi.org/10.1016/j.plantsci.2011.05.009.
- 9。
Rausher MD,Miller Re,Tiffin P.化学素生物合成途径基因进化速率变化模式。mol Biol Evol。1999年; 16:266-74。
- 10.
Aastrup S, Outtrup H, Erdal K.大麦籽粒原花青素定位。carsb Res Commun. 1984; 49:105-9。https://doi.org/10.1007/BF02913969.
- 11.
王志强,王志强,王志强,等。植物种皮对种子休眠、萌发和寿命的影响拟南芥.植物理性。2000; 122:403-14。https://doi.org/10.1104/pp.122.2.403.
- 12.
Himi E, Yamashita Y, Haruyama N, Yanagisawa T, Maekawa M, Taketa S。ant28用于原花青素合成的基因编码R2R3 MyB结构域蛋白质(Hvmyb10)高度影响大麦的籽粒休眠。Euphytica。2011;188(1):141 - 51。https://doi.org/10.1007/S10681-011-0552-5.
- 13。
大麦籽粒颜色的生理基因研究。博士论文,英属哥伦比亚大学,1955年。
- 14。
Strygina kv,Börnera,khlestkina ek。大麦甲酮对沙孔素合成的调节网络组分的鉴定与表征。BMC植物BIOL。2017; 17(4):184。https://doi.org/10.1186/s12870-017-1122-3。
- 15.
Mullick DB, Faris DG, Brink VC, Acheson RM。大麦果皮和糊粉组织的花青素和花青素。acta botanica sinica(云南植物学报),2018;https://doi.org/10.4141/cjps58-071.
- 16.
紫色大麦花色苷类化合物QTL的遗传分析与定位Hordeum Vulgare.L.)谷物。Plos一个。2017; 12(8):E0183704。https://doi.org/10.1371/journal.pone.0183704.
- 17.
花青素缺乏突变体的双等位基因检测。《大麦新闻》1978;8:57-9。
- 18.
Shoeva OY, Mock惠普,Kukoeva TV, Börner A, Khlestkina EK。紫粒和黑粒中类黄酮生物合成途径基因的调控Hordeum Vulgare..Plos一个。2016; 11(10):E0163782。https://doi.org/10.1371/journal.pone.0163782.
- 19。
Khlestkina艾克。决定小麦不同器官颜色的基因。Russ J Genet Appl Res. 2013; 3:54-65。https://doi.org/10.1134/S2079059713010085.
- 20.
姜伟,刘涛,南伟,Jeewani DC,牛勇,李超,王勇,史旭,王超,王杰,李勇,高旭,王振中。两种转录因子的研究进展tappm1.和TaPpb1协同调节小麦紫色果皮花青素的生物合成。acta botanica yunnanica(云南植物研究). 2018;69(10):2555-67。https://doi.org/10.1093/jxb/ery101.
- 21.
Myler JL,Stanford EH。大麦的彩色遗传。J AM Soc Agron。1942; 34:427-36。
- 22.
伍德沃德RW, Thieret JW。大麦紫色外稃、外稃和果皮互补基因的遗传研究(Hordeum Vulgare.l .)。阿格龙j . 1953; 45:182-5。
- 23.
Cockram J, White J, Zuluaga DL, Smith D, Comadran J, Macaulay M, Luo Z, Kearsey MJ, Werner P, Harrap D, Tapsell C, Liu H, Hedley PE, Stein N, Schulte D, Steuernagel B, Marshall DF, Thomas WT, Ramsay L, Mackay I, bald DJ。AGOUEB联盟,Waugh R, O’sullivan DM.全基因组关联图谱到未测序大麦基因组的候选多态性解析。中国科学(d辑:地球科学)2010;https://doi.org/10.1073/pnas.1010179107.
- 24。
贾强,朱军,王军,杨军,张刚。基因的遗传定位和分子标记的开发PreS2控制大麦紫色粒。Euphytica。2016;208:215-23。https://doi.org/10.1007/s10681-015-1593-y.
- 25。
Himi E,Taketa S.孤立候选基因的大麦ANT1.和小麦rc.不同营养组织中控制花青素色素沉着的基因。中国生物医学工程学报。2015;29(4):1287-98。https://doi.org/10.1007/S00438-015-0991-0..
- 26。
Zakhrabekova S,Dockter C,Ahmann K,Braumann I,Gough SP,Wendt T,Lundqvist U,Mascher M,Stein N,Hansson M.遗传联系有助于克隆ert-M.在大麦中调控植物结构,并鉴定了一个强有力的候选ANT1.参与花青素的生物合成。植物学报。2015;88:609-26。https://doi.org/10.1007/s11103-015-0350-x.
- 27。
Strygina KV, Khlestkina EK。结构与功能的分化TaMpc1小麦和大麦的基因。BMC Evol Biol. 2019;出版中。
- 28.
Shoeva Oy,Kukoeva TV,BörnerA,khlestkina ek。大麦ANT1.是玉米的同系物吗C1其产物是调控叶鞘中花青素合成的调控机制的一部分。植物品种。2015;134(4):400 - 5。https://doi.org/10.1111/pbr.12277.
- 29.
Gordeeva Ei,Shoeva Oy,Khlestkina EK。标记辅助开发面包小麦近代线携带各种组合的紫果皮(页等位基因。Euphytica。2015; 203(2):469-76。https://doi.org/10.1007/s10681-014-1317-8.
- 30.
Hichri I, Heppel SC, Pillet J, Leon C, Czemmel S, Delrot S, Lauvergeat V, Bogs J.碱性螺旋-环-螺旋转录因子MYC1参与调控葡萄藤类黄酮生物合成途径。摩尔。2010;3:509-23。https://doi.org/10.1093/mp/ssp118.
- 31。
Albert NW, Davies KM, Lewis DH, Zhang H, Montefiori M, Brendolise C, Boase MR, Ngo H, Jameson PE, Schwinn KE。一个保守的转录激活因子和抑制因子的网络调节花青素色素沉着。植物细胞。2014;26:962 - 80。https://doi.org/10.1105/tpc.113.122069.
- 32.
关键词:大麦,查尔酮合成酶,二氢黄酮醇还原酶,黄酮-3-羟化酶,花色素苷,原花青素Theor Appl Genet 1992; 83:695-706。https://doi.org/10.1007/BF00226687.
- 33.
draka A, Franckowiak J, Lundqvist U, Bonar N, Alexander J, Houston K, Radovic S, Shahinnia F, Vendramin V, Morgante M, Stein N, Waugh R.大麦形态和发育的遗传分析。植物杂志。2011;155(2):617 - 27所示。https://doi.org/10.1104/pp.110.166249.
- 34.
基于微卫星标记的小麦遗传多样性分析。中国科学(d辑:地球科学)1995;91(6-7):1001-7。https://doi.org/10.1007/BF00223912..
- 35.
李建忠,Sjakste TG, Röder MS, Ganal MW。127个大麦微卫星新标记的开发及遗传定位。应用计算机学报。2003;107(6):1021-7。https://doi.org/10.1007/S00122-003-1345-6.
- 36。
Ramsay L, Macaulay M, degli Ivanissivich S, Maclean K, Cardle L, Fuller J, Edwards K, Tuvensson S, Morgante M, Massari A, Maesti E, Marmiroli N, Sjakste T, Ganal M, Powell W. Waugh R遗传学,2000;156:1997 - 2005。
- 37。
RöderMs,Korzun V,Wenehake K,Plaschke J,Tixier M-H,Leroy P,Ganal MW。小麦微卫星地图。遗传学。1998年; 149:2007-23。
- 38。
Offerman JD, Rychlik W. Oligo引物分析软件。在:Krawetz SA, Womble DD,编辑。生物信息学导论:理论与实践方法。新泽西州:Humana出版社;2003.p . 345 - 61。
- 39。
花青素的紫外-可见光谱分析。在:Wrolstad RE, Acree TE, An H, Decker EA, Penner MH, Reid DS, Schwartz SJ, Shoemaker CF, Sporns P,编辑。食品分析化学的现行规程。纽约:约翰·威利父子,2001年卷;2001.F1.2.1-F1.2.13页。
- 40。
ABDEL-AAL E-SM,HUCL P.一种快速量化蓝色阿列酮和紫果皮小麦的总花青素。麦片Сhem。1999年; 76:350-4。https://doi.org/10.1094/cchem.1999.76.3.350.
- 41。
Himi E, Nisar A, Noda K.颜色基因(R和rc.)对于谷物和植物精灵上调小麦的黄酮类生物合成基因。基因组。2005; 48:747-54。https://doi.org/10.1139/g05-026.
致谢
我们感谢Börner博士为美国的鲍曼附近提供了美国母弓,Galina Generalova女士和奥尔加Zakharova女士进行技术援助。
资金
这项工作得到了俄罗斯基础研究基础(RFBR)No.16-34-60052(包括出版成本)的批准。植物在ICG温室设施中培养(由预算项目编号0324-2018-0018支持)。
数据和材料的可用性
发达的线条的种子可以从ICG Collection'Genagro'获得(俄罗斯新西伯利亚,http://ckp.icgen.ru/plants/) 根据要求。
关于这个补充
本文已作为一部分发布BMC Plant Biology Volume 19 Supplement 1, 2018: Selected articles from BGRS\SB-2018: Plant Biology。该补充的全部内容可在网上找到//www.cinefiend.com/articles/supplements/volume-19-supplement-1.
作者信息
从属关系
贡献
EIG参与了QRT-PCRS分析和手稿的起草。AYG设计QRT-PCR的引物,进行了QRT-PCR并分析了数据。TVK培养大麦,进行杂交和标记辅助选择线,提取RNA。EKK设计了这项研究,协调了这项研究并批判性地修改了手稿。OYS解释了数据并写了稿件。所有作者阅读并认可的终稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
戈迪娃,我,格拉戈列娃,a.y.,库科列娃,电视et al。紫色大麦(Hordeum Vulgare.标记辅助开发NILs,用于研究花青素生物合成调控网络的特性。BMC植物BIOL.19,52(2019)。https://doi.org/10.1186/s12870-019-1638-9
关键字
- Hordeum Vulgare.
- 微卫星
- 同基因的线附近
- 转录因子
- 结构基因
- ANT1.
- Ant2.
- 积极的反馈