- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 发表:GydF4y2Ba
花粉发育和生育需要发育梭菌中的脯氨酸合成GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba18GydF4y2Ba, 文章编号:GydF4y2Ba356GydF4y2Ba(GydF4y2Ba2018GydF4y2Ba)GydF4y2Ba
抽象的GydF4y2Ba
背景GydF4y2Ba
在许多植物中,氨基酸脯氨酸在花粉中大量积累,在拟南芥中,脯氨酸合成的中断导致小孢子发育的流产。到目前为止,尚不清楚是局部生物合成还是脯氨酸运输决定了可育花粉发育的成功。GydF4y2Ba
结果GydF4y2Ba
我们分析了脯氨酸生物合成基因的表达模式GydF4y2Ba吡咯啉-5-羧酸合成酶1和2(P5CS1GydF4y2Ba&GydF4y2Ba2GydF4y2Ba),这两种亚型在发育中的小孢子和花粉粒中表达强烈,但在周围的孢子体组织中表达不一致。我们引入了GydF4y2Bap5cs1 / p5cs1 p5cs2 / p5cs2GydF4y2Ba突变的背景,额外的副本GydF4y2BaP5CS2.GydF4y2Ba在花椰菜花叶病毒(CaMV)的控制下GydF4y2Ba)35SGydF4y2Ba子,tapetum-specificGydF4y2Ba脂质转移蛋白12GydF4y2Ba(GydF4y2BaLTP12.GydF4y2Ba)启动子或花粉特异性GydF4y2BaAT5G17340GydF4y2Ba启动子确定在哪个位点脯氨酸生物合成可以恢复脯氨酸缺乏的小孢子的育性。通过β-葡萄糖醛酸酶(GUS)分析和花粉粒和9/10期花药中脯氨酸的直接测定,证实了这些启动子的特异性。的表达GydF4y2BaP5CS2.GydF4y2Ba在…控制之下GydF4y2BaAT5G17340GydF4y2Ba启动子完全恢复了突变体花粉的脯氨酸含量和正常的形态和育性。相反,表达GydF4y2BaP5CS2.GydF4y2Ba由GydF4y2BaLTP12.GydF4y2Ba或GydF4y2BaCamv35s.GydF4y2Ba启动子仅能部分恢复花粉发育,对花粉育性影响不大。GydF4y2Ba
结论GydF4y2Ba
综上所述,我们的结果表明,脯氨酸运输不能满足雄性生殖系细胞的需求。花粉发育和育性取决于小孢子发育后期和成熟花粉粒中局部脯氨酸的生物合成。GydF4y2Ba
背景GydF4y2Ba
最近观察到拟南芥中脯氨酸合成破坏引起的堕胎在配子体发育期间引起不孕症的突发性突出了脯氨酸对花粉生育的重要性[GydF4y2Ba1GydF4y2Ba那GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].这些发现提供了生育能力与高水平的自由脯氨酸之间的功能联系,在花器器官的非压力条件下 - 特别是花药和花粉粮食 - 不同植物物种[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba].然而,花粉中如此高水平的脯氨酸是由于局部合成还是来自其他孢子体组织的进口,尚不清楚。GydF4y2Ba
在高等植物中,脯氨酸是通过短途径合成的,它催化消耗ATP和nadph的谷氨酸还原为脯氨酸。在第一步限速步骤中,谷氨酸被双功能酶Δ转化为谷氨酸半醛GydF4y2Ba1GydF4y2Ba-pyrroline-5-carboxylate合成酶(P5CS)。在第二步中,谷氨酸半醛自发循环成ΔGydF4y2Ba1GydF4y2Ba- 通过酶P5C还原酶(P5CR)进一步减少到脯氨酸的吡咯啉-5-羧酸盐(P5C)。一些作者假设来自鸟氨酸的脯氨酸合成的替代途径,通过酶的顺序作用催化,酶喹啉-δ-氨基转移酶和p5cr [GydF4y2Ba11GydF4y2Ba那GydF4y2Ba12GydF4y2Ba].这两种酶的差分定位和功能的观察GydF4y2BaP5CSGydF4y2Ba表达对繁殖是必不可少的(见下文),提示由谷氨酸合成是拟南芥脯氨酸生物合成的唯一功能途径[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba13GydF4y2Ba].GydF4y2Ba
在拟南芥中,P5CS是由两个同源基因编码的GydF4y2BaP5CS1.GydF4y2Ba(GydF4y2BaAT2G39800.GydF4y2Ba) 和GydF4y2BaP5CS2.GydF4y2Ba(GydF4y2BaAt3g55610GydF4y2Ba) [GydF4y2Ba14GydF4y2Ba].GydF4y2BaP5CS1.GydF4y2Ba被认为负责应激诱导的脯氨酸积累,作为纯合GydF4y2Bap5cs1GydF4y2Ba突变体在压力下不积累脯氨酸[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba15GydF4y2Ba].相比之下,GydF4y2BaP5CS2.GydF4y2Ba主要参与胚胎发育和花的转变等发育过程:GydF4y2Bap5cs2GydF4y2Ba纯合突变体通常是胚胎致死的,但可以用外源脯氨酸挽救,并能在有利条件下产生有活力的种子[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba15GydF4y2Ba].救援GydF4y2Bap5cs1 / p5cs2GydF4y2Ba到目前为止还没有报告双突变体,并纯合的准双突变体GydF4y2Bap5cs1GydF4y2Ba和杂合GydF4y2Bap5cs2GydF4y2Ba(GydF4y2Bap5cs1 / p5cs1 p5cs2 / p5cs2GydF4y2Ba,从这里被称为GydF4y2Bap5csGydF4y2Ba倍半体(Sesquimutants)营养组织游离脯氨酸水平极低,开花较晚,雄性生殖能力下降。的条件下GydF4y2Bap5csGydF4y2Ba患有亚历山大举措判断的花粉颗粒的术术植物大约一半的花粉粒度小,萎缩,缺乏核,不可行,如亚历山大污染[GydF4y2Ba3.GydF4y2Ba].当GydF4y2Bap5csGydF4y2Ba三倍半个体可以自我受精,传播GydF4y2Bap5cs2GydF4y2Ba突变等位基因下一代低于预期和形成流产纯合的形成GydF4y2Bap5cs2GydF4y2Ba未观察到突变胚胎。传输GydF4y2Bap5cs2GydF4y2Ba来自花粉的突变等位基因GydF4y2Bap5csGydF4y2Ba对于野生型雌蕊的术语几乎从未观察到(0%到0.8%,观察到的50%的预期传播的透射)表明只有有功能的花粉GydF4y2BaP5CSGydF4y2Ba等位基因发育正常,是肥沃[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].GydF4y2Ba
详细描述了雄性生殖系的发育,并将其分为13个阶段[GydF4y2Ba16GydF4y2Ba]:阶段1至7包括在花药局内发育孢子肠细胞,减数分裂和自由孢子四胞胎的释放。在阶段8和9中,单独的幼儿孢子从胼insed的四轮释放并变为真空。从第10阶段开始,微孔和绦虫细胞都有助于花粉壁和外部的形成。阶段11和12分别标记为分别产生双细胞和三细胞花粉的有丝分裂。第12阶段还通过隔膜变性准备花粉颗粒的释放,其在第13阶段完成,口腔破裂。在早期阶段,孢子菌细胞和周围的绦虫细胞通过Plasmodesmata互连,从而使营养物质和大分子的对称进入花粉母细胞[GydF4y2Ba17GydF4y2Ba].Tapetum在花粉发育和生育率中起重要作用,首先通过烟草中的胶束细胞的遗传烧蚀来证明,这导致雄性不育[GydF4y2Ba18GydF4y2Ba].后来,杨等人。(2003)[GydF4y2Ba19GydF4y2Ba的基因突变GydF4y2Ba毯行列式1GydF4y2Ba通过强迫绒毡层细胞前体分化为小孢子细胞而不是绒毡层,导致拟南芥雄性不育。最近,花药壁中间层在可育花粉发育过程中也发挥了重要作用[GydF4y2Ba20.GydF4y2Ba].在减数分裂期间,小孢子四分体之间和周围形成了厚厚的胼胝质壁,在这个阶段,小孢子四分体被共分离[GydF4y2Ba17GydF4y2Ba那GydF4y2Ba21GydF4y2Ba].因此,微微孢子依赖于组织塑料传输或内源性合成以进一步积累代谢物,例如脯氨酸。GydF4y2Ba
可用数据表明,但没有证明,脯氨酸可以在花粉颗粒中合成或在周围的孢子体组织中合成。实际上,微阵列数据表明,脯氨酸合成所涉及的所有基因在拟南芥幼儿孢子和花粉颗粒以及花粉和花蕾中表达[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba].不幸的是,大多数微阵列用于分析鲜花的不同部分的不区分GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba.我们发现一个实验(基因表达Omnibus加入GSM159352),其中CATMA阵列上的基因特异性探针在COL-0和WS-0 Pollen中产生了2至10倍的信号[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba24GydF4y2Ba].Székely等。(2008)检测到Arabidopsis花粉中的P5CS1:GFP融合蛋白,观察与转录相容GydF4y2BaP5CS1.GydF4y2Ba在雄性生殖系中或导入P5CS1蛋白或mRNA。P5CS2:GFP在花药中的信号不明显,而在孢子体花药组织中表现较强[GydF4y2Ba15GydF4y2Ba].GydF4y2Ba
另一方面,有环境证据表明,脯氨酸也可以从远处组织主动转运,或由孢子体花药组织释放后进入花粉粒。脯氨酸通过韧皮部导管从营养组织到花组织的长距离运输已被证实[GydF4y2Ba25GydF4y2Ba那GydF4y2Ba26GydF4y2Ba和基因GydF4y2Ba脯氨酸转运蛋白1(prot1GydF4y2Ba;GydF4y2BaAT2G39890.GydF4y2Ba)拟南芥中特定脯氨酸载体的编码已被证明在成熟花粉中高度表达[GydF4y2Ba27GydF4y2Ba,这两种证据明显表明,运输是花粉中脯氨酸积累的原因。然而,单敲除、双敲除和三敲除的突变基因均不属于GydF4y2BaprotGydF4y2Ba家庭 (GydF4y2BaAT2G39890.GydF4y2Ba那GydF4y2BaAT3G55740GydF4y2Ba那GydF4y2BaAT2G36590GydF4y2Ba)表现出脯氨酸含量或花粉萌发率的变化[GydF4y2Ba27GydF4y2Ba].进一步氨基酸载体的表达具有更宽的基底特异性,例如GydF4y2Ba赖氨酸组氨酸转运蛋白2(LHT2GydF4y2Ba;GydF4y2BaAt1g24400GydF4y2Ba) 和GydF4y2BaLHT4GydF4y2Ba(GydF4y2BaAt1g47670GydF4y2Ba),在显影中检测到或成熟花粉,但目前还没有关于这些转运中花粉的生理功能信息[GydF4y2Ba28GydF4y2Ba].GydF4y2Ba
为了评估花粉育性所需的脯氨酸是否以及在多大程度上是在雄性生殖系中局部合成的,还是来自周围的孢子体组织,我们分析了其表达模式GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba在拟南芥花药中产生,并进行了表征GydF4y2Bap5csGydF4y2Basesquimutant植物中表达的功能性拷贝GydF4y2BaP5CS2.GydF4y2Ba在营养组织中,在绒毡层中或在发育花粉粒中。对这些植物的分析表明,花粉发育特别是花粉育性所必需的脯氨酸主要是在发育中的小孢子和成熟花粉粒中合成的,在绒毡层或其他孢子体组织中合成的脯氨酸很少或没有贡献。GydF4y2Ba
结果GydF4y2Ba
启动子GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba在花粉发育后期的小孢子和花粉粒中有活性吗GydF4y2Ba
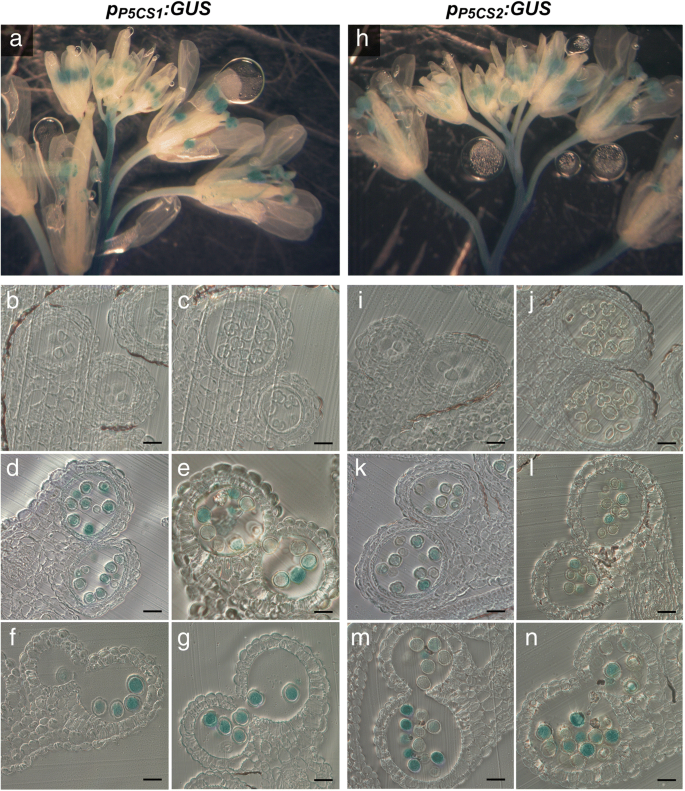
作为建立花粉发育和育性所需脯氨酸合成的第一步,我们分析了在花粉发育和育性控制下GUS酶活性的模式GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba在不同发展阶段的拟南芥中的启动子区域(图。GydF4y2Ba1GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S1)。作为启动子序列,我们采用2932 bp的上游GydF4y2BaP5CS1.GydF4y2Ba和2097年的BP上游GydF4y2BaP5CS2.GydF4y2Ba起始密码子,根据Ábrahám等人(2003)[GydF4y2Ba29GydF4y2Ba].我们选择并分析了18个独立的变压器GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba构建和21GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯。GydF4y2Ba从每个结构中,我们选择3个具有代表性染色模式的纯合子系进行更详细的分析。这两个GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba在花药中诱导特异性GUS表达,在主干中并在花梗中延伸到较小的延伸,但不是在鲜花或芽的其他部分中(图。GydF4y2Ba1GydF4y2Baa和h)。组织学横截面的分析显示GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba在花粉发育的第10 - 13阶段,即第一次有丝分裂之前到成熟花粉释放之前,小孢子和成熟花粉粒的发育特别活跃(图2)。GydF4y2Ba1GydF4y2Bab, c, d, e, f和g, i, j, k, l, m和n)。GydF4y2Ba1GydF4y2Bab和c, i和j),或在花药的任何孢子体组织中(图。GydF4y2Ba1GydF4y2Ba这些结果表明,拟南芥从第10期开始,花药中脯氨酸的合成几乎只发生在雄性配子体组织,即小孢子和花粉粒中,而在绒毡层、中间层和内膜等周围的孢子体组织中很少或不表达。GydF4y2Ba
花药中Gus活性的组织化学定位GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba转基因拟南芥。花序的GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba(GydF4y2BagGydF4y2Ba) 和GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba(GydF4y2Bah nGydF4y2Ba)转基因植株用X-Gluc溶液浸润,染色过夜,固定后清除,进行显微分析。GydF4y2Ba一个hGydF4y2Ba花蕾和花在不同发育阶段的全山花序几乎只在花药中显示GUS活性。GydF4y2Bab-gGydF4y2Ba和GydF4y2Ba在GydF4y2Ba不同发育阶段的花药横切面:GydF4y2Bab,我GydF4y2Ba第8阶段与人蛋前微孔母细胞;GydF4y2Bac jGydF4y2Ba第9阶段小孢子四分体;GydF4y2Bad、kGydF4y2Ba第十阶段,两者都有强烈的活动GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba四处分离后;GydF4y2Bae、lGydF4y2Ba第11期具发育完全的外壁和退化的绒毡层;GydF4y2BaF,MGydF4y2Ba12阶段12带隔膜变性和GydF4y2BaG,N.GydF4y2Ba第13阶段与成熟花粉在花药裂开。在任何孢子素的花药组织中,几乎没有GUS染色。所有刻度条=20μmGydF4y2Ba
生物信息学启动子分析,包括基因本体论(GO)富集分析,表明在启动子中GydF4y2BaP5CS2.GydF4y2Ba并且,在较小程度上,GydF4y2BaP5CS1.GydF4y2Ba推定GydF4y2BaCIS.GydF4y2Ba-调控元件富集于与花粉发育和育性、花粉管生长、花药发育和双受精形成合子和胚乳相关的转录因子结合位点(附加文件)GydF4y2Ba2GydF4y2Ba:图S2)。此外,两者的发起人GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba包含WRKY34和WRKY2,参与花粉发育和功能[充分表征的转录因子识别位点GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba].GydF4y2Ba
Camv35s.GydF4y2Ba启动子驱动的孢子体表达GydF4y2BaP5CS2.GydF4y2Ba不拯救异常GydF4y2Bap5cs1 / p5cs2GydF4y2Ba花粉GydF4y2Ba
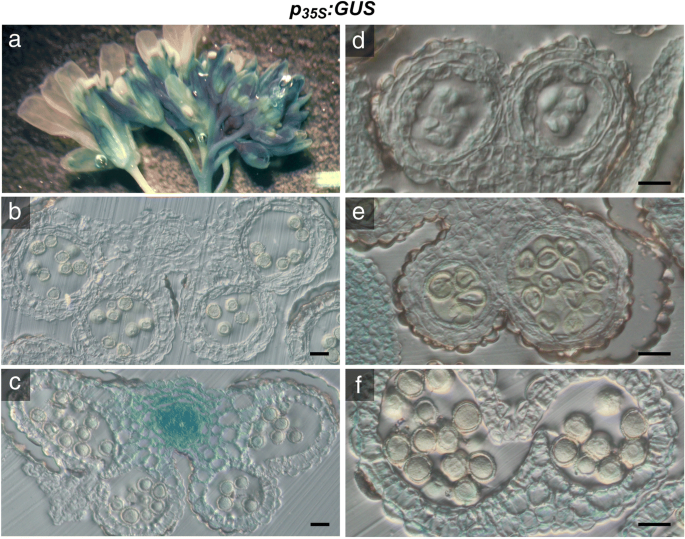
在尝试补充异常花粉发育GydF4y2Bap5csGydF4y2Ba过度表达的癫痫GydF4y2BaP5CS2.GydF4y2Ba,我们引入了转基因的GydF4y2BaP5CS2.GydF4y2Ba在…的控制之下GydF4y2BaCamv35s.GydF4y2Ba据据报道,促进剂在拟南芥的大多数组织和器官中促进基因表达,尽管不适于发育梭菌和花粉颗粒[GydF4y2Ba32GydF4y2Ba].以确定其组织特异性GydF4y2BaCamv35s.GydF4y2Ba推动者,我们分析了携带A的植物的花药中的GUS活动GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba组织化学染色构建。在整个花序GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba在雌蕊,长丝和萼片中的衍射GUS活性以及不同发育阶段的花芽(图。GydF4y2Ba2GydF4y2Ba一个,附加文件GydF4y2Ba3.GydF4y2Ba:图S3A,B)。花树的组织学横截面GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba在维管束显示强GUS活性(图GydF4y2Ba2GydF4y2BaC)光和漫射活性GydF4y2BaCamv35s.GydF4y2Ba在减数分裂后的第8期,在花药和小孢子的所有孢子体组织中都有启动子(图。GydF4y2Ba2GydF4y2BaB,C和D)。在第9阶段,在无核梭菌中和阶段11和12的花粉晶粒中,没有检测到GUS活性(图。GydF4y2Ba2GydF4y2BaE和f),确认Wilkinson等人的结果。(1997)[GydF4y2Ba32GydF4y2Ba].GydF4y2Ba
花药中Gus活性的组织化学定位GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba转基因拟南芥植物。花序的GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba将转基因植株用X-Gluc溶液浸润,染色过夜,固定并清除,进行显微分析。GydF4y2Ba一种GydF4y2Ba整个花序GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba在不同发育阶段的细丝,萼片,雌蕊和花芽中染色GUS染色。GydF4y2Bab-fGydF4y2Ba组织切片GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba花药矩:GydF4y2BaB.GydF4y2Ba未染色的花药在11/12阶段,由于光散射而显示出微弱的蓝色彩虹色。GydF4y2BaCGydF4y2Ba强大的GUS染色在第11/12阶段的血管束。在花粉囊内完全成熟的花粉中没有检测到GUS活性。酒吧在(GydF4y2BaB.GydF4y2Ba) 和 (GydF4y2BaCGydF4y2Ba= 50 μm。GydF4y2BaD.GydF4y2Ba第8期花药在高倍镜下显示弱,弥漫GUS染色在所有孢子体组织。GydF4y2BaE.GydF4y2Ba第9期花药在单核小孢子中无GUS染色。GydF4y2BaFGydF4y2Ba第12期花药在退化的花药壁中GUS活性较弱,而在成熟花粉中则没有。在一些花粉粒中可见的淡绿色可能表明35S启动子的残留活性,但也可能来自X-Gluc染色的可溶性中间体的扩散或花粉粒固有的低gus样活性[GydF4y2Ba57GydF4y2Ba那GydF4y2Ba58GydF4y2Ba那GydF4y2Ba59GydF4y2Ba].柱= 20 μm in (GydF4y2Bad-fGydF4y2Ba)GydF4y2Ba
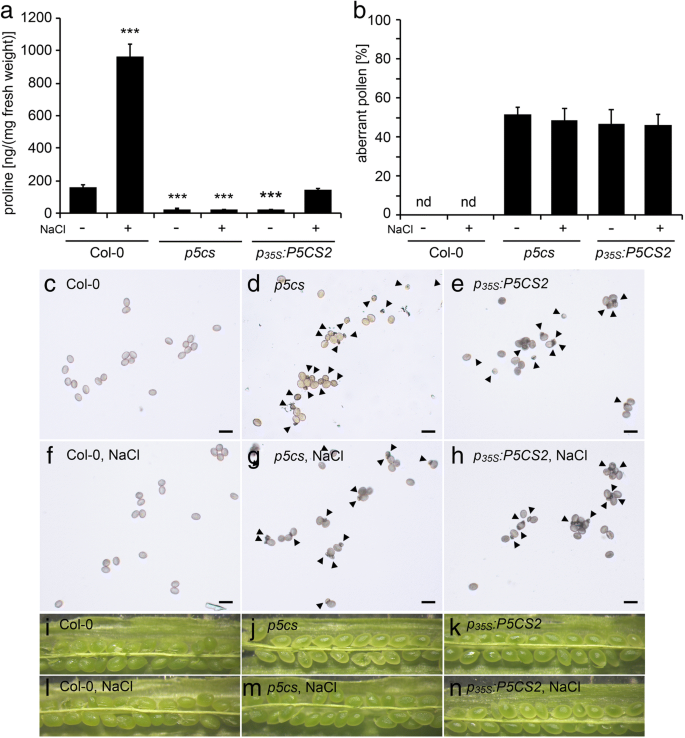
随后,一个GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba结构被引入GydF4y2Bap5csGydF4y2Ba倍半突变体来评估组织表达的影响GydF4y2BaP5CS2.GydF4y2Ba在亲本孢子体组织中的发育GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉。但是,尽管存在存在GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba结果表明,在花序中检测到低水平的游离脯氨酸(图。GydF4y2Ba3.GydF4y2Ba一个,附加文件GydF4y2Ba4.GydF4y2Ba:表S1)GydF4y2Ba.GydF4y2Ba高水平GydF4y2BaP5CS2.GydF4y2Ba在植物营养发育的早期至开花期均有脯氨酸的表达和积累,而在开花前期则有脯氨酸的表达和积累GydF4y2BaP5CS2.GydF4y2Ba游离脯氨酸的表达量和水平下降到与原脯氨酸相似的水平GydF4y2Bap5csGydF4y2Ba昏迷线,表明GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba转基因被沉默(数据未显示)。在先前的研究中,我们观察到,轻度盐应激废除内源性的共抑制GydF4y2BaP5CSGydF4y2Ba转基因诱导的基因GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS1GydF4y2Ba构建[GydF4y2Ba9.GydF4y2Ba].因此,盐处理(0.1M NaCl)GydF4y2Bap5csGydF4y2Ba举行的戏曲仿真GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba构建恢复脯氨酸合成至类似于非应激野生型植物的水平(图。GydF4y2Ba3.GydF4y2Ba一个,附加文件GydF4y2Ba4.GydF4y2Ba:表S1)。然而,GUS酶活性的变化规律GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba0.1 M NaCl处理对花药的结构没有影响(数据未显示)。GydF4y2Ba
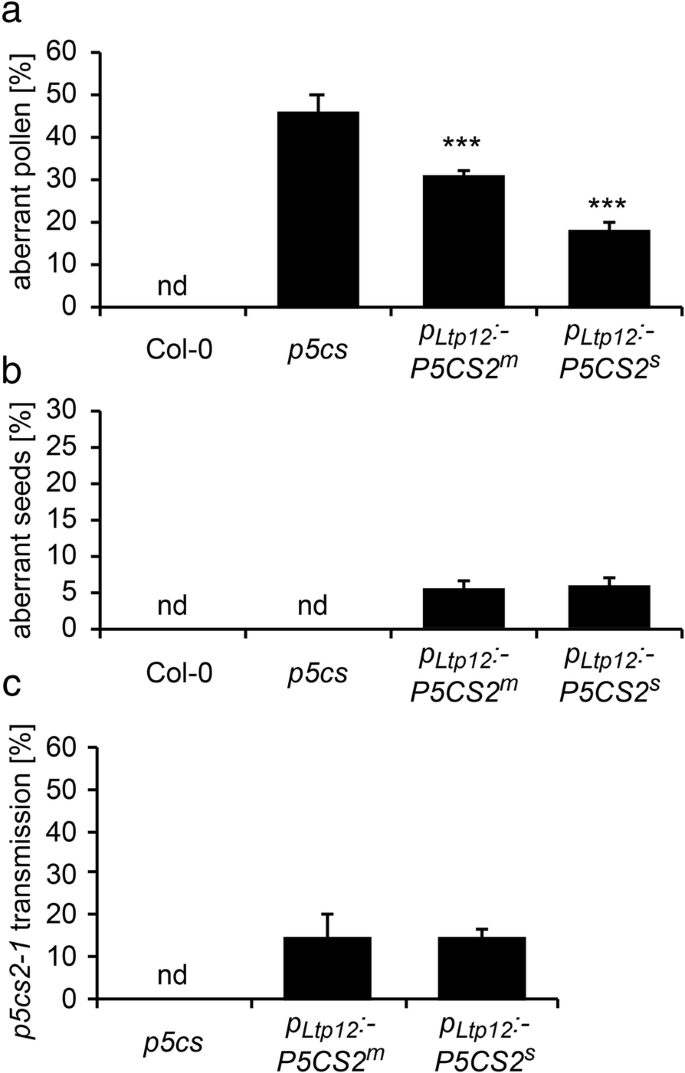
水稻花粉发育及育性分析GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba线条。GydF4y2Ba一种GydF4y2Ba野生型(Col-0)的花序中的脯氨酸积聚,GydF4y2Bap5csGydF4y2BaSesquimutants(GydF4y2Bap5csGydF4y2Ba) 和GydF4y2Bap5csGydF4y2Ba纯合的倍半突变体GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba构建(GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba).根据材料和方法,植株要么正常浇水,要么暴露在100mm NaCl下。条形图代表来自不同植物的至少三个样品的平均±SE。***表示与Col-0野生型有显著差异(GydF4y2BaP.GydF4y2Ba < 0.001, by student’s T-test).B.GydF4y2Ba从植物处理的植物中的花粉粒的百分比以与(GydF4y2Ba一种GydF4y2Ba).条形图代表52至311的±SE分析来自至少三种独立植物的花粉粒。nd:未检测到。GydF4y2Ba碳氢键GydF4y2Ba野生型花粉粒的亮视野显微照片(GydF4y2Bac、fGydF4y2Ba),GydF4y2Bap5csGydF4y2Ba(GydF4y2Bad、gGydF4y2Ba), 和GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba(GydF4y2Bae、hGydF4y2Ba)从正常浇水的植物(GydF4y2Bac, d, eGydF4y2Ba)或经NaCl处理的植物(GydF4y2BaF,G,HGydF4y2Ba).箭头表示小的、异常的花粉粒。柱= 50 μm。GydF4y2Ba在GydF4y2Ba开,过早的角果Stereomicroscopic图像。没有异常种子,指示的杀伤力GydF4y2Bap5cs2-1GydF4y2Ba纯合的胚胎(与图1相比较。GydF4y2Ba6.GydF4y2Ba),但在正常情况下均不可见(GydF4y2Ba我知道GydF4y2Ba)NaCl治疗后(GydF4y2BaL-M.GydF4y2Ba)GydF4y2Ba
无论是在正常条件下还是在轻度盐胁迫处理下,两者之间的差异均无统计学意义GydF4y2Bap5csGydF4y2Ba倍半植物有或没有GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba转基因,既不处于畸形花粉的频率(图。GydF4y2Ba3.GydF4y2BaB,C,D,E,F,G和H)也不是自授粉植物的单片机中所得胚胎的比例(图。GydF4y2Ba3.GydF4y2Bai,j,k,l,m和n)。此外,存在额外的GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba转基因没有能够传播GydF4y2Bap5cs2-1GydF4y2Ba突变等位基因与野生型雌蕊异花授粉的F1代GydF4y2Bap5csGydF4y2BaSesquimutant花粉(附加文件GydF4y2Ba4.GydF4y2Ba:表S1)。重要的是要注意尽管花粉表型相同(即,高频率的异常花粉颗粒,而且没有传播GydF4y2Bap5cs2-1GydF4y2Ba等位基因),NACL治疗诱导在花药中显着增加的自由脯氨酸水平GydF4y2Bap5csGydF4y2Ba昏迷的植物GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba转基因存在(图。GydF4y2Ba3.GydF4y2Baa).这些结果表明,孢子体花药组织中游离脯氨酸的水平与野生型植物相似,不足以弥补野生型植物的发育缺陷GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉。GydF4y2Ba
绒毡层或小孢子特异性启动子的选择GydF4y2Ba
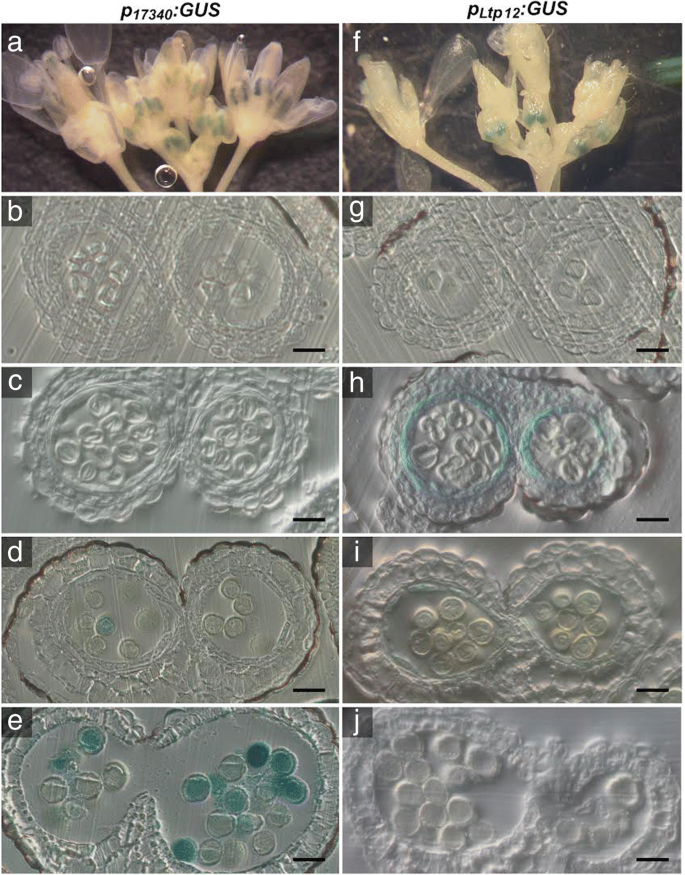
为了进一步研究脯氨酸合成在绒毡层(最接近花药室的孢子体细胞层)、小孢子和花粉粒中的影响,我们决定将其作为靶点GydF4y2BaP5CS2.GydF4y2Ba通过使用组织特异性启动子来这些细胞。基于可用的微阵列和文献数据,我们选择了微孔和花粉特异性启动子GydF4y2BaAT5G17340GydF4y2Ba(GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba)和绒毡层特异性GydF4y2BaLTP12.GydF4y2Ba(GydF4y2BaAT3G51590.GydF4y2Ba)启动子[GydF4y2Ba33GydF4y2Ba那GydF4y2Ba34GydF4y2Ba那GydF4y2Ba35GydF4y2Ba].这些启动子的特异性通过产生含有这些启动子的拟南芥株系来验证GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba转录融合构建体和分析不同阶段的花药中的GUS活性模式(图。GydF4y2Ba4.GydF4y2Ba,附加文件GydF4y2Ba3.GydF4y2Ba:图S3C-F)。确认之前的观察,GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba诱导强GUS活性特别在绒毡层在阶段9和花药发育的10,并且当绒毡层退化GUS表达消失。在相同的发育阶段,GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba在配子体发育的后期,小孢子的GUS活性更强。在花药的其他组织中几乎未检测到GUS酶活性。GydF4y2Ba
花药中Gus活性的组织化学定位GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba转基因拟南芥植物。花序的GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba(GydF4y2Ba安妮GydF4y2Ba) 和GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba(GydF4y2Baf jGydF4y2Ba)转基因植株用X-Gluc溶液浸润,染色过夜,固定后清除,进行显微分析。GydF4y2Ba一个fGydF4y2Ba花蕾和花在不同发育阶段的全山花序只在花药中显示GUS活性。GydF4y2Ba抵扣GydF4y2Ba和GydF4y2BaG-J.GydF4y2Ba不同发育阶段的花药横切面:GydF4y2Bab, gGydF4y2Ba第8阶段与人蛋前微孔母细胞;GydF4y2Bac、hGydF4y2Ba第9期小孢子四分体。绒毡层中有较强的GUS活性GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba(H);GydF4y2Ba维,我GydF4y2Ba第一阶段10的开始GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba发育中的花粉表达(GydF4y2BaD.GydF4y2Ba)和花药退化绒毡层中残留的GUS活性GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba构建(GydF4y2Ba一世GydF4y2Ba);GydF4y2Bae, jGydF4y2Ba第12期花粉发育完全,GUS活性强GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba表达式(GydF4y2BaE.GydF4y2Ba).12期花药未检测到GUS活性GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba转基因植物(GydF4y2BajGydF4y2Ba).棒= 20 μmGydF4y2Ba
Tapetum-specific表达GydF4y2BaP5CS2.GydF4y2Ba减少异常花粉的发病率,但导致生育能力恢复差GydF4y2Bap5cs1 / p5cs2GydF4y2Ba花粉GydF4y2Ba
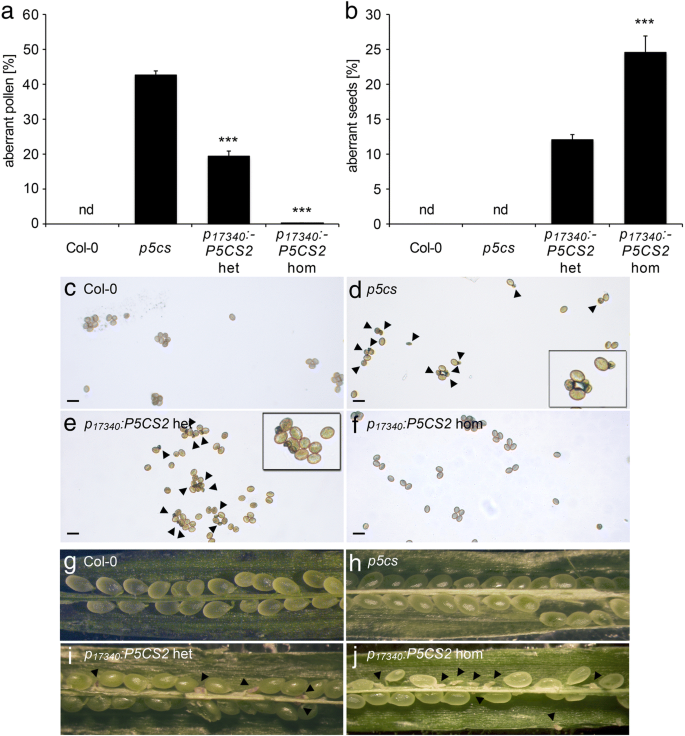
Tapetum细胞提供微孔发育的营养素,并有助于形成花粉外层的外层[GydF4y2Ba36GydF4y2Ba].调查if.GydF4y2BaP5CS2.GydF4y2Ba在发育中的小孢子中,绒毡层的表达可以替代脯氨酸的合成GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba构造成GydF4y2Bap5csGydF4y2BaSesquimutant植物。我们选择了超过20个主要转型体,携带两种GydF4y2Bap5cs2-1GydF4y2Ba突变等位基因和GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba其中9个携带了转基因的一个副本。在杂合子植物中,畸形花粉的比例比杂合子减少GydF4y2Bap5csGydF4y2Ba倍半植物,虽然程度不同(数据未显示)。我们选择3个纯合子系,代表中度(GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BamGydF4y2Ba)和强壮(GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BaS.GydF4y2Ba花粉发育缺陷的互补GydF4y2Bap5csGydF4y2Basesquimutant以获得更详细的分析(附加文件GydF4y2Ba4.GydF4y2Ba:表S1)。花粉中异常花粉的比例为46±3%GydF4y2Bap5csGydF4y2Ba三倍半花的数量分别为31±1%和18±2%GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BamGydF4y2Ba和GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BaS.GydF4y2Ba分别行(无花果。GydF4y2Ba5.GydF4y2Ba一种)。GydF4y2Ba
水稻花粉发育及育性分析GydF4y2Bap5csGydF4y2Ba举行的戏曲仿真GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba构造。GydF4y2Ba一种GydF4y2Ba野生型(Col-0)的异常花粉粒百分比GydF4y2Bap5csGydF4y2BaSesquimutants(GydF4y2Bap5csGydF4y2Ba) 和GydF4y2Bap5csGydF4y2Ba患有中等的癫痫症(GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:GydF4y2BaP5CS2.GydF4y2BamGydF4y2Ba)或强烈(GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BaS.GydF4y2Ba) 表达GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba构造。nd:没有发现;***表明了显着的差异GydF4y2Bap5csGydF4y2Ba(GydF4y2BaP.GydF4y2Ba < 0.001, by student’s T-test).B.GydF4y2Ba在中文中描述的基因型自施剂后,SILIQUES中异常种子的百分比GydF4y2Ba一种GydF4y2Ba.GydF4y2BaCGydF4y2Ba的百分比GydF4y2Bap5cs2-1GydF4y2Ba野生型雌蕊与上述植物花粉交叉授粉获得的携带等位基因的突变苗(以抗磺胺嘧啶为标记)GydF4y2Ba一种GydF4y2Ba.酒吧GydF4y2Ba一种GydF4y2Ba那GydF4y2BaB.GydF4y2Ba和GydF4y2BaCGydF4y2Ba代表至少三个独立实验的平均值±SE。nd:未检测到。数据GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BaS.GydF4y2Ba代表来自两个独立转基因线的混合数据GydF4y2Ba
接下来,我们确定了单体中的中产胚胎的百分比GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba植物。在GydF4y2Bap5csGydF4y2Ba由于花粉谷物的不孕症,术术植物,胚胎致死的纯合体不能形成GydF4y2Bap5cs2-1GydF4y2Ba等位基因,因此是单身缺乏流入胚胎。在有效互补花粉生育率的情况下,有50%的花粉谷物GydF4y2Bap5cs2GydF4y2Ba-GydF4y2Ba1GydF4y2Ba突变会产生25%纯合GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体,这是胚胎致命的,因为GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba在胚胎中不得授予p5cs表达。GydF4y2Ba
当。。。的时候GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba植物自交后,由于胚胎发育失败而流产的种子数量从0%增加到0%GydF4y2Bap5csGydF4y2Ba倍半植物在5±1%GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BamGydF4y2Ba6±1%GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BaS.GydF4y2Ba行(无花果。GydF4y2Ba5.GydF4y2Bab)。在用野生型雌蕊,花粉从杂交GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BamGydF4y2Ba和GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BaS.GydF4y2Ba植物传播GydF4y2Bap5cs2-1GydF4y2Ba突变等位基因到下一代的频率约为15%GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba线路远低于50%,预期的完全互补缺陷GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变花粉(图。GydF4y2Ba5.GydF4y2Bac).自交后流产胚胎的观察和传代GydF4y2Bap5cs2-1GydF4y2Ba异交花粉突变等位基因表明GydF4y2BaP5CS2.GydF4y2Ba在绒毡层表达能恢复生育能力GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变花粉,虽然只有一个相当低的程度。GydF4y2Ba
花粉特异性表达GydF4y2BaP5CS2.GydF4y2Ba完全救出异常GydF4y2Bap5cs1 / p5cs2GydF4y2Ba花粉GydF4y2Ba
组织化学的GUS分析整个花序和组织学横截面的分析证实了GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba几乎完全活跃于胃孢菌素,从拟南芥阶段开发花粉,拟南芥的阶段开发(图。GydF4y2Ba4.GydF4y2Ba,附加文件GydF4y2Ba3.GydF4y2Ba:图S3E,f)。连贯,我们生成了一个GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba构建目标GydF4y2BaP5CS2.GydF4y2Ba对发育中的花粉特异表达,并将其引入GydF4y2Bap5csGydF4y2Ba术语仿植物,以验证功能性P5CS2的花粉特异性表达是否可以拯救形态和功能性缺陷GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体的花粉。一个有效的互补预期的结果将是在花药异常花粉数量的减少,而在长角果增加流产胚胎的数目 - 完全互补高达25%。GydF4y2Ba
我们选择了53种卡那霉素抗性转化体,其中16个携带GydF4y2Bap5cs2-1GydF4y2Ba等位基因,与观察到的非互补的传播率相似GydF4y2Bap5csGydF4y2Ba癫痫仿真。在原发性转化体的花药中,我们观察到5-20%的异常花粉晶粒,表明副本依赖性互补GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba构造。从具有单拷贝插入的转化体GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba构建后,选择4个独立的纯合子系进行进一步分析。GydF4y2Ba
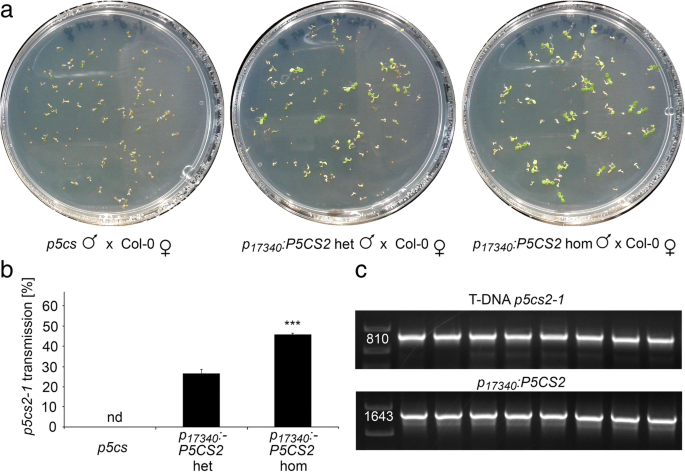
在这些批次的植物中,异常花粉的比例为43±1%GydF4y2Bap5csGydF4y2Ba而在杂合子和纯合子中则分别降低到20±1%和0.15±0.10%GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba转基因植株(图GydF4y2Ba6.GydF4y2Baa, c, d, e和f,附加文件GydF4y2Ba4.GydF4y2Ba:表S1)。自授粉后GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba结果表明,在弯子叶期有胚的角果中,杂合子的败育率为12±1%,纯合子的败育率为24±2%GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba植物(图GydF4y2Ba6.GydF4y2Bab, g, h, i和j)。24±2%的缺陷胚胎在纯合子中出现GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba植物表明GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba恢复了生育能力GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变花粉但无法恢复胚胎的胚胎发育GydF4y2Bap5cs1GydF4y2Ba/GydF4y2Bap5cs2GydF4y2Ba双突变体胚胎。与野生型雌蕊异交证实为杂合子GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba突变体植株产生26±2%的可育花粉GydF4y2Bap5cs2-1GydF4y2Ba等位基因(总共182个抗钙含量为182株),当花粉供体为纯合时增加至46±1%GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba建造(94株中43株耐磺胺嘧啶植物;无花果。GydF4y2Ba7.GydF4y2Ba,附加文件GydF4y2Ba4.GydF4y2Ba:表S1)。GydF4y2Ba
花粉和种子缺陷的形态学分析GydF4y2Bap5csGydF4y2Ba癫痫杂质补充GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba表达式。GydF4y2Ba一种GydF4y2Ba异常花粉粒的百分比和GydF4y2BaB.GydF4y2Ba野生型植物角果中异常种子的百分比(Col-0);GydF4y2Bap5csGydF4y2BaSesquimutants(GydF4y2Bap5csGydF4y2Ba)和杂合或纯合互补系(GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Bahet / hom)。柱状图代表16-22个样本的平均±SEGydF4y2Ba一种GydF4y2Ba每种基因型9个单身GydF4y2BaB.GydF4y2Ba由两个独立互补株系混合而成。nd:没有发现;在GydF4y2Ba一种GydF4y2Ba***表明了显着的差异GydF4y2Bap5csGydF4y2Ba,而在GydF4y2BaB.GydF4y2Ba***表示之间的显着差异GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Bahet,GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Bahom (p < 0.001,经学生t检验)。另外两条互补线也产生了类似的结果。GydF4y2Ba氟GydF4y2Ba野生型花粉颗粒的明亮视野显微照片GydF4y2BaCGydF4y2Ba和GydF4y2Bap5csGydF4y2BaSesquimutantsGydF4y2BaE-F.GydF4y2Ba或者没有GydF4y2BaD.GydF4y2Ba这GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CSGydF4y2Ba建立在纯合子GydF4y2BaFGydF4y2Ba或杂合状态GydF4y2BaE.GydF4y2Ba.图中还显示了放大倍率较高的插图GydF4y2Bap5csGydF4y2Ba倍半和杂合互补系。箭头表示小而枯萎的花粉粒。GydF4y2BaG-J.GydF4y2Ba来自野生型的打开的,早产的Sysiques的立体镜像GydF4y2BaGGydF4y2Ba和GydF4y2Bap5csGydF4y2BaSesquimutantsGydF4y2BaI-J.GydF4y2Ba或者没有GydF4y2BaHGydF4y2Ba这GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CSGydF4y2Ba构造。具有致死率的异常种子GydF4y2Bap5cs2-1GydF4y2Ba纯合胚胎用箭头表示GydF4y2Ba
的表达GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba恢复生育力GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉。GydF4y2Ba一种GydF4y2Ba由野生型雌蕊产生的种子受精花粉从一个GydF4y2Bap5csGydF4y2BaSesquimutant(最左边的面板),或aGydF4y2Bap5csGydF4y2Ba倍半杂合子(中间面板)或纯合子(最右边面板)GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba构建物在含磺胺嘧啶的培养皿上发芽,以记录其传播GydF4y2Bap5cs2-1GydF4y2Ba等位基因。GydF4y2BaB.GydF4y2Ba如上所述,在交叉授粉后野生型雌蕊后代抗钙噻嗪抗幼苗的百分比GydF4y2Ba一种GydF4y2Ba条形图代表了至少三次独立实验的平均值±SE,实验对象为两个独立的转基因株系。nd:没有发现;***表示差异显著GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Bahet(GydF4y2BaP.GydF4y2Ba学生t检验< 0.001)。另外两条线产生了非常相似的结果。GydF4y2BaCGydF4y2Ba磺胺嘧啶耐药后代的PCR分析。利用PCR方法对抗性植株进行分析GydF4y2BaT-DNAGydF4y2Ba生成GydF4y2Bap5cs2-1GydF4y2Ba突变(上图)和GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba构造(下半部分)。PCR产物的大小与预期碱基对数量相符(见附件)GydF4y2Ba
花粉生育率的回收率与碱孢子中的脯氨酸浓度与花粉颗粒相关联GydF4y2Ba
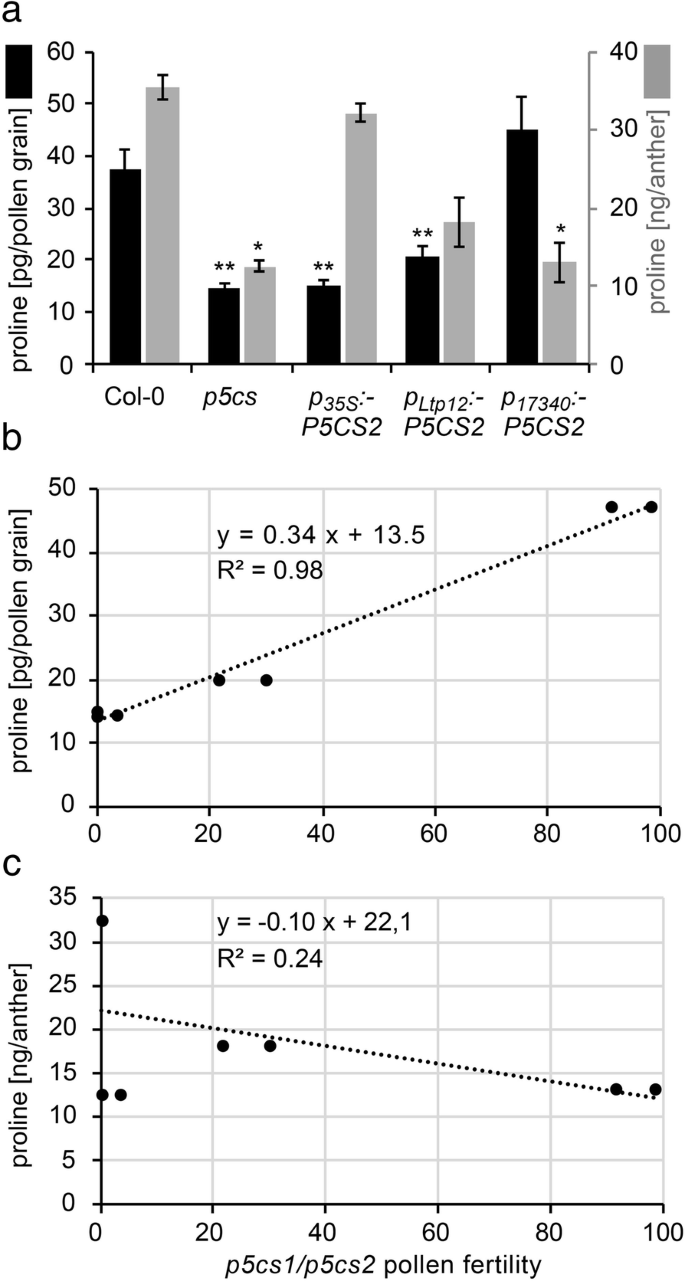
以验证是否有组织特异性表达GydF4y2BaP5CS2.GydF4y2Ba的确导致脯氨酸水平的改变,我们测量阶段9-10花药脯氨酸含量和成熟的野生型的花粉粒,GydF4y2Bap5csGydF4y2Ba癫痫仿生和GydF4y2Bap5csGydF4y2Ba转基因的倍半突变体GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba那GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba或GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba构造(图。GydF4y2Ba8.GydF4y2Ba一个,附加文件GydF4y2Ba4.GydF4y2Ba:表S1)。野生型花药中游离脯氨酸含量为36±2 ng/粒,野生型花粉中游离脯氨酸含量为39±2 pg/粒。的条件下GydF4y2Bap5cs2GydF4y2Ba钙质植物,脯氨酸含量约为野生型花药中含量的三分之一(12±2ng /花药)。平均通常开发和畸形的花粉,脯氨酸含量GydF4y2Bap5cs2GydF4y2Ba倍半花粉14±1 pg/粒。这两个GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba或GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba对花药中脯氨酸含量有显著的促进作用,但仅对花药中脯氨酸含量有显著的促进作用GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba在花粉中诱导更高的脯氨酸含量。反过来,GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba对9/10期花药中脯氨酸含量无影响,但使成熟花粉中脯氨酸含量恢复到野生型花粉水平。与生育能力相比GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变花粉在不同的系,估计从胚胎致死的外观GydF4y2Bap5cs2-1GydF4y2Ba自我自行或从传输速度之后的纯合子种子GydF4y2Bap5cs2-1GydF4y2Ba等位基因与野生型雌蕊的脯氨酸含量呈较强的正相关(RGydF4y2Ba2GydF4y2Ba= 0.98,GydF4y2BaP.GydF4y2Ba < 0.001; Fig.8.GydF4y2Bab),而花药中脯氨酸含量与花粉育性无关(图。GydF4y2Ba8.GydF4y2BaC)。GydF4y2Ba
花粉育性与花粉粒中脯氨酸含量有关。GydF4y2Ba一种GydF4y2Ba花粉颗粒(黑条,左轴)和第9/10阶段的脯氨酸含量(黑条,左轴),来自野生型(Col-0)的阶段9/10波纹(灰杆,右轴),GydF4y2Bap5csGydF4y2BaSesquimutants(GydF4y2Bap5csGydF4y2Ba) 和GydF4y2Bap5csGydF4y2Ba患者携带GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:p5cs2,pGydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2BamGydF4y2Ba或者GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2Ba构造。在每次分析中,平均收集了1000个花粉粒或200个9-10期的花药。条形代表两个(花药)或三个(花粉)独立样本的平均±SE。*和**表示与相应的Col-0野生型样本有显著差异(GydF4y2BaP.GydF4y2Ba< 0.05或GydF4y2BaP.GydF4y2Ba< 0.01)。GydF4y2Bab, cGydF4y2Ba生育力GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变花粉估计在附加文件GydF4y2Ba4.GydF4y2Ba:不同互补线中的表S1与花粉颗粒中脯氨酸的量相关GydF4y2BaB.GydF4y2Ba或9 ~ 10期花药中脯氨酸的含量GydF4y2BaCGydF4y2Ba.很强的相关性(虚线回归线)被发现在花粉粒和花粉育脯氨酸积累(R之间GydF4y2Ba2GydF4y2Ba= 0.98,GydF4y2BaP.GydF4y2Ba < 0.001), while no significant correlation (dotted regression line) was found between proline accumulation in anthers of stage 9–10 and pollen fertility
讨论GydF4y2Ba
与不同植物种类的花粉颗粒中发现的高脯氨酸浓度一致[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba那GydF4y2Ba37GydF4y2Ba]脯氨酸生物合成已被证明是在拟南芥中的花粉发育和生育能力所必需的[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba],但在花粉发育过程中是否需要合成脯氨酸,或者在花粉囊外的孢子体细胞中也可以合成脯氨酸并运输到花粉粒中,尚不清楚。GydF4y2Ba
P5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba在发育中的小孢子中强烈表达,而在花粉囊外的孢子体细胞中不表达GydF4y2Ba
在花粉粒中积累的脯氨酸的配子体来源的第一指示从脯氨酸生物合成基因的启动子活性的分析得到GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba在拟南芥花。虽然具有组织特异性,与发育相关的表达GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba已经报道了[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba38GydF4y2Ba,这些基因在花药发育过程中的表达仍缺乏详细的组织学分析。为了填补这一空白,我们分析了表达的拟南芥株系的花药GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba或GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba.这两种结构都在雄性配子体组织中诱导了GUS的强烈表达,但在周围的孢子体组织中却没有显著的表达,这部分与Szekely等(2008)的数据形成了对比GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba: P5CS2:绿色荧光蛋白GydF4y2Ba在孢子体花药组织中构建,但仅零星地在花粉或前体细胞中。从配子体细胞系输出P5CS2 mRNA或蛋白质到周围的花药组织是可能的,但在花粉发育的后期阶段极不可能。在小孢子和花粉中观察到较强的GUS染色GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba植物表示强烈的活动GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba启动子,这与公开可用的转录组数据一致[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba那GydF4y2Ba35GydF4y2Ba].GUS mRNA或蛋白质可能与拟南芥P5CS1和P5CS2蛋白质的稳定性不同,因此可能不完全反映在雄性系中的P5CS1和P5CS2表达的定时。拟南芥初学孢子或花粉的蛋白质组分析到目前为止未检测到衍生自P5CS1或P5CS2的肽[GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba那GydF4y2Ba41GydF4y2Ba].然而,在最近对烟草花粉发育的研究中,在成熟的花粉和花粉管中检测到P5CS衍生的肽,但不在早期的发育阶段进行[GydF4y2Ba42GydF4y2Ba].烟草雄性配子体的发展的代谢组分析发现,脯氨酸积累从花粉丝分裂开始并在干燥的花粉中达到峰,而在花粉管生长期间脯氨酸浓度迅速下降[GydF4y2Ba43GydF4y2Ba].在同一研究中,Rotsch等人。(2017)报道了类似于苯磺酸的相似的积累模式,一种不同的氨基酸与脯氨酸不同的氨基酸GydF4y2Ba2GydF4y2Ba- 在环形结构中群组。GydF4y2Ba
此外,生物信息识别推定GydF4y2BaCIS.GydF4y2Ba-上游区域的调控元件GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba,通过PlantPan 2.0和Place分析发现,与花粉发育和育性相关的转录因子的假定结合位点富集。特别是GydF4y2BaP5CS2.GydF4y2Ba含有WRKY2和WRKY34的结合基序,WRKY2和WRKY34是参与花粉发育和功能的最具特征的转录因子[GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba].这些程序确定了与Tapetum开发或功能相关的转录因子的推定结合位点,表明我们的本地化数据GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba结构是正确的。GydF4y2Ba
仅有的GydF4y2BaP5CS2.GydF4y2Ba微微孢子和花粉粒中的过度表达完全恢复了异常GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变花粉粒GydF4y2Ba
为了证实在配子体细胞脯氨酸合成的重要性,我们产生GydF4y2Bap5csGydF4y2Ba患有额外副本的卓越植物GydF4y2BaP5CS2.GydF4y2Ba在花药的配子体或孢子体细胞中表达任一具体。其理由是,以评估其结构,到什么程度,能救的功能GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉。我们表示GydF4y2BaP5CS2.GydF4y2Ba在小孢子和花粉粒中具有花粉特异启动子的GydF4y2BaAT5G17340GydF4y2Ba导致了发育缺陷和生育缺陷的充分互补GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉。我们得出结论,在微微孢子和开发的配子体内的P5Cs活性足以提供花粉发育和生育的脯氨酸所需的脯氨酸。GydF4y2Ba
反过来,GydF4y2Bap5csGydF4y2Ba表达额外的副本GydF4y2BaP5CS2.GydF4y2Ba在tapetum(GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2)GydF4y2Ba或花粉囊外孢子体细胞(GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2)GydF4y2Ba只显示非常有限或没有互补GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉形态和育性。的表达GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba和GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba显著提高了花药中脯氨酸含量,但对花药花粉中脯氨酸含量影响不大或没有影响GydF4y2Bap5csGydF4y2Ba癫痫仿真。观察了GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba构造补充了花粉异常GydF4y2Bap5csGydF4y2Ba比GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba尽管在后者的花药中发现更高水平的脯氨酸,可以通过不同的表达模式来解释GydF4y2Ba.GydF4y2Ba这GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba构建体诱导GydF4y2BaP5CS2.GydF4y2BaTapetum中的表达直接围绕着杂草细胞谱系的细胞。显然,脯氨酸转运到幼儿孢子的短距离更有效,并且可能通过微孔发育早期阶段或通过从绦虫细胞的脯氨酸泄漏到细胞外空间中的Plasmodesmata,可能是在Tapetum变性期间的肺泡泄漏。发展花粉的能力通过高处培养细胞外脯氨酸GydF4y2BaPROT1.GydF4y2Ba表达已经证明,虽然没有花粉缺陷GydF4y2BaprotGydF4y2Ba突变体表明它在野生型条件下具有较小的重要性[GydF4y2Ba27GydF4y2Ba].而脯氨酸则是通过活性GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba在花药血管似乎并不为开发花粉访问。GydF4y2Ba
的失败GydF4y2BaP5CS2.GydF4y2Ba表达在绒毡层或花药的脉管系统中,能完全恢复发育和育性GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉有力地表明,这GydF4y2BaP5CSGydF4y2Ba在雄性生殖系中表达不仅是充分的,而且是花粉育性的必要条件。花粉中脯氨酸含量与育性密切相关,而花药中脯氨酸含量与育性关系不明显GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉。尚待确定的是,哪些前体被用于脯氨酸的生物合成,以及它们如何被传递给发育中的花粉以确保充分的生育能力。GydF4y2Ba
花粉中脯氨酸积累的可能作用GydF4y2Ba
几个函数提出了高脯氨酸积累的花粉:它可能有助于保持花粉活力尽管干燥在运输遥远的花蕊,这可能有助于花粉来补充抵达雌蕊和它可能提供一种能源或源建筑材料在花粉管生长的GydF4y2Ba1GydF4y2Ba那GydF4y2Ba44GydF4y2Ba].此外,已经提出了脯氨酸和结构相似的哌果酸的信号传导功能,然而到目前为止,这两种代谢物之间没有功能或代谢联系的报道[GydF4y2Ba45GydF4y2Ba那GydF4y2Ba46GydF4y2Ba那GydF4y2Ba47GydF4y2Ba].Furthemore,脯氨酸可作为分散花粉的昆虫,往往只提供花粉的一小部分给其他的花朵和使用的主要部分为能源和蛋白质丰富的食物来源的奖励。GydF4y2Ba
我们的数据表明,高水平的脯氨酸对可育花粉的发育是必需的。畸形和不育GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变花粉GydF4y2Bap5csGydF4y2Basesquimutants被证明缺乏DNA和储存化合物,这表明在发育过程中启动了一个受控的细胞死亡程序[GydF4y2Ba3.GydF4y2Ba].尚待确定的是,细胞程序性死亡是由缺乏脯氨酸引起的,还是与脯氨酸合成邻体相比,缺乏脯氨酸的小孢子发育迟缓引起的。在玉米根中,脯氨酸水平调节细胞周期进程和类似的机制可能在配子体有丝分裂产生三核花粉的过程中存在[GydF4y2Ba48GydF4y2Ba].GydF4y2BaP5CS2.GydF4y2Ba绒毡层中的表达对发育的影响大于对育性的影响GydF4y2Bap5cs1 / p5cs2GydF4y2Ba双突变体花粉表明细胞死亡诱导阈值可能低于支持充分育性所需的脯氨酸水平。GydF4y2Ba
结论GydF4y2Ba
在这项研究中,我们证明了大多数,如果不是全部,脯氨酸对花粉发育和生育能力的影响,可以通过当地的合成内部开发孢子占和成熟花粉粒和脯氨酸运输从不同的孢子体组织的贡献,如果有的话,是非常有限的。在花粉生产过剩脯氨酸可能增加花粉育性,因此作物不利条件下的产量,而脯氨酸合成的抑制花粉会启用混合生产条件雄性不育:我们的发现开辟有趣的可能性为育种方法。GydF4y2Ba
方法GydF4y2Ba
植物生长条件GydF4y2Ba
野生型和突变体GydF4y2Ba拟南芥GydF4y2Ba(l)Heynh。,生态型哥伦比亚 - 0(COL-0),在24/21°C的生长室中生长,光强度为300μEGydF4y2Ba−2GydF4y2Ba年代GydF4y2Ba−1GydF4y2Ba每天16小时和8小时黑暗。一个拟南芥系纯合GydF4y2Bap5cs1GydF4y2Ba和杂合GydF4y2Bap5cs2GydF4y2Ba(称为是GydF4y2Bap5csGydF4y2Basesquimutant),已被表征和之前的描述[GydF4y2Ba2GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba].在盐处理中,从开花开始到试验结束,每周用0.1 M NaCl溶液浇灌植株2次。分析GydF4y2Bap5cs2-1GydF4y2Bamutant allele transmission via pollen during cross-pollination or during selfing, surface sterilized seeds were stratified for three days at 4 °C, and germinated on ½xMS plates supplemented with 12 μg/ml sulfadiazine and 2% (W.GydF4y2Ba/GydF4y2BaV.GydF4y2Ba)蔗糖。的存在GydF4y2Bap5cs2-1GydF4y2Ba通过使用特异性引物对随机样品的PCR分析进一步证实突变等位基因GydF4y2BaP5CS2.GydF4y2Ba:T-DNA连接或磺胺嘧啶抗性基因(附加文件GydF4y2Ba5.GydF4y2Ba:表S2)。GydF4y2Ba
转基因植物的产生GydF4y2Ba
分子克隆技术按照标准协议进行,引物列于附加文件GydF4y2Ba5.GydF4y2BaS2:表。在这项工作中使用的酶从赛默费雪科学公司或新英格兰生物实验室购买。RNA和DNA的提取如前所述[GydF4y2Ba3.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba].的构造GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba那GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba通过更换来源GydF4y2BaCamv35s.GydF4y2BapBI121 (Clontech, Paolo Alto, California)启动子的起始密码子上游2932 bpGydF4y2BaAtP5CS1GydF4y2Ba,上游2097 bpGydF4y2BaAtP5CS2GydF4y2Ba或上游2632 bpGydF4y2BaAT5G17340GydF4y2Ba,直接连接或吉布森组装GydF4y2Ba.GydF4y2Ba生成GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba: P5CS2GydF4y2Ba和GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba: P5CS2GydF4y2BaGUS基因的编码序列被cDNA所取代GydF4y2BaAtP5CS2GydF4y2Ba.为GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba构造,前六个密码子GydF4y2BaLTP12.GydF4y2Ba(GydF4y2BaAT3G51590.GydF4y2Ba)和上游1092 bp的序列插入到pENTR-D-TOPO中,通过LR重组转移到pHGWFS7中[GydF4y2Ba49GydF4y2Ba].为GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba构建,cDNAGydF4y2BaAtP5CS2GydF4y2Ba并插入到pENTR-d-TOPO和GydF4y2BaLTP12.GydF4y2Ba启动子区域通过Gibson组装插入到起始密码子生成的一个独特的NcoI位点。由此产生的GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba: P5CS2GydF4y2Ba融合构建物通过LR重组转移到pEG301 [GydF4y2Ba50GydF4y2Ba].包括原生pBI121在内的所有结构体均被引入野生型拟南芥或拟南芥中GydF4y2Bap5csGydF4y2Ba花卉垂度的奇异GydF4y2Ba根癌土壤杆菌GydF4y2Ba应变GV3101 [GydF4y2Ba51GydF4y2Ba].用卡那霉素、潮霉素或BASTA筛选T1转化子、T2单插入株系和T3纯合子株系。每个株系中都有所需转基因基因,通过PCR进行确认。每个GUS基因或育性分析都使用来自至少两个独立株系的纯合植株。GydF4y2Ba
评估花粉发育与生育率GydF4y2Ba
为了评估发育畸变,花粉晶粒在玻璃载玻片上敲击,在光学显微镜下拍摄,并拍摄了总花粉颗粒上的异常花粉粒的百分比。通过比较自我期间的预期遗传率,或用野生型雌蕊的突变花粉的十字架进行评分,观察到GydF4y2Bap5cs2-1GydF4y2Ba突变的等位基因。为了分析胚胎发育,在立体显微镜下解剖角部(Zeiss Stevi SV 6, Carl Zeiss Microimaging GmbH, Jena, Germany)。使用Jenoptik ProgResW C3数码相机(Jenoptik, Jena, Germany)获取数字图像。所有的分析都至少重复了四次。应用χ 2检验分析了预期分离率和实际分离率的差异GydF4y2Ba2GydF4y2Ba测试。GydF4y2Ba
脯氨酸的分析GydF4y2Ba
根据Bates测量幼苗或整个花序中的脯氨酸含量[GydF4y2Ba52GydF4y2Ba],使用L-脯氨酸作为标准。每次测量至少重复三次,代表来自超过一百14天幼苗的平均值或从五个植物汇集的花序。通过将HPLC色谱图与L-脯氨酸标准进行比较来测量花药或花粉晶粒中的脯氨酸含量。为了从花粉颗粒中提取脯氨酸,从玻璃载玻片上的花收集约10,000种花粉晶粒。用Axio Imager拍摄的代表性数量的微观扇区.A2光学显微镜(Zeiss,德国),配备DC500数码相机(徕卡,德国),并用ImageJ分析估算花粉编号[GydF4y2Ba53GydF4y2Ba].从玻璃载玻片中收集花粉晶体,以合适的3%(GydF4y2BaW.GydF4y2Ba/GydF4y2BaV.GydF4y2Ba) 5-磺基水杨酸(~ 50 μl),然后真空浓缩,调节花粉浓度至1000 μlGydF4y2Ba−1GydF4y2Ba.为了从花药中提取脯氨酸,在解剖显微镜下采集9 ~ 10期约200株花药,用50 μl 3% (w/v) 5-磺基水杨酸提取。花药发育阶段的确定由Cecchetti et al. (2015) [GydF4y2Ba54GydF4y2Ba].提取液14000 g离心20 min,真空还原上清至7 μl。根据Francioso等人(2017)的说法,提取物中的氨基酸与DABS (4-N, n -二甲氨基偶氮苯-4 ' -磺酰氯,Sigma-Aldrich, USA)衍生。[GydF4y2Ba55GydF4y2Ba].用于色谱分析的梯度级溶剂购自意大利米兰的卡洛尔巴试剂。氨基酸标准品和所有其他试剂均从Sigma-Aldrich (St. Louis, MO, USA)获得。GydF4y2Ba
组织化学的GUS染色和成像GydF4y2Ba
为了分析GUS活性,用5-溴-4-氯-3-吲哚基-β-D-葡糖醛酸(X-Gluc)溶液的真空渗透样品,其补充有1mM铁氰化物作为氧化催化剂,然后在37°C孵育过夜[GydF4y2Ba56GydF4y2Ba].然后在室温下在甲醇/乙酸(3:1,V:V)中在甲醇/乙酸(3:1,V:V)中的恒定搅拌下固定并清除绿色组织,然后在70%乙醇中进行几次洗涤。用于组织学分析的植物样品脱水,嵌入了Technocit 7100树脂(HeräeusKulzer,Wehrheim,Germany)中,切成了8μm的部分,其中HM 350 SV自动切片机(Microm,Walldorf,德国)。使用Axio Imager.a2光学显微镜(德国),配备了组织学图像,配备了DC500数码相机(徕卡,德国)。GydF4y2Ba
缩写GydF4y2Ba
- CaMV35S:GydF4y2Ba
-
花椰菜马赛克病毒35s成绩单GydF4y2Ba
- CATMA:GydF4y2Ba
-
完全拟南芥转录组微阵列GydF4y2Ba
- GUS:GydF4y2Ba
-
β葡萄糖醛酸酶GydF4y2Ba
- LHTGydF4y2Ba:GydF4y2Ba
-
赖氨酸组氨酸转运蛋白GydF4y2Ba
- LTP12.GydF4y2Ba:GydF4y2Ba
-
脂质转移蛋白12GydF4y2Ba
- P5C:GydF4y2Ba
-
δ.GydF4y2Ba1GydF4y2Ba-pyrroline-5-carboxylateGydF4y2Ba
- p5cr:GydF4y2Ba
-
P5C还原酶GydF4y2Ba
- P5CS:GydF4y2Ba
-
P5C合成酶GydF4y2Ba
- protGydF4y2Ba:GydF4y2Ba
-
脯氨酸转运蛋白GydF4y2Ba
- X-Gluc:GydF4y2Ba
-
5-溴-4-氯-3-吲哚基-β-D-葡糖醛酸。GydF4y2Ba
参考GydF4y2Ba
- 1.GydF4y2Ba
Biancucci男,Mattioli的R,福兰尼G,Funck d,科斯坦蒂诺P,在被子植物有性生殖脯氨酸和GABA的已找到M.作用。前植物科学。2015; 6:680。GydF4y2Ba
- 2.GydF4y2Ba
陈志强,陈志强,陈志强,等。拟南芥生殖发育对脯氨酸合成的影响。BMC Plant Biol. 2012;12:191。GydF4y2Ba
- 3.GydF4y2Ba
拟南芥中的男性配子体发育需要Mattioli R,Biancucci M,Lonoce C,Costantino P,Trovato M.脯氨酸。BMC植物BIOL。2012; 12:236。GydF4y2Ba
- 4.GydF4y2Ba
丹德卡尔AM蒋洪辉脯氨酸积累的调节GydF4y2Ba拟南芥GydF4y2Ba(L) Heynh在发育过程中和对干燥的反应。植物学报。1995;18(11):1280-90。GydF4y2Ba
- 5.GydF4y2Ba
Khoo U, Stinson HT。细胞质雄性不育花药与正常可育花药游离氨基酸差异。美国国家科学技术学会1957;43(7):603-7。GydF4y2Ba
- 6.GydF4y2Ba
krogaard h,安德森为。在开发Invivo期间尼古利亚纳 - alata花药的游离氨基酸。physiol植物。1983; 57(4):527-31。GydF4y2Ba
- 7。GydF4y2Ba
Lansac AR, Sullivan CY, Johnson BE。高粱中游离脯氨酸的积累(GydF4y2Ba高粱双色GydF4y2Ba)花粉。[J] .计算机科学与技术。1996;74(1):40-5 .]GydF4y2Ba
- 8。GydF4y2Ba
Mattioli R,Falasca G,Sabatini S,Altamura MM,Costantino P,Trovato M.脯氨酸生物合成基因GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba在拟南芥花的转变中有重叠作用,但在胚的发育中没有重叠作用。杂志。2009;137(1):72 - 85。GydF4y2Ba
- 9。GydF4y2Ba
陈志强,王志强,王志强,等。拟南芥细胞内脯氨酸水平对开花时间和花序结构的影响。植物学报。2008;66(3):277-88。GydF4y2Ba
- 10.GydF4y2Ba
研究表明,LeProT1是番茄花粉中脯氨酸、甜菜碱和-氨基丁酸的转运载体。植物细胞。1999;11(3):377 - 92。GydF4y2Ba
- 11.GydF4y2Ba
mestichelli lj,gupta rn,spenser身份证。从鸟氨酸到脯氨酸的生物合成途径。J Biol Chem。1979年; 254(3):640-7。GydF4y2Ba
- 12.GydF4y2Ba
Roosens NH,星期四TT,艾斯坎达HM,鸟氨酸 - 德尔塔转氨酶cDNA的雅各布M.分离和在其表达盐胁迫的效果GydF4y2Ba拟南芥GydF4y2Ba.植物理性。1998; 117(1):263-71。GydF4y2Ba
- 13.GydF4y2Ba
Funck D,Stadelhofer B,Koch W. Ornithine-δ-氨基转移酶对于精氨酸分解代谢而不是脯氨酸生物合成至关重要。BMC植物BIOL。2008; 8:40。GydF4y2Ba
- 14.GydF4y2Ba
两个Strizhov N,亚伯拉罕E,ÖkrészL,布利克林S,Zilberstein A,谢尔Ĵ,康奇C,Szabados L.差异表达GydF4y2BaP5CSGydF4y2Ba盐胁迫过程中,控制脯氨酸积累的基因需要ABA,并受到ABA1、ABI1和AXR2的调控。植物j . 1997; 12(3): 557 - 69。GydF4y2Ba
- 15.GydF4y2Ba
Székely G, Ábrahám E, Cséplő A, Rigó G, Zsigmond L, Csiszár J, Ayaydin F, Strizhov N, Jásik J, Schmelzer E, et al.;复制GydF4y2BaP5CSGydF4y2Ba拟南芥基因对脯氨酸生物合成的应力调节和发育控制起不同的作用。工厂J. 2008; 53(1):11-28。GydF4y2Ba
- 16.GydF4y2Ba
鲍曼杰。拟南芥:形态和发育图谱。纽约:施普林格;1994.GydF4y2Ba
- 17.GydF4y2Ba
Sager R, Lee J-Y。胞间连丝在整合细胞信号中的作用:来自发育和环境信号及应激的见解。[J] .机器人。2014;65(22):6337-58 .]GydF4y2Ba
- 18。GydF4y2Ba
Mariani C, De Beuckeleer M, Truettner J, Leemans J, Goldberg RB。用嵌合核糖核酸酶基因诱导植物雄性不育。大自然。1990;347:737。GydF4y2Ba
- 19。GydF4y2Ba
杨氏Sl,XIEA LF,Mao Hz,Puah CS,杨WC,江LX,Sundaresan v,Ye D. Tapetum Matterninant1是拟南芥的特制于拟南芥。植物细胞。2003; 15(12):2792-804。GydF4y2Ba
- 20.GydF4y2Ba
Cecchetti V,Celemin D,Napoli N,Ghelli R,Brunetti P,Costantino P,Cardarelli M.中间层中的植物素最大控制拟南芥的雄蕊开发和花粉成熟。新植物。2017; 213(3):1194-207。GydF4y2Ba
- 21.GydF4y2Ba
Al Mamun E, Cantrill LC, Overall RL, Sutton BG。水稻减数分裂和减数分裂后早期花药的细胞组织。细胞生物学杂志。2005;29(11):903-13。GydF4y2Ba
- 22.GydF4y2Ba
Winter D, Vinegar B, Nahal H, Ammar R, Wilson GV, Provart NJ。一个“电子荧光象形文字”浏览器,用于探索和分析大规模的生物数据集。《公共科学图书馆•综合》。2007;2 (8):e718。GydF4y2Ba
- 23.GydF4y2Ba
Hruz T, Laule O, Szabo G, Wessendorp F, Bleuler S, Oertle L, Widmayer P, Gruissem W, Zimmermann P. generesearcher v3:用于转录组元分析的参考表达数据库。难以Bioinforma。2008;2008:420747。GydF4y2Ba
- 24.GydF4y2Ba
allmeersch J, Durinck S, Vanderhaeghen R, Alard P, Maes R, Seeuws K, Bogaert T, Coddens K, Deschouwer K, Van Hummelen P, et al。对CATMA微阵列进行基准测试。拟南芥转录组分析的新工具。植物杂志。2005;137(2):588 - 601。GydF4y2Ba
- 25.GydF4y2Ba
J-L。水分亏缺对紫花苜蓿韧皮部液中脯氨酸和其他氨基酸含量的影响。植物杂志。1996;111(1):109 - 13所示。GydF4y2Ba
- 26.GydF4y2Ba
MäkeläP,Peltonen-Sainio P,Jokinen K,Pehu E,SetäläH,Hinkkanen R,Somersalo S.摄影和植物植物植物涂层糖粉的易位。植物SCI。1996年; 121(2):221-30。GydF4y2Ba
- 27.GydF4y2Ba
Lehmann S, Gumy C, Blatter E, Boeffel S, Fricke W, Rentsch D。GydF4y2Ba在Planta.GydF4y2BaATPROT家族的兼容溶质运输器的功能。J Exp Bot。2011; 62(2):787-96。GydF4y2Ba
- 28.GydF4y2Ba
Foster J,Lee Yh,Tegeder M. LHT氨基酸转运蛋白家族成员的明显表达在花中表明植物繁殖中的特异性作用。性植物团体。2008; 21(2):143-52。GydF4y2Ba
- 29.GydF4y2Ba
拟南芥中的芸苔类固醇抑制了αbraháme,rigóg,székelyg,nagy r,koncz c,szabados l。脯氨酸生物合成的脯氨酸生物合成的轻依赖性诱导。植物mol biol。2003; 51(3):363-72。GydF4y2Ba
- 30.GydF4y2Ba
关义,孟X,khanna r,lamontagne e,liu y,张某,据称parken开发和拟南芥的功能需要摇头的粘性转录因子。Plos Genet。2014; 10(5):E1004384。GydF4y2Ba
- 31.GydF4y2Ba
雷R,李X,MA Z,LV Y,Hu Y,Yu D.拟南芥Wrky2和Wrky34转录因子与VQ20蛋白相互作用,调节花粉发育和功能。工厂J. 2017; 91(6):962-76。GydF4y2Ba
- 32.GydF4y2Ba
王志强,王志强,王志强,等。CaMV 35S启动子在转基因植物花粉释放中的作用。acta botanica sinica(云南植物研究)1997;48(307):265-75。GydF4y2Ba
- 33.GydF4y2Ba
白志强,张志强,张志强,等。转基因植物花药特异性基因启动子活性的比较研究GydF4y2Ba拟南芥GydF4y2Ba.植物学报2002;21(1):90-6。GydF4y2Ba
- 34.GydF4y2Ba
Costa-Nunes Ja。一种新的拟南芥标志物,强烈标记无核微微孢子和随后的阳性配子体发育阶段。springerplus。2013; 2(1):237。GydF4y2Ba
- 35.GydF4y2Ba
HONYS D,TWELL D.拟南芥单倍体男性配子瘤发育的转录组分析。基因组Biol。2004; 5(11):R85。GydF4y2Ba
- 36.GydF4y2Ba
Hesse M,Pacini E,Willemse M. Tapetum:细胞学,功能,生物化学和进化。维也纳:斯普林克;2012年。GydF4y2Ba
- 37.GydF4y2Ba
张海霞,张海霞。花粉中脯氨酸代谢的研究进展。足底。1983;159(1):46-9。GydF4y2Ba
- 38.GydF4y2Ba
Yoshiba Y,Nanjo T,Miura S,Yamaguchi-Shinozaki K,Shinozaki K.应力响应和发育监管GydF4y2BaDelta(1) - 吡咯啉-5-羧酸合成酶1GydF4y2Ba(GydF4y2BaP5CS1.GydF4y2Ba)基因表达GydF4y2Ba拟南芥GydF4y2Ba.中国生物医学工程学报。1999;26(3):369 - 372。GydF4y2Ba
- 39.GydF4y2Ba
邹军,宋丽,张伟,王勇,阮胜,吴文辉。拟南芥成熟花粉和萌发花粉的比较蛋白质组学分析。acta botanica yunnanica(云南植物研究). 2009;51(5):438-55。GydF4y2Ba
- 40。GydF4y2Ba
赫尔姆斯-戴维斯R,田中CK,Vensel WH,Hurkman WJ,拟南芥成熟花粉的味好S.蛋白质组映射。蛋白质组学。2005; 5(18):4864-84。GydF4y2Ba
- 41。GydF4y2Ba
Noir S,Brautigam A,Colby T,Schmidt J,Panstruga R.拟南芥成熟花粉蛋白组的参考图。Biochem Biophys Res Communce。2005; 337(4):1257-66。GydF4y2Ba
- 42.GydF4y2Ba
黄志刚,李志刚,李志刚,等。二倍体小孢子母细胞花粉发育早期和晚期的细胞特异性蛋白分析。细胞蛋白质组学。2014;13(1):295-310。GydF4y2Ba
- 43.GydF4y2Ba
Rotsch啊,Kopka J,Feussner I,Ischebeck T.中央代谢产物和甾醇分析将烟草雄性配子发育和花粉管生长分为八个代谢阶段。工厂J. 2017; 92(1):129-46。GydF4y2Ba
- 44.GydF4y2Ba
Lehmann S,Funck D,Szabados L,Rentsch D.脯氨酸代谢和植物发育中的运输。氨基酸。2010; 39(4):949-62。GydF4y2Ba
- 45.GydF4y2Ba
Bernsdorff F,DöringA-C,Gruner K,Schuck S,BräutigamA,Zeier J.哌啶酸通过水杨酸依赖性和依赖性途径策划植物系统获得的抗性和防御引发。植物细胞。2016; 28(1):102-29。GydF4y2Ba
- 46.GydF4y2Ba
赫尔曼H,Funck d,Rentsch d,Frommer WB。拟南芥糖信令朝向外源脯氨酸应用突变体的超敏反应。植物理性。2000; 123(2):779-89。GydF4y2Ba
- 47.GydF4y2Ba
NávarováH,Bernsdorff楼DÖRINGAC,Zeier J.哌啶酸,防御扩增和引发的内源性调节剂,是可诱导的植物免疫的关键调节剂。植物细胞。2012; 24(12):5123-41。GydF4y2Ba
- 48.GydF4y2Ba
王克,张俊,王g,风扇x,太阳x,qin h,xu n,zhong m,qiao z,唐y等。脯氨酸响应1在调节一般蛋白质合成和玉米中的细胞周期中起着关键作用。植物细胞。2014; 26(6):2582-600。GydF4y2Ba
- 49.GydF4y2Ba
Karimi M,Inze D,Depicker A. Gateway Vectors forGydF4y2Ba农杆菌GydF4y2Ba介导植物转换。植物科学进展,2002;7(5):193-5。GydF4y2Ba
- 50.GydF4y2Ba
Earley Kw,Haag Jr,Pontes O,Opper K,Juehne T,Song K,Pikaard CS。植物功能基因组和蛋白质组学的网关兼容载体。工厂J. 2006; 45(4):616-29。GydF4y2Ba
- 51.GydF4y2Ba
花的倾斜:一种简化的方法GydF4y2Ba农杆菌GydF4y2Ba介导的变换GydF4y2Ba拟南芥GydF4y2Ba.工厂J. 1998; 16(6):735-43。GydF4y2Ba
- 52.GydF4y2Ba
贝茨LS,Waldren RP,特亚律ID。快速测定游离脯氨酸的水应力的研究。植物土壤。1973; 39(1):205。GydF4y2Ba
- 53.GydF4y2Ba
Schneider CA, Rasband WS, Eliceiri KW. NIH图像到ImageJ: 25年的图像分析。Nat方法。2012;9(7):671 - 5。GydF4y2Ba
- 54.GydF4y2Ba
Cecchetti V, Brunetti P, Napoli N, Fattorini L, Altamura MM, Costantino P, Cardarelli M. ABCB1和ABCB19生长素转运体对拟南芥花药早期和晚期发育具有协同作用。植物学报。2015;57(12):1089-98。GydF4y2Ba
- 55.GydF4y2Ba
HPLC法测定生物样品中生物活性硫化合物、氨基酸和生物胺的含量。Adv Exp Med Biol. 2017; 975:535-49。GydF4y2Ba
- 56.GydF4y2Ba
Jefferson RA, Kavanagh TA, Bevan MW。GUS融合:β -葡糖醛酸酶在高等植物中的敏感和通用的基因融合标记。EMBO j . 1987; 6(13): 3901 - 7。GydF4y2Ba
- 57.GydF4y2Ba
Plegt L, Bino RJ。ß-glucuronidase活性在从转基因和非转基因植物的雄配子体发育过程中。摩尔Gen Genet 1989; 216:321-7。GydF4y2Ba
- 58.GydF4y2Ba
胡春英,Chee PP, Chesney RH, Zhou JH, Miller PD, O' ' w . .植物学报1990;9:1-15。GydF4y2Ba
- 59.GydF4y2Ba
Nishihara M, Ito M, Tanaka I, Kyo M, Ono K, Irifune K, Morikawa H. ß-glucuronidase基因在百合花粉中的表达(GydF4y2Ba百合longiflorumGydF4y2Ba),烟草(GydF4y2Ba烟草GydF4y2Ba)、烟草和牡丹(GydF4y2BaPaeonia Lactiflora.GydF4y2Ba)通过粒子轰炸。植物理性。1993; 102:357-61。GydF4y2Ba
致谢GydF4y2Ba
我们感谢瓦伦蒂娜·切凯蒂医生提供的有用的技术建议。我们感谢罗斯·米勒、西尔维娅·库恩和康斯坦茨大学的园丁团队在基因分型和植物护理方面的帮助。GydF4y2Ba
资金GydF4y2Ba
这项工作得到了Sapienza Università和MT、意大利教育、大学和研究部(Progetti di Ricerca di Interesse nationale)和康斯坦茨大学(University of Konstanz)和DF的研究经费的部分支持。GydF4y2Ba
数据和材料的可用性GydF4y2Ba
本研究中生成的所有突变体和结构均可根据相应作者的合理要求获得。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
贡献GydF4y2Ba
通过MT,DF和RM构思,设计和进行实验。通过Mb和Ae进行一些分子和遗传实验。通过LM设计并进行生化分析。本文由Mt,DF和PC编写。所有作者都已经阅读并赞成最终的手稿。GydF4y2Ba
相应的作者GydF4y2Ba
道德声明GydF4y2Ba
伦理批准和同意参与GydF4y2Ba
拟南芥野生型(COL-0)和T-DNA插入线的种子是从诺丁汉拟南芥股票中心(NASC)获得,并在Sapienza大学的M. Trovato的实验室中培养和遗传修饰。Konstanz符合机构,国家或国际指导和立法。GydF4y2Ba
同意出版GydF4y2Ba
不适用。GydF4y2Ba
利益争夺GydF4y2Ba
Paolo Costantino教授是BMC植物生物学的一位编辑委员会成员,但没有参与这份手稿的编辑评估。其他提交人声明他们没有竞争利益。GydF4y2Ba
出版商的注意GydF4y2Ba
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。GydF4y2Ba
附加文件GydF4y2Ba
额外的文件1:GydF4y2Ba
图S1。GydF4y2Ba花药中Gus活性的组织化学定位GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯和pGydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba转基因拟南芥植物。花序的GydF4y2BaP.GydF4y2BaP5CS1.GydF4y2Ba:格斯GydF4y2Ba(A-C)GydF4y2Ba和GydF4y2BaP.GydF4y2BaP5CS2.GydF4y2Ba:格斯GydF4y2Ba(D-F)GydF4y2Ba将转基因植株用X-Gluc溶液浸润,染色过夜,固定并清除,进行显微分析。每个面板显示12/13阶段来自独立转基因株系的完整花药。GUS酶活性仅在花粉粒中检测到。比例尺A、B、D、E为50 μm, C、f为25 μm。(PDF 2779kb)GydF4y2Ba
额外的文件2:GydF4y2Ba
图S2。GydF4y2Ba预料到的GydF4y2BaCIS.GydF4y2Ba的启动子中的调控元素GydF4y2BaP5CS1.GydF4y2Ba和GydF4y2BaP5CS2.GydF4y2Ba.概述来自PlantPAN2的转录因子的主要推定结合位点的示意图(GydF4y2Bahttp://plantpan2.itps.ncku.edu.twGydF4y2Ba)和地方(GydF4y2Bahttp://www.dna.affrc.go.jp/place/GydF4y2Ba)在硅分析GydF4y2BaP5CS1.GydF4y2Ba(GydF4y2BaAT2G39800.GydF4y2Ba) 和GydF4y2BaP5CS2.GydF4y2Ba(GydF4y2BaAt3g55610GydF4y2Ba)启动子。启动子分析在2932 BP和2097年的起始密码子上游进行GydF4y2BaP5CS1.GydF4y2Ba或GydF4y2BaP5CS2.GydF4y2Ba, 分别。推定GydF4y2BaCIS.GydF4y2Ba-花粉发育和育性相关转录因子结合基序对应的调控元件(SBP、bHLH、WRKY;GO的“与花粉发育相关”[GO:0009555]、“花粉管生长”[GO:0009860]、“花药发育”[GO:00048643]和“双受精形成合子和胚乳”[GO:0009567])显著富集并以红色标记。(PDF 1149 kb)GydF4y2Ba
额外的文件3:GydF4y2Ba
图S3。GydF4y2Ba花药中Gus活性的组织化学定位GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba那GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba和GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba转基因拟南芥植物。花序的GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba(A,B)GydF4y2Ba那GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2Ba(C, D)GydF4y2Ba和GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba(E, F)GydF4y2Ba将转基因植株用X-Gluc溶液浸润,染色过夜,固定并清除,进行显微分析。在12/13阶段,每个面板显示一个完整的花药GydF4y2Ba(A,B,E,F)GydF4y2Ba或阶段9/10GydF4y2Ba(C, D)GydF4y2Ba来自独立的转基因线。在长丝和血管组织中检测到GUS活性GydF4y2BaP.GydF4y2Ba35个年代GydF4y2Ba:格斯GydF4y2Ba花药,但不在花粉粒。这GydF4y2BaP.GydF4y2BaLTP12.GydF4y2Ba:格斯GydF4y2BaGUS基因在绒毡层中特异性表达,而GUS基因在绒毡层中特异性表达GydF4y2BaP.GydF4y2Ba17340GydF4y2Ba:格斯GydF4y2Ba在花粉颗粒中几乎完全检测到转基因花药。秤条是50微米。(PDF 2798 KB)GydF4y2Ba
额外的文件4:GydF4y2Ba
表S1。GydF4y2Ba花粉形态和育性数据综述。(PDF 22 kb)GydF4y2Ba
额外的文件5:GydF4y2Ba
表S2。GydF4y2Ba本研究中使用的引物(PDF 35 KB)GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
马蒂奥利,R.,比安库奇,M., El Shall, A。GydF4y2Ba等等。GydF4y2Ba花粉发育和生育需要发育梭菌的脯氨酸合成。GydF4y2BaBMC植物杂志GydF4y2Ba18,GydF4y2Ba356(2018)。https://doi.org/10.1186/s12870-018-1571-3GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-018-1571-3GydF4y2Ba
关键词GydF4y2Ba
- 脯氨酸生物合成GydF4y2Ba
- 花粉的开发GydF4y2Ba
- 组织特异性GydF4y2Ba
- 花儿GydF4y2Ba
- 拟南芥GydF4y2Ba