摘要
背景
无性种子形成(apomixis)在许多植物科中都有观察到,但在农作物中很少见。无融合生殖作物的产生将给农业带来革命性的变化,因为无性繁殖种子生产提供了一种低成本和高效的杂交种子生产方式。h菊科(Asteraceae)是研究配子体无融合生殖(gametophytic apomixis,即种子无性繁殖)分子组成的模式系统。
结果
在本研究中,无融合生殖产生了一个参考转录组h经历无减数分裂、孤雌生殖和自主胚乳发育的关键无融合事件。此外,从授粉前和授粉后阶段的转录组序列失败的丧失(垂耳)表现出孤雌生殖和自主胚乳发育缺失的突变体加入。转录组由147,632个contigs组成,其中50%的contigs注释有同源基因及其可能的功能。转录组用于鉴定无融合生殖和授粉依赖期间差异表达的转录本(左边)种子发展。差异表达转录本的基因本体论富集分析表明,无融合生殖和授粉依赖的种子发育之间的一个重要差异是表观遗传基因调控相关基因的表达。标记关键发育阶段(如无孢子胚囊发育和种子发育)的基因也通过在这些发育阶段的增强表达而被识别出来。
结论
一个全面的花参考转录组的生产h为无融合生殖的分子基础研究和无融合生殖基因的鉴定提供了宝贵的资源垂下的轨迹。
背景
apomixis是一种一种性植物繁殖,可绕过减数分裂和施肥,从而导致母克隆的活种子[1].在属于40个家庭的大约400个植物物种中观察到,然而这些植物中很少是作物物种[2].将Apomixis特征引入商业杂交种子将允许固定混合活力[2].由于无融合生殖在农业上的应用,将其转化或工程应用于农作物是许多无融合生殖研究的最终目标。因此,许多模式植物被开发来研究无融合生殖[3.,4,5,6,7,8,9,10.].
配子体无融合生殖只是一系列无融合生殖发育途径中的一种。其特征是由无孢子母细胞(aposporous initials, AI)或大孢子母细胞(MMC) (diplospory)形成未退化胚囊,并由未退化卵细胞通过孤雌生殖形成胚胎。在某些情况下,中央细胞自主增殖产生胚乳,但通常需要一个精子细胞受精(假配子)[1].大多数履历是伪心的,除了几种自主阿普奇(潜力),主要是在Asteraceae [11.].属hL.(Asteraceae)含有潜力病的性和空调物种(子属皮西拉菌)和双孢子的(亚属h)[12.].最近,子宫皮西拉菌和亚属h被视为单独的属,具有属于属的牙孢子物种皮西拉菌和种二倍体属h[13.].在本研究中,我们仍将撇子群称为h亚因子皮西拉菌.
h亚因子皮西拉菌已经发展成为一个模型系统来研究配子体无融合生殖的分子成分[14.].各种研究利用这个模型来进一步了解这一组的细胞学和分子事件。例如,Koltunow等人描述了该群体有性和无融合生殖成员中与配子发生、胚胎发生和种子成熟事件相关的花的发育阶段[9].有性和无融合生殖种种子发育过程中的关键调控过程是相似的h亚因子皮西拉菌;差异发生在时间上和空间[15.].另外,基因组区域赋予丛白和单性发生H. Caespitosum,也在亚属皮西拉菌,是通过缺失图谱研究确定的[16.].这些被称为独立位点肢体缺失(贷款) 和损失的孤雌生殖(垂下的),分别。贷款参与aposporous声母的形成及其后续的发展做出aposporous胚囊。因此,在该位点雇用减数分裂缺失区域植物生产减少胚囊。这些突变体,不过,保留卵细胞和中央细胞来进行自发增殖分别产生的胚和胚乳的能力。垂下的负责孤雌生殖。这个区域的缺失与保留产生aposporous胚囊,但需要施肥,以使胚和胚乳开发能力突变有关。这些突变体携带隐性等位基因(垂耳).在这两个位点上也发现了功能缺失的突变体,这些突变体利用性途径产生种子[16.].
该模型系统为研究无融合生殖提供了独特的机会。例如,缺乏几乎相同的无融合生殖和有性系阻碍了转录活性无融合生殖相关基因的发现Paspalum simplex.[17.].的h模型系统克服了这一挑战,因为它包括了自然的无融合体以及完全或部分失去无性繁殖能力的突变体。缺乏基因组和转录组的参考材料h是高通量基因表达分析的另一个挑战。我们的目的是产生一个参考花转录组h这将为无融合生殖、有性生殖和突变体基因表达的比较分析提供一个有用的工具h.
我们对无融合生殖进行了比较转录组学研究h(R35)及其传粉依赖(垂耳)突变体。这使我们可以在野生型中的阳性生物体中比较基因表达,以在突变型植入诱导的胚胎发育期间发生。该参考转录组将有助于推进我们关于亚非统计学的监管网络和途径的知识。它还可以帮助努力映射所发现的基因垂下的地区的h.
结果
测定R35的头状突起分期,lop138以及正在发育的A36
为了了解自主种子发育相关基因的表达情况,首先利用胚胎筛选来确定要取样的头状突起阶段。野生型无融合生殖品系R35在第6期已经有成熟的胚囊,在第7期已经开始了胚胎发生。的lop138突变体在第6阶段包含成熟的胚囊,但不能进行胚胎发生,除非交叉授粉。授粉传粉系A36虽然无孢子,但产生成熟胚囊的时间比R35更长,启动胚胎发育也更晚。这些观察允许鉴定头状突起阶段取样,以产生转录组数据。研究R35和R35在孤雌生殖和受精诱导的胚胎发育、胚胎发生前和胚胎发生后的转录变化lop138被选中了。A36还选择“胚胎发生后”阶段(表1).
从取样的生殖组织中分离RNA
为了获得足够的RNA用于分析,需要人工解剖不同阶段头状细胞的生殖组织,然后汇集。由于分离和池化步骤都会导致组织中的RNA降解,因此在组织收集过程中,我们尝试了各种溶液来寻找合适的组织存储和分离介质。从这些试验中发现,RNAase游离水可以作为解剖培养基。从表中所列各阶段进行重复采样1.收集多个胚珠和卵巢(50-93),分离出1.4-4.5 μg总RNA(附加文件1:表S1)。
De Novo组装
Illumina的Hiseq 2000对制备的cDNA文库的测序总计791,095,876份良好的读数。Trinity组件总共产生了179,195名属于85,000个组分(基因座)的转录物。对于每个文库,将75-81%的读数被映射回参考转录组,因此转录组代表所有文库和读取的副取样被认为是有效的。
转录组的N50和平均转录长度在500 bp左右。BUSCO评估显示转录组是不完整的,有一些冗余。进一步对转录组进行处理,去除嵌合和冗余转录本,得到一个包含147,632个转录本的组合,属于74424个位点。这将重复BUSCOs的数量减少了10%。该参考转录组已保存在Shotgun Assembly项目DDBJ/EMBL/GenBank中,登录号为GEEH00000000。
转录组注释
为了注释这些转录本中可能编码的蛋白质,对两个e值截断为1e-4的蛋白质数据库进行BLASTX搜索。第一个数据库包含了所有的NCBI-NR植物蛋白序列,BLASTX对其进行了比对,得到了35373个相似点h成绩单(47.5%)。第二个数据库是Swiss-Prot,它是手工整理的,通常通过实验或文献证据来支持。BLASTX对该数据库进行了比对,发现了25377份(34%)转录本的相似性。在巩固结果后,总共鉴定出35436个转录本(48%)与这些数据库中的蛋白质相似。
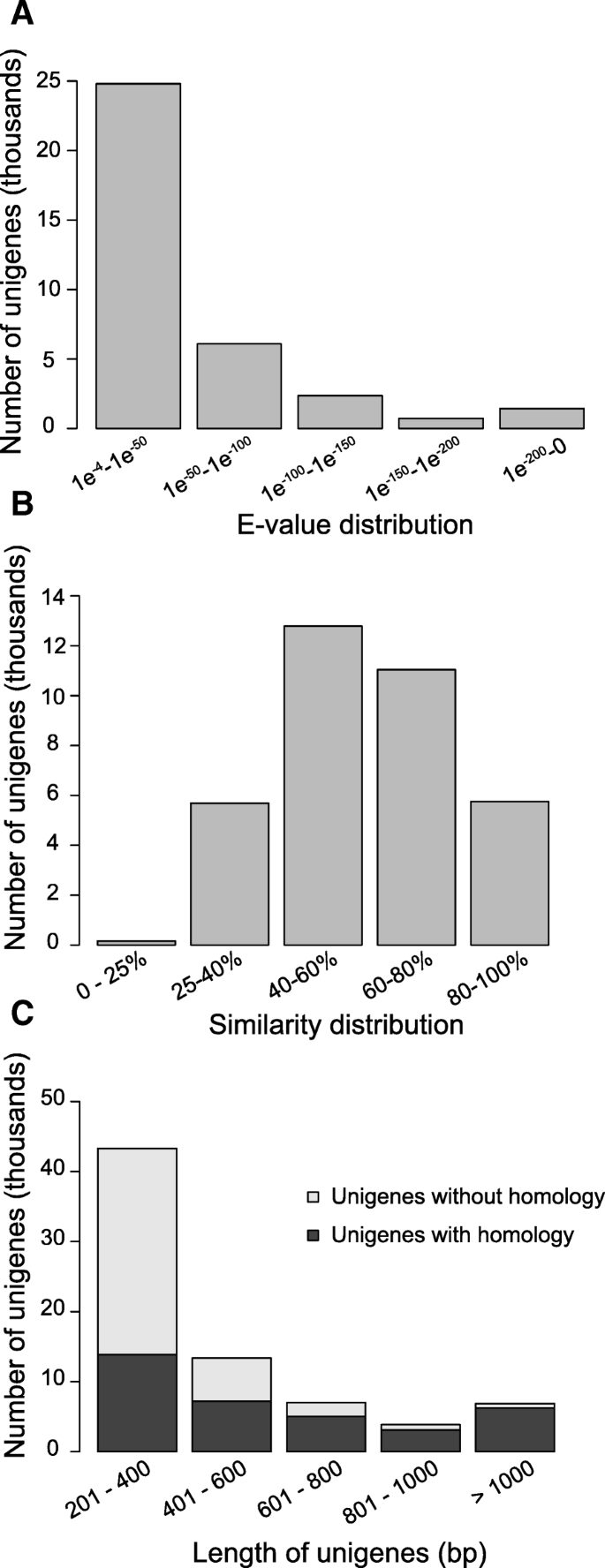
这些BLASTX命中的e值分布如图所示。1并显示30%的人具有非常高的相似性,e值低于1e-50。数字1 b显示了BLASTX结果的百分比相似性分布,表明87%的匹配具有超过25%的一致性。52%的基因在数据库中没有匹配。正如预期的那样,相似基因的百分比随着基因长度的增加而增加。1 c).例如,32%的长度从201到400bp的基因具有数据库命中,而90%的超过1000bp的令人震惊(图。1 c).因此,超过一半的转录本缺乏相似性的原因可能是由于它们的长度较短,没有蛋白质编码序列。然而,包括在这组转录本编码新蛋白和聚腺苷化非编码rna。
通过计数与每个库的每个转录本对齐的读取来估计整个库的转录本丰度。使用TPM和UPC归一化方法对原始读计数进行归一化和缩放。
差异表达(DE)转录本的鉴定
Capitulah携带异步成熟的多个小花。结果,预计连续的Capitulum阶段的样品将表示重叠的发育阶段。为了确定在阶段之间表达的转录物中的重叠程度,在每个连续的样本之间应用Spearman的相关性。所有样本的表达轮廓与现有发展阶段的表达方式呈正相关,其中大多数具有高于0.7的相关系数(附加文件1:表S2)。根据观察结果,我们决定可以将连续头状突起阶段的标本进行组合,进行对比分析。通过四个主要的比较来确定与无融合生殖发育和受精诱导的种子发育相关的表达变化(表1)2).额外的文件1表S3记录了这些分析中确定的DE转录本的数量。使用DESeq进行的比较分析的结果显示在附加文件中2,3.,4,5.
使用De抄本进行四次比较以发现丰富的GO术语(表2).比较1和2的目的是通过比较成熟胚囊样本和自发胚胎发生的样本,确定与自主种子发育相关的基因和过程(附加文件)2和3.).对自主种子发育启动相应的转录本进行GO富集分析(比较1),结果富集了86个GO项(附加文件)1:图S2)。其中,细胞生长调控、分生组织生长调控、气孔复杂形态发生调控和器官形态发生调控等富集项多与生长和器官形态发生有关。对R35中成熟胚胎和胚乳相应转录本的氧化石墨烯富集分析(比较2),得到299个富集的氧化石墨烯术语,总结在(附加文件)1:图S3)。除细胞和器官生长相关术语外,该套装含有胚胎和胚胎发育的术语;如子叶血管组织模式形成,侧向根部发育,花序形态发生,种子涂层,种子涂层的粘液挤出,种子萌发和种子休眠维持。
比较3旨在发现授粉诱导的种子发育在孤雌生殖无能的遗传中丰富的功能(lop138).这导致384个丰富的GO术语(附加文件4)属于广泛的GO术语类别(附加文件1:图S4)。大多数富集本集中的术语也富集了R35(附加档案)1:图S2和S3)。然而,在“生殖”这一类别中,与有性生殖有关的GO词汇被丰富了lop138只有,这表明在没有垂下的轨迹aposporous胚囊在功能上等同于性胚囊。具体的“有性繁殖”词条;双受精的调节形成合子和胚乳中,在氮饥饿偶联的诱导调控,预减数分裂DNA复制和大孢子发生。另外,GO术语“基因表达的表观遗传调控”被富集lop138但R35不是。
比较4旨在发现孤雌生殖能力和孤雌生殖能力差异的相关功能(lop138).共有16,530个序列,在至少一个成对比较中(lop138对比无融合生殖材料),以鉴定富集的氧化石墨烯(表2).这导致了518个GO条款的丰富(附加文件5),属于在(附加文件1:图S5)。经过浓缩的GO类别与R35 DE集中的GO类别相似(由比较2,附加文件产生)3.) 和lop138(由比较3,附加文件产生4).
GO分析使用具有GO注释的参考数据集中的所有转录本执行(附加文件)6).GO分析的一个局限性是只有48%的转录组被注释。因此,有大量的DE转录本没有GO注释(其中一些有BLAST命中,但没有相关的GO注释),不能包含在GO分析中。这些成绩单列在附加文件中7(额外的文件1:表S4)提供了在不同类别中没有GO条款的DE成绩单数的摘要。
综上所述,四次比较得到的DE集合共享丰富的GO项。不同DE组之间的主要差异是与基因表达的表观遗传调控和有性生殖相关的术语丰富lop138但R35不是。该观察结果表明,在授粉诱导的种子发育过程中,大量参与表观遗传调节和其他性生殖过程的转录物lop138但不在R35,经历自主种子发展。
差异表达转录本的整体表达模式
表观遗传调节
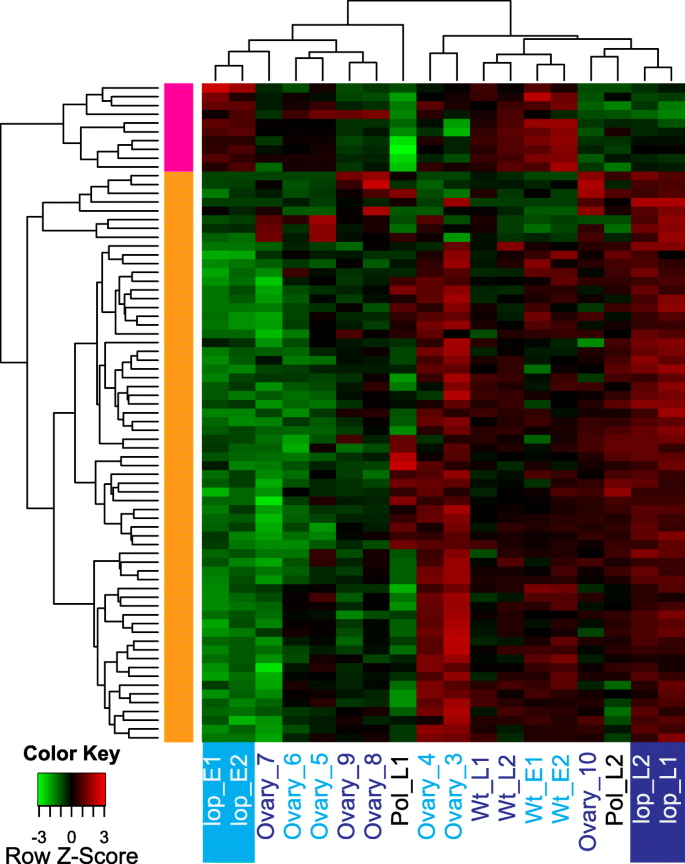
分层聚类用于探讨用基因表达的表观遗传调节注释的DE转录物的全局表达变化(图。2;额外的文件8).聚类分析表明,在胚胎发育过程中,大多数转录本上调lop138(图。2)与DNA甲基化和染色质沉默功能相关(附加文件8).许多与表观遗传调控相关的转录本在lop138,与R35(Ovary_3,Ovary_4)的早期阶段大配子高表达示出,并继续显示在胚珠在阶段5(Wt_E)和阶段7(Wt_L)表达的一定水平(图2).这表明在R35的自主种子发育期间,表达了借助于DNA甲基化和染色质沉默的基因,但响应于胚胎和胚乳的发育并未表现出表达的显着变化。这可以涉及在R35的显影种子中缺乏父基因组,这可能需要在中央细胞和早期胚乳中重组外观蛋白酶态。在玉米,米饭等性植物中拟南芥,基因组DNA的去甲基化发生在中央细胞受精之前[18.,19.,20.,21.].去甲基化允许转座子(TEs)的转录和小干扰RNA (siRNA)的产生,这些小干扰RNA可以作为移动元件在受精后的胚胎中识别和沉默te。作为删除垂下的基因座恢复在牙胚囊中的性行为lop138,全局去甲基化可能发生在未加盖的胚珠中lop138.在授粉后,在胚胎中的TESlop138可能会表现出看起来导致许多引用的表观遗传调控的调控。
相对较少的与表观遗传调控相关的转录本在授粉前样品中上调lop138.在R35中,这些转录本在胚胎前(Wt_E)和胚胎后(Wt_L)样本中都有高表达(组1,图1)。2).其中许多转录物,属于图1中的第1组。2,编码argonaute 4 (AGO4)推定同源基因。Argonaute (AGO)蛋白是小rna诱导沉默通路的核心组成部分;它们可以作用于转录后基因沉默(post-transcriptional gene silencing, PTGS)和转录基因沉默(transcriptional gene silencing, TGS)通路。
异时性
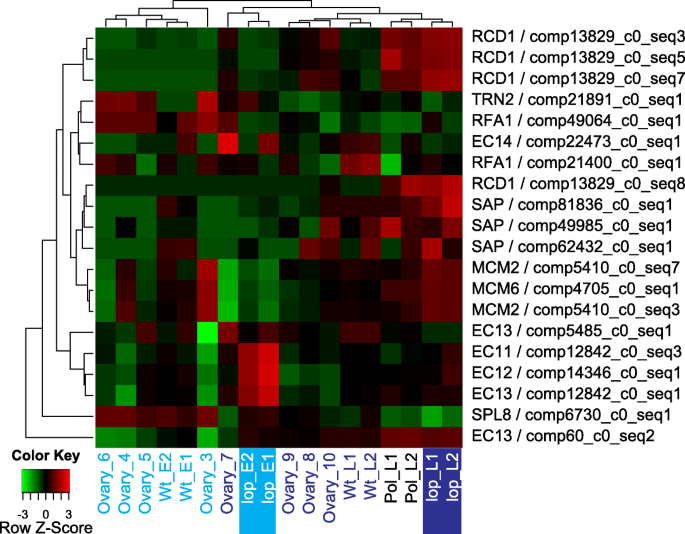
差异表达和GO项富集分析的结果并没有确定孤雌能力野生型R35特有的机制。这表明无融合生殖与lop138种子发育可能是一个时空过程。许多研究认为无融合生殖是有性生殖途径失调的结果;因此,在无融合生殖过程中,有性生殖的基因和调节机制以异源慢性方式被使用[14.,15.,22.,23.,24.].探索异时性h与GO术语类别“再现”的差异表达的转录的全局表达模式进行了研究(图3.).在这一类别中,GO术语“大孢子发生”(megasporogenesis)被丰富了,这是因为预测的转录本编码的蛋白质类似于转录调节因子不育无花瓣(SAP)、鳞状osa启动子结合样蛋白8 (SPL8)和蛋白TORNADO 2 (TRN2)(图。3.).在拟南芥SPL8.,SAP.和TRN2具有对雌性配子生成和其他发育过程的起始至关重要的调节作用[25.].因此,如果推定的立体表观SPL8.,SAP.和TRN2在h就像在拟南芥,这些基因可以预期在涉及雌性配子发生的阶段更活跃,这在野生型中h在第6阶段完成(表3.).
由于DNA复制许可因子的推定直向同源,富集了相关的去术语“预解性DNA复制”MCM2-7(MCM2-7)络合物和复制因子A蛋白1(RFA1)(表3.).所述Mcm2-7中复杂蛋白质发挥作用,以确保复制每个细胞周期出现一次[26].RFA1在所有真核生物中保存,是DNA复制,修复和重组所必需的[27].根据它们在细胞分裂中的作用,表达推定MCM2-7复杂和RFA1可预期在细胞增殖阶段增加。in.lop138,细胞分裂在胚囊成熟后停止,因此可以预期参与细胞分裂的基因的表达,因为细胞分裂在胚胎发生过程中,授粉后阶段增加。在R35中,成熟的胚囊囊通过自发胚胎发生进行;因此,在成熟的胚囊囊和后胚胎发育阶段之间,细胞分裂中所涉及的基因的表达可能没有显着差异。推定的直觉MCM2和MCM6被确定为上调lop138但在R35的胚后样品中不存在。3.;额外的文件1:表S3,S4和S5)。虽然没有在DE R35后胚胎样本相对于前胚胎样本,假定MCM2和MCM6在阶段3中表现出相对高的表达和R35(图4倍的样品。3.).在R35,推定RFA1接受雌配子发育(3-5)和早期胚胎发育(阶段6-7)阶段中表达高。in.lop138,假定的RFA1在胚胎发育过程中表达没有变化(图。3.).
与生殖相关的氧化石墨烯术语“氮饥饿诱导结合的调节”被富集,因为预测转录本编码与细胞分化蛋白RCD1相似的蛋白质,该蛋白通过在酵母中控制分化功能参与有性生殖的开始[28].四个预测编码RCD1的转录本在授粉后的样品中上调lop138A36在胚后标本中也有高表达(图。3.).与R35的胚胎前阶段(3-5)相比,其中三个推定RCD1.在胚胎后阶段(7-10)R35的表达也增加(图7-10)。3.).GO术语“形成受精卵和胚乳的双受精调节”被富集,因为转录本可能编码类似于卵细胞分泌(EC1)蛋白的蛋白质拟南芥.in.拟南芥, 5个功能冗余EC1例如基因(EC1.1,EC1.2,EC1.3,EC1.4和EC1.5)在施肥之前在卵细胞中在卵细胞中表达,并在双重施肥期间调节配子相互作用[29].基于EC1的功能和表达方式拟南芥,假定的EC1有望积极参与lop138,在种子发育过程中使用双重施肥。六个推定EC1lOP138,EC1orologs在R35中未被识别为DE(附加文件)2,3.,4,5).虽然没有在R35,推定EC1垂直表道在胚胎前(WT_E)和胚胎后(WT_L)胚轴样品以及后胚胎后A36样品中显示出一定程度的表达(图。3.).一个假定的向上调节EC1授粉后授粉后的矫正物lop138可能表明一些蛋细胞尚未引发胚胎发生。
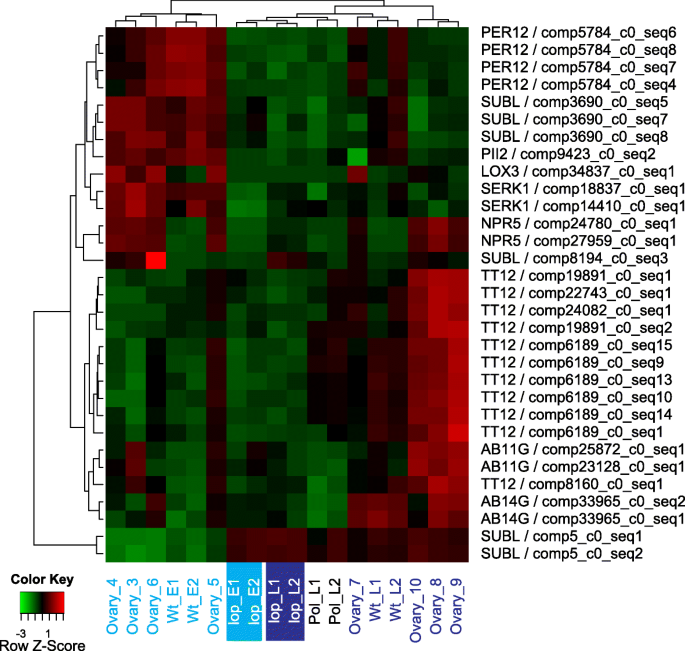
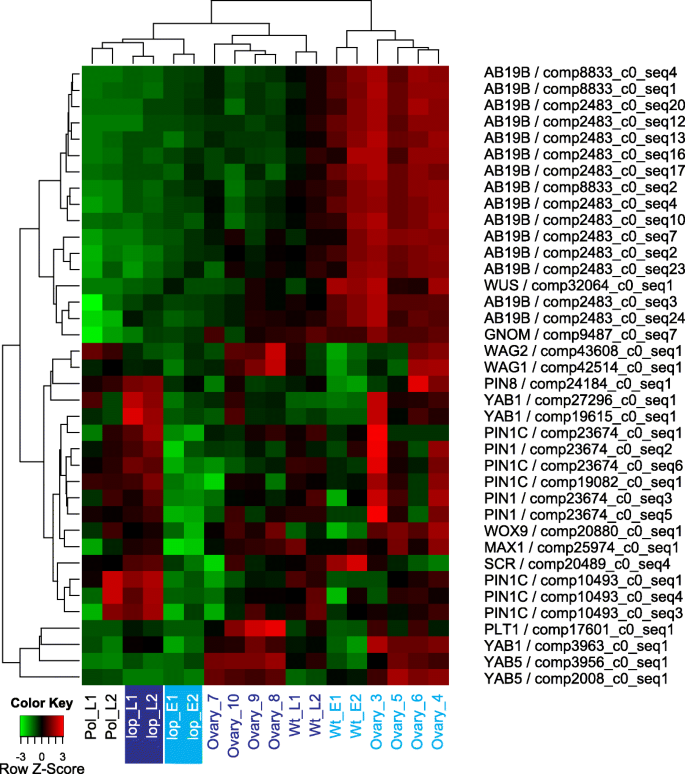
对于相对于R35中的转录物lop138在样本中,“繁殖”类别包括GO术语“子叶维管组织模式形成”、“种子休眠的维持”、“种皮粘液挤出”和“繁殖结构发育”。数字4显示与这些术语相关的转录本的表达模式。与花结构发育相关的转录本大多在R35胚前样品中上调,推测编码ABC transporter B family member 19 (AB19B), PER12 (PER12),梨形孢indica-insensitive protein 2 (PII-2),体细胞胚胎发生受体激酶1 (SERK 1),调节蛋白NPR5 (NPR5)和脂肪加氧酶3 (LOX3)(图。4).许多这些蛋白质通过参与生长素运输(AB19B)在植物发育中发挥作用[30.]、对生物和非生物胁迫的反应(过氧化物酶)[31],介导真菌和宿主的共生关系,促进生长和种子生产(PII-2)[32[促进叶片和花卉营销命运,并通过诸如的阳性调节YAB1和YAB3.(NPR5)[33,34]并参与Loxs在植物生长,耐害虫,衰老或伤害的反应[35,36].最值得注意的是SERK参与信号转导的跨膜蛋白的基因编码,与体细胞胚胎发生和无融合生殖有关,并在许多植物物种中对生物和非生物刺激的响应中发挥作用[37].因此,上调推定SERK1R35胚前样本的转录本可能表明该基因在R35中诱导孤雌生殖中发挥作用。与从种皮中挤出粘液相关的转录本推定为枯草杆菌素样蛋白酶(SUBL)。在R35的胚前样本中,更多与SUBL相似的转录本被上调(图)。4).
ABC转运蛋白G系列构件11(AB11G)和ABC转运蛋白G系列构件14(AB14G)的推定立即与子叶血管组织模式形成有关。这些转录物在R35的后胚胎样品中上调(图。4).与种子休眠维持相关的转录本推定为透明的外种皮12(TT12)并在R35的胚胎后样品中上调(图。4).在R35中,随着种子发育的进行,可能编码AB11G、AB14G和TT12的转录本的表达模式与它们在子叶组织形成和种子成熟中的相关功能相匹配。
胚模式基因与生长素极性运输
在早期胚胎发生期间,Zygote中的不对称分裂建立了胚胎的顶端基底轴线。虽然基底细胞传递生长调节剂激素毒素,但顶端细胞对植物素作出反应,并且这种蟾蜍蛋白的螺旋蛋白梯度触发顶端胚胎结构的规格。诸如销形成1(PIN1)的砧座载体及其极地定位在早期胚胎和根部形成的顶部基底图案形成的规范中起重要作用。疾病载体的极性定位取决于指向囊泡贩运,其受ARF鸟嘌呤 - 核苷酸交换因子GNOM调节的[38].一个h转录GNOM的转录物在R35的预胚胎阶段上调(图。5).在R35的预胚胎阶段中,许多与生长素转运相关的转录物。这些是AB19B,丝氨酸/苏氨酸 - 蛋白激酶WAG1和WAG2,MAX1和PIN蛋白。大多数PIN蛋白也在授粉后的授粉后的样品中调节lop138(图。5).AB19B参与生长素输送并与PIN一起的蛋白质,建立极性生长素浓度梯度30.].WAG1和WAG2也通过增强pin介导的生长素极性运输参与调控生长素信号[39].MAX基因被认为通过影响pin介导的生长素在茎中的运输来抑制腋芽的生长[40].上调参与R35的前胚胎阶段生长素输送转录物表明植物激素生长素和在卵巢其浓度梯度h可能是自主胚胎发育诱导的重要线索。
WUSCHEL(WUS)调节干细胞形成和维护[41),在拟南芥在胚胎发生的16细胞阶段,首先在将形成茎尖分生组织(或SAM)的细胞中表达[42].一种植物特异性同源域转录因子,WUSCHEL-RELATED HOMEOBOX9(WOX9.),通过正向调节的表达促进干细胞命运WUSCHEL(WUS)在资产管理证券内[43].在R35,推定WUS同源物在胚前期表达量高(图。5),这可能表明更早的归纳WUS在无融合生殖卵巢h促进干细胞的识别和维护,导致早熟的体细胞胚胎发生。的假定同系物WOX9.R35在胚前和胚后卵巢中也表达上调,进一步表明干细胞分化可能在无融合胚胎形态观察之前的早期卵巢发育阶段就已经开始。其他胚胎发育模式基因,如稻草人(可控硅)[44]和淡水螯虾基因[45还鉴定了(图。5).
胚乳发育
R35的胚乳可以自主发育,但需要受精lop138.预计对具有相似性的蛋白质的转录物预测,在其他植物(如PCG复合体(FIS1 / MEA,FIS2,FIS3 / FIE,RBR和MSI1)中的其他植物中发挥着关键作用的蛋白质的临界作用,被研究被研究,以发现它们是否差异在R35或lop138.FIS复合物的三个成员(FIE, RBR和MSI1)的表达得到了各自高百分比相似性的支持拟南芥蛋白质序列及预测h肽(70%以上的同一性)。然而,只有三个假设MSI1同源基因在胚胎发育过程中上调lop138。没有表达的证据意味着和FIS2在h但是表达了赶时髦的人和CLF是支持的。表格4预测其编码的名单序列PcG蛋白及其DE状态。
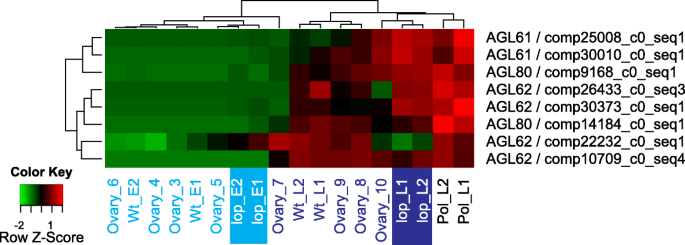
in.拟南芥中央细胞和胚乳的发育需要静止的疯子箱蛋白(AGL61,AGL62和AGL80),并且在中央细胞和植物中均表达[46,47,48].以了解基因的表达与已知的表达域拟南芥,所有DE转录本推定编码AGL61、AGL62或AGL80蛋白(附加文件1:表S5)被映射(图热量。6).大多数转录本在胚后阶段表现出高表达lop138,R35(阶段7-10)和A36,反映了胚乳发育的合胞阶段。
在发育阶段显示增强表达的基因
本研究产生的转录组包括连续的发育阶段,从巨配子发生到胚胎发生和种子成熟过程的子房(Ovary_3 - Ovary_10)。因此,卵巢数据集有两个理想用途;1)研究每个头毛阶段发生的独特过程,这可能有助于识别R35无融合生殖启动和进展的过程,2)识别关键发育阶段的分子标记。
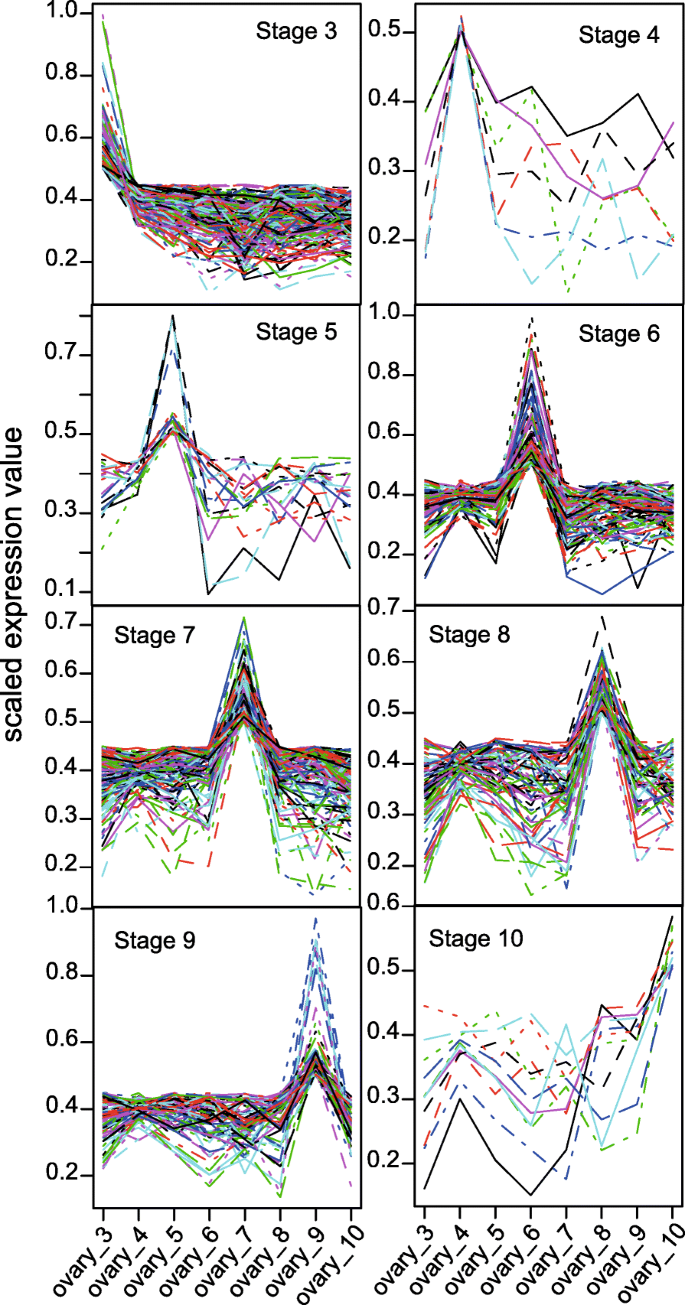
为…识别发育阶段标记物h,每个基因的表达用UPC值表示,UPC值为0(不活跃)至1(活跃)[49].为了简化分析,仅选择每个组分的最长转录物作为该组分(基因)的代表。在时间点绘制UPC值,以选择在Capitulum阶段(0.5是截止值)中显示表达峰的那些(图。7).第3阶段活性增强的基因数量最高,第4、5和10阶段活性增强的基因数量较低。额外的文件9列出支持表达的BLASTX结果和读取计数h表现出阶段性增强活性的基因。
KOBAS 2.0 [50.]用于识别显示阶段增强表达的基因集合中的富集途径和氧化石墨烯项。额外的文件1:表S6为舞台增强表达式数据集提供丰富的途径。R35的卵巢数据组的Capitulum阶段增强基因表达分析显示,Capitulum第3阶段3,其中AIS在兆浮穴四胞胎附近区分,富集于参与生物合成和IAA降解的途径中。IAA是营养班的最常见的天然植物激素,涉及植物生长和发展的各个方面(Frick和Strader,2018)。Capitulum阶段,其中胚胎胚囊发育和成熟(阶段4和5),未呈现许多在这些阶段期间表现出增强表达的基因,也不是它们具有富集的功能。来自第6和7阶段的卵巢,其中预期寄生发生的卵母生具有相对较多的基因,具有增强的表达,然而这些基因集不会导致富集途径术语的富集(附加文件1:表S6)。
木犀草发育阶段标记基因
确定可靠的发育阶段标记物h . praealtum中,使用0.5的UPC值作为截止,以确定在特定的发育阶段的活性基因。发育阶段的标记被确定为:1)在R35正在进行aposporous胚囊发育阶段,即阶段3至6(附加文件10.一个);2) R35和R35的胚胎发育阶段lop138,即R35的7-10期和授粉后阶段lop138(附加文件10.B);3)无融合生殖R35标记;即转录本在R35的任何阶段都有活性,但在R35的一个或两个阶段都没有活性lop138(授粉前和授粉后级)(附加文件10.c)。
这些转录本被鉴定为无孢子胚囊发育阶段的潜在标志物(附加文件)1:表S7)。其中许多预测会编码在脂质转移或脂质代谢中发挥作用的蛋白质,还有三个与转录因子基因相似的转录本,GATA18,IAA32和bhlh61,被确定(附加文件1:表S7)。将转录物鉴定为R35中胚胎发育的阶段的潜在标志物,lop138A36编码的转录因子在种子发育过程中起作用拟南芥如MADS-box转录因子PHERES1, AGL61,核转录因子Y亚基B-6和B-9(附加文件)1:表S8)。额外的文件1:表S9列出无融合生殖R35,的潜在标记即转录活性在R35中的一个或多个发育阶段但在一个未激活或两个阶段的lop138.
讨论
h亚因子皮西拉菌含有阿普奇和性物种,已经开发成用于研究Apomixis的分子和遗传成分的模型系统[9].以前的工作使用了无孢子的h . praealtum(R35),用于基于缺失发现两个独立的无融合生殖的显性基因座[16.].的轨迹肢体缺失(贷款)被发现负责避免在胚囊发育期间减少分裂,突变体缺少这种基因座的突变体恢复以形成胚胎上胚囊。的轨迹损失的孤雌生殖(垂下的)被认为是孤雌生殖和自主胚乳发育所必需的,而缺失该位点的突变体则回归到受精对胚胎和胚乳发育的要求[16.].在无融合生殖R35背景中,缺失突变体的可用性使R35和衍生的缺失突变体对转录组研究具有吸引力。为了更好地发现无融合生殖和两性融合生殖之间的转录差异,本研究设定了一个亚属生殖组织参考转录组的目标皮西拉菌.R35,垂耳加入突变(lop138)和另一种属亚属的离孢子种皮西拉菌,H. Auricalacum.(A36),用于产生参考转录组。
为了产生转录组,我们首先需要制定对生殖组织取样的方案h能产生良好质量RNA测序。这里,手动解剖程序开发了涉及使用的无RNA酶的水中浸没解剖期间和小花,用于存储收集的胚珠直到RNA可以提取使用铵盐溶液。本程序是在新颖h并为进一步的工作提供有价值的模板h和其他菊科物种。用于手动解剖整个卵巢该程序是相对快速的,因而卵巢直接收集到的RNA提取缓冲液然后进行处理以从卵巢和胚珠获得高质量的RNAh(附加文件1:表S1)。rabiger等。[51.]还报道手动解剖h将卵巢转化为液氮,然后提取RNA,这证实了卵巢取样相对容易。
包括牙胚囊的发育阶段从R35和A36取样自主显影种子。授粉之前的发育阶段和授粉后授粉的突变体lop138.产生来自所有这些发育阶段的参考转录组。该参考转录组是第一re novo转录组h该研究结合了无融合生殖的所有关键事件(无孢子胚囊发育、孤雌生殖和自主胚乳发育)和部分性事件(授粉诱导胚胎和胚乳发育)的数据。参考转录组已保存在Shotgun Assembly项目DDBJ/EMBL/GenBank中,加入编号为GEEH00000000。
转录组通过广泛的爆炸搜查并进行术语映射。最近,卵巢转录om来自两个早期的APOMicatic事件h . praealtum(MMC和功能兆匹斯波的发展阶段)已被[51.].本文所提供的参考转录组为早期无融合生殖事件提供了额外的资源,并与孤雌生殖和自主胚乳发育的关键无融合生殖事件相关,为无融合生殖研究提供了有价值的贡献。不同时期和植物资料(无融合生殖的R35和A36,部分有性的)的代表lop138)使得转录组可以用于无融合生殖和有性生殖的比较分析Hieracium。
通过差异表达分析发现无融合生殖和无融合生殖的差异表达序列具有功能富集lop138登记入册。这是通过鉴定R35的基因表达变化对授粉非依赖性种子发育的响应,以及突变体加入后对授粉诱导种子发育的响应lop138(附加文件2,3.,4,5).授粉诱导的种子发展lop138导致R35中比授粉独立的种子发育更多的转录变化。然而,GO term富集分析R35和差异表达的转录本lop138分别揭示了转录的两个差异表达的组共享许多富集的GO术语类别。有富含几个GO项类别lop138其中之一是基因表达的表观遗传调控。其他GO类别丰富了lop138只有行为、细胞周期和DNA代谢过程。的样本lop138并与无融合生殖的R35和A36的样本进行比较,以发现与lop138和无融合生殖的R35和A36(附加文件4和5).转录本差异表达lop138相比于无融合生殖种质时,导致在还通过成绩单的课程共享种子发育过程中差异表达的许多GO项类别的富集lop138在r35(附加文件1:图S5)。这突出了Apomictic和性种子发展途径显示许多共同特征。许多研究表明,性繁殖途径的放松管制是可能的赤霉素的原因,因此预期阿巴莫西斯和性繁殖预计将共享关键部件[15.,24.].
性繁殖所必需的分子信号的正轨,如EC1和RCD1.被鉴定为在受精诱导的种子发育过程中差异表达lop138和在R35和A36(图中也检测到其表达。3.).in.拟南芥, EC1蛋白在双受精过程中调控配子相互作用,并在受精前的卵细胞中特异表达[29].in.h,大多数假定EC1传粉前标本中同源基因上调lop138,这表明h这些序列在受精前也可能具有信号作用(见表)3.).然而,在APOMicicTR35和A36中也检测到这些序列,虽然未被鉴定为差异表达,但大多数序列在胚胎前和R35的后胚胎阶段显示出表达(表3.).同样地,orthologsRCD1.,通过其在酵母中的分化控制功能,参与有性生殖的开始[28],在种子发育过程中表达上调lop138,r35和a36。观察到的表达模式EC1和RCD1.本研究表明,在无融合生殖胚珠中可以检测到有性生殖的分子信号,无融合生殖种子的发育可能利用有性途径的元素来促进自主种子的发育。这与目前的理解相一致,即无融合生殖途径覆盖在默认的性途径上,并利用有性生殖的元素来启动体细胞内的胞外孢子和自主种子发育[24.].
Koltunow等人[24.]能够证明在MMC,这是性途径的起始减数分裂,对于认可,这是aposporous胚囊的起源的启动是必要的。他们进行了特异性阻碍在MMC减数分裂并观察到没有被认可形成和随后的aposporous胚囊实验,表明的功能贷款依赖于性途径的启动[24.].的垂下的轨迹可能以类似的方式运行贷款它的功能是响应性途径的线索。的识别h与其他物种有性生殖起始基因同源的序列,如EC1和RCD1,对理解单性发生机制的重要贡献h.
Koltunow等人[24.]提出两个赋予无融合生殖的基因座h后来确定为贷款和垂下的,沉默性欲表观遗传或基因。提出了在无融合生殖控制区域(ACR)类似的模型雀稗.ACR的特征在于高胞嘧啶甲基化,位于异铬菊酯旋钮上[52.].Podio等人[52.假设ACR中含有孤雌生殖激活和抑制基因,胞嘧啶甲基化可能使孤雌生殖抑制基因失活,从而导致孤雌早育发生。为了验证他们的假设,Podio等人[52.]特异性抑制DNA甲基转移酶,以防止甲基化,并且发现单性生殖呈负影响。去甲基化的影响雀稗类似于删除的效果垂下的轨迹的h,因为垂下的失功能突变体恢复到性欲[16.].这表明,它们或者涉及抑制性欲或抑制单性生殖抑制基因的遗传成分丢失垂耳突变体。
除了表观遗传调节之外,涉及生物和非生物信号传导的途径可能会参与自主种子发育的诱导。在R35中,在预胚胎前和R35的后胚胎阶段上调节对促进型转运,应力,干细胞Niche规范和维护和胚胎图案的蛋白质的转录蛋白的转录蛋白致力于编码蛋白质的转录蛋白。(图。5).in.lop138,这些途径占授粉后上调(图。5).这些结果表明,无融合生殖种子的发育可能是由生长激素生长素的转运、逆境响应和信号转导等多种环境信号途径共同作用的结果。这些途径可能招募了在胚珠发育早期决定细胞命运的基因,从而导致早熟胚胎发生。其他研究也将生长素与体细胞胚胎发生联系起来[53.],以及授粉后胚乳起始以外的自主种皮发育[54.].应激也被认为可以诱导体细胞胚胎发生[55.[许多研究观察到应激诱导的信号通路和体细胞胚胎发生诱导之间的关系[56.,57.,58.].
转录组数据也被用于鉴定标记无孢子胚囊发育和胚胎发育阶段的转录本。通过对转录组丰度的估计,转录本在R35的无孢子胚囊发育期间、在R35、A36和R35的胚胎发育阶段优先活跃lop138被确定(无花果。7;额外的文件10.).这些序列可以作为调查它们标记的发育阶段的简短列表。发育标志物基因列表的有效性通过已知与各自的发育事件相关的基因的代表性来证明,例如LOX2.,AGL61和PHE1.我们确定的同源物LOX2.作为患有胚胎囊发育的标记阶段(附加文件10.A),这与先前的研究发现一致LOX2.与人工智能细胞相关。同源基因在缺失的突变体中下调贷款,即负责就AI展开诉讼的地点[51.,59.].AGL61,其特异性在雌性配子体和早期胚乳的中央细胞中表达拟南芥[48,60.,被鉴定为无融合生殖和突变体的胚胎和胚乳发育阶段的标志(图。6).类似的PHE1,这是在胚胎和胚乳中表达的患者表达的印迹基因拟南芥[61.,62.],被确定为标记的阶段进行胚和胚乳发育的无融合生殖和突变种质(附加文件10.B)。
R35和A36的种子发育在很大程度上是自主的(没有父系输入),因此表达PHE1当从母亲那里继承时,它应该是沉默的,而当从父亲那里继承时,它应该是表达的拟南芥[61.,62.]提出了R35和A36中改进的印迹系统。[63.[是否建议在伪敏捷的APOMICT中,由于通过减少的精子(4M:1P基因组比率)由于两个未更好的极性核的施肥而被破坏的规范2M:1P基因组率被破坏,压印系统的改性可能抵消胚乳中的过量母体基因组。这可以通过减少极性细胞核(复子化)的沉默沉默的沉默来实现,从而增加患者表达印迹基因的剂量[63.].总之,一个父系表达印记基因的转录活性的直向同源物的鉴定,PHE1在这两种性产生的种子和无融合生殖种子h突出显示压印系统可以修改h.或者,印迹基因h可以从这些不同的拟南芥.最近的研究表明,由于重复基因的新官能化,一些印迹基因可能是特异性的物种。例如,提出了FIS2-PRC2复合物,以肥胖的痤疮特异性,并由VRN-PRC2复杂成员重复,其中拟南芥,在配子体和种子发育中起新的作用[64.].基因组复制是多倍体的一个特征h在本研究中使用的物种,因此新功能的印迹基因可能不同于其他物种已知的基因,如拟南芥.为了简化分析,从转录组中除去重复的转录物,然而,这些转录物中没有任何来自PRC2复杂基因或涉及印记的基因(附加文件11.).
预计参考转录组将有助于进一步研究PCG基因的作用h.PCG复合体的下调成员,可在受精之前压制中央细胞增殖拟南芥,如f,没有导致自主性胚乳在性中发育h[22.,23.].f没有与之相关联垂下的轨迹的h . praealtum[24.].但由于其在无融合生殖中的下调作用,在自主种子发育中仍有必要h种导致自主种子发育起始期减少和种子败育增加[23.].在这项研究中,只有一个序列编码的蛋白质与拟南芥5 (AtFIE)在R35的所有阶段均有表达(表4).这与之前的观察结果一致,一个单一的等位基因f在无融合生殖和有性生殖的卵巢中表达h[23.].虽然f无融合生殖和有性生殖的种子发育都是必要的吗h,它没有与许多PCG复合体的成员互动,例如意味着,MSI1和RBR在体外(23.].h目前尚不清楚与FIE相互作用的蛋白质。[23.]提示SWINGER (EZI1)可能与在h(HFIE),因为它是含有PCG蛋白的设定结构域,并且对ATCLF的同源性更高,而不是ATMEA。Swinger对ATCLF的同性恋很重要,因为ATCLF是唯一与体外相互作用的PCG蛋白质HFIE [23.].本文鉴定了与SWINGER和AtCLF高度相似的蛋白编码序列(见表)4).这些序列为未来研究提供了调查作用的资源f在种子发育过程中h.
结论
发展无融合生殖作物有可能彻底改变现代农业。它将提供一种简单的方法,通过允许杂交后产生的高产单株产生无性系种子[2].这样农民就能够收集和种植下一季的种子,以更低的成本高效和稳定地生产高质量的种子、水果和蔬菜。
我们的最终目标是识别赋予Apomixis的基因,以便该特征可以设计成作物物种。为实现这一目标,我们一直在研究模型承认h之前已经确定了两个位点(LOP和LOA)h成为占儿所。瓣膜源突变体表现出阳离病发生和自主胚乳发育的丧失。综合花卉参考转录组h这为研究无融合生殖的分子基础和LOP位点基因的鉴定提供了有价值的资源。我们的研究结果支持了这样一种观点,即无融合生殖和有性生殖的种子发育途径有共同的组成部分,正是在不需要授粉的情况下开启了这些途径,从而实现了无融合生殖[15.,24.].我们鉴定了许多在生殖发育中起重要作用的基因,以及种子发育不同阶段的潜在标记基因。这些基因提供了一种更详细地研究与无融合分裂、孤雌生殖和自主胚乳发育的关键无融合事件相关的转录变化的方法。
在R35,孤雌生殖和自主胚乳发育是由控制垂下的轨迹并被继承为单个单元。然而,重组被抑制在垂下的这使得R35单性生殖与自主胚乳形成的遗传成分之间的依赖程度难以解决[16.].研究涉及的其他无融合生殖和性品种h说明单性生殖和单性胚乳的形成可能受单性生殖和单性胚乳独立组成部分的控制垂下的在R35中紧密相关的基因座[65.].本研究产生的转录组数据应该有助于解决遗传成分垂下的轨迹。随着基因模型的可用性h[51.],以及大量的EST数据库和高密度莴苣基因图谱(摘要以)在菊科中[66.], R35及其衍生突变体lop138的RNA-seq数据可以被定位到黄龙的基因组资源h和生菜。该转录组应该有助于鉴定Apomicic R35和突变液淋巴结138之间的基因组 - 范围的调节差和所涉及Apomixis的循环基因座的遗传组分。
方法
植物材料
植物材料来自野生型无融合生殖植物的活标本和来自无融合生殖附加物的突变植物(ϒ 138) [16.].野生型植物Hieracium praealtum(VILL)察恩由其登录码R35简称。为了澄清,这家工厂以前被称为Hieracium caespitosum(C4D) [16.但后来被证实是h . praealtum.Hieracium aurantiacumL.用于授予突变委员会加入,并通过其加入代码A36提及。突变名υ138,简称为“lop138,是通过γ辐射从R35中得到的,删除了损失的孤雌生殖(垂下的)轨迹(Catanach, Erasmuson, Podivinsky, Jordan and Bicknell 2006)。lop138保留了肢体缺失(贷款)基因座,因此它产生了胚胎胚囊,但不能启动自主种子发育(Catanach,Erasmuson,Podivinsky,Jordan和Bicknell 2006)。受精时lop138与母亲父母(Koltunow,Johnson,Rodrigues,等,or。2011)相比,产生活种子和杂交后代的倍率水平增加。R35,lop138和A36在植物系(奥塔哥大学)的加热温室中繁殖,在施肥的盆栽混合中,在自然光下用SON-T AGRO 400w灯增强,每天提供16小时的光照。
筛选发育胚胎的胚囊
为了确定包含胚珠的头状花序的发育阶段,在Koltunow等人所描述的阶段将小花群从头状花序中移除。9然后用双面胶带固定在显微镜载玻片上。然后在小花上滴一滴水,将其淹没,在解剖显微镜下,每个小花的顶和子房壁都被剥掉。这使胚珠露出来。在胚珠被膜的中间部分,用尖端很细的钳子(5号邓蒙特钳子)切开一条缝,让胚珠的内容物漂浮在周围的水中。然后,用钳子将胚囊从胚珠上分离出来。将每个胚囊用藏红花染色液从钳上冲洗到新的显微镜载玻片上。这是在显微镜下进行的,以确保胚囊被移出。将胚囊置于染色液中浸泡5分钟,染色后在复合显微镜下观察胚囊是否存在胚胎。
组织收集和RNA分离程序
取特定时期的卵巢,用镊子从适当的头状花序发育阶段取一组小花放在显微镜载玻片上。用干净的不含RNA酶的刀片将卵巢切除,然后放入RNA提取缓冲液中。从头状花序收集所有卵巢后,均质卵巢用于后续的RNA提取。该方法用于Koltunow等人的第5 - 10阶段的头状突[9].阶段3和4的小花太小而无法掌握镊子,因此苞片被从Capitulum中除去。然后,虽然仍然附着在容器上,小花被放在显微镜滑块上。小花的营养部分被切断并从载玻片中取出。卵巢从容器上刮下并放入裂解缓冲液中进行RNA提取。用Magmax™-96总RNA分离试剂盒(AMAMION)提取RNA,其包括DNase步骤。
为了在特定阶段收集胚珠,用镊子从适当的分阶段中除去小花,并用如上所述的双面胶带连接到显微镜载玻片上。然后将RNase自由水放在小花体上以完全淹没它。在解剖显微镜下,将Pappus剥离,以及卵巢壁。这暴露了胚珠,用镊子除去并转移到含有储存介质的管中。合并多个胚珠材料,用RNAWYUSEWS-MICRO KIT(AMALION)萃取总RNA,其包括DNase步骤。概述了RNA样本和产量(附加文件1:表S1)。
RNA序列
在新西兰基因组学设施(NZGL)(奥塔哥大学),TruSeq RNA样本准备试剂盒从R35的胚珠和子房组织中提取的总RNA制备cDNA文库,lop138和A36(表1).RNA完整性用Agilent生物分析仪2100进行检测,只使用RIN值大于7的RNA样本进行cDNA制备。共制备了18个cDNA文库,其中8个来自R35的子房样本(未复制),5个来自R35的胚珠样本,lop138和A36具有生物复制。这些文库在Illumina Hiseq2000上测序,通过配对结束测序方法(100bp),横跨四个测序通道。使用FASTQC(版本0.1.1)进行序列读取的质量控制[67.].
de novo转录组合体组装程序
为了确定特定基因在不同发育阶段和样本基因型中的相对表达水平,我们首先使用来自18个cDNA文库的序列数据制作了一个从头组装的参考转录组。为了生成参考转录组,我们进行了以下操作:使用“-h 20”参数在FASTQ数据上运行DynamicTrim,该参数设置质量评分下限为20。使用' -l 50 '参数对裁剪后的数据运行LengthSort,以选择至少50个碱基的读。每个经过修剪和排序的数据文件的前4,000,000个读被合并到两个单独的文件(分别对应读对的read1和read2)和Trinity汇编器(版本r2011-08-20) [68.]对所得合并文件运行。山姆文件对齐和发电用BWA AlN和BWA SAMPE(0.6.1-R104)来完成。
评估大会有效性
使用两种方法评估参考组件的有效性:
- 1。
计算每个库映射回引用程序集(PMBR)的读的百分比。这是通过使用samtools和bash命令wc -l提取和计数每个对齐文件(.sam)的映射读取来完成的。从每个.sam文件中也以类似的方式计算总顺序读取。然后计算PMBR为(映射读/总读)*100。
- 2。
所有可用的表达序列标记(EST)序列h和其他菊科的物种从NCBI下载(于2014年4月4日最后一次访问)。独立BLAST(NCBI-BLAST-2.2.27 +)[69.用来对新重建的人进行BLASTN搜索h在1E-4的E值截止时对这些EST的转录组。
评估的完整性
转录的完整性基于序列邻接(N50),它是最小的装配尺寸,其中所述组装的碱的至少50%被发现,并通过搜索基准通用评估单拷贝直向同源物(BUSCOs),在真核细胞集BUSCOs从下载http://busco.ezlab.org./,搜索h通过使用Busco_v1.1软件进行转录组[70].
去除嵌合体和冗余成绩单
从NCBI (ftp://ftp.ncbi.nlm.nih.gov/refseq/release/)并用作Blastx的数据库(NCBI-Blast-2.2.27 +)[69.]通过1E-2的E值截止。yang和smith去除嵌合抄本,管道和脚本[71.],得到(https://bitbucket.org/yangya/optimize_assembler)并实施。根据同源性搜索结果被用来从转录识别和删除嵌合体。要删除多余的成绩单,CD-HITS-EST版本4.5.4 [72.,73.]用于去除与相似阈值为90%的较长的转录本完全一致的序列。差异表达但被删除的冗余转录本在附加文件中提供11..
注释
注释策略总结在(附加文件1:表S10)。为了向非冗余转录组进行注释,下载了两个高质量的蛋白质序列数据库并格式化为BLAST数据库。这两个数据库使用含有植物物种的蛋白质序列的参考序列数据库(Refseq)(从(ftp://ftp.ncbi.nlm.nih.gov/refseq/release/)和UniProtKB的Swiss-Prot部分中包含的所有蛋白质序列(下载地址http://www.uniprot.org/uniprot.).BLAST分析(ncbi-blast-2.2.27+) [69.]用于搜索的h转录在使用BLASTX算法在1E-4的e-值截止的两个蛋白质数据库。从这些搜索结果进行了合并和巩固,以产生用于转录的最终注解。如果htranscript获得了来自RefSeq和Swiss-Prot的条目的点击,Swiss-Prot的结果被选择,因为Swiss-Prot是手工整理的,通常通过实验或文献证据来支持。为了识别可能编码全长多肽的新转录本,使用开放阅读框架(orf)预测服务器(http://proteomics.ysu.edu/tools/OrfPredictor.html).使用定制的python和R脚本(附加文件12.)只保留预测肽段长度至少为100个氨基酸的转录本。
基因本体论术语定位
通过BLASTX对转录组进行注释后,使用与查询序列编码的预测多肽相匹配的基因座编码蛋白id(受试者id)为转录本分配GO术语。为了实现这一点,首先将来自两个不同数据库(Swiss-Prot和RefSeq)的BLASTX结果中的主题ID转换为entrez基因ID,使用以下步骤:http://www.uniprot.org/uploadlists/).2)REFSEQ'GI ID'首先映射到UNIPROTKB'AC ID',然后将“AC IDS”映射到UNIPROT网站上的ENTREZ基因ID(http://www.uniprot.org/uploadlists/).使用自定义的R脚本(文件S1), GO术语被映射到NCBI文件(gene2go.gz)的基因id (ftp://ftp.ncbi.nlm.nih.gov/gene/DATA/,最后一次访问2015年3月19日),其中包含一个全面的基因ID列表及其相应的GO ID(文件S2)。
量化和归一化表达式
为了估算跨采样条件的转录性丰度,从对齐文件(.sam)计算支持每个转录物的读取的数量。使用SAM2COUNT.PY脚本计算与每个转录物(MAQ)的最小映射质量(MAQ)对齐的读取[74.].然后使用两种不同的方法标准化数字计数数据:
- 1。
标准化的每百万记录(TPM)方法[75.]应用于校正转录物长度和测序深度效应。TPM是对流行的RPKM方法的轻微修改,并且使用[75.在自定义R脚本中,如下所示;标准化因子(z)的计算方法是将每个转录本的读计数(tc)除以其长度(tl),并对每个库的这些值求和(z = sum(tc/tl))。然后计算每个抄本的TPM,其读计数乘以100万,再除以其长度与z的乘积(TPM = (tc*1e6)/(z*tl))。
- 2。
通用表达式代码(UPC)的规范化方法[49]也被用来将数字计数按比例划分为表明基因活动水平的值,从0到1。UPC包(版本2.10.8)取自bioconductor (http://bioconductor.org)和“UPC_RNASeq”功能实现,并启用了用户定义的“GC注释”。一个自定义的python脚本(附加文件12.)用于计数每个转录物的GC含量,然后在UPC_RNASEQ中用作“GC注释”文件。
数据2,3.,4,5和6使用TPM值创建,TPM值以中位数为中心,并使用热图分层聚类。2function in R. For visualizing the expression of each transcript across the samples, the median centered and clustered expression values were scaled by z-score and attributed a color, with bright red representing highest expression and light green representing lowest expression.
参考资料
- 1。
Nogler GA。配子体孤雌生殖。出自:Johri PBM,编辑。被子植物胚胎学:第1版。柏林:施普林格;1984.p . 475 - 518。
- 2。
Spillane C,Curtis Md,Grossniklaus U. Apomixis技术发展 - 处女诞生在农民的田地?NAT BIOTECHNOL。2004; 22(6):687-91。
- 3.
两性无融合生殖杂种的染色体和胚胎学分析黍最大Jacq。中国科学(d辑:地球科学)1980;58(2):153-6。
- 4.
罗氏(Roche D, Cong P, Chen Z, Hanna WW, Gustine DL, Sherwood RT, Ozias-Akins P.)Cenchrus ciliaris.l .)和非洲狼尾草Fresen。植物j . 1999; 19(2): 203 - 8。
- 5。
关键词:臂虫,无融合生殖,玉米,连锁群中国科学(d辑:地球科学)1997;94(3):439-44
- 6。
Naumova TN,Osadtchiy JV,Sharma VK,Dijkhuis P,Ramulu Ks。在植物中的apomixis:invisthory的结构和功能方面Poa nemoralis和p . palustris.原生质1999; 208(1-4):186-95。
- 7。
陈志强,陈志强,陈志强,等。草原早熟禾无融合生殖候选基因的分离与鉴定。植物学报2004;56(6):879-94。
- 8.
Noyes RD, Rieseberg LH。两个独立的基因位点控制着三倍体开花植物的无融合生殖Erigeron Annuus..遗传学。2000;155(1):379 - 90。
- 9.
Koltunow AM, Johnson SD, Bicknell RA。菊科植物有性和无融合生殖的发育。植物生殖学报,1998;11(4):213-30。
- 10。
草原早熟禾无融合生殖的遗传证实了一个基因表达率和外显率存在差异的5个位点模型。植物细胞。2005;17(1):24里面。
- 11.
HörandlE.APOMictic植物中自生育能力的演变。性植物团体。2010; 23(1):73-86。
- 12.
山楂中的无融合生殖:孟德尔的实验报应。J Exp Bot. 2011;62(5):1699-707。
- 13.
Hand ML, Vit P, Krahulcova A, Johnson SD, Oelkers K, Siddons H, Chrtek J Jr, Fehrer J, Koltunow AM。从自然群体和实验群体中无融合生殖相关标记的保存推断毛竹和菊科植物无融合生殖基因座的进化。遗传。2015;114(1):17-26。
- 14.
比克内尔RA, Koltunow AM。理解无融合生殖:最近的进展和遗留的难题。植物细胞。2004;16:S228-45。
- 15.
Tucker MR, Araujo AC, Paech NA, Hecht V, Schmidt ED, Rossell JB, De Vries SC, Koltunow AM。有性生殖和无融合生殖hSubgeus pilosella是密切相关的发育途径。植物细胞。2003; 15(7):1524-37。
- 16。
Catanach As,Erasmuson SK,Podivinsky E,Jordan Br,Bicknell R.遗传区域的删除映射与Hieracium的Apomixis相关的遗传区域。Proc Natl Acad Sci U S A. 2006; 103(49):18650-5。
- 17。
单纯性雀稗(Paspalum simplex Morong)花的无融合结合相关等位基因的特异性表达。中国生物医学工程学报。2010;61(6):1869-83。
- 18.
古铁雷斯马科斯JF,哥斯达黎加LM,PRA MD,斯科尔滕S,克兰兹E,佩雷斯P,迪金森HG。在植物的配子印记基因的表观遗传的不对称性。NAT Genet。2006; 38(8):876-8。
- 19.
种子发育过程中重复元素的广泛去甲基化是基因印迹的基础。科学。2009;324(5933):1447 - 51。
- 20.
Hsieh T-F,Ibarra Ca,Silva P,Zemach A,Eshed-Williams L,Fischer RL,Zilberman D.拟南芥胚乳的基因组宽去甲基化。科学。2009; 324(5933):1451-4。
- 21.
Local DNA低甲基化激活水稻胚乳中的基因。中国科学院院刊2010;107(43):18729-34
- 22.
Rodrigues JCM,Luo M,Berger F,Koltunow AMG。PolycomB组基因在服从中的性和性种子发育中的功能。性植物团体。2009; 23(2):123-33。
- 23。
Rodrigues JCM,Tucker Mr,Johnson SD,Hrmova M,Koltunow AMG。Hieracium中的性和Apomictic种子形成需要植物Polycomb-Group基因受精独立胚乳.植物细胞。2008;20(9):2372 - 86。
- 24。
Koltunow AM, Johnson SD, Rodrigues JC, Okada T, Hu Y, Tsuchiya T, Wilson S, Fletcher P, Ito K, Suzuki G,等。无性生殖是无融合生殖的蓝藻亚属的默认模式,其中两个显性基因座起着使无融合生殖成为可能的作用。工厂j . 2011, 66(5): 890 - 902。
- 25。
Byzova MV,Franken J,Aarts MGM,Almeida-Engler J,Engler G,Mariani C,Campagne MMVL,Angenent GC。Arabidopsis无菌Apetala,一种多功能基因调节花序,花和胚珠发育。基因开发。1999; 13(8):1002-14。
- 26。
雷米。MCM复合体:其在DNA复制中的作用和癌症治疗的影响。Curr癌药物目标。2005; 5(5):365-80。
- 27。
Longhese MP,Plevani P,Lucchini G.复制因子A是用于DNA复制,修复和重组的体内。Mol细胞Biol。1994年; 14(12):7884-90。
- 28。
冈崎N,冈崎K,渡边Y,加藤-林男,山本男,冈山H.新型因子真核生物控制中是高度保守裂殖酵母性发育。Mol细胞Biol。1998; 18(2):887-95。
- 29。
Sprunck S, Rademacher S, Vogler F, Gheyselinck J, Grossniklaus U, Dresselhaus T.卵细胞分泌的EC1在双受精过程中触发精子细胞激活。科学。2012;338(6110):1093 - 7。
- 30.
Okamoto K,Ueda H,Shimada T,Tamura K,Koumoto Y,Tasaka M,Morita Mt,Hara-Nishimura I. ABC Transporter B家族蛋白,ABCB19是花序茎的细胞质流和颅重血性所必需的。植物信号表现。2016; 11(3):E1010947。
- 31.
Shigeto J,Tsutsumi Y. III类过氧化物酶的不同功能和反应。新植物。2016; 209:1395-402。
- 32.
Shahollari B, Vadassery J, Varma A, Oelmüller R.富含亮氨酸重复蛋白是内生真菌介导的生长促进和提高种子产量所必需的piriformospora indica.在拟南芥.植物j . 2007; 50(1): 1-13。
- 33.
Jun JH, Ha CM, Fletcher JC。叶柄上的叶片通过直接激活协调拟南芥的器官决定和轴向极性不对称LEAVES2.植物细胞。2010;22(1):62 - 76。
- 34。
哈CM,君JH,弗莱彻JC。通过转录因子的YABBY和诺克斯家人的调控拟南芥叶形态的控制。遗传学。2010; 186(1):197-206。
- 35。
贝尔e,creelman ra,mullet je。拟南芥中伤口诱导的茉莉酸积累需要叶绿体脂氧合酶。Proc Natl Acad Sci U S A. 1995; 92(19):8675-9。
- 36。
拟南芥脂氧合酶基因家族的酶活性多样性。脂质。2009;44(2):85 - 95。
- 37.
Santos MO, Aragão FJL。SERK基因在植物环境反应中的作用。植物学报。2009;4(12):1111-3。
- 38.
部分功能缺失等位基因揭示了GNOM在生长素转运相关的拟南芥胚后发育中的作用。发展。2004;131(2):389 - 400。
- 39.
黄凤英,黄凤英,黄凤英,等。质膜结合的AGC3激酶在TPRXS(N/S)基序磷酸化PIN生长素载体,以指导顶端PIN的循环。发展。2010;137(19):3245 - 55。
- 40。
贝内特T,Sieberer T,威利特B,布克Ĵ,Luschnig C,Leyser O.拟南芥MAX途径控制拍摄通过调节植物生长素输送支化。CURR生物学。2006; 16(6):553-63。
- 41。
在拟南芥茎和花的分生组织完整中,WUSCHEL基因是必需的。发展。1996;122(1):87 - 96。
- 42。
斯塔尔Y,西蒙R.植物干细胞小生境。诠释J发育生物学。2005; 49(5-6):479-89。
- 43。
Wu X,Dabi T,Weigel D.对于Arabidopsis Metistem的增长和维护,Homeobox基因刺激/ WOX9的要求。CURR生物学。2005; 15(5):436-40。
- 44.
Di Laurenzio L, Wysocka-Diller J, Malamy JE, Pysh L, Helariutta Y, Freshour G, Hahn MG, Feldmann KA, Benfey PN。稻草人基因调控不对称的细胞分裂,这对产生拟南芥根的径向组织至关重要。细胞。1996;86(3):423 - 33所示。
- 45.
拟南芥(Arabidopsis thaliana)的胚胎模式研究。生物医学进展。2007;23(1):207-36。
- 46.
Portereiko MF, Lloyd A, Steffen JG, Punwani JA, Otsuga D, drew GN。在拟南芥中,中心细胞和胚乳发育需要AGL80。植物细胞。2006;18(8):1862 - 72。
- 47。
Kang I-H, Steffen JG, Portereiko MF, Lloyd A, drew GN。在拟南芥胚乳发育过程中,AGL62 MADS结构域蛋白调控细胞分化。植物细胞。2008;20(3):635 - 47。
- 48。
Steffen JG, Kang I-H, Portereiko MF, Lloyd A, drew GN。AGL61与AGL80相互作用,是拟南芥中心细胞发育所必需的。植物杂志。2008;148(1):259 - 68。
- 49。
Piccolo SR, Withers MR, Francis OE, Bild AH, Johnson WE。转录激活的多平台单样本估计。中国科学(d辑:地球科学)2013;110(44):17778-83。
- 50.
谢超,毛欣,黄杰,丁勇,吴军,董胜,孔林,高刚,李春英,魏林。KOBAS 2.0:一种用于富集途径和疾病标注与识别的web服务器。核酸学报2011;39(增刊2):W316-22。
- 51.
Rabiger DS,泰勒JM,斯普里格斯A,手ML,亨德森ST,约翰逊SD,Oelkers K,Hrmova男,斋藤K,铃木G,等人。集成的山柳基因组转录和资源的产生使无融合生殖启动阶段的小RNA途径的探索。BMC生物学。2016; 14:86。
- 52.
波迪奥男,卡塞雷斯ME,Samoluk SS,成城JG,Pessino SC,Ortiz的JPA,在雀稗属的无融合生殖特异性区域的Pupilli F.甲甲基化状态分析。孤雌生殖建议的表观遗传控制。J Exp Bot。2014; 65(22):6411-24。
- 53.
苏耶,赵XY,刘烨,张克,奥尼尔SD,张Xs。制素诱导的WUS表达对于拟南芥体细胞胚胎发生过程中的胚胎干细胞更新是必不可少的。工厂J. 2009; 59(3):448-60。
- 54.
Figueiredo DD, Batista RA, Roszak PJ, Hennig L, Köhler C.拟南芥胚乳生长素的产生驱动种皮发育。Elife。2016;5:e20542。
- 55.
杨旭,张欣。高等植物体细胞胚胎发生的调控。植物学报。2010;29(1):36-57。
- 56.
金峰,胡丽,袁东,徐军,高伟,何玲,杨晓霞,张晓霞。棉花体细胞胚与合子胚转录组比较分析:对体细胞胚发育的胁迫响应功能的证据。植物生态学报;2014;12(2):161-73。
- 57.
Salvo SAGD, Hirsch CN, Buell CR, Kaeppler SM, Kaeppler HF。玉米体细胞胚胎发生早期的转录组分析显示应激因子和胚胎发生相关基因的表达发生了改变。《公共科学图书馆•综合》。2014;9 (10):e111407。
- 58。
Wickramasuriya AM, Dunwell JM。拟南芥胚胎发生的全球范围转录组分析。BMC基因组学。2015;16:301。
- 59。
Okada T, Hu Y, Tucker MR, Taylor JM, Johnson SD, Spriggs A, Tsuchiya T, Oelkers K, Rodrigues JCM, Koltunow AMG。在进入有丝分裂之前,在前层次开始无融合生殖的扩大细胞转变为胚囊程序。植物杂志。2013;163(1):216 - 31所示。
- 60。
Bemer M,Wolters-arts M,Grossniklaus U,Angenent GC。MADS Domain蛋白戴安娜与静脉曲张的80一起起作用,以指定拟南芥胚珠中的中央电池。植物细胞。2008; 20(8):2088-101。
- 61。
拟南芥(Arabidopsis thaliana) MEDEA Polycomb组蛋白通过亲本印迹控制PHERES1的表达。Nat麝猫。2005;37(1):28 - 30。
- 62。
科勒C,亨尼格L,毕兰C,片仔癀S,Gruissem W,Grossniklaus U的多梳基蛋白MEDEA通过控制MADS-box基因的PHERES1表达调控种子的发育。基因开发。2003; 17(12):1540至1553年。
- 63。
斯皮尔曼男,Vinkenoog R,斯科特RJ。单性生殖的遗传机制。PHILOS反式 - [R志林斯顿丝氨酸乙生物科学。2003; 358(1434):1095-103。
- 64。
邱y,刘s-l,亚当斯kl。聚胞抑制复合物中基因重复后的齐心并犯。植物理性。2017; 174(2):1192-204。
- 65。
Ogawa D,Johnson SD,Henderson St,Koltunow AMG。从麦芽酸钠两种其他成分的自主胚乳形成(Aute)的遗传分离。植物繁殖。2013; 26(2):113-23。
- 66。
Truco MJ,Ashrafi H,Kozik A,Leeuwen H,鲍德斯J,Reyes Chin Wo S,Stoffel K,Xu H,Hill T,Van Deynze A等人。莴苣的超高密度,基于转录物的基础遗传图谱。G3(Bethesda)。2013; 3(4):617-31。
- 67。
高通量序列数据的质量控制工具。2010年。http://www.bioinformatics.babraham.ac.uk/projects/fastqc/
- 68.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I, Adiconis X, Fan L, Raychowdhury R, Zeng Q, et al.;从RNA-Seq数据中重建一个没有基因组的全长转录组。生物科技Nat》。2011;29(7):644 - 52。
- 69.
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ。基本的局部对齐搜索工具。中华医学会昆虫学分会。
- 70.
思茅FA,普华永道RM,IOANNIDIS P,Kriventseva EV,Zdobnov EM。BUSCO:评估基因组组装和注释完整性与单拷贝同源基因。生物信息学。2015; 31:3210-2。
- 71.
杨Y,史密斯SA。优化德诺读曲RNA-SEQ数据的Novo组装,用于语言核糖。BMC基因组学。2013; 14(1):328。
- 72.
李伟,李志强,李志强,等。基于聚类分析的蛋白质数据库构建方法。生物信息学。2001;17(3):282 - 3。
- 73.
Li W,Godzik A. CD-his:用于聚类和比较大套蛋白质或核苷酸序列的快速计划。生物信息学。2006; 22(13):1658-9。
- 74.
Buffalo V. Sam2counts.py - 将SAM映射结果转换为参考序列计数。2010年。https://github.com/vsbuffalo/sam2counts.
- 75.
Wagner GP,Kin K,Lynch VJ。使用RNA-SEQ数据测量mRNA丰度:RPKM测量在样品之间不一致。理论Biosci。2012; 131(4):281-5。
致谢
我们要感谢Mik Black,Benoit Auvray,Peter Stockwell和Rudiger Brauning帮助生物信息学和统计分析;Rob Day和Robyn Lee用于组织和RNA隔离的指导;和苏珊·麦肯齐有助于养成本研究中使用的植物。
资金
这项工作得到了奥塔哥大学的支持,通过向合成生物学和启动伙伴关系提供的研究生奖学金。
数据和材料的可用性
在当前研究期间生成和分析的数据集可在序列读取存档中获得https://www.ncbi.nlm.nih.gov/生物项目编号为“PRJNA284533”。参考转录组保存在Shotgun Assembly项目DDBJ/EMBL/GenBank中,登录号为GEEH00000000。
作者信息
从属关系
贡献
SB,交流,JL,RB和RM设计了实验。SB进行的实验。SB,交流,RB和RM分析数据。SB和RM撰写和交流,JL和RB编辑的稿件。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
附加文件
额外的文件1:
附加图S1-S5和表S1-S10。(docx 6791 kb)
额外的文件2:
差异表达分析,以发现R35中对雌跖母发生相关的变化。(XLSX 256 KB)
额外的文件3:
差异表达分析发现与无融合生殖种子发育相关的变化。(XLSX 1028 kb)
额外的文件4:
差异表达分析发现罗普138中性诱导种子发育相关的变化。(XLSX 2077 KB)
额外的文件5:
差异表达分析发现与静态胚囊囊相关的差异垂耳138相对于R35。(XLSX 2718 kb)
额外的文件6:
在差异表达的转录物中进行富集富集分析,从将APOMictic Accession(R35和A36)的样品与突变分配的样品进行比较(垂耳138)。(XLSX 4571 KB)
额外的文件7:
差异表达的成绩单,没有GO注释,有或没有爆炸点击。(XLSX 974 KB)
额外的文件8:
与“基因表达的表观遗传调控”相关的差异转录本表。(XLSX 15 kb)
额外的文件9:
显示阶段优先表达的转录本。(XLSX 61 kb)
附加文件10:
标记阶段的基因列表在R35中经历了牙胚囊发育的。(XLSX 17 KB)
附加文件11:
被差异表达但识别为重复和在加工过程中从转录除去转录物。(XLSX 68 KB)
额外的文件12:
R脚本。(多克斯20 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Bräuning, S., Catanach, A., Lord, J.M.等等。野生型模型apomict的比较转录组分析Hieracium praealtum和它的失败的丧失(垂耳)突变体。BMC植物杂志18,206(2018)。https://doi.org/10.1186/s12870-018-1423-1
收到了:
接受:
发表:
关键词
- apomixis.
- 单性发生
- 无性
- h
- RNA序列
- 转录组