摘要
背景
体内单倍体诱导(HI)的基础Stock6-衍生诱导系是产生单倍体最普遍的方法。然而,HI的生物学机制尚未完全了解,在单倍体诱导过程中发现了双胚粒,这可能为HI异常双受精提供了潜在的证据。
结果
我们调查了不同单倍体诱导剂的后代的双胚胎频率。结果表明,增加高潜力显着改善了双胚粒的频率。与由单倍体诱导线Cauhoi授粉的后代的平均双胚籽粒频率(平均频率= 0.07%)相比,通过单倍体诱导线Cau5授粉的后胚的频率改善为0.16%。通过用四个单倍体诱导剂授粉具有分化的HIR的单倍杂交ND5598进一步证实该结果,其中双胚胎频率与HIR高度相关。在237个双胚胎核中,我们鉴定了30个单倍体双胚胎粒(12.66%),频率远远大于三种其他诱导线的平均HI速率(频率范围2-10%)。另外,在高频(41个双植物中的8个)发生非细倍性。这种Aneuproidy水平提供了新的洞察HI期间异常双重施肥。此外,我们观察到该领域双植物之间的生长速率的差异,为双株的4.22%以显着不同的速率增长。简单序列重复标记(SSR)和3072个SNP芯片基因分型结果显示> 90%的双植物共享相同的原点,并且生长差异可归因于营养素,营养素竞争以及可能的激素调节。
结论
这些结果表明,HI能力的增强可以增加双胚核频率,而本研究观察到的单倍体双胚核和非整倍体双胚核的高频率为我们理解HI和异常胚胎发生的机制提供了新的见解。
背景
高等植物的受精和胚胎发生是一个复杂而受严格调控的过程。多胚现象是一种不正常的现象,在某些开花植物中有报道[1]. 自发孪生在拟南芥中广泛存在,许多多胚突变体已被鉴定。基因突变双胞胎可以从胚胎发生早期的悬浮细胞转化中建立差异化结构,并最终导致聚氧化氮。twn突变体也可以通过胚柄转化产生额外的胚。而twn2突变体通过异常分化的胚柄细胞产生多个胚胎[2,3.,4].拟南芥中观察到的多胚bim1型胚胎模式突变不是由胚柄细胞分裂产生的,这表明了多次受精事件或过早的合子卵裂[5]. 水稻中的多胚促进基因(OSPE.)是通过插入T-DNA而克隆的/Ds公司来自可育突变体[6].在进一步的研究中,Paul等人报道多个胚胎在OSPE.突变体是序贯增殖和裂解对血小痛胚胎的结果[7].玉米多胚的自发发育最初是由Schrenk [8].Pesev等人研究了从一个合成玉米群体中选育双胚系的可能性,与单胚籽粒相比,双胚籽粒的蛋白质和油含量都显著提高[9]. 双胚核仁率为2.1%~25.3%,平均为11.8%。对玉米自交系VIR17的双胚现象的分析表明,两种类型的双胚都是自发发生的,即胚柄胚和合子原胚的典型分裂,用2,4-二氯苯氧乙酸(俗称2,4-D)授粉后[10].
在玉米中的体内Hi天然存在于1959年首次报道的罕见现象,即,无论遗传背景如何,单倍体会迅速发生Stock6[11].随后培育出具有较高单倍体诱导率(HIR)的玉米单倍体诱导剂系,使育种者能够有效地产生单倍体[12,13,14]. 因此,体内HI已成为生产玉米单倍体的首选手段[15,16].作为结果,Stock6其衍生的线被称为“单倍体诱导剂”。在双重施肥过程中,用单倍体诱导剂作为雄性父母,大多数种子用正常的胚乳和胚胎发育,分别具有倍增水平的3N和2n。除了一定比例的单倍体,即,胚乳水平的胚胎水平为胚乳和N用于胚胎[11,17],一些异常的籽粒伴随单倍体的产生;其中包括胚胎流产或空壳,胚乳败育程度不同,异卵受精增加[16,17,18,19,20.].此外,在1966年进行的一项研究中,在49,903个核中观察到49个双胚胎核,衍生自单倍体诱导剂的组合,这暗示了双胚胎和单倍体诱导之间的可能关系[21].然而,由于双胚核的频率低以及当时的分子生物学方法的限制,这些作者可以在单倍体诱导和增加的双胚胎粒数之间的关系时呈现很少的证据。后来,李等人。用两种单倍体诱导剂使用不同的杂交物,并获得26对双胞胎幼苗,它们使用形态学观察和分子分子来发布这些幼苗的初步发现[22].对于双胞胎幼苗的简单序列重复(SSR)标记基因型是相同的,尽管其中一些相对于农艺性能而变化。邱等人。[18还发现,在HI期间可以产生双胚胎,得到与Li等人的结果类似的结果。关于双胞胎幼苗的基因型和表型[22].
最近,三个研究小组在不同的期刊上独立报道了HI的基因。一致的结论是,GRMZM2G471240基因第4外显子中一个4-bp的插入引起了帧移和功能丧失,最终引发了HI [23,24,25].然而,HI及其伴随的异常籽粒在玉米中发生的生物学机制尚不清楚。在本研究中,我们对体内HI过程中双胚的产生进行了详细分析。目的是探讨不同单倍体诱导剂受精过程中双胚核率(TEKR)的变化规律,探讨HI过程中双胚的形成机制,为阐明HI的发生机制提供依据。
结果
玉米单倍体诱导剂增加TEKR
在我们的第一个试验中,包括17个不同的母系自交系与2个单倍体诱导剂授粉,我们发现只有60个双胚核(附加文件1)在60659个种子里。这种极低的TEKR(范围0-0.28%,平均0.08%)不允许我们在母体杂种优势群和双胚核心频率之间建立明确的联系。在17个自交系中,TEKR最高的3个自交系分别为4F1、GY923和Dan360,属于兰开斯特和Lvda红玉米芯组合群。
我们进一步分析了父本对TEKR的影响。如表所示1结果表明,供试自交系自交穗中未发现双胚粒。用诱导剂CAUHOI授粉的穗的TEKR为0 ~ 0.35%(平均为0.07%)。高HIR诱导剂系CAU5的后代TEKR为0 ~ 0.33%,平均TEKR为0.16%。虽然CAU5的平均HIR大于CAUHOI,但在本试验样本量下,CAU5和CAUHOI的TEKR差异并不显著(Student’s test)。
接下来,我们用4个单倍体诱导剂对单杂种ND5598进行授粉(表2)HIR与~ 2至~ 10%. CAU2,CAU5,CAU的HIRWX.,用杂交ND5598测定的CAUHOI值分别为10.27、9.42、5.33、2.29%;TEKR值分别为0.12%、0.11%、0.08%、0.02%。HIR与TEKR呈高度正相关,相关系数为0.97 (p < 0.05). Combining the phenomenon fo potential increased TEKR by haploid inducers in aforementioned trail, we thus concluded that the HI correlated with significantly greater numbers of twin-embryo kernels.
根据两个胚的形态、颜色和大小对双胚核的分类
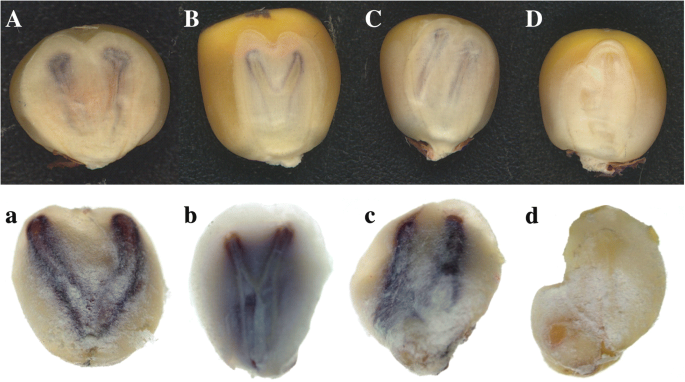
对我们在上述实验中获得的237个双胚粒,根据胚形态、胚色素沉着和胚大小进行了精细分类。每一种独特类型的双胚内核被计数(表1)3.).如图1所示。1,可区分四种结构类型,即V型、Y型、II型和“不确定”。对于V型,两个细菌从基部分开,类似于字母“V”(图。1). 类似地,Y型的两个胚芽在胚胎轴的中间被分开(图。1 b).对于II型,两个胚胎平行于胚轴,彼此分离(图。1 c). 不规则形状的双胞胎胚胎不符合上述任何类型,被归类为“不确定”。如图。1,可以区分四种结构类型,即v型(总量的47.7%),y型(39.2%),II型(3.0%)和“不确定”(10.1%)(表3.).
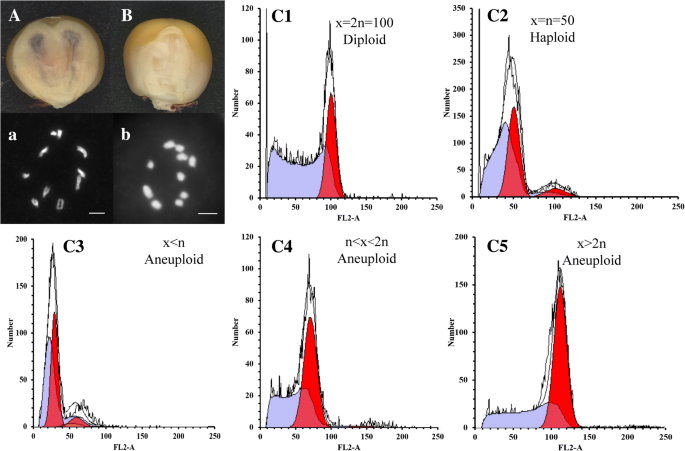
根据新泽西州R1在黄芩的色素沉着中,双胚核可分为紫色或无色(即杂交杂种,推测为单倍体)(图。2 a, B). 在237个双胚粒中,207个为二倍体,有2个紫色胚,30个为单倍体,有2个无色胚。为了验证倍性水平,对这些推测的双胚单倍体和二倍体进行染色体计数。推测的二倍体核的染色体数目是20(图。3A,A),而假定为单倍体的籽粒为10。3B,B.);这与标记得到的结果一致新泽西州R1并再次确认了准确性新泽西州R1双胚胎内核识别系统。因此单倍体双胚的比例为30/237×100 = 12.66%,远高于平均HIR。此外,我们将两种植物的大小与每个双胚籽粒进行比较,发现它们中的75%是平等的,我们定义为A型,而剩余的25%差异差异,并且被定义为B型(表3.).
双胚籽粒衍生的双植物间的表型和遗传变异
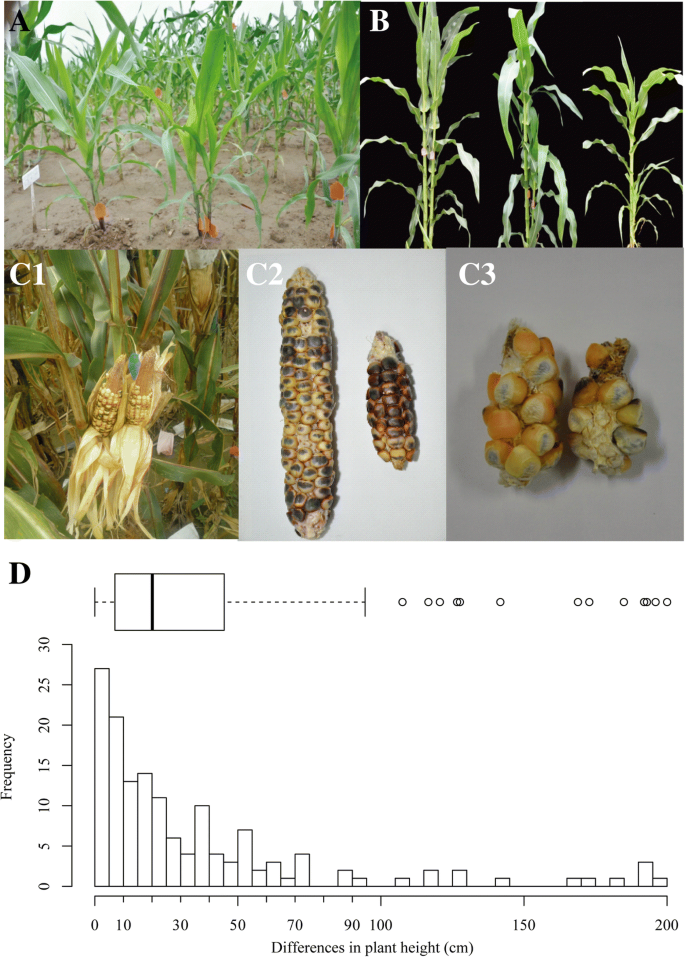
除了用于核解粒子的双胚胎核,182个双胚胎粒细胞萌发并生长在幼苗阶段,146人对成熟度幸存下来。每对的个体在早期阶段具有相同的形状,但植物高度随着它们的增长而变化(图。3a,b). 根据株高差异(PHD;见图。3d)两个人之间。如图所示,除了13个异常值外(总量的9%),所有其他不同之处基本相对于植物高度不同,并且来自大多数双胚胎的个体之间的磷磷脂小于100厘米。基于每个人的博士学位,我们将双胚植物分为三种类型,即Phd I型,II和III。对于I型,一对中的个体的植物高度变化为0至20厘米,并且它们的高度基本仍然是恒定的,直到收获;该组中每个人的耳朵正常,并且是大的(图。3, C1)或小(图。3, C3).然而,对于II型,高度的差异相当大,而收获的耳朵的尺寸相应地相应不同(图。3、C2).对于III型,较小的个体通常不能生长到成熟,而对于那些已经成熟的植株,由于矮小的身材,没有收获穗。各类型所占比例分别为:1型(49%)、2型(42%)、3型(9.0%);13异常值)。对这些博士学位较大的双胞胎植物,选择41对进行流式细胞术分析。其中,20株为二倍体双生植株。2,C1)和13是单倍体双胞胎植物(图。2,C2级).有趣的是,我们检测到8个具有非整倍体的双生植株,其中5个是非整倍体水平在n - 2n之间(图1)。2,C4级), 2个倍性水平大于2n的非整倍体(图。2 c5)和1个倍性水平小于n的非整倍体(图。2,C3级),这些非整倍体暗示了单倍体诱导过程中异常的双受精和染色体行为。
双生植物的基因型
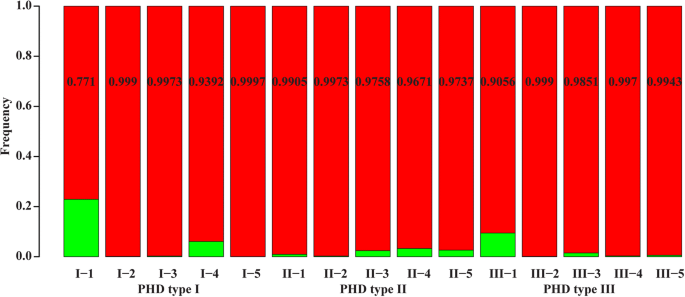
用30个SSR标记对50对双胞胎胚胎进行基因分型,并没有发现个体之间的任何遗传差异——即使是在三个PHD类别之间。然而,考虑到玉米基因组如此之大,30个分子标记可能不足以检测变异,我们使用包含3072个SNP标记的MaizeSNP3K芯片进行进一步的基因分型。在这个实验中,我们选择了15对双生植物进行基因分型,从三个PHD组中每个组5对。利用SNP-chip技术发现一对双胞胎幼苗之间存在许多基因组差异。4). 然而,来自PHDⅠ型的双生子对I-1的多态性最大,这是一个株高变化不大的群体;同一标记基因型的百分率仅为77.1%。其余93%(15株中的14株)显示> 90%的标记基因型相同。变异位点在整个基因组中分布均匀,在任何一个双胚植株中均未检测到连续的位点块。
讨论
HI过程中双胚籽粒的产生
在一些植物品种中已经报道了双胚核的产生。在玉米中,双胚现象最早于1894年被报道,随后的研究证实了这一点[1,9,10,18,22,26,27].这些研究人员还发现了其他的内核异常,包括单倍体;单倍体双生植株极少发生,正常粒与双胚粒之间差异不明显。因此,研究双胚籽粒的形成机制或调控一直是一个难题。祖先诱导剂系的发现Stock6,这在后代触发了3.23%的单倍体,为获取玉米单倍体进行了新方法[11].近几十年来,由于双单倍体(DH)在玉米育种中的巨大应用潜力,人们开发了许多具有较高HIR的新诱导剂用于DH育种[12,14,28,29].1966年Sarkar和Coe首次描述了HI期间的双胞胎胚胎现象,但是很少有证据表明HIR和TEKR之间的关系[21].我们之前的研究证实了诱导剂授粉的玉米穗中双胚粒高频率的现象[22]但是虽然很难确定效果是否归因于单倍体感应能力。在我们目前的研究中,我们设计了一种实验,以验证使用不同的单倍体诱导剂的大群中的现象。我们计算了Cau5和Cauhoi授粉的17个近交系的平均TEKR,结果表明TEKR与CAU5组合的可能改善。这种效果也发生在DAN360和YE8112之类的某些特定材料中(附加文件2).这种结果是通过Fulbrid ND5598授粉与四个诱导剂Cau5,Cau授予Fluther验证WX.结果表明,HIR与TEKR之间存在较强的相关性。因此,我们得出结论,高HI能力可以显著提高双胎发生的频率。然而,由于TEKR发生的频率较低,我们的结果不足以确定母本之间的确切关系。
双胚粒细胞分类
对被子植物多胚现象的研究主要集中在孪生子苗上,包括孪生子苗的分类和变异分析。在这里,我们扩展了我们之前的观察,研究两个胚胎融合基于玉米胚的特定特性。我们发现87%(206/237)的双胚具有相同的胚轴,包括V型和y型,推测这些双胚主要来源于幼胚的分裂。虽然曾有单倍体-二倍体双胚粒的报道[21],在我们目前或以前的研究中找不到这种双胚内核[22].更重要的是,对各个双胚核的两种细胞倍增性的分析显示,发现了30个单倍体 - 单倍体核,其占所有双胚粒的〜12.6%。频率高于本研究中使用的三条诱导型线的平均HIR(CAU5,〜10%; CAUWX., ~ 5%; 考霍伊~ 2%;). 这些结果表明,与二倍体相比,单倍体幼胚更容易分裂产生双胚粒。
除二倍体双生植株外,双胚籽粒常发生非整倍体,包括n < x < 2n、x > 2n和x < n。根据田间双生植株的表型特征,对这些双生植株进行了PHD分类;大多数双生植物的博士值小于20cm,但仍有一定比例的植物博士值较大。据报道非整倍体影响拟南芥和玉米的生长[30.,31.];实际上,我们观察到双胞胎细菌中的频繁的四倍倍性,这意味着对增长差异的重要贡献。另一方面,当基因分型基于SSR或SNP芯片时,我们没有检测到巨大的基因组差异;因此,可以排除遗传差异。除了遗传因素外,植物生长也受营养供应和与环境的相互作用的影响[32.].在双胚籽粒的发芽阶段,两种细菌竞争有限的营养素,因此我们可以推断出在植物中胚芽发展或植物生长期间对营养成长的竞争导致我们所观察到的双胞胎植物。在我们观察到的237个双胚胎核中,59个胚芽之间的大小变化。细菌之间的差异肯定会导致博士学位。此外,植物激素尤其是3-吲哚乙酸,在调节增长和发展方面发挥重要作用[33.,34.].双生植株多为Y型和V型,有连接部分,可能在双生植株之间的通讯中起重要作用,类似于玉米的分蘖现象[35.].这可能是由于顶端优势抑制了小植物的生长。
不同类型双胞胎胚胎产生的机制
虽然最近的研究表明,编码帕洛汀样磷脂酶的基因的功能丧失触发器HI [23,24,25],其中的机制Stock6-衍生的诱发HI的诱导剂尚未完全阐明。有证据表明花粉发育或受精异常[16].除了单倍体外,高能力的增加可以提高胚胎中止核的频率,胚乳中产内核和异质化核[16,17,18,19,20.],表明,有助于HIR的基因或基因率抗于正常双重施肥或发育过程的早期阶段。观察到Tekr的增加与具有高HIR的诱导者组合也可能归因于异常发育。已经假设两个假设,即单次施肥和染色体消除,以解释HI的机制;有两个假设的证据,例如在单倍体中检测到的染色体片段[36.,37.,38.]和两个不同的精子或精子流动性的差异[39.,40].
我们目前的数据揭示了高频率的单倍体 - 非植物双胚胎核和二倍体 - 非素醇双胚胎核(8是40个双胚胎核中的一种非细胞)。考虑到大多数双胚胎粒是v型和y型和与单个Zygote共享相同的起源,这些单倍体 - 非素醇和二倍体 - 非素倍性核可能衍生自染色体消除的Zygotes;也就是说,如果在胚胎切割之前完成染色体消除,则将种子发生成单倍体双胚胎粒。在幼胚后切割后染色体消除的延续将导致非整倍性。我们的结果提供了新的观点,授粉后可能不会立即发生染色体消除,而是在细胞分裂期间逐渐发生。这与先前的研究一致,染色体消除在授粉后7天内完成[37.].此外,作为胚胎发生的特殊现象,Twin-胚胎显示出繁殖生物学研究的高价值。所有这些证据表明,在体内单倍体诱导期间发现的双胚胎粒细胞给出了了解玉米母体单倍体诱导的新视角。
结论
在这项研究中,我们证明了HIR在HI期间对提高双胞胎胚胎频率的作用。此外,我们对双胚核进行了深入的分类,揭示了年轻胚胎分裂的高频率。此外,观察到高频率的非整倍体。这些非整倍体为我们理解HI后染色体消除过程提供了新的视角。
方法
植物材料
不同母系自交系中双胚籽粒的诱导
为了系统地评价双胚籽粒的频率,对17个玉米优良自交系(附加文件3.),以不同遗传背景(杂种优势群)为母本,与诱导系杂交,获得双胚粒。五组[41.]被指定为Reid Year Dent(Reid),兰卡斯特肯定作物(兰开斯特),P组,唐西平,和LVDA Red Cob组。在这些近交系组中,Yu87-1和QI319来自P组,Longkang11,BY815,JI846,GY923,4F1和MO17来自兰开斯特,DAN360,YE107和LV28来自LVDA Red COB组,ZHENG58,B73,Ye8112,Tie7922和Ye478来自Reid,Jing24来自唐札津。两个诱导物线Cauhoi [36.]和CAU5 [16], hir分别为~ 2%和10%。
用单倍体诱导剂进行手授粉,获得玉米双胚粒,如前所述[22].该实验于2012年7月在中国北京市农业大学(中国农业大学39°56'n,116°20'e)进行。收获的耳朵是风干的。推定的单倍体核可以使用标记物在耳朵上识别新泽西州R1,产生一种紫色糊粉,但无色的盾片。此外,新泽西州R1标记系统还可用于双胚核识别,即,由于粪便上的深紫色色素沉着[42.]双胚核的两个胚芽呈紫色,易于鉴定。同样,可以鉴定出单倍体双胚核。
研究HIR和双胚核频率之间的关系,另外两个诱导线,即CAU2(HIR〜8%)和CAUWX.(由CAU5与糯自交系杂交而成;HIR公司~ 5%),为结实性好的杂交种ND5598授粉。在本研究中,TEKR的计算公式为TEKR(%) = (双胚粒数/果穗总粒数) × 100%. HIR是根据Xu等人计算的[16].
双胚籽粒的观察与分类
我们收集的每一个孪生胚核都有一个编码,然后用ScanMaker i800(德国Microtek)扫描。根据胚中两种胚芽的形态、大小和颜色对其进行了分类。为了清晰地观察胚胎,我们将胚乳在45℃的水中浸泡20-28小时后,小心地从每个籽粒中取出胚乳。然后分离整个胚胎,在体视显微镜下检查并拍照。
双胚植株的田间表现
双胚种子在培养箱中发芽。对双生苗发芽后的形态进行了研究。因为幼苗太弱,不能在户外生长,它们被移植到苗圃,直到4- 5叶阶段。然后,这对双胞胎幼苗被移植到田间。我们关注这些双生植物的农艺性状,特别是株高,以评估个体之间可能的差异。
双胚植株的倍性
用多种方法测定了双胚植株的倍性水平。种子期的色素沉着新泽西州R1在Scutellum上用于推定的单倍体双胚核核鉴定。在该田间的植物中,染色体计数在雄性配子体Meiosis I阶段的预先α或中期进行,其可以确定倍增性。为了进一步确认双植物的倍率,我们使用流式细胞术,其可以基于植物细胞核的DNA含量来区分单倍体,二倍体和非植物单倍体[43.].收集幼叶组织,30 min内用细胞裂解液处理30 min。如Kleiber等所述,提取细胞核,流式细胞术测定DNA含量[44.].对于用流式细胞术定量的所有样品,典型单倍体和二倍体B73的幼叶样品用于对照。根据B73的信号峰和其相应的单倍体样品测定相对核倍性。具有与B73相同峰值的样品是二倍体,并且随着B73单倍体的具有相同峰的样品是单倍体。短倍性的信号峰是那些既不与单倍体也不是单倍体的峰值,也不是二倍体[22]. 在146个成熟的双生子植株中,从PHD较大的双生子植株中采集43个样品,用流式细胞仪检测其倍性水平。这些样本涵盖了生长不良的孪生植物、推测的单倍体和基于其形态特征的二倍体植物。与二倍体相比,单倍体植株较矮,叶片直立狭窄,不育。
双生植物的分子遗传差异
田间多数双生植株具有相似的表型。然而,有一小部分植物差别很大。为了评估双生植株在分子水平上的差异,我们选择了50对PHD不同的双生植株进行SSR分析。采用CTAB法从叶片组织中提取DNA [45.].30个高质量的SSR标记(附加文件4)有清晰的条带,即扫描基因组后使用200个标记。然后我们用3072个SNP标记检测了孪生苗。利用Illumina金门SNP基因分型平台,对三组15个双胚种子的30个个体进行了基因分型[46.,47.].这些分子标记被用来评估双胞胎植株之间的遗传差异。
缩写
- DH:
-
双倍倍增
- 你好:
-
单倍体诱导
- 河流:
-
单倍体诱导率
- 博士:
-
植物高差
- SNP:
-
单核苷酸多态性
- SSR公司:
-
简单序列重复
- TEKR:
-
双胚核率
参考
- 1.
Lakshmanan KK、Ambegaokar KB。多胚性。被子植物胚胎学。柏林:施普林格;1894
- 2.
Vernon DM, Meinke DW。胚性转化双胞胎的多胚胎突变体拟南芥.Dev杂志。1994;165:566 - 73。
- 3.
Vernon DM,Hannon MJ,Le M,Forsthoefel NR。扩大的作用TWN胚胎发生中的1个基因:子叶形态和形态缺陷twn1突变体的拟南芥(十字花科)。[J] . chin J Bot, 2001; 88:570-82。
- 4.
关键词:胚柄,多胚性,val - trna合成酶twn2突变拟南芥.美国国家科学研究院1997;94:7349-55。
- 5。
bbim1是一种参与油菜素内酯信号传导的bHLH蛋白,通过与DORNRÖSCHEN和DORNRÖSCHEN-LIKE的相互作用控制拟南芥胚胎模式。植物学报。2009;69:57-68。
- 6。
Puri A, Basha P, Kumar M, Rajpurohit D, Randhawa G, Kianian S, Rishi A, Dhaliwal H.多胚胎基因(OSPE.)大米。Funct Integr Genomics. 2010; 10:359-66。
- 7。
关键词:多胚插入突变体,多胚发育,多胚插入突变体OSPE.米饭。植物细胞代表2012; 31:1779-87。
- 8。
Schrenk H. Teratological notes。公牛Torrey机器人俱乐部。1894;21:226-7。
- 9.
关键词:玉米,自交系,双胚,培养理论应用,1976;47:197-201。
- 10.
玉米卵裂多胚现象的研究。《植物性繁殖》1992;5:224-6。
- 11.
科伊,呃。单倍体频率高的玉米品系。我是纳特。1959;93:381–2.
- 12.
Röber F, Gordillo G, Geiger H.玉米单倍体的体内诱导——新诱导剂的表现和双单倍体在杂交育种中的意义。Maydica。2005;(3):275。
- 13.
关键词:热带玉米,单倍体,诱导剂,诱导率,单倍体51作物科学。2011;(4):1498 - 506。
- 14。
董旭,徐锡伟,李玲,刘传祥,田小丽,李伟,陈淑娟。玉米高油单倍体诱导剂的标记辅助选择与评价。摩尔繁殖。2014;34(3):1147 - 58。
- 15.
盖革H。加倍单倍体。作者:Bennetzen JL,Hake S,编辑。玉米手册。纽约:斯普林格;2009年。641–657.
- 16。
徐锡伟,李玲,董旭,金文伟,艾mechinger AE,陈淑娟。配子体和合子选择通过体内诱导玉米母体单倍体导致分离畸变。实验机器人,2013;64:1083-96。
- 17。
Dong X,Xu XW,Miao JK,Li L,Zhang DF,Mi XL,Liu CX,Tian XL,Melchinger A,Chen S。精细映射基尔1玉米体内单倍体诱导的影响。中国生物医学工程学报。2013;126(7):1713-20。
- 18。
关键词:玉米,单倍体诱导,染色体随机消除,形态学,细胞,分子生物学植物生物学杂志。2014;1:83-90。
- 19.
刘传祥,李伟,钟勇,董旭,胡洪兴,田晓林,王丽丽,陈斌,陈超,Melchinger AE,陈淑娟。细的映射问题8玉米体内单倍体诱导的影响。中国生物医学工程学报,2015;
- 20.
刘慈、陈碧杰、马英赫、徐旭伟、李伟、东X、田XL、陈C、钟Y、陈M、陈思杰。玉米单倍体诱导中异源受精机制的新认识。大提琴。2017;213(8):174.
- 21.
Sarkar KR, Coe EH。玉米母系单倍体起源的遗传分析。遗传学。1966;54(2):453。
- 22.
李磊,董旭,徐晓伟,刘丽伟,刘传祥,陈世杰。玉米母系单倍体诱导双苗观察。中国农业大学学报。2012;17(5):1-6。
- 23.
刘传祥,李旭,孟DX,钟勇,陈超,董旭,徐锡伟,陈宝平,李伟,李玲,田晓丽,赵慧明,宋文斌,罗浩华,张庆华,赖建军,金文伟,严建军,陈世杰。在ZmPLA1上插入一个4-bp编码的假定磷脂酶A,可以诱导玉米单倍体。摩尔。2017;10(3):520 - 2。
- 24.
kellieher T, Starr D, Richbourg L, Chintamanani S, Delzer B, Nuccio M, Green J, Chen Z, McCuiston J, Wang W, Liebler T, Bullock P, Martin B. MATRILINEAL,一种精子特异性磷脂酶,激活了玉米单倍体诱导。大自然。2017;542(7639):105 - 9。
- 25.
Gilles Lm,Khaled A,Laffaire JB,Chaignon S,Gendrot G,Laplaige J,Berges H,Beygon G,Bayle V,Barret P,Comadran J,Martainant JP,Rogowspy PM,Widiez T.丧失花粉特异性磷脂酶的丧失不喜欢爸爸在玉米中触发血管生殖。Embo J. 2017; 36(6):707-17。
- 26。
玉米花的异常。见:美国植物工业局简报。华盛顿:温特沃斯出版社;1913.
- 27。
玉米及其近缘植物的异常-ⅰ。托里植物俱乐部公报。1921:253-5。
- 28。
关键词:玉米,单倍体,遗传控制,单倍体诱导系中国生物医学工程学报,1988;
- 29。
母本单倍体玉米植株的特性及其在玉米育种中的潜在应用。大提琴。1994;79(1):13–8.
- 30.
亨利•伊姆、迪克斯•英国石油公司、米勒•ES、伯卡特•瓦科•D、科迈•L。拟南芥非整倍体的表型结果。遗传学。2010;186(4):1231–45.
- 31.
伯奇勒。植物和果蝇的非整倍体:基因组不平衡研究的起源。精细胞发育生物学。2013;24(4):315–9.
- 32.
Agren GI,Weih M。不同尺度下的植物化学计量:元素浓度模式比基因型更能反映环境。新植物醇。2012;194(4):944–52.
- 33.
戴维斯PJ。植物激素的性质、发生和功能。植物激素。荷兰2010:1-15施普林格。
- 34.
卢顺芳,杨淑英,陈德庭,邢毅,齐华雅,陈丽娟,余思明。一类新的赤霉素氧化酶控制水稻的半矮化、分蘖和根系发育。植物细胞。2008;20(10):2603 - 18。
- 35.
Doebley J,Stec A,Hubbard L.玉米顶级优势的演变。自然。1997年; 386(6624):485。
- 36.
李莉、徐旭伟、金伟、陈思杰。高油诱导剂CAUHOI诱导玉米单倍体过程中DNA导入的形态学和分子生物学证据。足底。2009;230:367–76.
- 37.
赵旭,徐锡伟,谢海霞,陈淑娟,金文伟。与玉米单倍体诱导剂杂交时的受精和单亲本染色体消除。植物杂志。2013;163:721-31。
- 38。
张泽,邱富子,刘yz,马克,李泽,徐sz。染色体消除和体内单倍体产生玉米菌(Zea mays L.)诱导的6衍生的诱导型诱导。植物细胞代表2008; 27(12):1851-60。
- 39。
Bylich VG,查利克斯克。ZMS系中存在一对不同形态精核的花粉粒可能是其单倍体诱导能力的原因之一。玉米遗传学合作通讯。1996;70:33–33.
- 40
enaleeva nk,tyrnov vs,selivanova lp,Zavalishina a。玉米单倍体诱导的单层施肥与综合体诱导问题。dokl biol sci。1996年; 353(1):225。
- 41.
吴X,李耀,施益,宋益,王泰,黄yb,李玉。利用高通量SNP基因分型精英玉米种质的精细遗传表征。Al Appl Genet。2014; 127(3):621-31。
- 42.
一种检测玉米单倍体的胚胎标记。作物科学。1966;6:213-5。
- 43.
舒特B,雷诺MM,博斯曼FT,布莱汉姆GH。流式细胞术测定石蜡包埋组织细胞核DNA倍体水平。流式细胞术。1985;6(1):26–30.
- 44.
杨晓东,李建平,张建平,等。温带和热带玉米单倍体育性的研究进展。作物科学。2012;52:623。
- 45.
穆雷MG,汤普森WF。高分子量植物DNA的快速分离。核酸研究1980;8:4321-6。
- 46.
李克,颜建斌,李建生,杨旭。两个玉米重组自交系群体果皮贯入仪抗性的遗传结构。BMC植物生物学。2014;14:152.
- 47.
孟YJ,李杰,刘俊,胡hx,李文,刘万,陈SJ。DH及其在玉米中茎秆性状的倍性效应和遗传建筑探索。BMC植物BIOL。2016; 16:50。
致谢
我们感谢Liang Li博士,为这项研究提供了有用的建议和评论。我们还感谢Paul Fourounjian博士帮助语言修订本手稿。
同意出版
不适用。
资金
国家重点研发计划“玉米杂种优势利用技术与强杂种优势培育”项目(no . 2016YFD0101200); CS教授“现代玉米产业技术体系”项目(no . CARS-02-04)。关键词:玉米;
数据和材料的可用性
在当前研究中生成和分析的数据集可根据合理要求从通讯作者处获得。
作者信息
从属关系
贡献
CS设计研究并协助撰写稿件。LL进行实验,分析数据并撰写稿件。LW参与实验,分析数据,撰写稿件。LC进行了部分数据分析,并协助撰写稿件。LW和LC对手稿进行了批判性的修改。CB、TX、CC和LJ进行了现场实验。所有作者阅读并批准最终稿件。
相应的作者
道德声明
伦理批准并同意参与
不适用。
相互竞争的利益
提交人声明他们没有竞争利益。
出版商的注意
《自然》杂志对已出版的地图和附属机构的管辖权主张保持中立。
权利和权限
开放获取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/),允许在任何介质中不受限制地使用、分发和复制,前提是您给予原始作者和来源适当的信任,提供到知识共享许可证的链接,并说明是否进行了更改。知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用本文
刘磊,李伟,刘畅。等。单倍体诱导可增加玉米双胚和异常受精的发生频率。BMC植物BIOL.18,313(2018)。https://doi.org/10.1186/s12870-018-1422-2
收到了:
接受:
发表:
关键词
- Twin-embryo
- 体内单倍体诱导
- 单倍体诱导率
- 双胚核率
- 流式细胞术