抽象的
背景
在甜橙、柑桔和柠檬等主要柑橘品种中,珠心组织的体细胞胚胎发生被广泛认为是诱导多胚现象的重要途径。这种无融合生殖的能力在利用杂交种子的农业生产系统中具有吸引力,许多研究已经阐明了各种类型的无融合生殖的分子机制。为了鉴定柑橘体细胞胚胎发生的基因,我们使用了包含柑橘多胚位点预测基因的自定义寡核苷酸芯片,比较了单胚品种和多胚品种在生殖组织中的表达谱。全部长度CitRKD1将其被鉴定为负责柑橘体细胞胚胎发生的候选基因,从Satsuma普通话中分离出来,通过反义过度表达使用转基因'Hamlin'甜橙进行研究。
结果
候选基因CitRKD1主要转录在聚氧化铝品种的生殖组织中,是含有植物RWP-RK域的蛋白质的成员。CitRKD1由两个等位基因组成(Citrkd1-mg1.和citrkd1-mg2.在控制胚胎类型(单/多胚胎)的多胚胎位点上,在结构上分为两种类型,在上游区域有或没有微小的反转录重复转座元件(MITE)插入。citrkd1-mg2.花和幼果中以螨插入为主,珠心细胞发生体细胞胚发生。的损失CitRKD1在转基因甜橙和转基因T1确认植物源于通过DNA诊断通过自授予自授粉产生的Zygotic胚胎。95柑橘的基因分型PCR分析传统和繁殖品种揭示了CitRKD1多胚等位基因占优势,具有多胚等位基因的主要柑橘品种产生多胚种子。
结论
CitRKD1多胚位点在调控柑橘体细胞胚发生中起主要作用。CitRKD1由多个等位基因组成,这些等位基因分为两种类型,一种是上游区域有螨插入的多胚等位基因,另一种是没有螨插入的单胚等位基因。CitRKD1在多胚品种的生殖组织中有多胚等位基因。螨的插入在上游区域CitRKD1可能参与调节转录CitRKD1.
背景
柑橘种类核心组织中的体细胞胚胎发生是一种缺氧系统和遗传均匀的克隆,其具有与母体植物相同的基因型,尽管它们高度杂合子基因组,但仍然可以通过播种种子来制备[16.].Apomixis的这种能力在使用杂种种子的农业生产系统中具有吸引力,许多研究人员研究了各种透氧的分子机制[20.].在各种类型的Apomixis中,柑橘apomixis,其中在Nucellar组织中的体细胞胚胎发育,被归类为孢子素蚜虫[37].主要柑橘品种,如萨摩普通话(柑橘unshiuMarc。),甜橙(c . sinensis(L.)Osbeck),葡萄柚(C. Paradisi.Macfad。),庞肯普通话(c .试一般来说,除了种子中的合子胚胎外,还会发育一个或多个与母树基因相同的体细胞胚胎。这种在同一个子房组织中产生多个体细胞胚和一个合子胚的能力在柑橘中被称为多胚性。在柑橘育种中,由于体细胞胚胎优先于合子胚胎生长,多胚现象经常阻碍从有性杂交中获得合子胚胎的努力。因此,在杂交育种中一般选择单胚品种作为种子亲本,这减少了有效的配种组合,限制了育种的进行。而多胚法在砧木繁殖中是有用的,尽管柑橘属的基因组高度杂合,但单靠播种可以制备遗传一致的砧木。
到目前为止,已经进行了各种各样的研究,以研究柑橘不定胚发生的分子机制,以及其他类型的无融合生殖[20.].根据对不同杂交群体分离的观察,多胚现象主要遗传到后代[15.].可以想到,在体细胞胚胎发生中涉及单一或少数基因,并且已经开发了与聚氧化铝源位(Mono / Polymonyony)连接的几个分子标记进行了研制[11.,17.,29.].在我们之前的研究中[29.,30.],一个主要的多胚位点位于普通话标准遗传图谱(AGI map)连锁群1上[36.柑橘普通话的脚手架1(C. Clementina基因组序列[42].随后对该多胚位点进行了分子标记,并构建了该多胚位点的单倍型特异性细菌人工染色体(BAC) contigs。随后,对该多胚位点的基因组区域进行了测序,并从基因组序列中预测了70个开放阅读框[28.].已经使用基于转录的方法来探索与柑橘体细胞胚胎发生相关的基因。通过减去抑制杂交(SSH)和微阵列分析已经鉴定了单次杂交或聚氧化铝品种中具有特定转录谱的各种基因[10.,22.,27.].在这些研究中,热冲击相关蛋白质(HSP)主要在聚氧化铝品种基因以及WRKY,WD40和丝氨酸羧肽酶(SCP)基因之间表达。
最近,下一代序列(NGS)技术允许对靶组织和生物的全基因组和转录物进行快速和全面的测序分析。使用NGS技术,探讨了涉及体细胞胚胎发生的调节基因,提出了MIRN23-5P-CS9G06920,一种微型RNA(miRNA,一种典型长度为20-24个核苷酸的非编码RNA)在调节体细胞胚胎发生方面具有重要作用[23.].据报道Citrwp.编码含RWP-RK域的蛋白质[35.]调节体细胞胚胎发生,因为仅在其中插入微型倒置重复转换元素(螨虫)Citrwp.基于ngs的柑橘多胚品种比较基因组序列分析及其转录水平Citrwp.它们的胚珠中胚珠的含量高于单胚品种[41].在217个分离群体中,螨与多/单胚型共分离。在拟南芥,含有RWP-RK结构域的RKD基因已经表征为蛋细胞相关基因表达计划的重要调节因子[35.].然而,这些候选基因通过转录组和NGS分析的功能验证尚待完成。
在这里,鉴定候选RKD基因(CitRKD1)负责柑橘体细胞胚胎发生,一种定制的寡核苷酸芯片设计使用新预测的orf从一个380 kbp的多胚胎位点草案序列[28.,并用于比较单胚和多胚品种生殖组织的转录谱。全部长度CitRKD1以转基因Hamlin甜橙为材料,通过反义过表达对其分子功能进行了研究。经检验的柑橘品种中有两种CitRKD1聚氧化铝基因座的等位基因。在上游区域中具有螨虫插入的等位基因在生殖组织中高度表达,并且可能参与体细胞胚胎发生。我们还开发了一种使用保守的序列来开发了一种鉴别DNA标记的聚/单声晶CitRKD1有助于增加柑橘育种遗传多样性的等位基因。
结果
微阵列分析以确定调节柑橘体细胞胚胎发生的候选基因
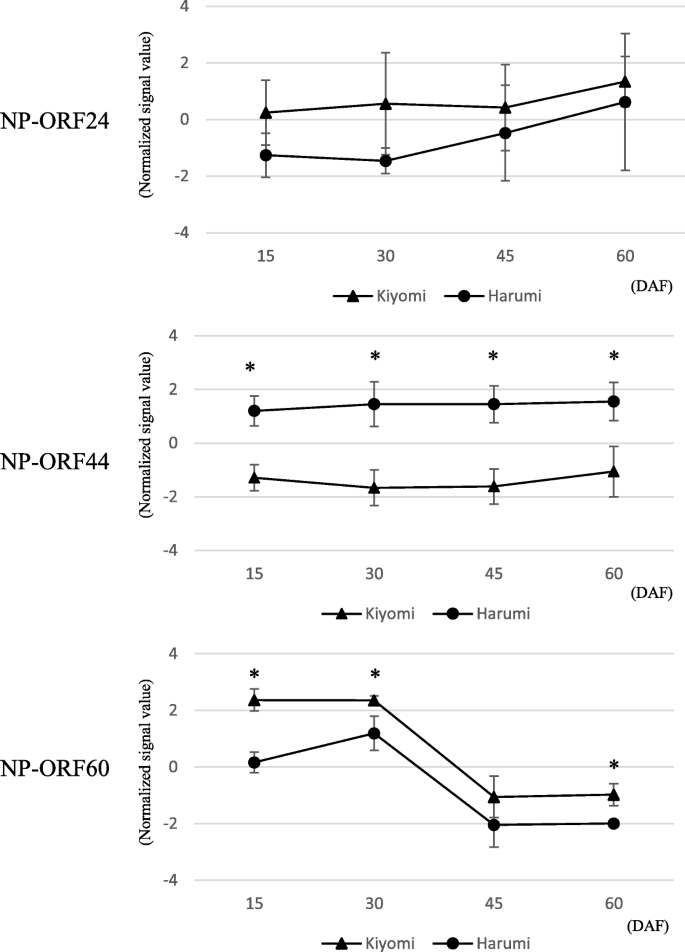
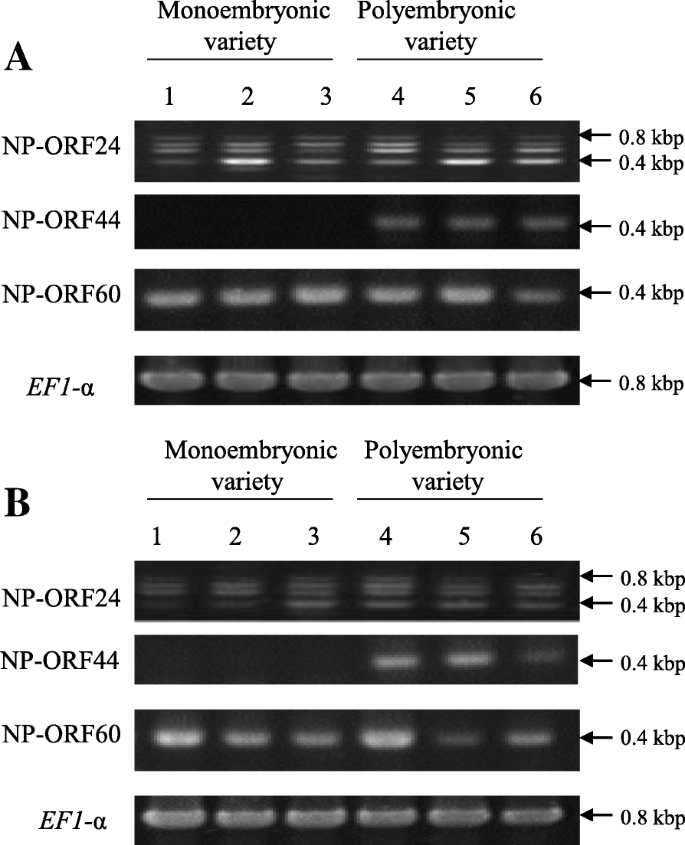
为了鉴定聚氧化铝基因座中调节柑橘体细胞胚胎发生的主要基因,使用序列设计了一种定制的寡核酸DNA微阵列。总共有391个探针,包括每个新预测的ORF的多个探针(命名为NP-ORF,以区分他们从先前报告的ORF用于聚氧化铝基因座[28.])和29,148用于将柑橘普通话基因组的mRNA基因组探针安装在定制寡核酸DNA微阵列上,其中50个基因与柑橘基因组序列的聚氧化铝基因座和mRNA基因座之间重叠。这种自定义寡核酸DNA微阵列用于比较在'Kiyomi'的开花(DAF)之后的15,30,45和60天的年轻整个水果中的基因表达模式(C. unshiu.马克.×C. sinensis.l. osbeck)作为单一形式品种和'harumi'('kiyomi'×C. Reticulata.Blanco)作为聚氧化铝品种。在严格的过滤条件下,聚氧化铝基因座中的391个探针中的12个概率在整个实验期间在“Kiyomi”和“Harumi”之间的显着表达变化大于2倍。这些探针衍生自NP-ORF24(3探针),无-ORF44(6探针)和NP-ORF60(3探针)。这些候选基因的表达模式如图2所示。1,使用相应探测的平均表达式值。NP-ORF24在柑橘基因组序列的scaffold 5中主要与ciclev10003992m同源,与多胚位点不同。它与柑橘基因组的其他不同位点有部分同源性,可能是多基因家族的成员。NP-ORF24在“Kiyomi”中的表达值有高于“晴美”的趋势,但在整个实验中标准差非常大。NP-ORF44与Ciclev10010497m同源,被注释为RWP-RK结构域蛋白。NP-ORF44在‘晴美’中的表达量显著高于‘清美’。NP-ORF60与ciclev10009286m同源,被注释为myb样dna结合蛋白。NP-ORF60的表达量在30 DAF前一直保持较高水平,然后在45 DAF时下降到最低水平,在两个品种中平行表达。采用逆转录聚合酶链反应(RT-PCR)技术,从3个单胚品种(‘Kiyomi’,clementine mandarin, matto buntan pumelo (植物L. Osbeck))和三种聚镁丙烯醛品种('harumi',satsuma普通话,ponkan普通话)(图。2).只有NP-ORF44才显示出明显的差异。对于NP-ORF24,观察到各种尺寸的PCR片段为400bp至800bp,但PCR片段预期为单一和400bp。这种表达式模式与爆炸搜索结果一致,表明NP-ORF24可能在柑橘中的各种基因座上有多个副鸟。根据这些结果,选择NP-ORF44作为该基因的候选物,该基因调节聚氧化铝基因座区79个NP-ORF中的体细胞胚胎发生。
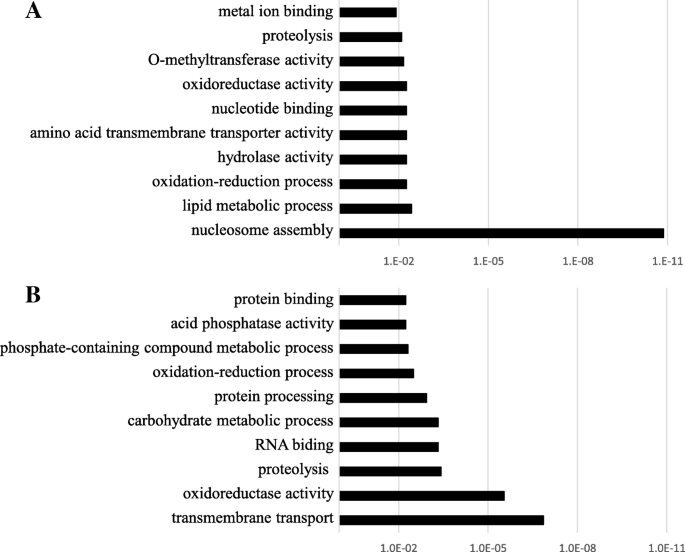
在柑橘基因组mRNA序列生成的29148个探针中,包括NP-ORF44 (Ciclev10010497m)在内的356个基因在整个实验期间“Kiyomi”和“Harumi”之间的表达变化超过2倍(Additional file)1:表S1和附加文件2:表S2)。与清美相比,晴美生殖组织中85个基因高表达,270个基因弱表达。其中有几个基因在过去的报道中被普遍确认,可能与体细胞胚胎发生有关,如udp -糖基转移酶超家族蛋白、锚蛋白重复家族蛋白、热休克蛋白和蛋白激酶[22.,23.,27.].这些基因被报道参与氧化应激反应和细胞内胼胝质沉积。采用GO项富集分析来解释其生物学功能(图。3.).核心组装是聚钼繁殖组织中最富集的术语,其次是脂质代谢过程,氧化还原过程和水解酶活性。相反,跨膜输送,氧化还原酶活性,蛋白水解和RNA结合过程较小。虽然这些术语中的一些可能反映“Harumi”和'Kiyomi'之间的基因组成分的差异,但该结果表明聚氧化铝生殖组织的进展比单烯丙基繁殖组织更具活性细胞增殖。事实上,体细胞胚的生长通常比Zygotic胚胎更加活跃。在这两个列表中发现氧化还原相关的GO术语,但弱表达基因中的频率相对较高。在棉花(gossypium hirsutumL.),诱导氧化应激促进体细胞胚胎发生[9].在开花之前,在早期芽阶段,氧化还原相关的GO术语非常富集[22.,23.].
CitRKD1的cDNA和基因组克隆的分离及序列分析
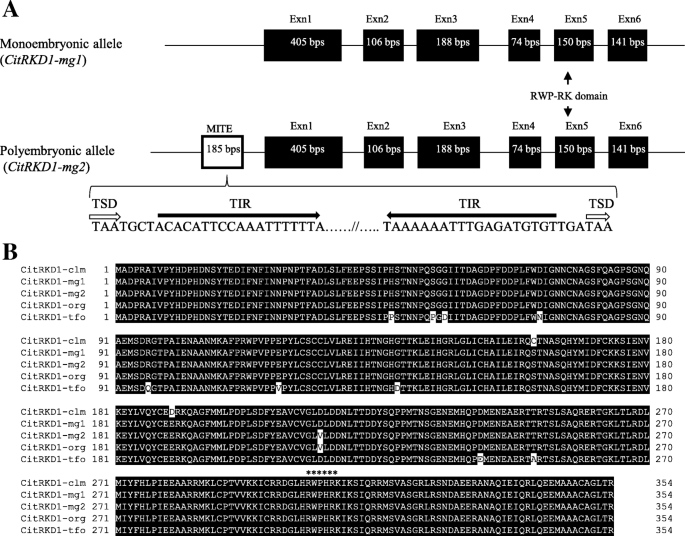
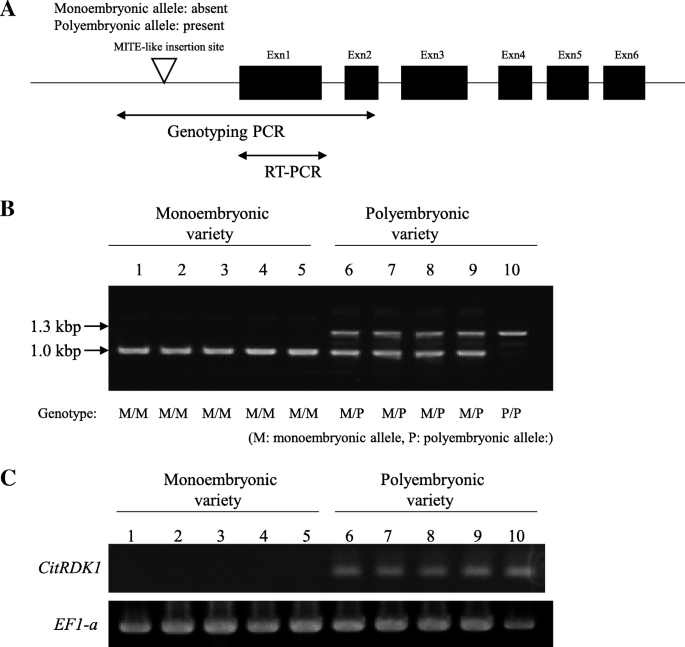
对应于NP-ORF44的全长cDNA和基因组克隆从SATSUMA普通话中分离,其特征在于它们的基因组结构(图。4A).两个独立的rkd同源物,命名Citrkd1-mg1.和citrkd1-mg2.,每个基因编码1065 bp的ORF,编码354个氨基酸,分子量为86.8 kDa, pI为4.2。orf之间有六个核苷酸的差异,但大多数是同义突变,只有一个非同义突变。其基因组克隆有6个外显子和5个内含子,在基因组的上游区域插入了一个219bp的序列,其中包括一个185bp推定的MITE序列citrkd1-mg2..螨虫具有典型的结构,具有目标站点复制(TSD)和端子插入重复(TIR)。插入侧翼为3bp tsd(taa),元件的端部具有19bp tsd(acacattccaatttttttta)。BLAST分析显示,这些基因对甜橙(橙子1.1g041600m)的RKD基因高度同源,柑橘普通话(CICLEV10010497M)和Trifoliate橙(枳壳trifoliataRAF。)(ANH22496)在氨基酸序列水平上具有超过97.5%的同一性。这些柑橘RKD基因被命名为CitRKD1以及甜橙的RKD基因(Citrkd1-org.)、柑橘(CitRKD1-clm)和Trifoliate橙色(CitRKD1-tfo)被认为是等位基因CitRKD1.氨基酸序列CiRKD1-mg1和citrkd1-mg2.与其他柑橘一致CitRKD1等位基因(无花果。4B.).它们推导的氨基酸序列包含羧基终端区域中的典型RWP-RK结构域。载体含有RWP-RK域的家庭成员最近被描述为蛋细胞相关基因表达计划的重要调节因素[35.].RWP-RK结构域由基本区域,螺旋区域和环路组成,并且在柑橘类物种中围绕这些区域周围的氨基酸序列很好地保守。因为柑橘的氨基酸序列CitRKD1等位基因高度保守,预计它们的蛋白质功能几乎相同。
基因组的结构CitRKD1等位基因(CitRKD1-MG1.和citrkd1-mg2.)从Satsuma普通话中孤立(一个)及氨基酸序列比对(b) 的CitRKD1橙色等位基因(Citrkd1-org., orange1.1g041600m), clementine mandarin(橘子)CitRKD1-clm,ciclev10010497m)和trifoliate橙色(CitRKD1-tfo,ANH22496)与Satsuma普通话的那些。包括典型目标站点复制(TIR端子插入的重复(TIR)结构的微型倒置重复转换元件(螨虫)被发现在上游区域中Citrkd1-mg2。星号表示植物RKD基因中保守的RWP-RK结构域
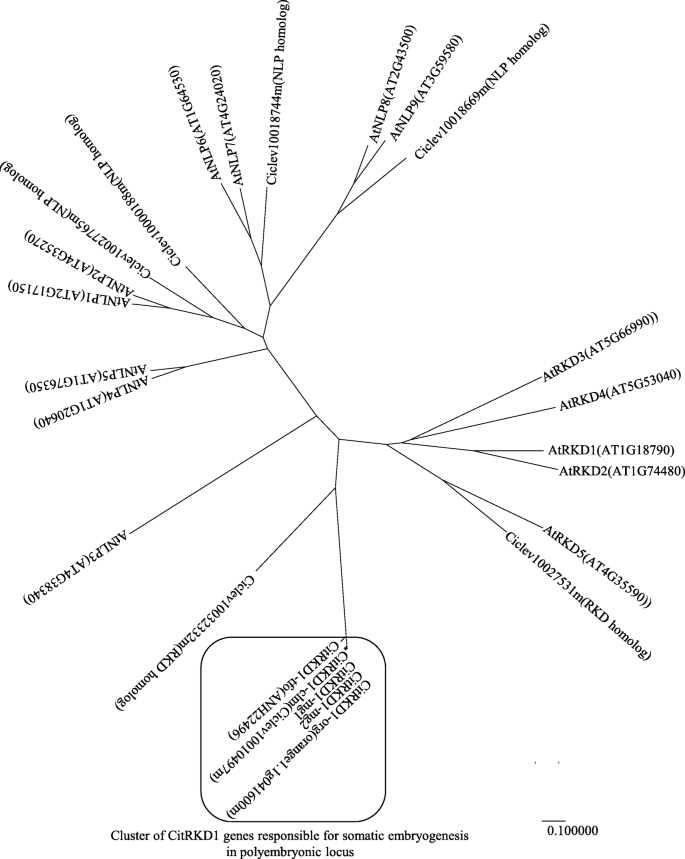
利用其氨基酸序列进行邻域系统发育树分析CitRKD1结果表明,柑橘和柑橘的NLP基因和RKD基因与柑橘的NLP基因和RKD基因有显著性差异拟南芥(图。5).柑橘基因组中有7个含有RWP-RK结构域的蛋白质。支架1中的Ciclev10010497m、支架4中的Ciclev10032332m、支架7中的Ciclev10027531m在结构上属于RKD基因家族。的柑橘CitRKD1等位基因在支架1中与CICLEV10010497M聚集,其对应于控制胚胎类型的聚氧化铝基因座,这意味着CitRKD1在该轨迹处包含多个等位基因。因为这CitRKD1等位基因更紧密地聚集在一起拟南芥RKD基因比拟南芥NLP的基因,CitRKD1被认为是RKD家族的一员,应该在调控体细胞胚胎发生方面发挥主要作用。
RT-PCR的苜蓿普通话各种组织中CITRKD1的表达分析
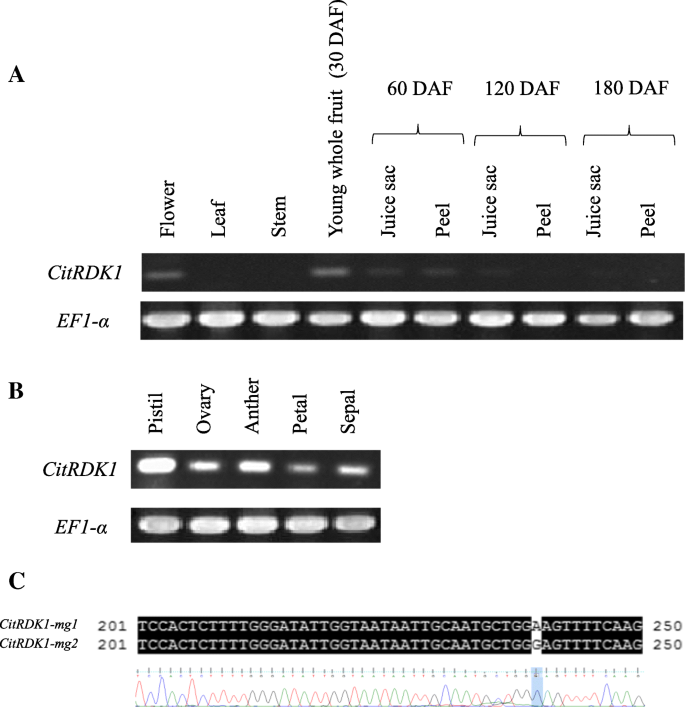
进行RT-PCR以研究表达模式CitRKD1在蜜橘的各种组织中。CitRKD1在30 DAF的花序和年轻整个果实的花中检测到转录物;此后,转录水平降低朝向60dAf(图。6A).在花糖器官在花序器中,CitRKD1在包括雌蕊,卵巢,花药,花瓣和萼片的所有检查组织中检测到转录物(图。6B.).相反,在叶和茎的营养组织或成熟果实中没有检测到转录本。这种表达模式可能与种子的体细胞胚发育有关,其中原基细胞的形成和初始球形胚的形成分别发生在花蕾期和60 DAF左右[18.,19.].
Satsuma普通话有两位等位基因(Citrkd1-mg1.和citrkd1-mg2.) 为了CitRKD1,但常规的RT-PCR不能澄清所获得的PCR片段是否来自任何一种或两者。PCR片段的直接测序分析表明转录物被扩增citrkd1-mg2.基于来自编码区域的起始位置的第240核苷酸的SNP(A或G)(图。6C).转录citrkd1-mg2.在上游区域插入螨可能负责体细胞胚胎发生。
在反义方向上用CITRKD1-MG2转换转基因甜橙色的生产
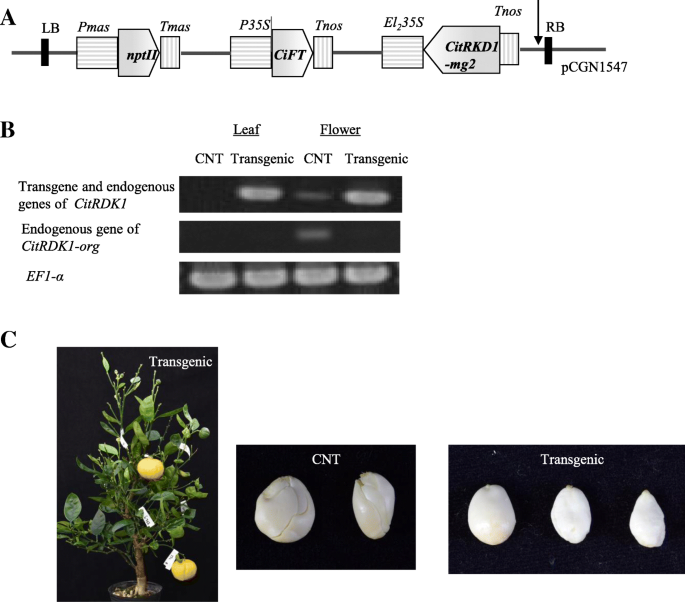
确定…的功能CitRKD1的编码区域citrkd1-mg2.在反义方向上插入到赠送共表达载体(图。7A)[7].“哈姆林”甜蜜的橘子在自然界中有聚玻璃晶种子,预计转基因的'哈林'甜橙不会产生聚镁丙烯酸种子.从'Hamlin'甜橙色幼苗共有1274个时静脉段农杆菌属携带赠送共表达载体构建体,其通常足够的数量以获得多种独立的转基因。最终,只能回收一个独立的转基因系,可能是由于再生和生长差,随后在温室中生长。通过PCR分析研究了转基因进入'Hamlin'甜橙,并确认所获得的转基因系携带载体构建体。进行Southern印迹分析以确定转基因系中转基因的拷贝数,并显示出它具有单一副本(数据未显示)。RT-PCR分析显示,转基因的转基因在转基因系中的叶子和花中高度积聚(图。7B.).在对照中,哈姆林甜橙,内源性甜橙的转录本CitRKD1等位基因(Citrkd1-org.)在叶片中未检测到,而在花中积累。rt - pcr使用Citrkd1-org.特异性引物揭示了内源性的转录水平Citrkd1-org.通过转基因的作用,在转基因甜橙中的检测水平下减少。1.5年后农杆菌属感染后,形态正常的花开花,花粉可育,但坐果失败。转基因甜橙侵染3年后成功结果,180 DAF收获自花授粉成熟果实。
通过反义过表达丧失CITRKD1功能导致在转基因甜橙中产生聚氧二氧化种子
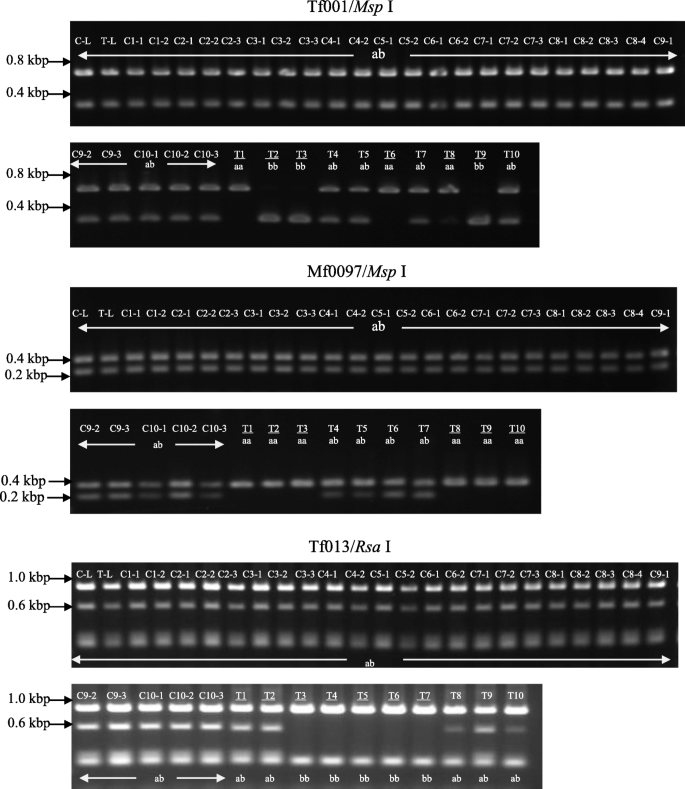
从收获的转基因水果的种子中除去种子涂层,随后拍摄转基因和对照'Hamlin'甜橙色种子(图。7C.).在转基因甜橙中,大部分种子表面光滑,少数种子表面略粗糙。相比之下,所有的对照“哈姆林”甜橙种子一眼就可以识别为多胚种子。在对照甜橙中,2-4个独立T1每个种子和27个独立的T1植物从盆中的10种种子生长。相反,10个独立的t1从10种转基因甜橙的10种种子生长植物。裂解扩增的多态序列(帽)标记分析进行调查T1植物从自授粉的子宫胚胎或体细胞胚胎中发芽。在AGI地图上的五个不同联动组上的五个帽标记[36.],在甜橙中表现出杂合子基因型,用于T1植物。所有T.15个CAPS标记与对照甜橙和转基因母树的杂合子基因型相同。相比之下,所有的T1从转基因甜橙色种子中发芽的植物对母树(A / A或B / B)产生了不同的基因型,这对于五个帽标记物中的任何一种都会发生自授粉。最小三个帽标记(TF0001 /MSP.我,Mf0097 /德我,TF0013 /Rsai)可以遗传地区分所有转基因T1来自母树的植物(图。8).这证实了失去了CitRKD1反义过度表达的功能导致转基因甜橙无法产生多胚种子。这一结果提供了强有力的遗传学证据CitRKD1在调节柑橘体细胞胚胎发生方面发挥重要作用。
上游区域螨虫插入与Citrkd1等位基因转录之间的关联分析
两者CitRKD1Satsuma普通话的等位基因,仅针对上游区域中的螨虫插入的等位基因仅观察到转录。了解上游区域中的螨虫插入之间的关联和转录cirkd1.等位基因,进行暂定基因分型PCR测定以扩增螨插位点周围的基因组区域(图。9A).5个单胚品种通常有一个大约1.0 kbp的单基因组PCR片段,而5个多胚品种通常有一个1.3 kbp的基因组PCR片段,有或没有1.0 kbp片段(图1)。9B.).1.0kbp基因组PCR片段衍生自CitRKD1没有螨虫插入,1.3 kBp基因组PCR片段来自CitRKD1用螨虫插入。单缩醛品种具有纯合基因型CitRKD1没有螨虫插入的等位基因,而聚氧化铝品种含有杂合学基因型,并且没有螨虫插入,或具有螨虫的纯合基因型。RT-PCR分析显示,转录物仅存在于聚氧化铝变异的生殖组织中(图。9C.).从基因组DNA和cDNA中扩增的PCR片段的序列分析表明,转录本是由插入螨的等位基因生成的(数据未显示)。因此,CitRKD1没有螨虫插入的等位基因可以被指定单次镁合成型等位基因CitRKD1具有螨插入位点的等位基因为多胚等位基因。考虑到CitRKD1转录产物仅在具有多胚等位基因的多胚品种中观察到,可以想象,在上游区域的MITE插入可能会影响多胚品种的转录水平CitRKD1.
启动子结构与转录之间的联系citrdk1.在10个代表性的柑橘品种。插图(一个)表明PCR扩增区域citrdk1.基因分型PCR (b)和RT-PCR(c).使用DAF30的年轻整个果实进行RT-PCR。基因型CitRKD1等位基因通过M(单脲烯类等位基因等位基因)和P(聚氧化铝等位基因)的组合显示。1:clementine mandarin, 2: ‘Kiyomi’, 3: Mato buntan pumelo, 4: hyuga-natsu, 5: ‘Nishinokaori’ tangor, 6: satsuma mandarin, 7: ‘Harumi’, 8: ‘Valencia’ sweet orange, 9: ponkan mandarin, 10: ‘Saga’ mandarin
95种传统和繁殖品种中Citrkd1和胚胎类型等位基因基因型之间的一致性
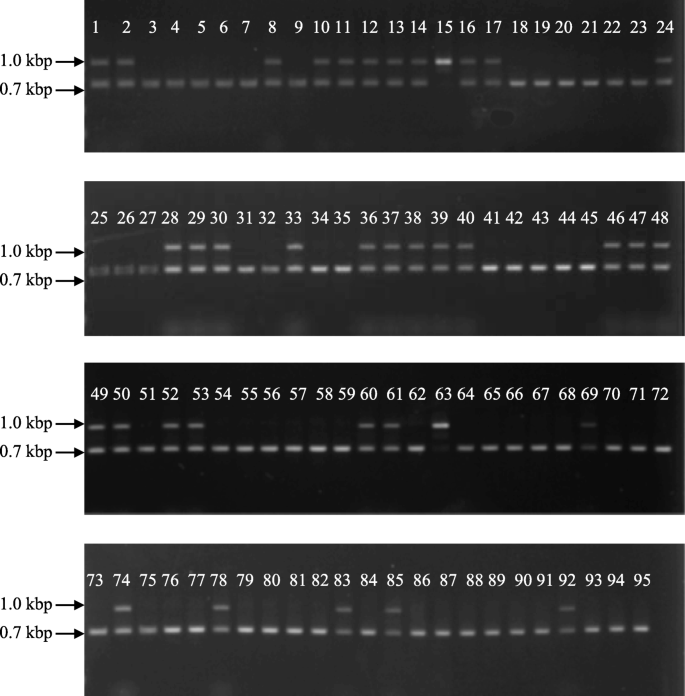
来确认两者之间的一致性CitRKD1等位基因基因型和胚胎表型,对日本育种计划的95种传统和繁殖品种的基因型进行了螨虫插入等位基因。使用保守的序列来新设计一对引物CitRKD1日本育种计划14个祖先品种等位基因(表1)[14.].在新引物的等位基因分型PCR中,约0.7和1.0 kbp片段分别对应于单胚等位基因(M)和多胚等位基因(P)(图。10.).在14个祖传品种中,邓肯葡萄柚、丹西橘子(C. Tangerina长的矮。甜橙、蜜橘、椪柑、地中海柑(c . deliciosa十。),国王普通话(C. nobilis.lour。)和'murcott'显示大约0.7和1.0kbp碎片,表明m / p基因型,而克莱门汀普通话,'mukaku-kishu'(C. Kinokuni.长的矮。田中),马托buntan pumelo, hassaku (C. Hassaku.长的矮。前田纳卡),Hyuga-Natsu(C. Tamurana.长的矮。田中前)和iyo-kan (C. IYO.长的矮。extanaka)具有约0.7kbp的单个片段,表明m / m基因型。基于等位基因基因分型PCR的片段模式,等位基因基因分型CitRKD1为剩余的81个品种进行。52个品种的基因型为m / m,27种谱系为m / p。只有“Seminole”和'Saga'普通话有P / P基因型,在等位基因基因分型PCR中具有约1.0kbp的单个片段。95个品种的胚胎类型与其等位基因基因型完全一致,具有M / M品种,具有单次杂种种子和具有聚氧化胺种子的M / P或P / P个品种。这种等位基因基因型和胚胎类型信息总结在表中1.
进行父母后代三重组分析以验证父母品种遗传的等位基因组合。大多数母体品种的等位基因基因型为m / m或m / p,因此它们的后代基因型应为m / m或m / p但不是p / p。在78个父母后代组合中,DNA诊断证实了父母治疗[31.,在父子关系中没有观察到差异。‘Seminole’和‘Saga’的多胚等位基因遗传自双亲的多胚等位基因,具有M/P基因型。这些结果证实了螨插入与多胚种子发育相关,且多胚等位基因相对于单胚等位基因占优势。
讨论
在目前的研究中,我们报道了分离和功能特征CitRKD1,具有RWP-RK结构域,可能参与柑橘Nucellar组织中的体细胞胚胎发生。CitRKD1(对应于聚钼基因座控制胚胎类型的NP-ORF44对应于NP-ORF44,通过各种分析基因表达,基因组结构和使用转基因甜橙的功能丧失来调节Nucellar组织中的体细胞胚胎发生。植物特异性的RWP-RK系列转录因子是文学分为两个主要的亚壳:氮样蛋白(NLPS),其是N信号的关键调节剂,并且参与结节器官,以及参与蛋细胞规格的RKD蛋白质和差异化[5].大多数RKD基因主要在植物生殖组织中表达,被认为通过重编程珠心细胞来调节卵细胞增殖。AtRKD5全部具有广泛的表达方式拟南芥包括营养器官在内的组织,并且在植物生命周期中可能具有基本功能,而不是在蛋细胞形成中的作用[21.,34.].系统发育分析(图。5),表明与体细胞胚胎发生有关的RKD基因可能在功能上发生了分化拟南芥RKD基因来源于双子叶植物的共同祖先基因。CitRKD1缺少RKD(A)亚家族结构的基序12,但在RWP-RK结构域周围有基序1和2 [5].因此,预期CITRKD1通过重编程核细胞来调节卵细胞增殖时具有类似的蛋白质功能。
丧失的效果CitRKD1通过通过反义过度表达使用转基因甜橙进行体细胞胚胎发生的功能,导致体细胞胚胎发生的破坏。虽然本研究只生成了一系列独立的转基因甜橙,但该结果提供了重要的遗传证据CitRKD1在聚氧化铝基因座中参与体细胞胚胎发生,转录CitRKD1是在珠心组织中产生多胚所必需的。目前,由于转基因多年生果树的幼果期较长,对其生殖器官性状的评价仍存在一定困难。此外,转基因株系成功率低的一个可能原因可能是转基因的有害效应。在拟南芥,变种人AtRKD1和AtRKD2卵细胞增殖相关基因在孢子体和配子体组织中均未表现出明显的缺陷atrkd.基因家族,但异位表达AtRKD1和AtRKD2引起植物生长的严重扭曲,包括异常组织增殖[21.].此外,Atrkd4功能突变体的丧失表现出受损的受损的子宫细胞伸长和随后的细胞分裂图案化[40].在Marchantia polymorpha,MPRKD.,它与atrkd.在没有受精的情况下,通过阻止孤雌生殖来保持卵细胞沉默,但异位表达MPRKD.在拟南芥没有产生任何明显的表型[34.].考虑到RDK家族基因与其他RDK家族基因完美地与胚胎发生过程中的下游相关基因亲密地与其他RDK系列基因交织在一起,因此可能失去CitRKD1功能可能对甜橙的再生有有害影响。事实上,在柑橘中获得再生植物的可行性取决于母体基因型,单次杂交品种倾向于体内和体外较低的胚胎源性能力,而不是聚氧化铝品种[4].
在柑橘中,多等位基因CitRKD1具有高序列同源物位于聚氧化铝基因座控制胚胎型(Poly / Monoembryony)。这些等位基因在结构上分类为聚镁二烯丙基等位基因,其中螨虫和单次杂交等位基因没有它。CitRKD1仅在聚氧化铝品种的生殖组织中检测到转录物,具有聚氧化铝等位基因。因此,通过影响转录,上游区域中的螨虫插入可能作为调节器。据报道,在偏析人口和代表品种中,在上游区域中的螨虫在上游区域中的插入与聚/单次杂交表型进行共聚[41].MITE是一类DNA转座子,由两侧有小的直接重复序列的TIRs组成[8].螨通常插入植物基因的启动子、非翻译区、内含子或编码区,在调控基因表达和基因组进化中发挥重要作用。插入接近基因的螨对转录水平的影响各不相同,例如,在水稻中,一些螨插入增加表达,一些螨插入减少表达,还有一些螨完全不影响表达(栽培稻)[24.].有许多报道中,基因的上游区域中的螨虫插入增强转录并导致新的表型,例如Hordeum Vulgare.[38),高粱双色[26.].这独联体- 上游区域中的注释元素Citrkd1-mg1.和citrkd1-mg2.使用地点数据库进行比较(https://sogo.dna.affrc.go.jp/cgi-bin/sogo.cgi?lang=en& pj=640&ack = page&page=newplace)(数据未显示)。各种各样的独联体- 发现诸如MYB识别站点的注释元素拟南芥RD22(MyB2Consensusat)[1, BELL同源结构域转录因子(BIHD1OS)的结合位点[25.],铜响应元素(Curecorecr)[33.]和光诱导的图案(Sorlip1)[12.]在两个上游地区都很常见。同时,几独联体-特定于citrkd1-mg2.被发现如a独联体-Regulatoratoratoratoratoratoratoratory元素,用于L1层特异性基因表达(Sorlip1AT9)[2]和糖反应元件(SRE) [39].这些独联体-调控元件不足以解释的广泛表达谱CitRKD1在聚氧化铝品种的生殖组织中。考虑到AtRKD1和AtRKD2在蛋细胞中暂时而优先表达拟南芥,可以想象,螨虫插入可能改变胚胎发生中的先天时间和组织特异性表达谱,导致各种生殖组织中的广泛表达,从开花到水果发育早期的延长基因表达。
DNA标记以检测在上游区域中的螨虫插入CitRKD1是利用日本柑橘育种计划中14个祖先品种的保守序列新开发的。该DNA标记被命名为P/M标记,可应用于柑桔、甜橙、柚子及其杂交种。利用P/M标记对95个品种和育种家系的等位基因型进行了评价,结果表明,这些品种的胚胎表型和亲代关系中的等位基因组合完全匹配。这些结果与之前的报道一致,柑橘多胚胎是由单一显性基因调控的[15.,32.].柑桔多胚现象使受精卵难以获得,是扩大遗传多样性的限制因素之一。该装置可广泛应用于柑桔品种的选育,有助于提高柑桔杂交育种的亲本组合数量。
结论
本研究提供了聚氧化铝基因座中具有RWP-RK结构域的CITRKD1在调节柑橘Nucellar组织中的体细胞胚胎发生方面发挥了主要作用。CitRKD1等位基因分为两种类型,聚氧化铝等位基因,具有螨虫插入和单次杂交等位基因。由于其几乎相同的氨基酸序列,这些等位基因的蛋白质功能几乎相同。转录CitRKD1可能可能由上游区域中的螨虫插入来控制,这可能用作转录调节器,以改变植物RKD基因的先天表达谱与蛋细胞特异性表达模式。本研究中获得的信息提供了新的洞察杂合工厂的审计繁殖,但需要进一步分析来阐明螨虫插入是否可以解释CitRKD1与典型的植物RKD基因相比,以具有蛋细胞特异性表达谱的典型植物RKD基因的术语和组织的繁多的表达模式,以及解决各种问题,例如由下游信令途径中发生的方式CitRKD1以及如何CitRKD1在APOMicic植物物种中进化了。
方法
植物材料和微阵列分析
在纳罗水果和茶树科学研究所(德国),柑橘研究系(日本Shizuoka,日本)培养的“Kiyomi”和“Harumi”分别用作单次镁和聚氧化铝品种的材料。为微阵列分析收集15,30,45和60个DAF的整个杨氏果实,立即在液氮中冷冻,并储存在-80℃下进行RNA分离。根据过去的报告提取总RNA [13.].
使用eArray系统(Agilent Technologies, Santa Clara, CA, USA;https://earray.chem.agilent.com/earray/)根据标准系统协议。在聚氧化铝基因座的380 kBp序列中使用79 kbp序列(登录号:ab573149)中使用79 kbp曲线构建探针[28.]由水稻基因组自动注释系统(Rice egaas) (http://ricegaas.dna.affrc.go.jp/程序,29148个组装的mrna在柑橘基因组序列ver。1.0(登录号:AMZM001000000) [42].对于79个NP-ORFs,尽可能针对每个外显子进行探针设计。总共产生了29,539个独立探针(391个探针来自多胚胎位点,29,148个探针来自柑橘基因组序列的mrna),并以安捷伦系统的4 × 44 K格式将复制件安装在定制的寡核苷酸芯片(安捷伦设计#059979)上。
根据制造商的说明,使用低输入快速amp标记试剂盒(安捷伦技术),用菁3标记的胞嘧啶三磷酸标记RNA样本。随后,根据制造商的说明,使用基因表达杂交试剂盒(安捷伦技术)将标记的crna在定制的oligo-DNA芯片上进行杂交。玻片在GE洗涤缓冲液(安捷伦技术)中洗涤后,用安捷伦微阵列扫描仪(G2505C,安捷伦技术)扫描。使用Feature Extraction软件(10.5.1.1版本),所有参数采用默认值,将图像转换为基因表达数据。数据分析使用Subio平台1.12版本(Subio Inc.,日本爱知)进行。原始数据归一化到探针强度高于背景水平的75百分位(gIsWellAbove = 1)。归一化值根据以下条件下的表达变化进行过滤:较低的信号强度cut-off < 100, cut-off探针用IsPosAndSignif标记,在所有实验中,“Kiyomi”和“Harumi”之间的表达比的表达变化大于2倍的差异。利用该软件的Fisher精确测试功能进行GO项富集分析。完整的微阵列数据已储存在NCBI基因表达集(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse115082.)在系列条目GSE115082下。
RT-PCR在15%和30多法'和“Harumi”中整个幼年水果中候选基因的基因表达分析
使用Quantitect®逆转录试剂盒(Qiagen,Hilden,德国)用1μg纯化的总RNA制备cDNA。PCR反应在PREFLEX PCR系统中进行(应用生物系统,福斯特城,USA,USA)热循环仪前taq.®DNA聚合酶(Takara,东京,日本)在以下条件下:30个循环,在94°C 10 s,在56°C 15 s,在72°C 60 s。利用Phytozome数据库中clementine、mandarin和sweet orange对应基因的保守序列,设计4个候选基因的引物序列(https://phytozome.jgi.doe.gov/pz/portal.html).它们的引物序列和对照基因的序列EF1-α.列于其他文件3.:表S3。每次反应的PCR产物在1.5%中使用电泳进行分析(v/ v)琼脂糖凝胶。
citrkd1 cDNA和基因组克隆的分离和测序
通过使用PrimeStar®GXLDNA聚合酶(Takara),在PCR扩增下从Satsuma普通话卵巢组织的cDNA获得对应于NP-ORF44的全长cDNA克隆。引物序列如下:前底漆,5'-taccttaaagaAGCCACCACCACGGA-3';反向底漆,5'-gtttcttcagctggtgatcctt-3'。根据前一份报告从Satsuma普通话中提取基因组DNA [6].基因组克隆,包括上游区域和编码区域约1.0 kbp,使用以下引物:正向引物,5 ' -AACGAAGGATTAACAGTATTC-3 ';反向引物5“-TAATCAGCCTACTTCGTTC-3”。利用Mighty克隆试剂集(Takara)将扩增的PCR产物克隆到pUC118载体(Takara)中,转化成pUC118载体大肠杆菌应变XL-1蓝色。Sanger测序分析使用BigDye Terminator v. 3.1 Cycle sequencing Kit (Applied Biosystems)和ABI PRISM 3100 Genetic Analyzer (Applied Biosystems)进行。从柑桔的cDNA和基因组DNA中分别获得两个独立的与NP-ORF44对应的克隆,并将其完整的核苷酸和氨基酸序列登记在日本DNA数据库(DDBJ) (Citrkd1-mg1.:LC385050,citrkd1-mg2.:LC385049).内含子和外显子通过基因组和cDNA克隆的序列比较确定。CITRKD1-MG1和CITRKD1-MG2的推导的氨基酸序列与在公共DNA数据库中登记的其他柑橘CITRKD1等位基因对齐。使用计算机程序GenetyX-Winver中的邻近加入方法进行系统发育树分析。11.0(软件开发,东京,日本),使用柑橘Citrkd1等位基因,以及NLP和克莱特柑橘普通话的RKD基因拟南芥。
RT-PCR的苜蓿普通话各种组织中CITRKD1的表达分析
对蜜橘的花、叶、茎、幼果全果(30 DAF)和果实组织(汁囊和果皮)(60、120和180 DAF)进行了取样。花在开花期分为花药、雌蕊、花瓣、子房和萼片。RNA提取、cDNA制备和RT-PCR方法如上所述,使用相同的NP-ORF44引物,在相同的条件下进行。从30 DAF嫩果cDNA中扩增出的PCR片段经上述方法直接测序。
过反义表达CuRKD-mg2转基因甜橙的生产
全长cDNACiRKD1-mg2插入了赠送co-expression向量(7在反义方向上,在花椰菜马赛克病毒(CaMV) 35 s启动子。以哈姆林甜橙为材料,接种上胚轴根癌土壤杆菌菌株LBA4404根据先前的报告[3.].每个不定量的射击在体外接枝到金属化的特洛伊·克朗(c . sinensisL.×p . trifoliata英国皇家空军)幼苗。这些嫁接的植物再嫁接到粗柠檬(C. jambhiri.郁郁葱葱。)。根据上一份报告进行转基因掺入和南方印迹分析[7].取样转基因甜橙的叶子和花,并通过RT-PCR对转基因的基因表达分析在NP-ORF44的相同条件下进行转基因。内源性的转录水平Citrkd1-org.引物为正向引物,5 ' - agagacttgatgatttttttttcatctcc -3 '位于转基因甜橙的第5外显子Citrkd1-org.;反向引物,5 ' - tgatccttagcattagaatgtgt - 3 '在3 '非翻译区Citrkd1-org..
转基因甜橙是自授粉,在180个DAF收获成熟的水果。除去转基因种子的种子涂层,并观察到转基因种子的表型变化。将每种种子分别种植成灌封土壤,并在25℃下在生长室中生长4周。从每个发芽的T的叶子中提取基因组DNA1进行植物和帽分析以比较T的基因型1根据过去的报告,控制和转基因的“哈姆林”甜橙之间的植物[36.].5个CAPS标记(Cp1624/MSP.我,tf0326 /哈哈我,Tf0001 /MSP.我,Mf0097 /德我和Tf0013 /Rsa选择I),因为标记基因座分别在不同的连杆(分别为1,2,5,7和8),并且它们在甜橙中含有杂合学基因型。使用电泳在2.0%中进行反应产物(v/ v)琼脂糖凝胶。
10个代表性柑橘品种上游叶螨插入与CitRKD1等位基因转录的关联
以10个代表性品种为研究对象,研究螨的插入是否影响其转录CitRKD1如下;clementine mandarin, ‘Kiyomi’, Mato buntan pumelo, hyuga-natsu and ‘Nishino kaori’ (‘Kiyomi’ × sweet orange) as monoembryonic varieties, and satsuma mandarin, ‘Harumi’, ‘Valencia’ orange, ponkan mandarin and ‘Saga’ mandarin as polyembryonic varieties. The absence or presence of the MITE insertion was evaluated by genomic PCR using the following primer set; forward primer (5′-GTTACTTGGAGACGGCCTAACG-3′) and reverse primer (5′-TCGATCATGTAATGCTGACTC-3′). RT-PCR was carried out under the conditions described above using the same primer set for NP-ORF44.
DNA标志物的发展鉴别单型/聚镁二烯丙基等位基因及其在日本育种计划中传统繁殖品种基因分型的应用
日本育种计划中的14个祖先柑橘品种[14.]用于获得参考序列CitRKD1等位基因,因为侏儒中的所有等位基因都来自他们;Duncan Grapefruit,Duncan Grapefruit,Clementine Mandarin,'Mukaku-Kishu',Tanigawa Buntan Pumelo,Hassaku,Hyuga-Natsu,Sweet Orange,Iyo-Kan,Satsuma普通话,Ponkan普通话,地中海普通话,国王普通话和'Murcott'。大约1.0 kBp到1.3 kBp片段,包括螨插入位点CitRKD1通过PREGESTAR®GXLDNA聚合酶(Takara)通过PCR从其基因组DNA扩增等位基因,其用于上述基因组PCR的相同引物组,并被测序。旨在精确地评估95个传统和育种品种的等位基因基因型,设计了一种用于DNA标记物(P / M标志物)的新底漆,鉴别单体/聚胚胎等位基因基因型的鉴定单次/聚胚胎等等基因型。11(软件开发有限公司)在其中使用保守的核苷酸序列。p / m标记的引物序列如下;感知底漆:5'-tctctggttcattgagaatcc-3'在上游区域,反义底漆:5'-ctgagcaccaggcaacaactac-3'在第二个外显子。使用的等位基因基因分型PCR使用前taq.®DNA聚合酶(Takara),程序30个循环,在25 μl反应溶液中,98°C 10 s, 58°C 5 s, 72°C 30 s。每个反应的PCR产物在1.5% (v/ v)琼脂糖凝胶。
缩写
- BAC:
-
细菌人工染色体
- 帽子:
-
切割扩增的多态序列
- DAF:
-
开花后的日子
- 螨:
-
微型反重复转座元件
- 门店:
-
新一代测序
- ORF:
-
开放阅读框架
- RKD:
-
rwp-rkd域内
- SNP:
-
单核苷酸多态性
- SSH:
-
减去抑制杂交
- 行动:
-
端子插入重复
- TSD:
-
目标网站重复
参考
- 1。
Abe H,Uraao T,Ito T,Seki M,Shinozaki K,Yamaguchi-Shinozaki K.拟南芥AtMYC2 (bHLH)和AtMYB2 (MYB)在脱落酸信号转导中起转录激活作用。植物细胞。2003;15:63 - 78。
- 2。
黄志刚,高桥英独联体-Regulatoratoratoratoratoratoratoratoratoratoratoratoratoratoratoratoratory的L1层特异性基因表达,其通过L1特异性同源域蛋白靶向。工厂J. 2001; 26:487-94。
- 3.
Boscariol Rl,Almeida Wa,Derbyshire Mt,MourãoFilhoFa,Mendes Bm。使用PMI /甘露糖选择系统恢复转基因甜橙植物(柑橘Sinensis L. Osbeck)。植物细胞代表2003; 22:122-8。
- 4.
按钮j,婆罗门ch。在体外脐橙未受精胚珠的核心植物的发展。J南非机器人。1971; 37:127-34。
- 5.
RWP-RK转录因子在植物氮素响应和配子体发育中的调控作用。J Exp Bot. 2014; 65:5577-87。
- 6。
delaporta SL, Wood J, Hicks JB。一种植物DNA的微型制剂。版本二世。Plant Mol Biol rep 1983; 1:19-21。
- 7。
Endo T, Shimada T, Fujii H, Nishikawa F, Sugiyama A, Nakano M, Shimizu T, Kobayashi Y, Araki T, Peña L, Omura M赠送柑橘鲜花和水果基因功能分析的共表达系统。J日本SoC Hort SCI。2009; 78:74-83。
- 8。
Feschotte C, Mouches C.微小重复转座因子家族(螨虫)的证据拟南芥蒂利亚纳基因组从像样的DNA转座子中出现。mol Biol Evol。2000; 17:730-7。
- 9。
Ganesan M,Jayabalan M.血红蛋白(红细胞)的评价:用于改善棉花的细胞胚胎发生和植物再生(gossypium hirsutuml .简历。SVPR2)。植物细胞代表2004;23:181-7。
- 10。
葛XX,柴丽娟,刘铮,吴晓明,邓XX,郭伟伟。基于ssh基因芯片的瓦伦西亚甜橙胚性、非胚性愈伤组织和体细胞胚发生相关基因的转录分析足底。2012;236:1107-24。
- 11.
洪启波,向树清,陈可良,陈乐格。在属中控制无融合生殖的两个互补显性基因柑橘类和枳壳.Acta Genet Sin。2001; 28:1062-7。
- 12.
通过基因组序列和微阵列数据的联合分析鉴定光敏色素a调控基因表达网络中涉及的启动子基序。植物杂志。2003;133:1605-16。
- 13。
Ikoma Y,Yano M,Ogawa K,Yoshioka T,XU ZC,Hisada S,Omura M,Moriguchi T.通过cDNA文库构建和RT-PCR分离和评价水果中的富含多糖的组织。J JPN SOC HORT SCI。1996; 64:809-14。
- 14.
Imai A, Kuniga T, Yoshioka T, Nonaka K, Mitani N, Fukamachi H, Hiehata N, Yamamoto M, Hayashi T.国家柑橘育种计划的遗传背景、近交系和遗传一致性。日本Hort J. 2017; 86:200-7。
- 15.
柑橘珠心胚的遗传。Bull Hort Res Stn. 1967; B7:1-10。
- 16。
珠心胚胎学。在柑橘类。遗传、育种和生物技术。(ed)即汗。CABI。2007;pp141 - 149。
- 17。
Kepiro JL,罗斯ML。AFLP标记与Nucellar Embricony(Apomixis)所必需的主要基因密切相关柑橘Maxima.×枳壳trifoliata.树基因基因组。2010;6:1-11。
- 18。
小林等。柑橘珠心胚发生的研究。珠心胚的形成与胚珠的发育。公牛果树Res Stn. 1978;E 2: 9-24。
- 19。
koltunow am。Apomixis:胚囊和胚胎没有减少的胚珠或胚珠。植物细胞。1993年; 5:1425-37。
- 20.
koltunow am,ozias-akins p,siddiqi i. apomixis。在:Becraft PW,编辑。种子基因组学。牛津:Wiley-Blackwell;2013. p。83-110。
- 21.
Köszegi D, Johnston AJ, Rutten T, Czihal A, Altschmied L, Kumlehn J, Wüst SE, Kirioukhova O, Gheyselinck J, Grossniklaus U, Bäumlein H. RKD转录因子家族成员诱导卵细胞样基因表达程序。植物j . 2011; 67:280 - 91。
- 22.
Kumar V,Malik Sk,Pal D,Srinivasan R,Bhat SR。胚珠的比较转录组分析显示柑橘中与核心聚咪唑相关的应激相关基因。树遗传学基因组织。2014; 10:449-64。
- 23.
龙JM,刘Z,吴XM,方烨,佳h,谢Zz,邓XX,郭效。基因组测量mRNA和小RNA转录组含有柑橘apomixis的启动。J Exp Bot。2016; 67:5743-56。
- 24.
Lu C,陈继,张Y,胡Q,Su W,kuang h.微型倒置重复转换元素(螨虫)已经通过扩增爆发累积并在基因表达和物种多样性中发挥重要作用栽培稻.生物医学进展。2011;29:1005-17。
- 25.
罗华,宋飞,郑志刚,等。水稻BELL同源结构域转录因子OsBIHD1基因在水稻抗病中的表达。植物医学杂志。2005;7:459 - 68。
- 26.
Liu J, Guimaraes CT, Lana UG, Alves VM, Wang YH, Schaffert RE, Hoekenga OA, Pineros MA, Shaff JE。在多药和有毒化合物挤压(MATE)家族的一个基因赋予高粱的铝耐性。Nat麝猫。2007;39:1156 - 61。
- 27.
NAKANO M,KIGOSHI K,Shimizu T,ENDO T,Shimada T,FUJII F,OMURA M.与聚氧化氮相关的基因和体外胚胎发生柑橘类.树遗传学基因组织。2013; 9:795-803。
- 28.
NAKANO M,Shimada T,Endo T,Fujii H,Nesumi H,Kita M,Ebina M,Shimizu T,Omura M.表征基因组序列显示与多样性多元化的强效柑橘类物种和品种,及其同步葡萄属和杨树.植物SCI。2012; 183:131-42。
- 29.
Nakano M, Shimizu T, Fujii H, Shimada T, Endo T, Nesumi H, Kuniga T, Omura M.多胚胎位点侧翼区域的定位和单倍分型柑橘unshiu马科。J JPN SOC HORT SCI。2008A; 77:109-14。
- 30。
NAKANO M,Shimizu T,Kuniga T,Nesumi H,Omura M,Fujii H,Shimada T,Endo T,Nesumi H,Kuniga T,Omura M.标记富集和施工单型基因组区域的单倍型特异性Bac Contigs柑橘类.育种Sci 2008 b; 58:375 - 83。
- 31。
Nonaka K,Fujii H,Kita M,Shimada T,Endo T,Yoshioka T,Omura M.帽标记在日本开发的柑橘品种鉴定及父母综合分析。霍尔霍夫。2017; 86:208-21。
- 32。
Parlevliet JE, Cameron JW。柑橘珠心胚遗传的证据。美国医学期刊。1959;74:252-60。
- 33。
Quinn JM,Merchant S.两个与之相关的铜响应元件衣原体Cyc6基因作为转录激活物的靶点。植物细胞。1995;7:623-8。
- 34。
RövekampM,Bowman JL,Grossniklaus U. Markantia Mprkd通过在没有施肥的情况下通过Kepping蛋细胞进行静止来调节配子体孢子体过渡。Curr Biol。2016; 26:1782-9。
- 35。
李志强,李志强,李志强,等拟南芥米饭和莲花japonicus..中国科学(d辑:地球科学)2005;60:229-37。
- 36。
Shimada T, Fujii H, Endo T, Ueda T, Sugiyama A, Nakano M, Kita M, Yoshioka T, Shimizu T, Nesumi H, Ikoma Y, Moriguchi T, Omura M.构建基于708个基因标记的柑橘框架遗传图谱。树木基因组。2014;10:1001-13。
- 37。
Strasburger E. Über多胚胎。耶:z . Naturwiss;1878.
- 38.
关键词:野生大麦,水分胁迫,耐水基因,Hsdr4植物学报2007;64:17-34。
- 39.
Tatematsu K,Ward S,Leyser O,Kamiya Y,Nambara E.鉴定CIS-Elements在拟南芥中起始腋芽过度生长期间调节基因表达的CIS元素。植物理性。2005; 138:757-66。
- 40。
Waki T,Hiki T,Watanabe R,Hashimoto T,Nakajima K.拟南芥RWP-RK蛋白RKD4在早期胚胎发生中触发基因表达和图案形成。Curr Biol。2011; 21:1277-81。
- 41。
王X,徐y,张某,曹l,黄y,cheng j,wu g,田s,陈c,刘y,yu h,杨x,兰h,王n,王l,xu j,jiang x,Xie Z, Tan M, Larkin RM, Chen LL, Ma BG, Ruan Y, Deng X, Xu Q. Genomic analyses of primitive, wild and cultivated citrus provide insights into asexual reproduction. Nat Genet. 2017;49:765–72.
- 42。
Wu GA, Prochnik S, Jenkins J, Salse J, Hellsten U, Murat F, Perrier X, Ruiz M, Scalabrin S, Terol J,等。对不同的柑橘、柚子和橙子基因组的测序揭示了柑橘驯化过程中混合剂的复杂历史。Nat生物技术。2014;32:656 - 62。
确认
不适用。
资金
这项工作得到了科学研究资助(C)的部分支持,批准号为16 K07608。
可用性数据和材料
完整的微阵列数据沉积在NCBI基因表达式综合征中(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=gse115082.)在系列条目GSE115082下。的核苷酸序列CitRKD1日本DNA数据库(DDBJ) (Citrkd1-mg1.:LC385050,citrkd1-mg2.:LC385049).
作者信息
从属关系
贡献
TS进行了转录组分析并起草了手稿。TE利用转基因甜橙对体细胞胚胎发生候选基因进行功能分析。HF设计开发了定制的寡聚阵列。MN从该多胚位点的一个380 kbp拟制序列进行基因预测。AS和GD通过微阵列和RT-PCR检测候选基因。SO和TY对柑橘传统品种和育种品种进行管理,并对其胚胎类型进行了研究。MO支持并监督了实验。所有作者阅读并批准了最终的手稿。
相应的作者
伦理宣言
伦理批准和同意参与
不适用。
同意出版物
不适用。
相互竞争的利益
作者声明没有竞争利益。
出版商的注意事项
施普林格《自然》杂志对已出版的地图和机构附属机构的管辖权要求保持中立。
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
岛田、远藤、藤井。et al。CitrkD1的螨虫依赖性表达与RWP-RK结构域调节柑橘Nucellar组织中的体细胞胚胎发生。BMC植物杂志18,166(2018)。https://doi.org/10.1186/s12870-018-1369-3
已收到:
接受:
发表:
关键字
- 体细胞胚胎发生
- rkd.
- 柑橘类
- DNA标记
- 卵细胞
- 无融合生殖
- 赠送共同表达系统