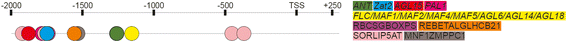抽象的
背景
PhotoPeriod UsensitePPD-1A等位基因决定小麦的早期开花。同源基因表达增加Ppd-D1a和PPD-A1A缺失在启动子区域中的结果,表达升高PPD-B1A由增加的拷贝数确定。
结果
在这项研究中,使用面包小麦品种Sonora和PSL2,在开花时间形成对比,与其交叉,“PPD-M”和“PPD-W”产生的近代引起的线PPD-B1A从索诺拉漫步,我们调查了影响的推定因素PPD-B1A表达式。通过分析PPD-B1A在3个不同的拷贝中,我们鉴定了一个indel和两个SNPs,从而将该等位基因与其他具有拷贝数变异的等位基因区分开来。
我们研究了表情PPD-A1那PPD-B1A,Ppd-D1与光感知有关的基因(巴那、那PhyC)和开花开始(VRN-1那TaFT1)并讨论了他们的互动。表达式PPD-B1A在比“PPD-W”前四天开花的“PPD-M”线,显着高。我们找到PhyC在线上令人上调PPD-B1A等位基因。表达PhyC“PPD-M”较高。微卫星基因分型证明,在“PPD-M”线中,从早期开花的父母SOORAA的染色体5B的泌辛统一区域存在迟发,而“PPD-W”没有这种血投。FHY3 / FAR1位于这一地区。转录因子的表达FHY3 / FAR1“Ppd-m”线高于“Ppd-w”线,说明FHY3 / FAR1对小麦开花时间有重要影响,可能导致“Ppd-m”比“Ppd-w”开花早。
结论
我们建议存在正向的双向调节PPD-B1A和PhyC带着FHY3 / FAR1贡献。
双向调节可以提出PPD-A1A和Ppd-D1a.在硅分析中,我们证明了其特异性Ppd-B1与同源基因相比,调控不仅涉及拷贝数的变化,还涉及不同的调控元件。
背景
PhotoMeriod灵敏度是一个重要的农艺特征,影响小麦标题日期,以及PPD-1(Photoperiod-1)基因是该过程的重要调节因素。这PPD-1基因是成员Pseudo-Response调节器(PRR.gene家族[1].有三种PPD-1六倍体小麦的基因Triticum Aestivum.,它位于染色体2a,2b和2d的短臂上[2那3.那4.]并被指定PPD-A1那Ppd-B1和Ppd-D1, 分别。负责光周周周周期不敏感性的突变等位基因,因此,短期内的早期开花(SD)条件用后缀“a”标记。
迄今为止,所有的光周期不敏感(PI)等位基因PPD-1已经确定了基因。Ppd-D1a在其启动子区域有2089 bp的缺失[1].该等位基因广泛应用于小麦的选择,其对表型的影响也得到了很好的研究[5.那6.].PPD-A1A首先使用显性等位基因使用杜鲁姆(小麦属植物硬质).有两种等位基因,其中两种等位基因在启动子中表征了1027bp或1117bp缺失[4.].这普通小麦PPD-A1ANishida等人所描述的[7.,与其他PI等位基因相似,在5 ' UTR区域有1085 bp的缺失。
Nishida等[7.PI透露PPD-B1A等位基因在冬季冬季 - Abukumase中,在启动子区的308bp插入。建议这种插入是螨虫(微型倒置重复转换元件)。另一个pi.Ppd-B1突变是一种拷贝数变异(CNV) [8.].野生型的单倍体拷贝数Ppd-B1等位基因是一种,而PI等位基因具有两到四个副本。除了副本号之外,这些等位基因可能具有不同的互通区域。因此,有三种变体PPD-B1A等位基因基于拷贝数和互联交叉点的差异如下:启动类型,SONORA64 / TIMSTEIN / C591类型和中国春季类型[8.]. Kiss等人[9.]确定了Ppd-B1LOCI不仅与副本号相关联,还与Intercopy结类型相关联。在现场条件下,Ppd-B1展示了Intercopy结类型以影响标题日期超过份数。
PhotoPeriod敏感(PS)PPD-1等位基因在光照期表达,黎明后3 ~ 6小时达到表达高峰;这些等位基因在黑暗期不表达。相反,所有的PI等位基因在整个24个周期内都表现出错误表达[1那4.那8.].这PPD-1A等位基因在光明和黑暗时期都有表达。在夜间期间,PIPPD-1A等位基因显示出上调TaFT1(Triticum Aestivum开花轨迹T)SD(短日)条件下的表达[10那11].TaFT1在叶子中表达并转移到花卉分子中诱导开花[12].
目前调查的目的是研究Ppd-B1PI等位基因具有增加的拷贝数,并表征该等位基因的功能规范及其与其他光周期基因的相互作用。PCR分析,分子克隆和测序用于表征Ppd-B1序列。为了分析调控抽穗期基因的日表达情况,采用SYBR Green I进行qPCR。PlantPAN 2.0数据库[13]来确定可能的植物转录因子结合位点。
方法
植物材料
两对近等基因系“Ppd-m”及其姐妹系“Ppd-0”m“Ppd-w”及其姊妹系列“Ppd-0”W.“他们的父母形成索诺拉(К-47942,Vrn-A1/Vrn-B1/Vrn-D1和Ppd-A1b/Ppd-B1a/Ppd-D1b)和psl2(photoperiod敏感线2,VRN-A1 / VRN-B1 / VRN-D1和PPD-A1B / PPD-B1B / PPD-D1B),有不同的抽穗期。“Ppd-m”系和“Ppd-w”系在索诺拉品种2B染色体上的渐渗与姊妹系不同。这一差异在之前的SSR分析中得到了证实[14].特异性分子标记分析也表明近等基因系(NILs)具有隐性等位基因Ppd-D1和PPD-A1[14]. 根据制造商的协议,使用GeneJET Plant Genomic DNA纯化微型试剂盒(Thermo Fisher Scientific,立陶宛)从幼苗中提取DNA。
Ppd-B1Intercopy区域分析
以前报道的PCR引物[8.用来定义Ppd-B1间皮区。如前所述进行PCR[8.].
SSR基因分型
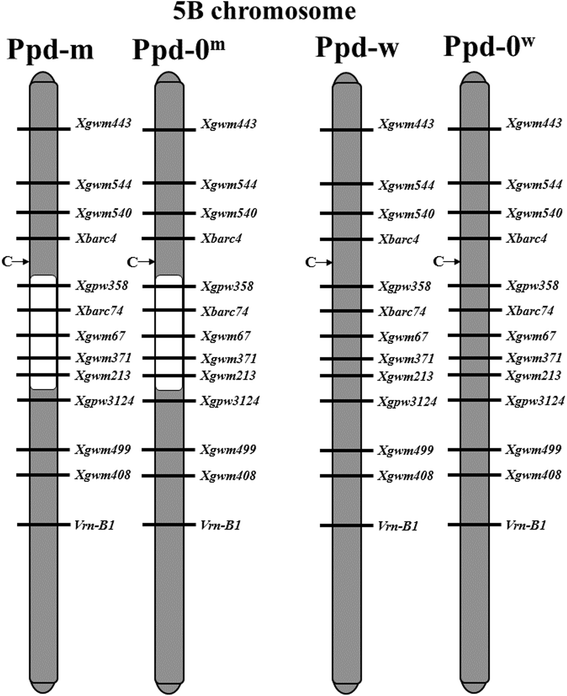
之前的研究对NILs全基因组进行了SSR分型[14].不幸的是,在举例说明一个错误描述的“PPD-w”和“PPD-0W.“线条。“PPD-W”和“PPD-0W.“线路在5B染色体上没有引入。因此,为了确定NIL中的5B染色体继承,我们使用了一组额外的标记(Xgpw358那XBarc74.那XGWM213那XGPW2124).标记序列及其退火温度可用[15].扩增片段在5%高分辨率琼脂糖MS-8 (Dia-m, Russia)中使用溴化乙啶染色进行分析。
底漆设计,PCR和测序Ppd-B1
之前,我们假设Ppd-B1在所研究的线等位基因可能通过序列的突变除来表征拷贝数变异[14]. 为了研究所有可能的序列变异,我们开发了一个编码区的引物,该编码区对所有基因都是特异的PPD-1基因。引物序列如下:F2-PPD-EXON2-ACCAGGCGTGGGGTGGGTATCT;R2-PPD-EXON6-GCTCTAGCTGCCTGTGGG;F3-PPD-EXON6-TGGAGATAGGTGCCCCCGGG;和R3-PPD-3UTR-GGACCGTCTCTGAATGATCCA。启动子区域的引物是Ppd-B1基因特定是由于差异的强烈差异PPD-1根据NCBI数据库中184个序列的比对设计启动子区域。引物序列为:F-Ppd-5UTR-CACTCTTATTCCCTCTATGCC和R-Ppd-5UTR-CTGTTATTATTGGAATCGTCAG。反应条件为:DNA浓度为5 ng/μL, 1× taq -聚合酶缓冲液(pH 8.6, 2.5 mM Mg2)+),200μmolesDNTPS,0.2μm的每个引物,1u Taq聚合酶(Medigen,俄罗斯)和无菌水,高达25μL的体积。PCR条件如下:94°С持续3分钟,35个循环(94°С40秒; 55°С为30秒; 72°С为72°С,60°S)和72°С7分钟。
扩增子使用1%琼脂糖凝胶中回收,并用从琼脂糖凝胶(硅质体,俄罗斯)试剂盒进行DNA洗脱纯化。将纯化的扩增子连接到PAL-TA载体(Evrogen,俄罗斯)中,用1μS的T4 DNA连接酶(Thermo Fishific,UK)。该构建体用于转换大肠杆菌根据CCMB80议定书制备的前10名态度细胞[16]. 使用带有X-Gal/IPTG的蓝白选择和针对序列的引物PCR选择带有目标插入物的菌落。使用Biosilica pDNA提取试剂盒(Biosilica,俄罗斯)提取质粒DNA。使用ABI PRISM染料终止剂循环测序准备反应试剂盒(美国Perkin Elmer Cetus)和M13引物以及以下靶序列的额外引物进行测序:F-5UTRad-TTCTTCACATAGGGT;R-5UTRad-CGCATAAGCAGC;F-ex4-GTGGCAGTGTAGTGGAAGT;和F-7ex-ACGCCGCTCAGAAGCAA。
光周期基因的昼夜定量表达
Sonora, PSL2,“Ppd-m”和“Ppd-w”植株在短时间(光照9 h, 20°C)的气候室Rubarth Apparate (RUMED GmbH)的控制条件下萌发后生长21天。从光照期开始的24小时开始,每个基因型在每个3小时的时间点采集3个重复样品到液氮中。使用植物RNA迷你prep (Zymo Research,美国)提取RNA,然后用RNase-Free DNase组(QIAGEN, Hilden,德国)进行DNase处理。根据制造商的协议,使用RevertAid First Strand cDNA Synthesis (Thermo Fisher Scientific,立陶宛)合成cDNA,以2 μg总RNA为模板,Oligo(dT)18引物。最终cDNA稀释20倍后,共2 μl用于以下分析。
对于表达分析,以前发表了引物TAFT-1,PPD-1[11],VRN-1[17],巴那、和PhyC[18基因被使用。这是FHY3 / FAR1采用URGI: Traes_5BS_BCC406654.2序列设计。引物序列如下:F-TaFHY3/FAR1-5B- GCAAACGTCATCAGGATACA和R-TaFHY3/FAR1-5B- CCTCTTCTCAGCTTTACTTGC。18S rRNA基因的引物[1]用于标准化。使用ABI 7500Fast实时PCR系统(Applied Biosystems,Fost City,Ca,USA)收集荧光数据,Sybr Green I(Syntol,Russia)作为嵌入染料。测量以三种技术复制进行。通过熔融曲线分析和2%琼脂糖凝胶电泳检查反应产物。根据Pfaffl提出的方法计算相对表达值[19]. 使用LinReg软件测定PCR效率[20.].靶基因的表达归一化针对18S rRNA。
统计分析
采用ANOVA和事后Tukey检验比较表达水平。采用Pearson系数(显著性水平)计算基因表达模式之间的相关性P.= 0.001)。
基因启动子的生物信息分析
PlantPAN 2.0 [13]数据库用于确定假定的植物顺式作用调控元件。对所有序列的2000 bp上游TSS(转录起始位点)、第一外显子和第一内含子进行分析,除了Taft-5d.由于数据库中没有其上游TS的序列。
结果
光周期不敏感的序列分析Ppd-B1等位基因
我们已经假设了Ppd-B1PI SOONORA中的基因,“PPD-M”和“PPD-W”的特征不仅是增加的拷贝数,而且是在其中一个拷贝中的核苷酸多态性,因为NILS“PPD-M”和“PPD-W”比具有相同背景的线略晚略高,又啰嗦Ppd-D1a基因(14].因此,我们分析了序列Ppd-B1不同的副本。为了研究可能的多态性,我们将基因与其启动子重叠的扩增子插入到载体中进行转化大肠杆菌被视为具有不同拷贝的不同菌落,然后对其进行测序和分析。
结果如图所示。1.我们调查中的每一条线都有在启动子区(-2373 bp)中的单个核苷酸indel不同Ppd-B1等位基因,这是在所述品种Sonora64,Timstein(DQ885765.2),和雷南(DQ885764.2)检测。因此,尼尔和父母品种索诺拉有所同样Ppd-B1Intercopy Region作为品种Sonora64,Timstein和C591。然而,检测到的多态性提供了这些的区别Ppd-B1等位基因。
其他SNP(-630bp)允许区分PI和PS NIL。因此,“PPD-M”和“PPD-W”具有“C”,并且姐妹线具有“G”在编码区域上游。在外显子3(+ 546bp)中,检测到的SNP通过增加的拷贝数(中国春天)将研究序列与另一个等位基因区分开来。
昼夜表达分析
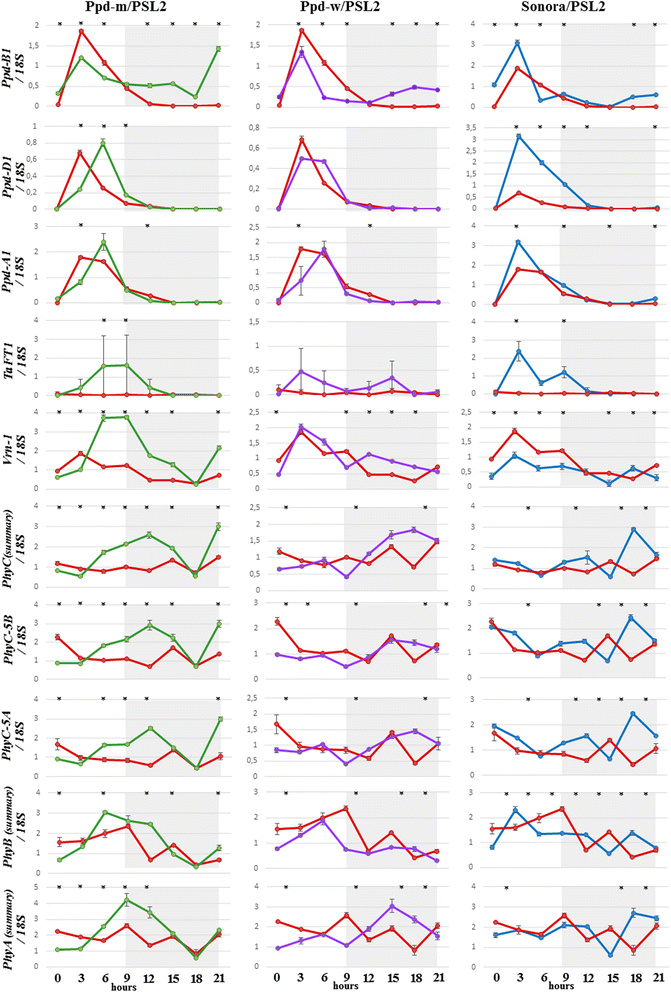
来研究两者之间的相互作用PPD-B1API等位基因和其他对小麦开花重要的基因,我们使用了QRT-PCR测定。我们使用了从晚开花的父母线PSL2,早期开花的父母品种Sonora与PI的21天老植物PPD-B1A等位基因,以及NILs“Ppd-m”和“Ppd-w”,代表在某些位点具有不同等位基因的PSL2,包括Ppd-B1a,introgressed索诺拉。
昼夜表达分析的结果在图2中示出。2.Ppd-B1在暗时段期间在PI线中表达,但是在光周期敏感PSL2中未在预期中表达。这TaFT1该基因仅在PI系中表达,支持先前的研究[10那11]在此过程中的影响PPD-1主导等位基因TaFT1表达了。
这Ppd-D1与PSL2和NILs相比,Sonora的表达增加。这一发现可能与第7外显子5bp的缺失有关。的特异性PPD-A1“Ppd-m”和“Ppd-w”的表达峰较Sonora和PSL2的表达峰移位。在“Ppd-m”线中可以观察到表达峰的移动Ppd-D1那TaFT1那VRN-1和其他基因。的表达模式VRN-1没有显示SONORA和“PPD-W”之间的任何强大差异,但PPD-M中相当较高。PhyC自亮期开始,表达量下降,在暗期出现一到两个峰值。PI系在暗期有升高表达的趋势。的表达模式、和巴可以由两个表达峰表征如下:一个在光周期结束时,一个在黑暗时期。
我们分析了相关性(附加文件1:表S1)在光感知中涉及的基因的表达模式(巴那、那PhyC)以及那些参与交易的人(PPD-A1那Ppd-B1那Ppd-D1那VRN-1那TaFT1)在光周期敏感线和不敏感线的暗、光周期。
所有植物的表达模式彼此显着相关,表明常见因素影响其表达。这PPD-1基因也与光周期敏感线上的光周期不敏感和ρ= 0.89-0.97相互明显相关(ρ= 0.55-0.85)。TaFT1表达与PPD-1在PI系和PSL2中,TaFT1根本没有表达。我们观察到表达水平之间的显着相关性TaFT1和Phyс-5a.(ρ= 0.75)和之间TaFT1和PhyC-5B(ρ = 0.8)。的表达模式VRN-1与显著相关PPD-1PSL2中的基因(ρ= 0.89-0.95)。这一发现可能表明存在影响其表达的常见因素。在pi线条,VRN-1与光(ρ= 0.65-0.79)和暗(ρ= 0.56-0.72)段期间所有的光敏色素相关。这些数据与一致[21,其中的影响PhyC和、在VRN-1使用RNA-SEQ分析显示表达。之间的相关性Ppd-B1和PhyC(PhyC相结合,PhyC-5B和PhyC-5A个别地)为过程中的PI行(ρ= 0.67)的黑暗时期显著。
表达模式的与光周期不敏感的特性线Ppd-B1等位基因
所有基因的表达高峰,除了Ppd-B1转移到“Ppd-m”线。亲本型和“Ppd-w”型没有表现出这些表达模式。最可能的原因是,来自索诺拉的额外渐渗基因中定位于“Ppd-m”而非“Ppd-w”的基因与PSL2背景基因互作,可能导致这种效应。“Ppd-m”系和“Ppd-w”系均有PPD-B1A来自索诺拉,但在SD条件下,他们的标题日期差异四天(“PPD-M”较早开花)[14].“Ppd-m”有以下两个在“Ppd-w”中未发现的索诺拉补充位点:在4D染色体附近xbarc165,在附近的5a染色体上XGWM154在染色体5b的脑脑熵区域(标记XBarc74.那XGWM67.那Xgwm371,XGWM213).与抽穗期的QTL相关的4D和5B染色体以前确定。在4D染色体的QTL定位于标记之间的区域WPT8836和XGWM165[22].目前已知,位于这些区域的基因中没有与抽穗时间调控相对应的。
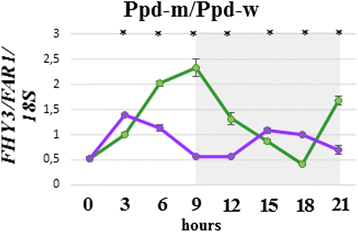
在染色体5B中,标题日期QTL与Xgwm371标记[23].随后,一个与候选基因相关的QTLFHY3 / FAR1那AP2 / ERF.和怀疑在5b蠕虫大分子区域中鉴定出[24].因此,使用另外的SSR标记物进行染色体5B基因分型,以确定血频区域的长度。结果,“PPD-W”和“PPD-0”中的染色体5BW."系完全遗传自PSL2。在“Ppd-m”株系中,早花亲本Sonora在携带该基因的区域中有一个基因渐入FHY3 / FAR1轨迹,而在“PPD-W”中,比PPD-M在四天之后,没有这种突出突出(图。3.).FHY3 / FAR1被认为是解释标题日期差异的一个很好的候选者。
来检查是否有什么不同FHY3 / FAR1线“PPD-m”和之间的表达“PPD-W”,我们应用了昼夜表达分析和证实的显著差异FHY3 / FAR1表情。黎明后6-9小时,该基因在“Ppd-m”中的表达更高,表明抽穗时间变异的可能原因(图。4.).FHY3 / FAR1表达模式与光敏色素相关VRN-1在很大层面。在晚上FHY3 / FAR1与Ppd-B1在PI线(“PPD-M”,“PPD-W”和SONORA)。
序列分析Ppd-D1和PPD-A1
Ppd-D1根据Guo提出的分类,Sonora有一个特异于单倍型IV的5 bp缺失[25].表型,这种单倍型比单倍型I弱得多,其由显着的PI等位基因表示在启动子区域中的2kb缺失,但略微减小出头时间[25].然而,与…相反25],他表示Ppd-D1Sonora的单倍型IV仅为5%Ppd-D1光期PSL等位基因(对应于单倍型II)的表达显著高于光期PSL等位基因(对应于单倍型II)的表达。最有可能是索诺拉的高表达Ppd-D1可以部分解释PI线花7-12天的事实,而不是Sonora,因为他们的Ppd-D1等位基因遗传自PSL2。
这PPD-A1PSL2和NILs的序列具有SNP (a /C),这在以前的任何发表中都没有描述过PPD-A1序列。比较包括使用BLASTN算法完成的286个四倍细小麦品种序列,并使用BLASTN算法完成。
讨论
Ppd-B1是唯一的PPD-1具有与拷贝数变异相关的显性PI等位基因的基因。然而,人们对其错误表达的机制知之甚少。此前,我们利用Sonora和PSL2杂交产生的近等基因系,对比开花时间,发现开花时间的差异与标记间2B染色体的渗透有关Xgwm148和Xgwm388来自Pi Sonora品种[14].Ppd-B1已知位于这个位置[26].早开的尼尔没有piPPD-B1ANishida等人鉴定的启动子区域插入318 bp的等位基因[7.].使用实时PCR,我们透露了Nils和Sonora的特点是增加了拷贝数Ppd-B1[14].
在这项研究中,我们证明了这一点PPD-B1A在PI线的特征在于拷贝数增加,并且类似于品种Sonora64,Timstein和C591的相似关系。但是,调查了PPD-B1A与Sonora64、Timstein和C591等位基因不同的是启动子区域有一个indel。
我们还发现了两个SNP。外显子3(+546 bp)中的SNP将研究序列与拷贝数增加的中国春季等位基因区分开来。
SNP(-630bp)区分PI和PS NIL。此SNP(“G”)先前检测到栽培品种谱系,Paragon和冬季Abukumase [1那8.].有趣的是,要注意的是,Ppd-B1亲本品种Sonora和所有其他四倍体和六倍体小麦的基因在此位置以“C”为特征。因此,“G”在这个位置是罕见的(4个品种,包括PSL2)。然而,光周期敏感性和这个SNP之间没有关联[1那7.那8.].
目的:研究检测到的单核苷酸多态性对大鼠血清白蛋白表达的可能影响PPD-B1A,研究对象之间的相互作用PPD-B1A等位基因和其他小麦开花基因的活性和这些基因的存在PPD-B1A,我们进行了日表达分析。
我们分析了光感知所涉及的基因表达模式之间的相关性(巴那、那PhyC)以及那些参与交易的人(PPD-A1那Ppd-B1那Ppd-D1那VRN-1那TaFT1)在光周期敏感线和不敏感线的暗、光周期。
TaFT1表达与PPD-1pi线中的基因,但在psl2中,TaFT1根本没有表达。我们确定了以下与RR (Response Regulator)或PRR (Pseudo Response Regulator)调控相对应的顺式元素:ARR14那RR14那PRR4那APRR2那ARR1.那RR1(Myb/SANT, Myb, ARR-B家族)和结合位点ARR1AT。这些发现提出了假定的地点TaFT1透过PPD-1基因。
在表达水平之间发现了显着的相关性TaFT1和Phyс-5a.和TaFT1和PhyC-5B在光时期。在夜间,TaFT1表达水平很低,光敏色素在黑暗中不活跃。这可能是受光敏色素的影响TaFT1表达式。完全,这一发现表明PPD-1重要但不是开花,并基于三联人PPD-1函数突变分析[27],建议TaFT1直接由植物十字体调节。最有可能的,这个过程是用的辅助下完成PPD-1. 在TaFT1启动子,发现与光敏色素调节相关的转录因子的以下结合位点:PIL5那POC1,PIF3那PAP3(bhlh / bzip),FHY3 / FAR1(Far1),VOZ2(voz),sorlip1at,sorlip2at,sorlrep5at,sorlip5at和Re1asphya3。表达相关性与TFBS对植物植物调节的鉴定TaFT1促进剂表明植物十字体是其他监管机构TaFT1.
我们发现两者之间有显著的相关性Ppd-B1和PhyC(PhyC相结合,PhyC-5B和PhyC-5A单独地)在PI线的黑暗时期。
光敏色素在黑暗中表达并产生不活跃的Pr(红光吸收光敏色素)分子[28那29]不能影响其他基因的表达;因此,相关性应该意味着表达Ppd-B1在夜间积极影响PhyC表达,但是PhyC不影响PPD-1在夜晚。关于Phya,可以观察到相同的趋势,但没有发现显着的相关性。因为野生类型PPD-1揭示了在黑暗期间没有表达,它是无法影响PhyC一般来说。我们可以这样假设PPD-1影响PhyC即使是在白天,但是PhyCMRNA在光线下劣化隐藏了这种推定效果。以前,显示了与pi的百合PPD-1A等位基因(Ppd-D1a或PPD-B1A)的光敏色素蛋白水平比隐性的姐妹系高PPD-1等位基因[30.].因此,我们建议PPD-1A基因可能影响PhyC直接或间接的表达。为了验证这一假设,我们分析了该基因的启动子序列PhyC基因检测为可能的结合位点PPD-1.
响应调节器的绑定站点(ARR2,RR2和TF_MOTIF_SEQ_0268用于ARR1AT的TFMATRIXID_0348)和伪响应调节器(APRR4的TF_MOTIF_SEQ_0252)可能由这些伪响应调节器(例如)调节PPD-1基因。其中一些TFS对应于Phytochrome-调节(EPR1 / RVE7那POC1 / PIF3那FHY3 / FAR1那SORLIP2AT,Sorlip1at.),表明他们自我调节。与开花或光周期调控相关的TFBSs如下:GATA12、AtHB33、AtDOF1、SPL3、TEM1、STM、GBOX10NT、BS1EGCCR、,和IBOXCORE。
一起参加表达相关数据,PhyC启动子分析以及PI中有植物色度蛋白质的增量的事实PPD-1A等位基因,如[30.),建议PPD-B1A在夜间表达并积极调节PhyC表达式。
“PPD-M”比“PPD-W”开花四天。使用SSR基因分型,我们证明了5B终点区域中的基因座在“PPD-M”和“PPD-W”线中不同。FHY3 / FAR1位于这个位点[24].结合位点的FHY3 / FAR1被确定在PPD-1那PhyC和TaFT1启动子。
使用昼夜表达分析,我们发现了FHY3 / FAR1“PPD-M”表达高于“PPD-W”。FHY3 / FAR1在所有线条的24-H周期内与植物十字体相关的表达模式Ppd-B1在pi线的夜晚。
FHY3 / FAR1,已知参与光敏色素信号传导拟南芥和米[31那32]通过控制植物灌注FHY1监管拟南芥[33].但是,没有关于的数据FHY3 / FAR1小麦的功能。
在小麦中,光敏色素(PhyB和PhyC)影响小麦的光合特性PPD-1表达 [18那21]和开花时间。FHY3 / FAR1,这是牵涉开花时间控制,可有助于这一过程。PPD-B1A建议增加PhyC表达式。因此,数据建议了双向调节PhyC和PPD-B1A具有推定的基因FHY3 / FAR1贡献。这个假设需要进一步调查和核实。本研究中使用的近似同学线在5B终点区域中不同,并且是这项工作的好源。
与Ppd-D1a还证明了Phytochrome蛋白的增加[30.].因此,建议这种机制是常见的PPD-1A等位基因。但是,监管Ppd-B1表达应该是不同的。
此前,有人建议,在启动子区中的缺失PPD-A1和Ppd-D1由于Che结合位点的消失,并且阻遏Che(CCA1远足探险)与其监管要素相关联的情况,导致相应基因的missxpression。7.].然后,可以假设增加了Ppd-B1显示在其主导等位基因中显示的副本编号,导致Misexpression,因为增加了PPD-1基因与阻遏相同数量。然而,在这种情况下,改变的表达应该在所有三个观察PPD-1基因。以前,已发布的数据[11]证明了PPD-B1A等位基因本身表现出错误表达,但不影响表达PPD-A1和Ppd-D1表达式。因此,关于关于该作用的假设Ppd-B1应拒绝与抑制因子数量相对应的拷贝数。有趣的是,没有Ppd-B1的PI等位基因在启动子区缺失,而PPD-A1和Ppd-D1以删除为特征。
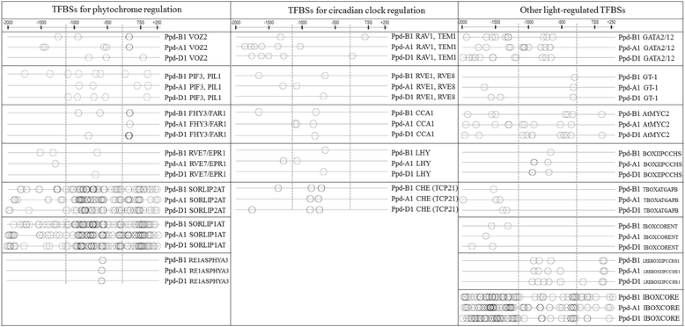
鉴定涉及的可能因素Ppd-B1但不是PPD-A1和Ppd-D1调节,我们研究了这些基因的启动子区域的序列,并测定了(1)TFBSS(转录因子结合位点),这些促进剂PPD-1同种型基因和(2)特异于的TFBSPpd-B1.
检测常见的TFBSPPD-1在A,B和D基因组中,使用PlantPan2多促进剂分析。Silico启动子序列分析中的一个揭示了PPD-1启动子具有许多与开花相关的顺式作用元素,其可根据其输入信号性质分为以下三组:植物中调节的,昼夜时钟调节的昼夜时钟调节和其他参与度量显影的结合位点。这些转录因子的详细描述总结在表中1.这些顺式元素的位置PPD-1序列如图所示。5..
PhyC和、最近被证明是规范的吗PPD-1表达 [18那21].建议这些基因是小麦光周期敏感性和开花交易的重要调节因素[18那21]大麦[34那35那36].虽然染色体的位置巴在小麦中发现[37]中,描述了这些基因座和开花之间没有关联。然而,巴是某些其他物种的开花时间的重要调节因素,如拟南芥[38那39].因此,调查巴谷类植物的序列和功能可能是对光敏感和开花机制的补充。在这里,我们可以假设PPD-1表达是由光敏色素与转录调节的协助调节,如PIF3那PIL5那FHY3 / FAR1那Rve7 / EPR1.,voz2,以及某些转录因子未知的TFBSs,如SORLIP2AT、SORLIP1AT、RE1ASPHYA3。
这PPD-1基因可能受小麦昼夜节律振荡器的调控[18]大麦[40].在大麦中,涉及该过程的一些基因是已知的,而在小麦中,提出了任何推定的昼夜循环梭菌。我们确定了可能涉及昼夜时钟调节的TFBSPPD-1基因如下:Rav1.那TEM1那TEM2那Rve1.那CCA1那LHY,Che..
这PPD-1激活的PhyC建议全天对光线敏感[41].最可能的情况是,这个过程可以由以下检测到的一些元素介导:gata2.那gata12.那GT-1,AtMYC2部分与未知转录因子结合位点,如BOXIIPCCHS、TBOXATGAPB、IBOXCORENT、LREBOXIIPCCHS1、IBOXCORE等。
特定于的绑定站点Ppd-B1并不是PPD-A1和Ppd-D1可能与昼夜节律、开花时间和来自以下家族的调控元素有关:AP2 (蚂蚁乙炔(),Zat12.),Mads Box / MIKC(AGL19.那FLC那MAF2那AGL69.那AGL68.那FLM那AGL6那AGL18那AGL14.,AGL15)和裂解酶芳香(PAL1)和TFBSS具有未知的TF RBCSGBOXPS,RebetalglHCB21,叶粘剂,Sorlip5AT和MNF1ZMPPC1。表中提出了这些转录因子的详细表征2.这些TFBS的位置Ppd-B1序列如图所示。6..
与开花交易相关联的转录因子MADS盒和MIKC.家庭基因。其中一些转录因子有助于开花诱导,其他转录因素有助于开花镇压。例如,AGL19.那AGL6和AGL14.是开花过渡的正稳压因素[42那43那44].相比之下,大多数已识别的疯子转录因子,即,FLC那MAF2那AGL69.那AGL68.那FLM那AGL15和AGL18,负面调节从植物转变为生殖发展的转变[45那46那47那48那49那50.那51.那52.]. 顾等人[50.]证明了FLC那MAF3(AGL70)那FLM(MAF1,AGL27)那MAF2 (AGL31)和MAF4(AGL69)相互作用,形成核复合物,负责开花抑制。
这些转录因子中的大多数都有相同的结合位点TFmatrixID_0503,除了AGL15,与TF_motif_seq_0105序列相关。基序TFmatrixID_0503对应于疯了转录因子不仅在拟南芥而且在Brachpodium distachyon.那奥雅萨苜蓿和巫术双色.这些转录因子被证明参与水稻开花过程和开花时间的形成[53.那54.].例如,osmads50.是一个正面的开花,和osmads56.对花卉过渡有负面影响[54.].osmads7.和osmads8.参与开花时间调制[55.].疯了在小麦中发现的基因[56.]. 其中一些是水稻的同系物osmads8.(osmads24.),osmads7.(osmads45.),可以影响开花时间[57.].然而,目前还没有关于小麦结合位点的数据疯了基因;因此,我们只能建议他们的关联与那些相同的网站拟南芥和大米疯了基因。
基于关于监管要素的数据Ppd-B1启动子和在部分同源的共同转录因子PPD-1基因,我们可以提出疯了基因在misexpression中发挥着重要作用PPD-B1A副本数量增加。已知许多这些基因是开花压缩机。最有可能的,Ppd-B1随着拷贝数的增加,在夜间期间继续表达;因此,阻遏因子的数量保持不变。
因此,我们已经确定了一套调节所有杂种的推定转录因子PPD-1基因。我们根据输入信号将这些转录因子分为三组,如下所示:Phytochrome调节,昼夜时钟调节和其他光调。但是,有几个Ppd-B1具体因素和疯了这些基因被认为是开花阻遏因子,并且最有可能Ppd-B1监管机构。我们未来的前景包括核实检测到的转录因子的参与Ppd-B1规定,讨论的尼尔是此类研究的相关模型。
结论
本研究的结果表明存在正面的双向调节PPD-B1A和PhyC带着FHY3 / FAR1贡献。双向调节可以提出PPD-A1A和Ppd-D1a.在硅分析中,我们证明了其特异性Ppd-B1与同源基因相比,调控不仅涉及拷贝数的变化,还涉及不同的调控元件。
缩写
- AGL:
-
ag
- 蚂蚁:
-
Aintegumenta
- 加勒比海盗:
-
拟南芥响应调节器
- CCA1:
-
生物钟相关1
- 基因:
-
DNA与RNA互补
- 格瓦拉:
-
CCA1徒步旅行
- CNV:
-
拷贝数变异
- FHY3 / FAR1:
-
远红细长的低铁膜3 /远红障碍反应1
- FLC:
-
开花基因座C.
- FLM:
-
开花基因座M.
- LHY:
-
晚细长的下胚轴
- 加:
-
疯狂影响开花
- 螨:
-
微型倒置重复转换元素
- nils:
-
Near-Isogenic行
- PAL1:
-
苯丙氨酸Ammonia-Lyase
- 体育:
-
PhytochromeA
- PI:
-
PhotoPeriod Usensite
- PIF3:
-
Phytochrome任命因子3.
- PIL1:
-
Phytochrome相互作用因子3样5
- PPD-1:
-
Photoperiod-1
- PRR.:
-
Pseudo-Response调节器
- PS:
-
photopheriod敏感
- PSL2:
-
光周期敏感线2
- QPCR:
-
定量聚合酶链反应
- QTLS:
-
数量性状位点
- RAV1:
-
与ABI3 / VP1相关
- Re1asphya3:
-
RE1假定的阻遏因子
- RR:
-
响应调节器
- rrna:
-
DNA编码RRNA
- Rve1:
-
Reveille1
- RVE7 / EPR1:
-
Reveille 7 /早期Phytochrome响应1
- RVE8:
-
Reveille8
- SD:
-
短暂的一天
- SORLIP2AT:SORLIP1AT:SORLIP5AT:
-
在光诱导型启动子序列的过表达
- SSR:
-
简单的序列重复
- TaFT1:
-
Triticum Aestivum开花轨迹T
- 专题一:
-
Tempranillo1
- tem2:
-
坦普拉尼洛2
- TFBS:
-
转录因子结合位点
- TSS:
-
转录起始位点
- VOZ2:
-
血管植物单锌指1
- VRN-1:
-
vernalization-1
- Zat2:
-
响应高光41
工具书类
- 1.
比尔斯J,特纳A,格里菲斯S,斯内普JW,劳里达。伪响应调节器在光周期不敏感的情况下错误表达Ppd-D1a小麦突变体(Triticum Aestivum.L.)。Al Appl Genet。2007; 115:721-33。
- 2.
法律CN,Sutka J,Worland Aja。小麦天长响应的遗传研究。遗传(Edinb)。1978; 41:185-91。
- 3.
Scarth R,法CN。光周期基因的位置,Ppd2和用于耳芽时间对小麦染色体2B附加的遗传因素。遗传(Edinb)。1983; 51:607-19。
- 4.
Wilhelm EP, Turner AS, Laurie DA。PhotoPeriod UsensitePPD-A1A四倍体小麦中的突变(小麦属植物硬质desf。)。Al Appl Genet。2009; 118:285-94。
- 5。
worldland T, Snape JW。世界小麦品种改良的遗传基础。In: William A, Alain B, Maarten G, editors。《世界小麦书》,一部小麦育种史。巴黎:拉瓦锡出版;2001.61 - 7页。
- 6。
Seki M,Chono M,Matsunaka H,Fujita M,Oda S,Kubo K,等。光周期不敏感等位基因的分布PPD-B1A和Ppd-D1a及其对日本小麦品种前往时间的影响。品种sci。2011; 61:405-12。
- 7。
Nishida H,Yoshida T,Kawakami K,Fujita M,Long B,Akashi Y等。光周期不敏感等位基因5'上游区域的结构变化PPD-A1A和PPD-B1A在六倍体小麦(Triticum Aestivum.以及它们对抽穗期的影响。摩尔品种。2013;31:27–37.
- 8。
Díaz A, Zikhali M, Turner A, Isaac P, Laurie d光周期-B1和vernalization-a1基因与小麦开花时间的改变有关(Triticum Aestivum.).Plos一个。2012; 7:E33234。
- 9。
Kiss T,Balla K,Bányai J,Veisz O,Karsai I。不同播期对小麦植株发育参数的影响(Triticum Aestivum.L.)。咖喱店。2014; 42:239-51。
- 10.
基塔川S,Shimada S,Murai K.的效果PPD-1小麦营养生长期和生殖生长期开花时间基因的表达。基因遗传系统。2012;87:161–8.
- 11.
肖LM,特纳AS,劳丽DA。对光周期的影响不敏感PPD-1A六倍体小麦三个基因组光周期途径的突变(Triticum Aestivum.).植物J. 2012; 71:71-84。
- 12.
严磊,傅德,李C,Blechl A,Taquilli G,Bonafede M,等。小麦和大麦春化基因VRN3.是一个正交的ft。Proc Natl Acad Sci U S A. 2006; 103:19581-6。
- 13.
植物启动子分析导航仪。http://plantpan2.itps.ncku.edu.tw/index.html.2017年5月5日访问。
- 14.
Kiseleva AA,Eggi Ee,Koshkin Va,Sitnikov Mn,Roder M,Salina Ea,等。检测遗传决定簇,其定义光周期敏感性差异Triticum Aestivum.l . near-isogenic线。俄罗斯J热内特。2014;
- 15.
GrainGenes 2.0。http://wheat.pw.usda.gov/GG3/.2017年5月5日访问。
- 16。
Hanahan D,Jessee J,Bloom Fr。大肠杆菌和其他细菌的质粒转化。方法酶。1991; 204:63-113。
- 17。
Shcherban Ab,khleskina ek,efremova tt,salina ea。两个差异表达的小麦VRN-B1等位基因对出头时间的影响与第一内含子的结构变化相关。Genetica 2013; 141:133-41。
- 18。
陈娜,李聪,胡伟,刘梅,林H,罗克韦尔,等。光敏色素C在长日照条件下促进小麦开花中起着重要作用。美国科学院学报。2014;111:10037–44.
- 19。
Pfaffl兆瓦。一种新的实时RT-PCR相对定量数学模型。核酸学报2001;29:e45。
- 20。
Ramakers C, rujter JM, Lekanne Deprez RH, Moorman AFM。定量实时聚合酶链反应(PCR)数据的无假设分析。>。2003;339:62-6。
- 21。
Pearce S,Kippes N,Chen A,Debernardi JM,Dubcovsky J. RNA-SEQ使用小麦的研究光敏色素B和光敏色素C突变体在开花和避荫途径的调节中显示出共同和特定的功能。植物生物学。2016;16:141.
- 22。
Griffiths S,Simmonds J,Leverington M,Wang Y,Fish L,Sayers L等人。ELITE欧洲冬小麦种质中耳出苗遗传控制的META-QTL分析。Al Appl Genet。2009; 119:383-95。
- 23。
Hanocq E,Niarquin M,Heumez E,Rousset M,Le Gouis J. QTL在面包小麦重组近交系中QTL对QTL的检测和映射。Al Appl Genet。2004; 110:106-15。
- 24。
Kiseleva AA,Shcherban Ab,Leonova,Frenkel Z,Salina EA。鉴定小麦5B染色体中的新标题日期决定因素。BMC植物BIOL。2016; 16(S1):35-46。
- 25。
郭z,宋y,周r,ren z,jia J.发现,评估和分布小麦的单倍型Ppd-D1基因。新植物。2010; 185:841-51。
- 26。
Mohler V,Lukman R,Ortiz-Islas S,William M,Worland Aj,Van Beem J等。光周期不敏感基因的遗传与物理映射Ppd-B1普通小麦。胡杨属。2004;138:33–40.
- 27
Shaw LM, Turner AS, henry L, Griffiths S, Laurie DA。突变的等位基因Photoperiod-1在小麦(Triticum Aestivum.L.)在漫长的日子里赋予延迟开花表型。Plos一个。2013; 8:E79459。
- 28
肯德里克·雷,克朗伯格·格姆。植物的光形态发生。多德雷赫特:荷兰斯普林格;1994
- 29
Terzaghi WB, Cashmore AR.光调节转录。植物生理学杂志。1995;46:445-74。
- 30.
科什金VA,Lisker IS,Merezhko AF,Kosareva IA,Dragavtsev VA。基因的影响PPD.小麦光敏色素、光周期敏感性及等基因系的生长发育。Dokl。拉斯。农业科学,2004;1:3-4。
- 31.
李,李G,王H,王邓x光敏色素信号机制。的。拟南芥的书。2011;29:e0148。
- 32.
Mongkolsiriwatana C, Pongtongkam P, Peyachoknagul S。silico.水稻光周期响应基因的启动子分析(奥雅萨苜蓿L.)。J NAT SCI。2009; 43:164-77。
- 33.
Genoud T,Schweizer F,Tscheuschler A,DeBrieux D,Casal Jj,Schäfere等。FHY1介导光活化的植物核导入感光体。Plos Genet。2008; 4:E1000143。
- 34.
Hanupappa M,Pratt L,Cordonnier-Pratt M,Deitzer Ga。PhotoCeriotioy - 不敏感的大麦线含有轻微不稳定的植物理性B.植物理性。1999; 119:1033-40。
- 35.
张志强,张志强,张志强,等。大麦光周期响应QTL与光感受器和春化基因的位置关系。Theor Appl Genet. 2006; 112:1277-85。
- 36.
Nishida H,Ishihara D,Ishii M,Kaneko T,Kawahigashi H,Akashi Y等。光敏色素C是控制大麦长日开花的关键因素。植物杂志。2013;163:804-14。
- 37.
Ogihara Y,Shimizu H,Hasegawa K,Tsujimoto H,Sasakuma T.染色体分配四种与光合作用相关的基因及其在小麦物种中的变异性。Al Appl Genet。1994年; 88:383-94。
- 38.
Johnson E、Bradley M、Harberd NP、Whitelam CC。光冠的光响应凤凰拟南芥的突变体。植物理性。1994年; 105:141-9。
- 39.
Neff MM,Chory J.植物植物A,Phytochrome B和Cryptochrome 1期间的遗传相互作用。植物理性。1998年; 118:27-35。
- 40.
Faure S,Turner As,Gruszka D,Christodoulou V,Davis SJ,Von Korff M等。昼夜钟表基因的突变早期成熟8.适应驯化的大麦(大麦芽)到生长季节较短。国家科学院院刊美A. 2012; 109:4-9。
- 41.
宋永华,沈金生,金月-舒舒立,黄志明。叶片光周期开花的时间测量机制。植物学报2015;66:441-64。
- 42.
Schönrockn,Bouveret R,Leroy O,Borghi L,KöhlerC,Gruissem W等人。polycomb-group蛋白抑制了花活化剂AGL19.在里面FLC独立的春化途径。基因Dev。2006;20:1667 - 78。
- 43。
Koo Sc,Bracko O,Park Ms,Schwab R,Chun Hj,Park Km,等。控制横向器官发展和开花时间拟南芥MADS-box基因艾奇马特6..工厂J.2010; 62:807-16。
- 44。
Pérez-Ruiz RV, García-Ponce B, Marsch-Martínez N, Ugartechea-Chirino Y, Villajuana-Bonequi M, de Folter S,等。XAANTAL2 (AGL14)是拟南芥茎尖分生组织转变复杂基因调控网络的重要组成部分。摩尔。2015;8:796 - 813。
- 45。
Michaels SD,Amarm。丧失开花轨迹C活动消除了延迟开花的表型fr自主途径突变,但对春化无反应。植物细胞。2001;13:935–41.
- 46。
Scortecci KC,Michaels SD,Amasino RM。鉴定A.MADS-box基因,开花轨迹米,阻遏开花。植物杂志2001; 26:229-36。
- 47。
Ratcliffe OJ,Kumimoto RW,Wong BJ,Riechmann JL。拟南芥分析MADS影响开花基因家族:MAF2通过短时间的寒冷防止春化。植物细胞。2003;15:1159–69.
- 48。
植物同源结构域手指蛋白VIN3-LIKE 2在光周期介导的花抑制因子MAF5的表观遗传调控中起重要作用。美国国家科学研究院2010;107:17029-34。
- 49。
顾晓霞,蒋东,王亚平,何亚平。组蛋白H2B单倍化作用对植物成花转化的抑制作用。植物j . 2009; 57:522-33。
- 50。
顾x,le c,王y,李z,姜d,王y等。拟南芥FLC思工成员形成开花 - 阻遏物配合物与内源和环境提示协调反应。NAT Communce。2013年,1947年; 4
- 51。
Scortecci K, Michaels SD, Amasino RM。基因之间的相互作用FLM和其他开花时间基因拟南芥.植物mol biol。2003; 52:915-22。
- 52。
AGL15和AGL18是拟南芥花转化的抑制因子。植物j . 2007; 50:1007-19。
- 53。
韩建杰,韩敏,安光。开花时间基因的功能分析osmads50.,假定的CO 1过度表达的抑制剂/AGAMOUS-LIKE 20(SOC1/AGL20.)与大米相似。植物j . 2004; 38:754 - 64。
- 54.
刘志辉,李胜,赵立辉,金淑玲,李永胜,崔淑华,等。osmads50.和osmads56.在水稻中调节漫长的一天(LD) - 依赖性开花的功能。植物。细胞环境。2009; 32:1412-27。
- 55.
Kang Hg,Jang S,Chung Je,Cho Yg,A G.表征两粒MADS盒基因控制开花时间。分子细胞。1997; 7:559-66。
- 56.
赵t,倪z,戴y,姚y,nie x,sun q.表征和表达42MADS-box小麦的基因(Triticum Aestivum.L.)。Mol Gen Genomics。2006; 276:334-50。
- 57.
Shitsukawa N, taira C, Kassai KI, Hirabayashi C, Shimizu T, Takumi S, et al.。同一类群三个同源基因间的遗传和表观遗传改变。小麦MADS Box基因的克隆及表达分析。
- 58.
Yasui Y,Mukougawa K,Uemoto M,Yokofuji A,Suzuri R,Nishitani A等。光敏色素相互作用维管植物ONE锌FINGER1和VOZ2冗余调节开花拟南芥.植物细胞。2012; 24:3248-63。
- 59.
在拟南芥中,PIF3以hy5依赖的方式调控花青素生物合成,这两个因子直接结合花青素生物合成基因启动子。植物j . 2007; 49:981 - 94。
- 60。
金志强,李洪波,崔光国,宋鹏,崔国强。PIF3在光敏色素介导的光信号转导中的功能特性。植物细胞。2003;15:2399 - 407。
- 61.
ODA A,Fujiwara S,kamada h,偶联g,mizoguchi t.反义抑制拟南芥PIF3基因不会影响昼夜节律,但导致早开花并增加英国《金融时报》表达式。2月。2004;557:259 - 64。
- 62.
哦E,金Ĵ,公园E,金J-I,康C,彩G. PIL5,一个光敏色素相互作用的碱性螺旋 - 环 - 螺旋蛋白质,是在种子萌发的关键负调节物拟南芥.植物细胞。2004;16:3045-58。
- 63.
Hudson Me,Lisch Dr,Quail ph。这FHY3和FAR1基因编码植物信号通路调节参与基因表达调节的转座酶相关蛋白。工厂J. 2003; 34:453-71。
- 64.
Li G,Siddiqui H,Teng Y,Lin R,WAN X,Li J等。拟南芥昼夜昼夜时钟下的协调转录规范。NAT细胞BIOL。2011; 13:616-22。
- 65.
在拟南芥中,MYB蛋白EARLY-PHYTOCHROME-RESPONSIVE1是一个奴隶昼夜节律振荡器的组成部分。植物细胞。2003;15:2476 - 88。
- 66.
通过基因组序列和微阵列数据的联合分析鉴定光敏色素a调控的基因表达网络中涉及的启动子基序。植物杂志。2003;133:1605-16。
- 67。
Bruce WB,Deng XW,Quail Pha。负作用的DNA序列元素介导植物精致的抑制凤凰基因转录。EMBO j . 1991; 10:3015-24。
- 68。
Ngai N,Tsai Fy,Coruzzi G.光诱导的豌豆As1基因的转录抑制:鉴定顺式元素和切割物质。工厂J. 1997; 12:1021-34。
- 69。
许慧,王玉华,刘雪峰,李建勇。拟南芥Rav1.被油菜素类固醇下调,可能在植物发育过程中起负调节作用。Cell Res.2004;14:8–15.
- 70。
Castillejo C,Pelaz S.之间的平衡概要和Tempranillo.活动的决定英国《金融时报》表达触发开花。Curr Biol。2008; 18:1338-43。
- 71。
王志强,王志强,王志强,等。REVEILLE1是一种myb样转录因子,整合生物钟和生长素途径。美国国家科学研究院2009;106:16883-8。
- 72。
Rawat R,Takahashi N,Hsu Py,Jones Ma,Schwartz J,Salemi Mr,等。Reveille8和Pseudo响应调节器5在拟南芥内时钟形成负反馈回路。Plos Genet。2011; 7:E1001350。
- 73。
法里纳斯B,马斯P。MYB转录因子RVE8/LCL5在组蛋白乙酰化昼夜节律控制中的功能意义。植物J。2011;66:318–29.
- 74。
沟口T,惠特利K,半泽Y,赖特L,沟口男,宋HR,等人。LHY和CCA1是维持拟南芥昼夜节律所需的部分冗余基因。Dev。细胞。2002;2:629-41。
- 75。
Pruneda-帕兹JL,布雷顿G,帕拉A,凯SAA。功能基因组学方法揭示CHE作为的一个组成部分拟南芥昼夜时钟。科学。2009; 323:1481-5。
- 76。
罗晓明,林文辉,朱松,朱建勇,孙勇,范学勇,等。通过GATA转录因子整合光和油菜素类固醇信号通路拟南芥.Dev。细胞。2010;19:872 - 83。
- 77。
Franco-Zorrilla JM,López-Vidriero I,Carrasco JL,Godoy M,Vera P,Solano R.植物转录因子的DNA结合特异性及其定义靶基因的潜力。Proc Natl Acad SCI U S A. 2014; 111:2367-72。
- 78.
Manfield IW,Devlin PF,Jen C,Westhead Dr,Gilmartin PM。在拟南芥GATA基因家族的演化期间,轻响应,昼夜调节和组织特异性表达模式的保守,收敛和分歧。植物理性。2007; 143:941-58。
- 79.
绿PJ、勇MH、库佐M、卡诺村上春树Y、西尔弗斯坦P、Chua NH。pea核蛋白因子GT-1的结合位点要求与细胞光依赖性转录激活所需的序列相关rbcS-3A基因。Embo J. 1988; 7:4035-44。
- 80。
Yadav V, Mallappa C, Gangappa SN, Bhatia S, Chattopadhyay SA。拟南芥中基本的螺旋-环-螺旋转录因子MYC2作为蓝光介导的光形态形成生长的抑制因子。植物细胞。2005;17:1953 - 66。
- 81。
块A,Dangl JL,Hahlbrock K,Schulze-Lefert P.功能边界,遗传细结构和CIS元素的偏差要求介导荷兰芹Chalcone合成酶启动子的光反应性。Proc Natl Acad Sci U S A. 1990; 87:5387-91。
- 82。
陈政司,郭力,施麦克。叶绿体甘油醛-3-磷酸脱氢酶B亚基核基因启动子分析拟南芥.acta botanica sinica(云南植物学报),2001;
- 83。
Yamamoto YY、Ichida H、Matsui M、Obokata J、Sakurai T、Satou M等。通过分析短序列的局部分布来鉴定植物启动子成分。BMC基因组学。2007;8:67.
- 84。
马丁内斯·埃尔南德斯A、洛佩兹·奥乔亚L、阿圭罗·阿斯托加G、埃雷拉·埃斯特雷拉L。光敏色素、隐色素和质体信号激活的最小红细胞光响应单位的功能特性和调节复杂性。植物生理学。2002;128:1223–33.
- 85.
舒尔茨·勒弗特P,丹格尔JL,贝克尔·安德雷姆,哈尔布鲁克K,舒尔茨W。诱导体内DNA足迹定义了欧芹查尔酮合酶基因紫外光激活所需的序列。EMBO J。1989;8:651–6.
- 86.
Borello U,Ceccarelli E,Giuliano G.构成,光响应和昼夜时钟响应因子竞争植物光调节促进剂中不同的L箱元素。植物J 1993; 4:611-9。
- 87.
Elliott Rc,Betzner As,Huttner E,Oakes MP,Tucker WQ,Gerentes D等人。AINTEGUMENTA, 一个Apetala2样拟南芥在胚珠发育和花器官生长中具有多效性作用的基因。植物细胞。1996;8:155–68.
- 88.
Klucher KM, Chow H, Reiser L, Fischer RL。这AINTEGUMENTA拟南芥胚珠和雌配子体发育所需的基因与花的同源性基因有关APETALA2. 植物细胞。1996;8:137–53.
- 89.
Iida A,Kazuoka T,Torikai S,Kikuchi H,Oya Ka。锌指蛋白RHL41在拟南芥中介导光均匀化反应。工厂J. 2000; 24:191-203。
- 90。
Davletova S,Davletova S,Schlauch K,Schlauch K,Coutu J,Coutu J等。锌 - 手指蛋白Zat12在拟南芥中的反应性氧和非生物胁迫信号中起着核心作用。植物理性。2005; 139:847-56。
- 91。
Lois R,Dietrich A,Hahlbrock K,Schulz WA。来自欧芹的苯丙氨酸氨 - 裂解酶基因:引导剂的结构,调节和鉴定和光响应性CIS作用元件。Embo J. 1989; 8:1641-8。
- 92。
Gilmartin PM,Sarokin L,Memelink J,Chua NH。分子开关灯为植物基因。植物细胞。1990; 2:369-78。
- 93。
Degenhardt J,Tobin Emadna。两个紧密定义的植物程度调控元素中的一个的结合活性LHCB.促进剂比绿色植物更丰富。植物细胞。1996; 8:31-41。
- 94。
关键词:光诱导dna结合因子(MNF1),玉米c4 -磷酸烯醇丙酮酸羧化酶(phosphoenolpyruvate carboxyylase, MNF1), dna结合acta botanica sinica(云南植物学报)1998;38:633-46。
致谢
感谢V. A. Koshkin教授提供Sonora、PSL2和NILs种子用于本研究。我们感谢SB RAS基因组学核心设施和人工植物培育联合准入中心ICG SB RAS。
资金
这项研究由俄罗斯科学基金会(http://rscf.ru/)授予№14-14-00161。人工植物种植联合接入中心ICG SB RAS的工作得到了IC&G预算项目No.0324-2016-0001的支持。这篇文章的发表已经由俄罗斯科学基金会(项目编号:14-14-00161)的资助。
可用性数据和材料
本研究期间生成或分析的所有数据都包含在本发布的文章及其补充信息文件中。
关于这个补充剂
本文已作为一部分发布BMC植物生物学第17卷补充1,2017:来自Plantgen 2017的选定文章。补充剂的全部内容可在线获得//www.cinefiend.com/articles/supplements/volume-17-supplement-1.
作者信息
隶属关系
贡献
概念化:AK,EP,ES。正式分析与调查:AK。项目管理,监督:es。写作 - 原始草案准备:AK。写作 - 评论和编辑:AK,EP,ES。所有作者阅读并认可的终稿。
相应的作者
道德声明
伦理批准和同意参与
不适用。
同意出版物
不适用。
利益争夺
提交人声明他们没有竞争利益。
出版商的注意事项
Springer Nature在发表地图和机构附属机构中的司法管辖权索赔方面仍然是中立的。
附加文件
附加文件1:表S1。
开花基因表达模式的相关系数。粗体表示有意义的值(P.= 0.001)。PI表示光周期不敏感和PSL意味着光周期敏感样品。(XLSX 26 KB)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Kiseleva,A.A.,Potokina,E.K.&Salina,E.A.特点Ppd-B1小麦近等基因系的表达调控及其对开花时间的影响。BMC植物BIOL.17,172(2017)。https://doi.org/10.1186/s12870-017-1126-z.
关键词
- 光周期敏感性
- 开花的时间
- Ppd-B1
- 光敏色素
- 常见的小麦