背景
微管是蛋白质微管蛋白的高度动态组合。它们的动态行为对有丝分裂至关重要,有丝分裂是染色体分裂形成新细胞的过程。微管动力学在细胞周期被内源性细胞调节器高度调节。此外,许多抗有丝分裂药物和天然化合物改变微管的聚合动力学,阻断有丝分裂,从而通过凋亡诱导细胞死亡[1]。该药物对微管蛋白的不同部位和微管内的不同位置结合,它们对微管动态产生了多样化的影响。然而,通过它们的抑制微管动态的常见机制,它们都在中期/期源转变中嵌入有丝分裂,并诱导细胞死亡。用不同的抗微管蛋白药物治疗后,还证明了根据细胞类型和实验条件,细胞凋亡在间差或有丝分裂中发生。2,3.]。
由于使用这些药剂和细胞凋亡而导致的细胞周期扰动的关系是很差的。通过在适当的抗性线中的鉴定和映射,已经获得了大多数抗敏药物的结合和作用方式的洞察。不幸的是,到目前为止,关于行动方式没有强有力的证据N-苯基氨基甲酸酯,有效的抗有丝分裂除草剂。尽管,最近的研究表明苯基氨基甲酸酯和苯并咪唑可以竞争β-微管蛋白的结合位点。苯并咪唑与不同的真核生物β-微管蛋白相互作用,对这些抗微管药物的耐药性可能是由β-微管蛋白的点突变引起的,β-微管蛋白用Ala、Asp、Gln、Lys、Val或Gly替换Glu-198,或用Tyr替换phe200 [4]。由于它被发现在真菌β-管蛋白的198位的氨基酸取代,导致对苯基氨基甲酸甲酸酯的负抗抗性,但是从ALA-165的Leu-250,Val的变化phe,来自Thr-237的Ala是苯基氨基甲酸酯交叉的原因-ressistance [5]。阐明异丙基的敏感/抗性 -N- 苯甲酯(IPC)抗性N. Sylvestris.突变体(6[苯并咪唑对不同浓度的Nocodazole及其对微管动力学和细胞周期进展的影响。在Nocodazole治疗后发现了两种不同的凋亡反应和对照和突变线的模式。
材料和方法
将Nocodazole(Sigma)溶解在二甲基磺酰氧化物(DMSO)中并储存在-20℃。Nocodazole治疗期间的最终DMSO浓度不超过0.5%。加入0.5%DMSO给对照样品。控制和IPC抗性突变体的根细胞N. Sylvestris.以各种浓度(0.01,0.1,10,100和500mKm)用Nocodazole在24小时内暴露线,然后在乙醇/乙酸混合物(3:1)中固定12小时。对于染色体计数和有丝分裂的分类,将载玻片染色,用acetoorcein(1%乙酸中1%溶液)染色24小时并检查。在Carl Zeiss光学显微镜上的1000x放大倍数下计算和分析细胞。
结果
在控制和IPC抗性中N. Sylvestris.不同浓度的诺考达唑处理不仅使有丝分裂指数从约7%增加到~ 12-13%,而且在有丝分裂的不同阶段出现有丝分裂象扰乱(见表)1和表2)。在药物效应后,在IPC抗性植物的预先存在下没有任何干扰,而Nocodazole浓度为10-500 mkm,则在剂量依赖的方式下揭示它们在对照植物细胞中(表1)。我们发现,这两种突变株的中期对诺考达唑更敏感,但对照的中期、后期和末期的干扰率大约是突变株的2 - 3倍(见表)1和2)。
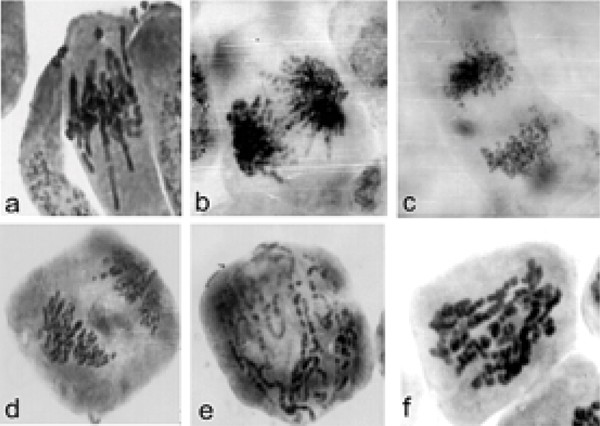
发现还发现不同的诺科唑浓度在控制和突变线中迅速诱导凋亡过程,但是诺科唑治疗后的细胞反应完全不同。甚至低浓度的Nocodazole(0.1-10 mkm)诱导的核DNA损伤:染色质雷拷贝和DNA碎片在预壳,中源性和对照植物细胞的外邦裂解(见图)1)。虽然高水平的Nocodazole(100-500 mkm)诱导了在包括间间的细胞周期的所有阶段的总DNA碎片。
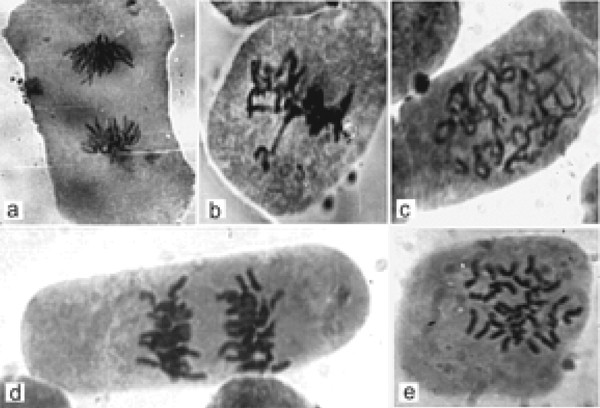
浓度为0.1MKM Nocodazole,仅在IPC抗性植物细胞中产生显着的中源性。发现在突变体系的细胞中,在染色体中的染色体延迟期间在中期的染色体隔离期间,10分钟的Nocodazole治疗诱导出现C-有丝分裂,染色体延迟和染色体 - 桥梁形成在不同阶段的有丝分裂(图2)。
高水平的Nocodazole(100-500mkm)导致细胞中的剧烈改变 - C-丝分裂,异常纺锤体形成,随后具有更频繁的异常情况(例如,多极化物,并且由于这,但是明星神木子的出现)。在任何浓度的Nocodazole治疗后,在IPC抗线中没有观察到任何DNA碎片。
结论
众所周知,用诺考达唑等微管干扰剂处理细胞可激活应激反应通路,阻滞细胞周期,诱导细胞凋亡。早期,诺可达唑常用于检测微管在囊泡运输中的作用[7],以诱导多倍体[8),非整倍性(9],当然还研究不同细胞的细胞凋亡[8- - - - - -13]。经常是Nocodazole效应导致DNA碎片,一个凋亡的一个标志。在我们的数据中,Nocodazole治疗揭示了对照的DNA碎片,对IPC敏感,N. Sylvestris.仅限线。在Nocodazole暴露后,未发现突变计划细胞中的任何DNA碎片。然而,在两条线中观察到细胞死亡。
我们发现诺考达唑增加了两种细胞系的有丝分裂指数,但也增强了凋亡反应。这些结果与早期在动物细胞上获得的数据一致[10]。我们还发现IPC抗性N. Sylvestris.突变细胞对控制的壬二唑治疗具有较少的敏感性N. Sylvestris.在中期、后期和末期的干扰率大约是在中期的2 - 3倍N. Sylvestris.控制线与突变体一体化相比。突变植物细胞的预脉冲中的微管对所有使用的Nocodazole浓度抵抗。如图所示,IPC抗性植物中的这种术阶段没有干扰。然而,在突变体中,在突变体中揭示了中期,神木语和斑斑酶的紊乱,在这种药物效果后作证了细胞自杀程序。
因此,我们可以总结IPC抗性植物细胞对Nocodazole的耐抗性而不是控制线。Nocodazole浓度从0.1〜500 mkm唤起透明细胞凋亡N. Sylvestris.植物细胞表征有丝分裂骤停和DNA碎片。它在IPC抗性细胞中引起细胞死亡过程,但在另一个不同的细胞降解方面。可以得出结论,在两种不同的植物系中,相同的诺科唑治疗可以诱导细胞抑制作用,然后是两种不同的植物死亡模式。最近,在相同的抗微生药草药物效应之后,还发现了两种不同的细胞动物在两种不同的细胞死亡模式中发现了两种不同的细胞死亡模式[3.]。据报道,Nocodazole具有独立于微管的脂肪效应[7,或如上文所述,不同类型的细胞可能有不同的凋亡反应。
可以假设Nocodazole治疗后对照植物细胞中较高的凋亡率也可能是突变突变体微管蛋白或突变微管相关蛋白(S)赋予IPC的抗体的后果N. Sylvestris.突变体线。诺考达唑对模式植物细胞系细胞作用的实验正在进行中。
参考
- 1.
Mollinedo F,Gajate C:微管,干扰剂和细胞凋亡。细胞凋亡。2003,8:413-450。10.1023 /答:1025513106330。
- 2.
Tsuchida T,Yoshimura K,Shirayama Y,Kawamoto K:Copemid诱导的培养人胶质瘤凋亡:电子显微镜和共焦激光微观观察在细胞周期不同阶段中分类的细胞。细胞测定法。1998年,31:295-299。10.1002 /(SICI)1097-0320(19980401)31:4 <295 :: AID-CYTO9> 3.0.co; 2-i。
- 3.
微管拮抗剂对肿瘤细胞粘附和漂浮培养的不同凋亡反应和模式的影响。中国生物医学工程学报。2003,19(4):497 - 503。
- 4.
Davidse LC,Ishi H:苯并咪唑的作用机制的生化和分子方面,N-phenylcarbamates和N- 苯甲甲脒肟和真菌中这些化合物的抗性机制。抗真菌剂 - 发现和行动方式。编辑:Dixon GK,Copping LG,Hollomon DW。BIOS Scientific Puppishers Ltd;1995年:305-321。
- 5.
富士武拉M,Kamakura T,Inoue H,Yamaguchi I:β-小管蛋白基因的氨基酸改变粗糙脉孢菌赋予抵抗碳纳西姆和二氯卓芳基。Curr Genet。1994年,25:418-22。10.1007 / BF00351780。
- 6.
Yemets A,Stelmakh O,Kundelchuk O,Blume Yab:获得和分析异丙基 -N- 苯胺氨基甲酸酯抗性线尼古利亚娜物种。细胞BIOL INT。2003年,27:307-310。10.1016 / S1065-6995(02)00348-7。
- 7。
MOLERO JC,WHITEHED JP,Meerloo T,James De:Nocodazole通过独立于微管的机制抑制了3T3-L1脂肪细胞中的胰岛素刺激的葡萄糖。J Biol Chem。2001,276:43829-43835。10.1074 / JBC.M105452200。
- 8。
Verdoodt B, Decordier I, Geleyns K, Cunha M, Cundari E, Kirsch-Volders M:高浓度纺锤体毒性诺科达唑诱导多倍体和细胞凋亡。诱变。1999,14:513-520。10.1093 /防止发酵/ 14.5.513。
- 9。
Decordier I,Dillen L,Cundari E,Kirsch-Volders M:用微管抑制剂治疗后通过细胞凋亡消除微核细胞。诱变。2002,17:337-344。10.1093 / MUTAGE / 17.4.337。
- 10。
Bumbasirevic V, Skaro-Milic A, Mircic A, Djuricic B:微管干扰药物诱导体外正常小鼠胸腺细胞凋亡激光与光电子学进展。
- 11.
Ikegami R,张家,Rivera-Bennetts Ak,Yager Td:通过用纺丝斯特比石药剂诺莫唑治疗激活早期斑马鱼胚胎中的中期检查点和凋亡计划。Zygote。1997年,5:329-350。
- 12.
Kook S, Shim SR, Kim JI, Ahnn JH, Jung YK, Paik SG, Song WK: nocodazole诱导大鼠-1细胞凋亡过程中黏附蛋白的降解。细胞生物学杂志,2000,18:1-7。10.1002 / (SICI) 1099 - 0844 (200001/03) 18:1 < 1:: AID-CBF840 > 3.0.CO; 2 n。
- 13.
张华,史旭,张庆军,张庆军:诺可达唑诱导p53依赖性c-Jun n -末端激酶激活对结肠癌HCT116细胞凋亡的影响。中国生物医学工程杂志。2002,27(4):436 -436。10.1074 / jbc.M203214200。
作者信息
隶属关系
通讯作者
权利和权限
开放获取本文在“生物资源”中央有限公司的许可下公布了这是一个开放式访问条款,分配根据创意公约归因许可证的条款(https://creativecommons.org/licenses/by/2.0.),允许在任何媒介上无限制地使用、分发和复制,但必须正确引用原作。
关于这篇文章
引用这篇文章
yemets,a.i.,stel'makh,o.a。&Blume,Y.B.诺可达唑可引起异丙基细胞凋亡N- 氨基氨基氨基酸酯抗性和敏感尼古利亚娜线条,但两种不同的方式。BMC植物杂志5,S37(2005)。https://doi.org/10.1186/1471-2229-5-S1-S37
关键词
- Nocodazole.
- 微管的动态
- 诺考达唑治疗
- Phenylcarbamates
- 抗杀菌药物