摘要
植物的自然环境是由一系列复杂的非生物胁迫和生物胁迫组成的。植物对这些胁迫的反应同样复杂。系统生物学方法通过在复杂的网络中识别调节枢纽,促进了多目标的方法。系统生物学将生物体的分子部分(转录本、蛋白质和代谢物)纳入功能网络或模型,这些功能网络或模型旨在描述和预测该生物体在不同环境中的动态活动。从生理水平到分子水平,综述了植物对非生物胁迫响应的研究进展。强调了从组学数据集集成中获得的新见解。确定了我们知识上的差距,为未来的作物改良研究提供了更多的重点领域。
评论
最近生物技术的进展大大改变了基因发现和功能基因组学的能力。首次,我们现在可以获得具有转录物,蛋白质和代谢物分析的细胞的整体“快照”。这种“系统生物学”方法允许更深入地了解生理学复杂的过程和蜂窝功能[1.]. 从收集的大量数据中可以形成新的模型,并从这些模型中产生新的假设。
了解基因的功能是基因组时代的主要挑战。虽然各个部件的许多功能未知,但是它们的功能有时可以通过与其他已知部分的关联推断,从而更好地了解整个生物系统。高吞吐量OMICS技术促进了新基因和基因功能的鉴定。此外,基因组级的网络重建是量化和表征基因型的关键,以表型关系[2.].
本文从转录组学、代谢组学、蛋白质组学和其他综合方法等方面综述了近年来植物非生物胁迫响应系统分析的研究进展。由于空间限制,我们试图强调重要的观点,特别是从系统生物学和组学方法在最近的环境压力研究中提供的。
对环境的植物反应是复杂的
植物是复杂的有机体。要估计一株植物的细胞总数是很困难的。据估计,一个简单的拟南芥叶片的近轴表皮层和栅栏叶肉细胞的数量分别约为27000个和57000个细胞[3.].7 .表皮层正面的另一种估计TH.拟南芥的叶子接近10万个细胞[4.每厘米)2.叶面积。拟南芥植物可以生长为14克鲜重,叶面积为258厘米2.(11克鲜重)[5.].因此,我们估计一株拟南芥可能有大约1亿个细胞(假设每克新鲜重量有240到1100万个细胞,则细胞数量在3000到1.5亿个之间)。假设一棵100万公斤的红杉可能有70万亿个细胞,其细胞大小是拟南芥细胞的100倍。将其与发育变化、细胞分化和与环境的相互作用结合起来,很容易看到这种复杂性有无数种排列方式。
细胞内具有多种细胞器的额外复杂性,核,血浆和线粒体基因组之间的相互作用,以及表现为符合符合符合符号的域的细胞领土,其能够在诸如诸如诸如Plasmodesmata上进行控制的转录因子和发育阶段。典型的植物细胞具有超过30,000个基因和未知数量的蛋白质,其可具有超过200名已知的翻译后修饰(PTMS)。细胞(和植物)对其环境的分子反应非常复杂。
作物生产的环境限制
1982年,博耶尔指出,环境因素可能限制作物产量高达70% [6.].2007年粮农组织的一份报告指出,全球只有3.5%的土地面积没有受到某些环境限制的影响(见表3.7 inhttp://www.fao.org/docrep/010/a1075e/a1075e00.htm).虽然很难获得对非生物胁迫对作物生产影响的准确估计(见表中的不同估计数1.)显而易见的是,基于受影响的土地面积的百分比和针对各种非生物应激的科学出版物数量的百分比继续对植物产生重大影响(表1.).如果有什么不同的话,今天的环境影响甚至更为显著;由于可耕地的持续减少、水资源的减少以及全球变暖趋势和气候变化的加剧,预计未来许多地区“五大”粮食作物的产量将下降[7.].
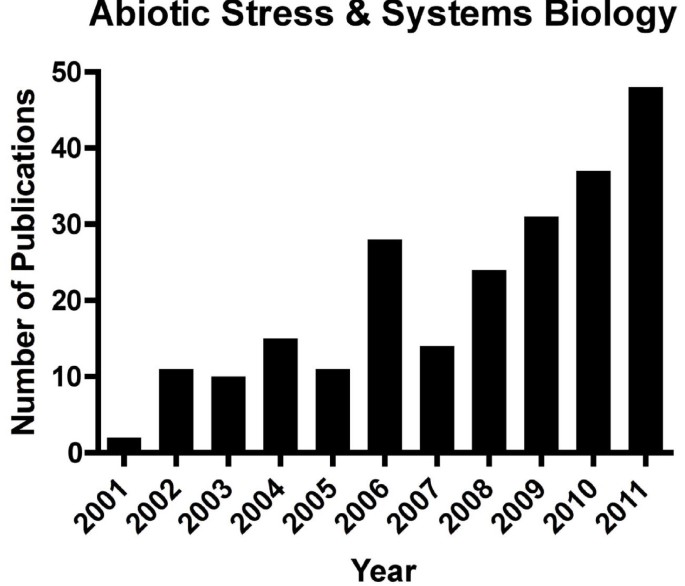
这种日益增长的关注反映在越来越多的侧重于非生物胁迫的出版物上。例如,自从2002年Kitano对系统生物学的关键评论以来[1.],使用系统生物学方法对植物中非生物胁迫发表的论文数量呈指数增加(图1.).
多因素限制植物生长
从根本上说,植物的生长需要能量(光)、水、碳和矿物质营养。非生物胁迫是指使生长和产量低于最佳水平的环境条件。植物对非生物胁迫的反应是动态和复杂的[8.,9];它们都是弹性(可逆的)和塑料(不可逆的)。
植物对胁迫的反应依赖于受胁迫影响的组织或器官。例如,根系对胁迫的转录反应是特定于组织或细胞的,并且根据所涉及的胁迫有很大的不同[10].此外,压力的水平和持续时间(急性和慢性)对反应的复杂性有显著影响[11,12].
水分亏缺通过减少扩张细胞对水分的吸收来抑制植物生长,并通过酶作用改变细胞壁的流变学特性;例如,通过细胞壁酶上活性氧(reactive oxygen species)的活性[8.].此外,水分不足会非酶作用改变细胞壁;例如,通过果胶酸盐和钙的相互作用[13].此外,对膨胀细胞的水导受水通道蛋白活性和木质部栓塞的影响[14–17].在任何抑制光合作用或呼吸之前发生水缺损的初始生长抑制[18,19].
生长受限的部分原因是生长区内新分裂的细胞包围木质部的基本性质[20.,21].这些细胞作为一个阻力,以防止水流向扩张的表皮细胞,使植物有必要发展一个更大的水势梯度。植物的生长受到渗透调节或传导水分的能力的限制。表皮细胞可以通过渗透调节增加水势梯度,这主要是由韧皮部的溶质提供的。这些溶质由光合作用提供,光合作用也为植物的生长和其他代谢功能提供能量。在长期胁迫下,CO的光合作用由于气孔限制而下降2.吸收和增加光抑制的困难,在耗散过剩的光能[12].
对非生物胁迫和生长抑制的最早的代谢反应之一是蛋白质合成的抑制[22–25]蛋白质折叠和加工增加[26].当压力变得更严重时,能量代谢会受到影响(例如糖、脂质和光合作用)[12,27,28].因此,响应压力的代谢存在逐渐和复杂的变化。
中央监管机构限制工厂的关键工序
对非生物应激的植物分子反应涉及与许多分子途径的相互作用和串扰[29].系统生物学和组学方法已被用于阐明植物对非生物胁迫反应的一些关键调控途径。
在许多非生物胁迫中,最早的信号之一涉及ROS和活性氮物种(RNS),它们修饰酶活性和基因调控[30.–32.]. ROS信号对非生物胁迫的响应及其与激素的相互作用已被全面综述[32.].ROS和RNS形成一个协调的网络,调节植物对环境的多种反应;关于活性氧(ROS)对植物响应非生物胁迫的氧化效应的研究很多,但仅有少数研究记载了RNS的亚硝化效应[30.].
激素也是植物对非生物胁迫反应的重要调节因子2.).最重要的是脱落酸(ABA)和乙烯[33.].ABA是对环境应力的许多植物反应的中央调节因子,特别是渗透胁迫[9,34.–36.].它的信号传导可以非常快而不涉及转录活性;ABA通过离子和水运输过程的生化调控来控制气孔开度就是一个很好的例子[35.].对ABA有较慢的反应涉及转录反应,转录反应调节生长、萌发和保护机制。
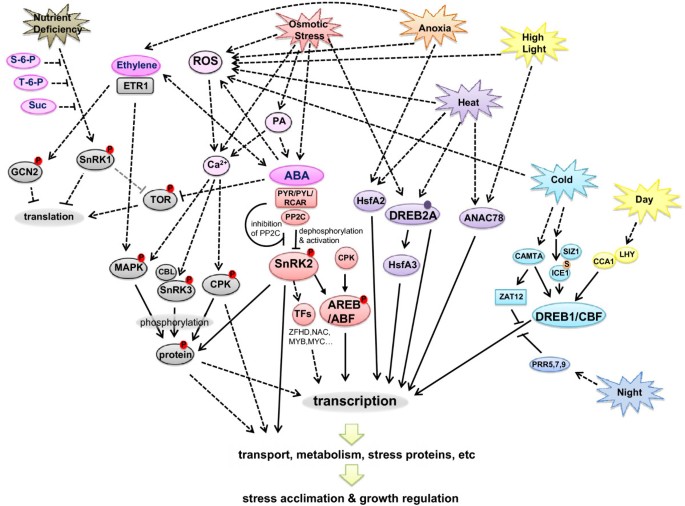
对非生物应激的植物反应信号网络的简化工作模型.椭圆形代表蛋白质、代谢物或过程。代谢物呈洋红色。磷酸化的蛋白质有红色的圆圈,里面有一个P。Sumoylated蛋白有一个橙色的圆圈,里面有一个S。紫色实圈表示需要修改才能激活DREB2。实线表示直接连接;虚线表示间接的联系(通过一些中间分子)。灰色的线表示这种反应在植物中没有表现出来。为了简化模型,并不是所有的应力和激素效应的联系和细节都显示在这张图中。 Abbreviations: ABA (abscisic acid), ANAC (Arabidopsis NAC domain-containing protein), CAMTA (calmodulin-binding transcription activator), CBL (calcineurin B-like interacting protein kinase), CCA (circadian clock associated), CPK (calcium-dependent protein kinase), DREB/CBF (dehydration response element binding protein/C-repeat binding factor), ETR1 (ethylene response 1), GCN2 (general control non-repressible 2), HSF (heat shock factor), ICE (inducer of CBF expression), MAPK (mitogen-activated protein kinase), LHY (late elongated hypocotyl), PA (phosphatidic acid), PP2C (protein phosphatase 2C), PRR (pseudo response regulator), PYR/PYL/RCAR (ABA receptors), RNS (reactive nitrogen species), ROS (reactive oxygen species), SIZ (SAP and Miz domain protein), SnRK (sucrose nonfermenting-1 related kinase), TFs (transcription factors), TOR (target of rapamycin), ZAT (zinc finger protein).
最近,ABA信号转导的必要成分已被确定,其作用方式也被阐明[37.]. 目前的ABA信号传导模型包括三个核心成分:受体(PYR/PYL/RCAR)、蛋白磷酸酶(PP2C)和蛋白激酶(SnRK2/OST1)[38.,39.].PYR/PYL/RCAR蛋白被两个独立的小组鉴定为可溶性ABA受体[38.,39.].第2型蛋白磷酸酶(PP2C)包括ABI1和ABI2,首先从ABA不敏感的拟南芥突变体中鉴定出来abi1-1和abi2-1,它们是ABA信号的全球性负调控因子[40].SNF1相关蛋白激酶2(SNRK2)是分离为ABA活化蛋白激酶的蛋白质激酶系列[41.,42.]. 在拟南芥中,这个家族的三个成员SRK2D/SnRK2.2、SRK2E/OST1/SnRK2.6和SRK2I/SnRK2.3正性和全局性地调节ABA信号,如三基因敲除突变体所示SRK2D SRK2E SRK2I.(srk2dei./snrk2.2 snrk2.3 snrk2.6,这缺乏ABA回应[43.].PYR/PYL/RCAR - PP2C - SnRK2复合物在ABA感知和信号转导中起关键作用。
对脱水和盐度胁迫的转录调控的研究揭示了aba依赖和aba独立的途径[44.].水分受限条件下的细胞脱水诱导内源ABA水平的增加,从而触发下游靶基因编码信号传导因子、转录因子、代谢酶等[44.].在营养阶段,aba反应基因的表达主要受被称为AREB/ABFs的bZIP转录因子(TFs)调控,这些转录因子以aba反应元件(ABRE)依赖的方式发挥作用[45.–47.].ABA信号级联的激活增强了植物对脱水胁迫的耐受性。相反,脱水响应顺式作用元件,DRE/CRT序列及其DNA结合ERF/ ap2型tf, DREB1/CBF和DREB2A,与aba独立脱水和温度响应通路相关[44.]. DREB1/CBFs在冷反应基因表达中的作用[48.,49.],而dreb2参与脱水反应和热反应基因的表达[50.].
乙烯也参与许多应激反应[51.–53.],包括干旱、臭氧、洪水(缺氧和缺氧)、热、冷、伤人和UV-B光[31.,33.,53.].乙烯信号转导是很明确的[51.,52.,在此不作详细讨论。已知干旱期间乙烯和ABA之间存在相互作用[31.,水果成熟[54.,55.]和花蕾休眠[56.].所有这些相互作用使得植物对胁迫的反应非常复杂[12,31.,52.].
在酵母中,已知的蛋白质合成和能量的中枢调节因子是SnRK1 (Snf1/AMPK), TOR1和GCN2 [57.–60.].这些蛋白质很大程度上是由酶的磷酸化控制的;这三种都是蛋白质激酶,在压力条件下作为代谢协调的关键枢纽[61.].在植物中,TOR活性受到渗透胁迫和ABA的抑制[62.]和GCN2活性受到紫外线、氨基酸饥饿、乙烯和冷胁迫的刺激[63.].SnRK1对能量消耗有反应,如低光、营养剥夺或缺氧条件[64.,65.],并与葡萄糖和ABA信号通路相互作用[66.].这种协同反应的结果之一是抑制蛋白质合成。
许多非生物胁迫直接或间接地影响糖的合成、浓缩、代谢、运输和储存。可溶性糖是与光、氮和非生物胁迫相互作用的潜在信号[67.–69.]调节植物生长和发展;至少10%的拟南芥基因是糖响应[68.].突变分析表明,糖信号传导与乙烯相互作用[70],阿坝[71.,72.] Cytokinins [73.和光[74.,75.]. 在葡萄中,糖和ABA信号通路相互作用以控制糖的运输。从葡萄浆果中分离的ASR(ABA,胁迫和成熟诱导)蛋白被ABA和糖协同上调,并上调己糖转运体的表达[76.].VVSK1是一种GSK3型蛋白激酶,也可被糖和ABA诱导,并上调几种己糖转运体的表达[77.].
糖饥饿和缺乏光照等应激会刺激SnRK1的活性([64.].SUC-P合成酶(SPS),3-羟基-3-甲基戊齐芳基还原酶,硝酸还原酶和海藻糖-6-P合成酶受到SNRK1磷酸化的负调节[78.],表明SNRK1通过磷酸化关键代谢酶调节代谢。翻译后氧化钇调制Adpg-eyrophorylase,通过SNRK1进行淀粉合成的关键控制,提供了磷酸化,氧化还原和糖代谢之间相互作用的有趣示例[79.].在拟南芥中,SNRK1激酶活性本身由GRIK1和GRIK2增加,其磷酸化SNRK1催化亚基的苏氨酸残留物[78.].SNRK2与ABA进行互动,用于控制气孔孔,并参与植物原代新陈代谢的调节。SNRK2.6的组成型表达急剧增强叶片中的蔗糖和总可溶性糖水平,大概通过控制SPS表达式[80].
共表达分析确定了调控中心
转录组学数据的一个重要应用是使用在线分析工具(如ATTED-II)对目的基因进行共表达分析。83])。这种方法对于理解基因-基因相关性和寻找靶条件下的主控基因是非常有前途的。
在一系列开创性的论文中,平井等人。84,85利用整合转录组学和代谢组学的方法,在拟南芥中发现了调节硫代葡萄糖苷生物合成的MYB转录因子。硫代葡萄糖苷代谢中的基因和代谢物被发现是协调调控的[84].共表达分析用于确定正向调节硫代葡萄糖苷代谢的两种MYB转录因子[85].然后,使用其中一种转录因子的爆震突变体和异位表达用于验证其在葡糖苷代谢中的阳性作用。将先前的未识别基因分配给这种生物合成途径,构建了监管网络模型[85].
Mao等人[86]用非靶向方法对拟南芥1094个微阵列进行了基因共表达网络分析。他们在这个网络中确定了382个模块。节点数最多的三个模块分别是光合作用、氧化应激响应和蛋白质合成。许多模块还涉及对环境压力的反应。他们用微阵列的一个子集构建了一个低温诱导的基因网络。对生长素刺激的反应是18个显著模块中最多的。
Carrera等人[87]利用InferGene构建拟南芥基因组调控模型。他们使用了1486个微阵列实验的数据集。10个基因被预测为影响最多基因数量的最核心调控枢纽。这组基因包括生长素(KAN3)、赤霉素(MYB29)、脱落酸(MYB121)、乙烯(ERF1)和胁迫反应(ANAC036)相关的转录因子基因。他们计算出了前12个基因子网络;其中4种与生物胁迫和非生物胁迫有关。在拟南芥调控网络AtRegNet中,预测的25%最相关转录因子的相互作用中有85%被验证http://arabidopsis.med.ohio-state.edu/moreNetwork.html.
Lorenz等人[88]研究了火炬松根系对干旱的响应,并在转录网络中确定了一些枢纽。排名靠前的中心包括硫氧还蛋白,一种肌醇转运体,心磷脂合成酶/磷脂酰转移酶,9-顺式-环氧类胡萝卜素双加氧酶,玉米素o -葡萄糖基转移酶和SnRK2激酶。这些基因参与磷脂代谢、ABA生物合成和信号转导、细胞分裂素代谢;它们似乎在压力调解中很重要。
Weston等人[89使用加权共表达分析来定义六个模块,用于拟南芥对非生物应激的反应。共同响应模块中的两个集线器是涉及Ca信号传导的Ankyrin重复蛋白质和基因。他们创建了一个基因组签名的汇编,并将它们与其共表达分析联系起来。使用相同的方法,他们将分析扩展到三种不同植物物种的热量和光线的反应[90].物种特异性反应涉及耐热性、热休克蛋白、ROS、低聚糖代谢和光合作用。
时间序列分析揭示了压力反应的多个阶段
时间序列分析允许一个区分主要和次要反应对压力。在综合时序转录组织分析对不同拟南芥ORGANS的7个非生物胁迫[28],阐明了一组对各种胁迫非特异性反应的核心基因(50%为转录因子)。其中包括AZF2、ZAT10和ZAT12转录因子。这种最初的反应被认为与能量稳态的重新调整有关,以应对压力。随着时间的推移(1小时后),出现了更多与应力有关的轮廓。
孙等人[91]对拟南芥9种不同的非生物胁迫的时间序列数据进行了复杂度量。他们发现,与低复杂度指标的基因相比,具有较高复杂性指标的基因具有更长的5'基因间区和更大的顺式调控基序密度。许多顺式调控基序被鉴定与先前的应激反应特征有关。
Vanderauwera等人[92]研究了过氧化氢(H2.O2.)利用微阵列分析高光胁迫下的信号传导。他们发现H2.O2.它不仅参与了高光胁迫的信号转导,而且还参与了盐度、水分亏缺、热、冷胁迫的信号转导。H2.O2.是花青素代谢途径的小、70 kD热休克蛋白和许多基因的关键调控因子。花青素在植物中扮演着重要的抗氧化剂角色。一种特异性的udp -糖基转移酶UGT74E2受H2.O2..在随后的研究中[93], UGT74E2对H2.O2.和糖基化的吲哚-3-丁酸(IBA)改性唾液稳态,植物形态,提高盐度和水缺损的应力耐受性。此外,发现植物蛋白与ABA相互作用,增加了植物的ABA敏感性。沉默聚(ADP-核糖)聚合酶在拟南芥中提高了高光应力耐受性[94,95]. 非生物胁迫耐受性的提高部分归因于能量利用效率的提高和氧化应激的减少[94,95].
Kusano等人。[96]通过代谢组学和转录组学分析,对UV-B光对拟南芥的影响进行了时间序列实验。他们发现,植物的反应分两个阶段,第一阶段是初级代谢物的上调,第二阶段是保护性次生代谢物的诱导,尤其是酚类物质。酚类物质的诱导与苯丙素途径相关的转录本相对应,但初级代谢的转录本的一致性较差,表明该途径可能受到其他机制(如激酶)的调控。
对干旱的转录组反应可以随着时间的时间而变化[97].这些反应似乎与荷尔蒙和其他在一天中自然变化的压力途径相互作用。发现了一组较小的核心基因,它们在一天中的任何时候都有反应。与之前的两项研究相比,这组基因被缩减为19个基因,包括一个NF-YB转录因子、几个PP2Cs、一个CIPK7和一个硫酸盐转运体。
对生长在两个不同地点的三个不同基因型杨树无性系的干旱胁迫研究和微阵列分析揭示了其对环境的表观遗传调控[98].在环境中历史较长的树木无性系显示出更大的DNA甲基化变化,从而影响了它们对干旱的反应。
发现葡萄藤的射击尖端生长对渗透压力比基因表达在逐渐渗透压力对葡萄葡萄酒的影响[27].蛋白质组学数据表明,蛋白质表达的变化与基因表达(G.R. Cramer,未发表的结果)相关联。转录组织数据和代谢组数据的整合表明盐度和异形水缺陷的响应的不同差异[27].干旱强调的植物在渗透调整和防止ROS和Photo incition的保护中诱导更大的反应。盐度在能量代谢,离子转运,蛋白质合成和蛋白质命运中的过程中诱导更大的反应。与类似短期应力的比较[11]表明逐渐,慢性应激反应比急性应激反应更复杂。
利用转录组学、蛋白质组学和代谢组学研究了田间水分不足对赤霞珠浆果(红葡萄酒葡萄)的影响[99–102]. 综合分析证实,苯丙素途径(包括花青素和二苯乙烯生物合成)在浆果果皮中以组织特异性方式被水分亏缺上调。水分亏缺影响浆果的其他代谢途径,包括ABA、氨基酸、类胡萝卜素、脂肪、糖和酸代谢。这些变化大多与果实品质性状的改善有关。
同样,Zamboni等人[103]在转录组织,蛋白质组学和代谢组科水平上调查浆果开发和凝结在葡萄树中。从四个发育阶段和三个凋亡间隔的多步假设方法,使用分层聚类策略(多元o2pl技术)实现了一体化,确定了链接转录物,蛋白质和代谢物的阶段特异性功能网络,为关键分子提供了重要的见解确定葡萄酒质量的过程。假设驱动的方法确定了在凋亡的分子事件中涉及的转录物,蛋白质和代谢物变量,这主要反映了一般应激反应。浆果成熟和凋亡的特征在于次级代谢物如酰化的花青素的积累,但跳跃还涉及激活渗透和氧化应激反应基因和斯蒂芬蛋白的产生和产税素。
Usadel等人[104]使用转录组,代谢组合和酶活性来研究冷温度随时间随时间的影响。他们发现一些酶活性和代谢物迅速发生变化,而其他酶活性则变化得更慢。酶活性的早期变化(6小时)与转录性丰富不良,但在78小时后,这些相关性得到大大提高。新陈代谢的大部分长期变化都可以归因于CBF调节件。
Caldana等人[105使用代谢组科和转录组织分析进行了具有不同温度和光强度的复杂时序序列实验(22个时间点)。这种高分辨率时间序列实验显示,代谢活动比转录活动更快地响应,表明在应激反应的早期阶段的代谢和转录之间断开和表明酶活性可能发挥重要作用。在1小时内发生变化的环境常见的代谢反应,包括能量代谢和翻译减少,并增加了信号级联的基因转录。在稍后的时间点,揭示了病情依赖性新陈代谢。例如,衍生自氨基酸的蛋白质降解和能量代谢在温热的温度和黑暗中发生。氨基酸分解代谢似乎在没有光合作用的情况下促进TCA循环。
Yun等人[106]以水稻对轻度低温胁迫(10℃)的反应为特征。他们发现转录调控在96小时内由三个动态复杂的阶段组成。早期转录阶段似乎是由氧化信号(H2.O2.),并导致随后诱导细胞防御和拯救机制。结合微阵列的时间共表达数据、启动子基序富集分析和氧化反应,构建了不同反应阶段的转录调控网络模型。bZIP-TGA转录因子模块(as1/ocs/TGA)是7个转录因子模块之一,是第一阶段最相关的调控模块。每个转录因子模块都由一组转录因子组成,表现出对低温调控的组合控制。这一网络的响应速度与耐寒性有关。抗冷基因型对这一转录调控网络的响应比敏感基因型快得多。此外,本研究鉴定的转录因子位于水稻基因组中已知的生长和胁迫qtl内。
整合组学分析确定分子网络功能的非生物应激反应
综合组学分析显著地增加了我们对植物对各种胁迫的反应的理解。这些分析对于全面分析非生物胁迫反应,特别是胁迫信号转导途径的最终步骤具有重要意义。
对转录组和代谢组的综合分析成功地证明了基因和代谢物之间的联系,阐明了脱水条件下ABA的广泛信号输出[107]和DREB1/CBF转录因子对低温的响应[108,109].代谢谱显示,ABA在脱水过程中积累,调节各种氨基酸和糖的积累,如葡萄糖和果糖。特别是BCAAs(支链氨基酸)、糖精、脯氨酸和胍丁胺的脱水诱导积累与其关键生物合成基因(BCAT2,LKR / SDH.,P5CS1,ADC2,分别),受内源ABA调控[107].此外,转基因拟南芥的代谢物分析过表达的DREB1A / CBF3揭示了低温调节代谢物(单糖,二糖,寡糖和糖醇)之间存在着惊显的相似性,并且由DREB1A / CBF3转录因子调节调节[108,109]. 特别是,低温诱导的半乳糖醇和棉子糖的积累与Gols3基因是DREB1A / CBF3的直接靶向[108,109].Maruyama等人[109]还分析了DREB2A的过度表达,这并没有增加转基因植物中任何低温调节代谢物的水平。DREB2A-CA在转基因植株中的过表达提高了其对脱水胁迫的耐受性,但对冷冻胁迫的耐受性仅略有提高[50.].这些结果表明,过表达DREB1A基因的转基因植物对冰冻胁迫的耐受性可能依赖于低温调节代谢产物的积累,尤其是蔗糖、棉子糖、半乳糖醇和甜菜碱迈奥肌醇。类似地,伪响应调节(PRR)节律性三突变体的转录组学和代谢组学分析显示,DREB1A/CBF基因和棉子糖的数量似乎受昼夜节律时钟的调节,在白天和晚上之间变化,就好像是在预测更冷的夜晚温度[110].
比较脱水,盐度,光,热或低温胁迫之间的代谢组科鉴定了在非生物应激反应中通常重要的代谢物或对每个应力特异[27,95,105,111,112].在拟南芥的代谢物分析研究中,拟合脱水和热应力的反应[95]中,高温胁迫降低了脯氨酸的毒性,说明在较严重的复合胁迫处理中,蔗糖取代植物中的脯氨酸作为主要的渗透保护剂。拟南芥对热休克和冷休克反应的代谢物的比较分析表明,热休克反应的大部分代谢物与冷休克反应产生的代谢物重叠[109,113].这些结果表明,脯氨酸、单糖(葡萄糖和果糖)、半乳糖醇和棉子糖等溶质的代谢网络在温度胁迫耐受中起着重要作用。Wienkoop等人[112鉴定了RNA结合蛋白(ATGRP7),其响应于低温胁迫而增加并响应于高温胁迫而降低。其丰富与谷氨酰胺和脯氨酸浓度显着相关。虽然棉花糖和半乳糖醇浓度是高温应答的显着标记,但它们的反应与AtgrP7,脯氨酸和谷氨酰胺的反应无关。
转录组学、代谢组学和酶活性被整合到钾缺乏的综合研究中[114].K缺乏碳和氮代谢显着影响。这种综合方法精确地精确地直接通过K缺乏抑制丙酮酸激酶活性(未转录),主要对所观察到的代谢障碍负责。
组学技术的系统应用促进了抗逆性作物的田间开发
许多基因影响胁迫耐受性,但确定的基因很少被证明在该领域有用。由于应激交互作用和应激反应的复杂性,我们需要在非生物应激研究中进行相关表型分析(包括现场实验),才能取得重大进展[113].本文将重点讨论以下研究,以突出系统生物学和组学方法的好例子,这些方法被用于识别调节应激耐受性的关键基因,然后在包括田间条件在内的多个实验中验证这些反应和表型。
从水稻胁迫处理的微阵列实验中鉴定出一个SNAC1基因[115].SNAC1是一种NAC转录因子,可诱导多种耐胁迫基因的表达,提高水稻的旱盐耐受性。转基因植株对ABA的敏感性增强,水分流失减少。在另一项干旱胁迫研究中,从水稻微阵列实验中鉴定出了一个LEA(胚胎后期丰富)基因,并通过T3代在干旱条件下进行了转化和田间试验[116].小穗肥力似乎是干旱条件下提高产量的主要因素。
对拟南芥中1500多个转录因子进行了详尽的筛选,确定了大约40个转录因子,当其过度表达时,可提高胁迫耐受性[117].其中一个转录因子NF-YB1在拟南芥中表现出显著的耐旱性。该过表达系的微阵列数据显示,基因表达很少差异,鉴定的基因之前不知道参与干旱耐受性。这种功能基因组学方法为提高植物的抗旱性提供了新的策略。在玉米中克隆了NF-YB1同源基因ZmNF-YB2,并在温室和田间小区进行过表达和耐旱性试验。转基因玉米具有较强的抗旱性,其叶绿素含量、光合作用、气孔导度和产量均有所提高。其中一个品种在干旱条件下连续两年增产50%以上。
哦,等等。118]利用微阵列技术鉴定了42个受应激影响的AP2转录因子。对其中两个转录因子AP37和AP59进行了功能表征。这两个转录因子关系密切,但在影响水稻表型方面存在明显差异。AP37对干旱、盐度、寒冷和ABA的响应;过度表达提高了对所有三种环境条件的应激耐受性。AP59对干旱和盐碱有响应,但对寒冷和ABA无响应,且仅对干旱和盐碱有较强的耐受性。两种过表达系在胁迫条件下均表现出较高的光合效率。转录因子的过表达诱导了共同和不同的基因组。AP59 T5纯合过表达株系在正常水田条件下受到减产影响,AP37过表达株系在干旱水田条件下受到减产影响,AP59过表达株系在干旱水田条件下受到减产影响。AP59过表达系的产量下降是由于对小穗发育的影响。 This study emphasizes the point that it is important to characterize gene effects on yield under field conditions.
绘制应激反应图谱提供了新的见解,并确定了我们对非生物应激反应知识的空白
通过对过去15年干旱胁迫相关论文的荟萃分析,我们得出了一个复杂的植物对干旱胁迫反应模型[12].该模型详细描述了糖、ROS/RNS、激素(ABA、乙烯、生长素、细胞分裂素、水杨酸、赤霉素和油菜素内酯)和氮代谢的相互作用。它强调了应激反应的高度复杂性。
从这篇综述中,我们构建了一个简化的工作模型,总结了一些已知的植物对非生物胁迫的信号反应(图1)2.).许多信号传递涉及到植物细胞中快速反应的磷酸化级联,这强调了在未来的模型中需要蛋白质组学数据和转录组学数据。PYR/PYL/RCAR-PP2C-SnRK2通路表明,蛋白磷酸化和去磷酸化是ABA信号转导中最重要的因素。乙烯和其他非生物胁迫信号通路也涉及类似的磷酸化和去磷酸化过程(图)2.).并不是所有的联系都可以在这个二维图形中画出来而不模糊其他许多联系。例如,ROS与非生物胁迫和激素的相互作用[32.]太复杂了,不能在这里显示。此外,实际的信号传导反应将依赖于该器官、组织或细胞在反应时的信号传导途径。人们需要使用更复杂的生物信息学程序,如Cytoscape [119]及其插件,以便在二维或三维空间中全面可视化交互[120[时间序列视图[121,这将允许这些数据在四个维度上查看。
虽然仍有一些技术问题必须解决,以产生蛋白质磷酸化的完整图像,但是已经开发了几种技术用于磷蛋白的大规模分析,称为“磷蛋白质”[122].质谱分析已鉴定拟南芥,稻米和稻草中成千上万的磷蛋白截形苜蓿[123–125].此外,两项研究报告了磷蛋白质中的ABA响应变化[126,127].对非生物胁迫信号突变体(如PP2C或SnRK)的磷酸化组学分析将确定非生物胁迫信号中蛋白磷酸化事件的相关网络。
转录组分析技术已经发展到可以随时使用高通量DNA测序仪和高密度微阵列(如贴片阵列)的程度。这些技术为分析非编码rna提供了新的机会,并可以阐明基因表达的表观遗传调控方面[128,129].类似的方法(130.,131.]揭示了暴露于非生物胁迫的植物的全球转录组,如脱水,冷,热,高盐度,渗透压和ABA。这些分析表明,这些压力不仅从前鉴定的应激响应基因增加或减少了转录性丰富,而且增加了成千上万的未识别的非蛋白质编码区。Matsui等人。[130.]估计,大约80%先前未注释的上调转录本来自于意义转录本的反义链。感官转录本的表达率(应激处理/未处理)与反义转录本的表达率呈显著的线性相关。有趣的是,这些数据表明,这种应激反应的反义转录本来自应激反应基因的反义链,RD29A.和CYP707A1.显然,转录调控比我们之前想象的要复杂得多。这种反义转录物是否具有生物学功能是一个有待解决的重要问题。
需要更多的研究以完全地图植物对非生物压力的反应。途径反应的性质将变化并且高度依赖于物种,器官,组织,细胞类型,植物的发育阶段,影响植物的压力或应力,压力的水平和持续时间。尽管在过去十年内对非生物压力收集了大量研究,但我们的知识仍然存在显着差距。我们仍然完全不了解植物感知压力。我们不知道所有受体和他们的行动部位(器官,组织和细胞组分)。虽然我们了解了大量关于下游信令(即转录途径),但我们对初级信令(即蛋白质组学)非常了解。植物中非生物应激反应的大多数文献基于转录组族数据而不是蛋白质组学数据。这并不奇怪,因为转录组技术更先进,更容易表现,更便宜。然而,转录组织分析不足,因为转录组科谱与蛋白质组学曲线的总体相关性差相不良[101,132.,133.或酶活性[104,114].只有一些研究描述了磷酸化级联和其他翻译后改性活动,以应对应力[134.].最近绘制荷尔蒙图谱的努力[126,127[灯管[135.磷酸化酶是很好的第一步。最后,我们需要更好的工具来促进系统生物学分析,特别是在生物信息学领域。转录组数据可以在几天或几周内收集,但数据分析往往需要一年以上的时间。
结论
我们在理解植物对非生物压力的反应方面取得了巨大进展。植物应对压力的能力存在固有的物理,形态和分子限制。系统生物学方法已经给了我们一个更全面的分子反应视图。转录组学研究进一步高,但蛋白质组学分析落后,特别是对翻译后修改的研究。对非生物胁迫的植物反应是动态和复杂的。多个OMICS研究的整合揭示了新的相互作用和规定领域。时间序列实验揭示了应力响应的动力学,鉴定了涉及核心基因组和病情依赖性变化的多个反应阶段。响应非生物应激的一致趋势是能量代谢和蛋白质合成的早期调节。这可能表明植物能量守恒,并且可以反映从植物生长到保护机制的转变。在本次审查中提出的许多例子中,ABA信号传导介导对非生物应激的植物反应。 Co-expression analyses are useful in that they have revealed key regulatory hubs that can be manipulated to produce different phenotypes. To get a comprehensive understanding of plant responses to abiotic stress, more extensive mapping of these responses at the organ, tissue and cellular level are needed. Such network analyses need to be extended to the proteomics and enzyme activities levels. Models need to be constructed and linked to phenotypic traits. The linkage of key regulatory hubs to phenotypic traits will allow for more rapid progress in the genetic manipulation and production of crop plants. Current progress is exemplified by the identification and validation of several key genes that improved stress tolerance of crops in the field. It is expected that progress in the plant sciences and systems biology will continue to accelerate in the near future.
工具书类
- 1.
北野H:系统生物学:简要概述。科学出版社,2002。10.1126 / science.1069492。
- 2.
Feist AM, Palsson BO:利用大肠杆菌进行基因组级代谢重建的应用范围日益扩大。生物技术学报。2008,26(6):659-667。10.1038 / nbt1401。
- 3.
Bemis SM, Torii KU:拟南芥地上器官形态发生过程中细胞增殖和发育程序的自主性。中国生物医学工程学报。2007,31(1):1 - 7。10.1016 / j.ydbio.2006.12.049。
- 4.
Riefler M,Novak O,Strnad M,Schmulling T:拟南芥Cytokinin受体突变体揭示芽生长,叶片衰老,种子大小,萌发,根部发育和细胞肝素代谢的功能。植物细胞。2006,18(1):40-54。10.1105 / TPC.105.037796。
- 5。
Gibeaut DM,Hulett J,Cramer Gr,Seamann JR:最大生物质拟南芥采用简单、低维护的水培方法,环境条件优越。植物生理学杂志。1997,115:317-319。10.1104 / pp.115.2.317。
- 6。
工厂生产力和环境。科学出版社,2002。10.1126 / science.218.4571.443。
- 7。
Lobell DB,Schlenker W,Costa Roberts J:1980年以来的气候趋势和全球作物生产。科学。2011,333(6042):616-620.10.1126/science.1204531。
- 8.
A, Inze D:从少到多:植物在有限的水下生长。生物技术进展。2010,21(2):197-203。10.1016 / j.copbio.2010.03.002。
- 9.
Cramer GR:非生物胁迫和植物从整个藤对基因的反应。Aust J Wine Res. 2010, 16: 86-93。
- 10.
Dinneny JR, Long TA, Wang JY, Jung JW, Mace D, Pointer S, Barron C, Brady SM, Schiefelbein J, Benfey PN:细胞特性介导拟南芥根系对非生物胁迫的响应。科学出版社,2008。10.1126 / science.1153795。
- 11.
Tattersall EA,Gremplet J,Deluc L,Wheatley MD,Vincent D,Osborne C,Ergul A,Lomen E,空白RR,Schlauch Ka,Cushman JC,Cramer Gr:成绩单丰富型材揭示了葡萄葡萄酒与寒冷的更大更复杂的反应渗透和盐度应力。Funct综合基因组学。2007,7(4):317-333。10.1007 / s10142-007-0051-x。
- 12.
光合作用和干旱:我们能从现有的数据中建立代谢联系吗?实验机器人,2011,62(3):869-882。10.1093 / jxb / erq340。
- 13.
综述:细胞壁生物合成和植物扩大的分子机制。植物保护学报。2009,36(5):383-394。10.1071 / FP09048。
- 14。
亲本B, Hachez C, Redondo E, Simonneau T, Chaumont F, Tardieu F:干旱和脱落酸对水通道蛋白含量的影响转化为水导率和叶片生长速率的变化:一种跨尺度的方法。植物生理学研究进展,2009,29(4):457 - 461。10.1104 / pp.108.130682。
- 15.
研究发现,刺激诱导的根系水分转运下调与活性氧激活的细胞信号通路和质膜内在蛋白内在化有关。植物学报,2008,56(2):207-218。10.1111 / j.1365 - 313 x.2008.03594.x。
- 16。
Vandeleur RK,Mayo G,Shelden MC,Gilliham M,Kaiser BN,Tyerman SD:Pip Aquaporins在水上运输中的作用通过根源:昼夜和干旱胁迫反应揭示了葡萄树的异常和抗氧化物品种之间的不同策略。植物理性。2008年
- 17。
Nardini A,Lo GMA,Salleo S:重新填充栓塞木质部导管:是韧皮部卸载的问题吗?。植物科学。2011,180(4):604-611.10.1016/j.plantsci.2010.12.011。
- 18。
Hummel I、Pantin F、Sulpice R、Piques M、Rolland G、Dauzat M、Christophe A、Pervent M、Bouteille M、Stitt M、Gibon Y、Muller B:拟南芥植物通过碳利用变化以低成本适应缺水:利用生长、代谢物、酶和基因表达分析的综合观点。植物生理学。2010年,154(1):357-372.10.1104/pp.110.157008。
- 19.
关键词:盐胁迫,玉米,叶片膨胀,干物质积累植物生理学杂志。1994,21:663-674。10.1071 / PP9940663。
- 20.
Nonami H, Wu YJ, Boyer JS:生长诱导水势下降:低水势下生长抑制的主要原因。植物生理学杂志,1997,22(2):1- 6。
- 21.
唐AC, Boyer JS:生长诱导水势与玉米叶片生长。中国生物医学工程学报,2002,31(3):431 - 431。10.1093 / jexbot / 53.368.489。
- 22.
干旱胁迫对甘蓝型油菜游离氨基酸积累和蛋白质合成的影响。[11]刘国华,李建平。植物生理学研究进展[j] .中国生物医学工程学报,2001,21(1):1 - 8。10.1111 / j.1399-3054.1994.tb02185.x。
- 23。
Vincent D,Ergul A,Bohlman MC,Tatterall EA,Tatterstall EA,Tillett RL,Wheatley MD,Woolsey R,Quilici Dr,Joets J,Schlauch K,Schooley Da,Cushman JC,Cramer Gr:蛋白质组学分析揭示了差异vitis Viniferal .简历。霞多丽和简历。赤霞珠及其对水分和盐分的反应。实验机器人,2007,28(6):649 - 652。10.1093 / jxb / erm012。
- 24。
Ben Zioni A,Itai C,Vaadia Y:水分和盐分胁迫,烟叶中的激动素和蛋白质合成。植物生理学。1967年,42:361-365.10.1104/pp.42.3.361。
- 25。
Dhindsa Rs,Cleland Re:水胁迫和蛋白质合成:I.蛋白质合成的差异抑制。植物理性。1975,55(4):778-781。10.1104 / pp.55.4.778。
- 26。
刘建华,Howell Sh:内质网蛋白质质量控制及其与植物环境应激反应的关系。植物细胞。2010,22(9):2930-2942。10.1105 / TPC.110.078154。
- 27。
Cramer GR, Ergul A, Grimplet J, Tillett RL, Tattersall EA, Bohlman MC, Vincent D, sondreger J, Evans J, Osborne C, Quilici D, Schlauch KA, Schooley DA, Cushman JC:水分和盐胁迫对葡萄的转录和代谢产物的早期和晚期变化。功能整合基因组学。2007,7(2):111-134。10.1007 / s10142 - 006 - 0039 - y。
- 28。
Kilian J, Whitehead D, Horak J, Wanke D, Weinl S, batitic O, D'Angelo C, Bornberg-Bauer E, Kudla J, Harter K: AtGenExpress全球胁迫表达数据集:UV-B光、干旱和寒冷胁迫响应的协议、评估和模型数据分析。植物学报,2007,50(2):347-363。10.1111 / j.1365 - 313 x.2007.03052.x。
- 29.
高桥年代,塞其M,石田J, Satou M,樱井T, Narusaka M, Kamiya A, M,只是Enju,秋山K, Yamaguchi-Shinozaki K, Shinozaki凯西:监测由高渗的诱导的基因表达谱,高盐度,氧化应激和脱落酸处理拟南芥细胞培养使用全长cDNA微阵列。中国生物医学工程学报,2004,24(1):1 -5。10.1007 / s11103 - 004 - 2200 - 0。
- 30.
Molassiotis A,Fotopoulos V:植物中的氧化和亚硝化信号:同一棵树上的两个分支?。电厂信号行为。2011,6(2):210-214.10.4161/psb.6.2.14878。
- 31.
干旱、臭氧、ABA和乙烯:从细胞到植物到群落的新认识。植物细胞环境,2009
- 32.
Mittler R, Vanderauwera S, Suzuki N, Miller G, Tognetti VB, Vandepoele K, golery M, Shulaev V, Van BF: ROS信号:新浪潮?植物学报,2011,16(6):300-309。10.1016 / j.tplants.2011.03.007。
- 33.
Goda H,佐佐木E,秋山K, Maruyama-Nakashita, Nakabayashi K,李W,小川M,山内Y,普雷斯顿J, K,青木牙T, Takatsuto年代,Fujioka年代,Asami T, Nakano T,加藤H,美津浓T,神H,山口,Nambara E, Kamiya Y,高桥H,平井一夫,樱井T, Shinozaki K,齐藤K,吉田年代,岛田Y:AtGenExpress激素和化学处理数据集:实验设计、数据评估、模型数据分析和数据获取。植物学报,2008,55(3):526-542。10.1111 / j.1365 - 313 x.2008.03510.x。
- 34.
Hubbard KE, Nishimura N, Hitomi K, Getzoff ED, Schroeder JI:早期脱落酸信号转导机制:新发现的成分和新出现的问题。基因工程学报,2010,24(16):1695-1708。10.1101 / gad.1953910。
- 35.
Kim TH, Bohmer M, Hu H, Nishimura N, Schroeder JI:保护细胞信号转导网络:研究进展脱落酸,CO2和Ca2+信号。植物保护学报。2010,31(6):531 - 531。10.1146 / annurev - arplant - 042809 - 112226。
- 36.
中国植物学报(自然科学版)植物生物学学报,2008,50(10):1187-1195。10.1111 / j.1744-7909.2008.00727.x。
- 37.
Umezawa T:Systems生物学方法脱离酸信号传导。j植物res。2011,124(4):539-548。10.1007 / s10265-011-0418-x。
- 38。
关键词:PP2C,磷酸酶,脱落酸,调节因子科学出版社,2009。
- 39。
公园SY, Fung P,西村N, Jensen博士,藤井裕久H,赵Y, Lumba年代,圣地亚哥J,罗德里格斯,Chow TF,阿尔弗雷德,Bonetta D,芬克尔斯坦R, Provart新泽西,Desveaux D,罗德里格斯PL,麦考特P,朱镕基JK,施罗德,Volkman BF,卡特勒SR:脱落酸抑制2型c通过PYR蛋白质磷酸酶/所有的家庭开始蛋白质。科学出版社,2009。
- 40.
梁J,Giraudat J:脱钙酸信号转导。Annu Rev植物植物植物Mol Biol。1998年,49:199-222。10.1146 / annurev.arplant.49.1.199。
- 41.
Yoshida R, Hobo T, Ichimura K, Mizoguchi T, Takahashi F, Aronso J, Ecker JR, Shinozaki K: aba激活的SnRK2蛋白激酶在拟南芥脱水胁迫信号转导中是必需的。植物生理学报,2002,43(12):1473-1483。10.1093 /卡式肺囊虫肺炎/ pcf188。
- 42.
Mustilli AC, Merlot S, Vavasseur A, Fenzi F, Giraudat J:拟南芥OST1蛋白激酶通过脱落酸调节气孔开度,并在活性氧产生的上游起作用。植物营养与肥料学报,2002,14(12):3089-3099。10.1105 / tpc.007906。
- 43.
Umezawa, Nakashima, Miyakawa, Kuromori, Tanokura, Shinozaki, Yamaguchi-Shinozaki: aba反应的核心调控网络的分子基础:传感,信号传导和运输。植物生理学报,2010,51(11):1821-1839。10.1093 /卡式肺囊虫肺炎/ pcq156。
- 44.
Yamaguchi-Shinozaki K, Shinozaki K:细胞反应和耐受脱水和寒冷胁迫的转录调控网络。植物生态学报,2006,26(6):649 - 652。10.1146 / annurev.arplant.57.032905.105444。
- 45.
Fujita Y, Fujita M, Satoh R, Maruyama K, Parvez MM, Seki M, Hiratsu K, ohame - takagi M, Shinozaki K, Yamaguchi-Shinozaki K: AREB1是拟南芥中新型abre依赖ABA信号的转录激活子,增强干旱胁迫耐受性。植物学报,2005,17(12):3470-3488。10.1105 / tpc.105.035659。
- 46.
拟南芥中碱性亮氨酸拉链蛋白(basic leucine zipper protein)介导的逆境响应脱落酸信号转导。植物细胞学报,2002,14(2):343-357。10.1105 / tpc.010362。
- 47。
Yoshida T, Fujita Y, Sayama H, Maruyama K, Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K: AREB1, AREB2,和ABF3是协同调控abre依赖的ABA信号通路参与干旱胁迫耐受的主转录因子,需要ABA完全激活。植物学报,2010,61(4):672-685。10.1111 / j.1365 - 313 x.2009.04092.x。
- 48。
拟南芥转录组分析表明,除CBF冷反应途径外,在冷驯化过程中还激活了多个调控途径。植物细胞学报,2002,14(8):1675-1690。10.1105 / tpc.003483。
- 49。
Maruyama K, Sakuma Y, Kasuga M, Ito Y, Seki M, Goda H, Shimada Y, Yoshida S, Shinozaki K, yamaguchi Shinozaki K:利用两种微阵列系统鉴定拟南芥DREB1A/CBF3转录因子的冷诱导下游基因。植物学报,2004,38(6):982-993。10.1111 / j.1365 - 313 x.2004.02100.x。
- 50。
Sakuma Y, Maruyama K, Osakabe Y, Qin F, Seki M, Shinozaki K, Yamaguchi-Shinozaki K:拟南芥转录因子DREB2A的功能分析。植物细胞学报,2006,18(5):1292-1309。10.1105 / tpc.105.035881。
- 51。
Stepanova A,Alonso JM:乙烯信号和响应:不同的监管模块相遇的地方。CurrOp植物BIOL。2009,12(5):548-555。10.1016 / J.PBI.2009.07.009。
- 52。
Yoo SD, Cho Y, Sheen J:乙烯信号网络中的新兴连接。植物科学进展,2009,14(5):270-279。10.1016 / j.tplants.2009.02.007。
- 53。
摩根PW,Drew MC:乙烯和植物对压力的反应。physiol植物。1997,100(3):620-630。10.1111 / j.1399-3054.1997.tb03068.x。
- 54。
9-顺式环氧类胡萝卜素双加氧酶(NCED)基因的克隆及功能分析。植物生理学报,2009,42(6):649 - 654。10.1016 / j.jplph.2009.01.013。
- 55.
孙玲,张敏,任军,齐军,张刚,冷鹏:果实成熟期和收获后脱落酸与乙烯的相互作用。中国生物医学工程学报,2010,31(1):1- 7。
- 56.
Ophir R,Pang X,Halaly T,Venkateswari J,Lavee S,Galbraith D,或E:Grape萌芽对两种替代休眠释放刺激的基因 - 表达探讨促使可能的线粒体活性,缺氧,乙烯-BA相互作用之间可能的联系和细胞扩大。植物mol biol。2009,71(4-5):403-423。10.1007 / s11103-009-9531-9。
- 57.
Petranovic d,Tyo K,Vemuri Gn,Nielsen J:酵母系统生物学的前景,用于人体健康:整合脂质,蛋白质和能量代谢。有限植物酵母菌。2010,10(8):1046-1059。10.1111 / J.1567-1364.201010.00689.x。
- 58.
酿酒酵母GCN2 eIF2激酶途径对氨基酸代谢的选择性控制。中国生物医学工程学报。2010,11:29-10.1186/1471-2091-11-29。
- 59.
Staschke Ka,Dey S,Zaborske JM,Palam LR,McClintick JN,Pan T,Edenberg HJ,Wek RC:一般氨基酸对照和雷帕霉素(TOR)调节途径在酵母中氮素同化中的靶向氨基酸控制的整合。J Biol Chem。2010,285(22):16893-16911。10.1074 / JBC.M110.121947。
- 60.
Smeekens S,Ma J,Hanson J,Rolland F:控制植物生长的糖信号和分子网络。植物生物学。2010, 13 (3): 274-279.
- 61.
嘿SJ,Byrne E,Halford NG:代谢与应力信号之间的界面。Ann Bot。2010,105(2):197-203。10.1093 / AOB / MCP285。
- 62.
拟南芥TOR激酶与植物生长、产量、抗逆性和mRNA翻译有关。环境保护与管理,2007,8(9):864-870。10.1038 / sj.embor.7401043。
- 63.
拟南芥eif2 α激酶GCN2是胁迫条件下生长所必需的,可被伤害激活。中国生物医学工程学报,2008,31(3):394 - 398。
- 64.
Baena-Gonzalez, Rolland F, Thevelein JM, Sheen J:植物胁迫和能量信号转导中转录网络的中心整合者。自然科学学报。2007,37(6):729 - 736。10.1038 / nature06069。
- 65.
Baena-Gonzalez E, Sheen J:收敛的能量和压力信号。植物科学进展,2008,13(9):474-482。10.1016 / j.tplants.2008.06.006。
- 66.
Jossier M,Bouly JP,Meimoun P,Arjmand A,Lessard P,Hawley S,Grahame HD,Thomas M:SnRK1(SNF1相关激酶1)在拟南芥的糖和ABA信号传导中起中心作用。植物J。2009年,59(2):316-328.10.1111/j.1365-313X.2009.03871.x。
- 67.
Obertello M, Krouk G, Katari M, Runko SJ, Coruzzi GM:拟南芥中碱性亮氨酸拉链转录因子1 (bZIP1)对氮和光调控的全球效应模拟。《中国生物医学工程学报》2010年第4期。
- 68.
拟南芥bZIP1转录因子参与糖信号转导、蛋白网络和DNA结合。分子植物学报,2010,3(2):361-373。10.1093 / mp / ssp115。
- 69.
Osuna D, Usadel B, Morcuende R, Gibon Y, Blasing OE, Hohne M, Gunter M, Kamlage B, Trethewey R, Scheible WR, Stitt M:添加蔗糖后拟南芥幼苗的转录本、酶活性和代谢物的时间响应。植物学报,2007,49(3):463-491。10.1111 / j.1365 - 313 x.2006.02979.x。
- 70.
(1)拟南芥葡萄糖敏感突变体与乙烯信号转导的相互作用。美国国家科学学会主办。中国科学(d辑)(英文版)。10.1073 / pnas.95.17.10294。
- 71.
Arenas-Huertero F,Arena-Huertero F,Arroyo A,Zhou L,Sheen J,Leon P:拟南芥葡萄糖不敏感突变体,GIN5和GIN6的分析,揭示了植物激素ABA在糖植物营养发育调节中的核心作用。基因开发。2000,14(16):2085-2096。
- 72.
ABA和糖的相互作用调节发育:相声或人群中的声音?中国生物医学工程学报,2002,25(1):1 - 6。10.1016 / s1369 - 5266(01) 00225 - 4。
- 73.
作者简介:Franco-Zorrilla JM, Martin AC, Leyva A, Paz-Ares J:拟南芥中磷酸盐饥饿、糖和细胞分裂素信号通路的相互作用及细胞分裂素受体CRE1/AHK4和AHK3的作用。植物生理学报,2005,54(2):457 - 461。10.1104 / pp.105.060517。
- 74。
拟南芥中β -淀粉酶基因的糖诱导表达。植物生理学杂志,1995,20(3):449 - 454。10.1104 / pp.107.3.895。
- 75。
Thum KE, Shasha DE, Lejay LV, Coruzzi GM:光和碳信号通路。交互电路的建模。植物生理学杂志,2003,22(3):431 - 434。10.1104 / pp.103.022780。
- 76。
葡萄ASR蛋白:一种参与糖和脱落酸信号转导的蛋白质。植物营养与肥料学报,2003,15(9):2165-2180。10.1105 / tpc.013854。
- 77。
葡萄糖诱导蛋白激酶VvSK1(糖诱导蛋白激酶VvSK1)调控葡萄细胞中的己糖转运和糖积累。植物生理学杂志。2010,52:1096-1106。
- 78。
沉W,Reyes Mi,Hanley-Bowdoin L:Arabidopsis蛋白激酶Grik1和Grik2通过磷酸化其活化环来特异性激活SNRK1。植物理性。2009,150(2):996-1005。10.1104 / pp.108.132787。
- 79.
Tiessen A, Prescha K, Branscheid A, Palacios N, McKibbin R, Halford NG, Geigenberger P:证据表明snf1相关激酶和己糖激酶参与了不同的糖信号通路,调节adp -葡萄糖焦磷酸化酶翻译后氧化还原激活。植物学报,2003,35(4):490-500。10.1046 / j.1365 - 313 x.2003.01823.x。
- 80
拟南芥蛋白激酶SnRK2.6介导蔗糖代谢和植物生长的调控。关键词:拟南芥,蛋白激酶,SnRK2.6植物生理学杂志。2010,31(1):1 - 5。10.1104 / pp.109.150789。
- 81
Lenz T,Fischer JJ,散渣M:探测小分子蛋白质相互作用:功能性蛋白质组学的新视角。J蛋白质组学。2011年
- 82.
Kaufmann K, Smaczniak C, de VS, Angenent GC, Karlova R:蛋白质组学在植物信号转导和发育中的应用。蛋白质组学。2011,11(4):744-755。10.1002 / pmic.201000418。
- 83.
Usadel B, Obayashi T, Mutwil M, Giorgi FM, Bassel GW, Tanimoto M, Chow A, Steinhauser D, Persson S, Provart NJ:植物生物学的共表达工具:假说产生的机会和警告。植物细胞环境学报,2009,32(12):1633-1651。10.1111 / j.1365-3040.2009.02040.x。
- 84.
Hirai MY, Yano M, Goodenowe DB, Kanaya S, Kimura T, Awazuhara M, Arita M, Fujiwara T, Saito K:转录组学和代谢组学在拟南芥(Arabidopsis thaliana)中的应用。美国国家科学学会主办。中国科学(d辑):科学(d辑)。10.1073 / pnas.0403218101。
- 85.
Hirai MY, Sugiyama K, Sawada Y, Tohge T, Obayashi T, Suzuki A, Araki R, Sakurai N, Suzuki H, Aoki K, Goda H, Nishizawa OI, Shibata D, Saito K:基于组学的拟南芥Myb转录因子调节脂肪族硫代葡萄糖苷生物合成研究。美国国家科学学会主办。2007, 40(15): 649 - 654。10.1073 / pnas.0611629104。
- 86.
[10]张建平,李建平,李建平,等。拟南芥基因共表达网络及其功能模块。中国生物医学工程学报。2009,20(4):461 - 468。
- 87.
Carrera J, Rodrigo G, Jaramillo A, Elena SF:改变环境条件下的拟南芥转录网络的逆向工程。中国生物医学工程学报,2009,30 (3):457 - 461
- 88.
Lorenz WW, Alba R, Yu YS, Bordeaux JM, Simoes M, Dean JF:微阵列分析和无标度基因网络识别干旱胁迫下火炬松(P. taeda L.)根系的候选调控因子。中国生物医学工程学报。2011,31(1):1- 6。
- 89.
关键词:植物,环境胁迫,共表达模块,分子标记生物医学工程学报。2008,2:16-10.1186/1752-0509-2-16。
- 90.
韦斯顿DJ,Karve AA,Gunter Le,Jawdy Ss,Yang X,Allen Sm,Wullschleger SD:杨树幼虫,拟南芥和甘氨酸的热休克反应潜在的比较生理学和转录网络。植物细胞环境。2011年
- 91.
关键词:序列熵,基因表达动力学,复杂性,序列熵生物信息学。2010,11:607-10.1186/1471-2105-11-607。
- 92.
Vanderauwera S, Zimmermann P, Rombauts S, Vandenabeele S, Langebartels C, Gruissem W, Inze D, Van BF:对拟南芥中过氧化氢调控的基因表达进行全基因组分析,揭示了一个高光诱导的转录簇参与花青素生物合成。植物生理学报,2005,42(2):457 - 461。10.1104 / pp.105.065896。
- 93.
在拟南芥中,udp -糖基转移酶UGT74E2对吲哚-3-丁酸稳态的干扰调节了拟南芥的结构和水分胁迫耐受性。植物细胞学报,2010,22(8):2660-2679。10.1105 / tpc.109.071316。
- 94.
多聚adp -核糖聚合酶(poly(ADP-ribose) polymerase, adp -核糖聚合酶)的沉默改变了植物的非生物胁迫信号转导。美国国家科学学会主办。2007, 40(8): 1570 - 1574。10.1073 / pnas.0706668104。
- 95.
植物中聚adp -核糖聚合酶(Poly(ADP-ribose) polymerase)对能量稳态、细胞死亡和胁迫耐受性的影响。植物学报,2005,41(1):95-106。
- 96.
Kusano M, Tohge T, Fukushima A, Kobayashi M, Hayashi N, Otsuki H, Kondou Y, Goto H, Kawashima M, Matsuda F, Niida R, Matsui M, Saito K, Fernie AR:代谢组学揭示了拟南芥对UV-B光的两种独立代谢反应的综合重组。植物学报,2011,67(2):354-369。10.1111 / j.1365 - 313 x.2011.04599.x。
- 97.
Wilkins O,Brautigam K,Campbell MM:一天中的时间形状拟南芥干旱转录om。工厂J.2010,63(5):715-727。10.1111 / J.1365-313x.2010.04274.x。
- 98。
Raj S,Brautigam K,Hamanishi ET,Wilkins O,Thomas BR,Schroeder W,Mansfield SD,Plant AL,Campbell MM:克隆历史塑造了杨树的干旱响应。美国国家科学院学报,2011年
- 99。
GRIMPLET J,DELUC LG,TILLETT RL,WHEATELY MD,SCHLAUCH KA,CRAMER GR,CUSHMAN JC:组织特异性mRNA表达曲折浆果组织。BMC基因组学。2007,8:187-10.1186 / 1471-2164-8-187。
- 100
Deluc LG, Quilici DR, Decendit A, Grimplet J, Wheatley MD, Schlauch KA, Merillon JM, Cushman JC, Cramer GR:水分不足改变了影响赤霞珠和霞多丽葡萄果实重要风味和品质性状的代谢途径。BMC Genomics. 2009, 10: 212-10.1186/1471-2164-10-212。
- 101
Grimplet J, Wheatley MD, Jouira HB, Deluc LG, Cramer GR, Cushman JC:水分充足和水分不足条件下葡萄浆果组织的蛋白质组学和选定代谢物分析。蛋白质组学。2009,9:2503-2528。10.1002 / pmic.200800158。
- 102.
Deluc LG, Decendit A, Papastamoulis Y, Merillon JM, Cushman JC, Cramer GR:水分不足会增加赤霞珠浆果中的芪代谢。农业化学学报,2011,59(1):289-297。10.1021 / jf1024888。
- 103.
Zamboni A, Di Carli M, Guzzo F, Stocchero M, Zenoni S, Ferrarini A, Tononi P, Toffali K, Desiderio A, Lilley KS, Pe ME, Benvenuto E, Delledonne M, Pezzotti M:鉴定公认的阶段特异性葡萄浆果生物标志物和组学数据集成到网络。植物生理学研究进展。2010,30(3):431 - 434。10.1104 / pp.110.160275。
- 104.
USADEL B,Blasing Oe,Gibon Y,Poree F,Hohne M,Gunter M,Trethewey R,Kamlage B,Poorter H,STITT M:拟南芥玫瑰花属玫瑰花属玫瑰病床响应的多级基因组分析,拟南芥玫瑰花属温度在非冷冻范围内。植物细胞环境。2008,31(4):518-547。10.1111 / J.1365-3040.2007.01763.x。
- 105.
Caldana C, Degenkolbe T, Cuadros-Inostroza A, Klie S, Sulpice R, Leisse A, Steinhauser D, Fernie AR, Willmitzer L, Hannah MA:拟南南对8种环境条件下的代谢组学和转录组学响应的高密度动力学分析。工厂2011年j .
- 106.
Yun KY,Park MR,Mohanty B,Herath V,Xu F,Mauleon R,Wijaya E,Bajic VB,Bruskiewich R,de LRBG:氧化信号触发的转录调控网络配置了粳稻对低温胁迫的早期反应机制。BMC植物生物学。2010, 10: 16-10.1186/1471-2229-10-16.
- 107.
urano k,maruyama k,ogata y,morishita y,takeda m,sakurai n,suzukih,suzuki k,shibata d,Kobayashi m,yamaguchi-shinozaki k,Shinozaki K:ABA监管的全球反应的表征拟南芥代谢组学。植物学报,2009,39(7):1065-1078。
- 108.
Cook D, Fowler S, Fiehn O, Thomashow MF: CBF冷反应通路在拟南芥低温代谢组中的重要作用。美国国家科学学会主办。中国科学(d辑)(英文版)10.1073 / pnas.0406069101。
- 109.
Maruyama K,武田M, Kidokoro年代,山田K,佐久间Y,铀源K, Fujita M, Yoshiwara K, Matsukura年代,Morishita Y,佐佐木R,铃木H,齐藤K,柴田D, Shinozaki K, Yamaguchi-Shinozaki K:代谢途径参与冷适应的综合分析确定代谢物和成绩单由DREB1A DREB2A。植物生理学研究进展。2009,30(4):457 - 461。10.1104 / pp.109.135327。
- 110.
Nakamichi N,Kusano M,Fukushima A,Kita M,Ito S,Yamashino T,Saito K,Sakakibara H,Mizuno T:拟南芥伪响应调节剂心律学三重突变体的成绩单剖析揭示了昼夜节律在冷应激反应中的作用。植物细胞生理。2009,50(3):447-462。10.1093 / PCP / PCP004。
- 111.
(1)拟南芥(拟南芥)温度胁迫代谢组学的研究。植物生理学杂志,2004,24(4):449 - 454。10.1104 / pp.104.052142。
- 112.
Wienkoop S,Morgenthal K,Wolschin F,Scholz M,Selbig J,Weckwerth W:组成和蛋白质组学表型的整合:数据协方差分析对拟南芥的低温和高温补偿响应剖析淀粉和RFO代谢。Mol细胞蛋白质组学。2008,7(9):1725-1736。10.1074 / MCP.M700273-MCP200。
- 113.
Salekdeh Gh,Reynolds M,Bennett J,Boyer J:分子育种期间干旱表型概念框架。趋势植物SCI。2009,14(9):488-496。10.1016 / J.Plants.2009.07.007。
- 114.
拟南芥主要代谢的多水平分析为钾营养在糖酵解和氮同化中的作用提供了新的见解。植物生理学研究进展。2009,30(2):431 - 434。10.1104 / pp.108.133629。
- 115.
胡,戴米,姚俊,萧湾,李X,张Q,熊L:过表达纳姆,ATAF和CUC(NAC)转录因子提高水稻的抗旱和耐盐性。美国国家科学学会主办。2006,103(35):12987-12992。10.1073 / pnas.0604882103
- 116.
关键词:水稻,LEA,过表达,抗旱性,抗旱性遗传理论与应用,2007,(1):35-46。
- 117.
Nelson DE, Repetti PP, Adams TR, Creelman RA, Wu J, Warner DC, Anstrom DC, Bensen RJ, Castiglioni PP, Donnarummo MG, Hinchey BS, Kumimoto RW, Maszle DR, Canales RD, Krolikowski KA, Dotson SB, Gutterson N, Ratcliffe OJ,听到JE:植物核因子Y (NF-Y) B亚单位赋予耐旱性,并导致提高玉米产量的水有限的英亩。美国国家科学学会主办。2007, 40(12): 1650 - 1655。10.1073 / pnas.0707193104。
- 118。
在干旱条件下,AP37转录因子的过度表达可以提高水稻的产量。植物生理学研究进展。2009,30(3):359 - 362。10.1104 / pp.109.137554。
- 119。
Shannon P,Markiel A,Ozier O,Baliga NS,Wang JT,Ramage D,Amin N,Schwikowski B,IDEKER T:Cytoscape:用于生物分子交互网络的集成模型的软件环境。Genome Res。2003,13(11):2498-2504。10.1101 / GR.1239303。
- 120。
Audenaert P,Van Pt,Brondel F,Pickavet M,Demeester P,Van Dpy,Michoel T:cyclus3d:用于集成网络中的网络图案的Cytoscape插件。生物信息学。2011,27(11):1587-1588。10.1093 / Bioinformatics / BTR182。
- 121
OmicsAnalyzer:一个用于组学数据建模的胞景插件套件。生物信息学。2010,26(23):2995-2996。10.1093 /生物信息学/ btq583。
- 122
用蛋白质组学的方法来理解途径调节中的蛋白磷酸化。中国生物防治学报,2010,13(3):285 - 288。
- 123
Sugiyama N,Nakagami H,Mochida K,Daudi A,Tomita M,Shirasu K,Ishihama Y:大规模磷酸化图谱揭示了拟南芥中酪氨酸磷酸化的程度。分子系统生物学。2008, 4: 193-
- 124
Nakagami H,Sugiyama N,Mochida K,Daudi A,Yoshida Y,Toyoda T,Tomita M,Ishihama Y,Shirasu K:大规模对比磷蛋白质鉴定植物中的保守磷酸化位点。植物理性。2010,153(3):1161-1174。10.1104 / pp.110.157347。
- 125
de la Fuente van Bentem S, Anrather D, Roitinger E, Djamei A, Hufnagl T, Barta A, Csaszar E, Dohnal I, Lecourieux D, Hirt H:磷酸化蛋白质组学揭示了参与RNA代谢的拟南芥蛋白在体内的广泛磷酸化。核酸研究进展,2006,34(11):3267-3278。10.1093 / nar / gkl429。
- 126.
关键词:植物激素反应,磷蛋白,细胞因子拟南芥使用tio2磷酸肽富集和质量精度前体对齐。植物学报,2010,63(1):1-17。
- 127.
植物激素脱落酸诱导的蛋白质磷酸化的变化。美国国家科学学会主办。[10]10.1073 / pnas.1007879107。
- 128.
Zhang X, Yazaki J, Sundaresan A, Cokus S, Chan SW, Chen H, Henderson IR, Shinn P, Pellegrini M, Jacobsen SE, Ecker JR .:拟南芥DNA甲基化的全基因组高分辨率定位和功能分析。细胞。2006,126(6):1189-1201。10.1016 / j.cell.2006.08.003。
- 129.
Gregory BD,Yazaki J,Ecker JR:利用瓷器微阵列进行植物全基因组分析。工厂J. 2008,53(4):636-644。
- 130.
Matsui A, Ishida J, Morosawa T, Mochizuki Y, Kaminuma E, Endo TA, Okamoto M, Nambara E, Nakajima M, Kawashima M, Satou M, Kim JM, Kobayashi N, Toyoda T, Shinozaki K, Seki M:拟南芥在干旱、寒冷、高盐度和ABA处理条件下的转录组分析。植物生理学杂志,2008,49(8):1135-1149。10.1093 /卡式肺囊虫肺炎/ pcn101。
- 131.
Zeller G, Henz SR, Widmer CK, Sachsenberg T, Ratsch G, Weigel D, Laubinger S:应力诱导的变化拟南芥转录组分析使用全基因组瓷砖阵列。植物学报,2009,58(6):1068-1082。10.1111 / j.1365 - 313 x.2009.03835.x。
- 132.
关键词:转录组数据,蛋白质组数据,整合分析生物技术评论,2007,27(2):63-75。10.1080 / 07388550701334212。
- 133.
Bohmer M, Schroeder JI:拟南芥悬浮细胞中脱落酸诱导和活性氧依赖的表达变化的定量转录组分析和蛋白质组学分析。植物学报,2011,67(1):105-118。10.1111 / j.1365 - 313 x.2011.04579.x。
- 134.
杨某,Vanderbeld B,Wan J,Huang Y:缩小目标:对耐旱性作物的成功基因工程。莫尔植物。2010,3(3):469-490。10.1093 / MP / SSQ016。
- 135.
Reiland S, Finazzi G, Endler A, Willig A, Baerenfaller K, Grossmann J, Gerrits B, Rutishauser D, Gruissem W, Rochaix JD, Baginsky S:比较磷酸化蛋白质组分析揭示了STN8激酶在循环电子流(CEF)微调中的功能。美国国家科学学会主办。2011.
作者信息
从属关系
相应的作者
额外的信息
作者的贡献
GRC对这份手稿的各个方面都有贡献。KU和KS参与了代谢组学和ABA信号部分和图2.. SD参与了引种、ABA和糖信号的研究。MP参与了时间序列分析部分。所有作者都阅读并批准了这份手稿的最终版本。
作者的原始提交的图像文件
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/2.0),允许在任何媒介上不受限制地使用、分发和复制,但前提是原稿被适当引用。
关于这篇文章
引用这篇文章
克拉默,g。r。Urano, K。Delrot, S。et al。非生物胁迫对植物的影响:系统生物学的观点。BMC植物BIOL.11,163(2011)。https://doi.org/10.1186/1471-2229-11-163
收到了:
认可的:
发表:
关键字
- 非生物胁迫
- 反应氮物种
- 反义转录
- agmatine.
- 非生物压力反应